Rabipur Prášek A Rozpouštědlo Pro Injekční Roztok V Předplněné Inj Stř
sp. zn. sukls144403/2016
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Rabipur prášek a rozpouštědlo pro injekční roztok v předplněné injekční stříkačce Virus rabiei inactivatum
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Po rekonstituci obsahuje jedna injekční lahvička (1,0 ml):
Virus rabiei inactivatum* (inaktivovaný, kmen Flury LEP)...........................> 2,5 IU
* pomnožený v purifikovaných buňkách kuřecího embrya (purified chick embryo cells, PCEC)
Tato vakcína obsahuje rezidua polygelinu, kuřecích proteinů (např. ovalbumin), lidského sérového albuminu a může obsahovat stopy neomycinu, chlortetracyklinu a amfotericinu B. Viz body 4.3 a 4.4.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok v předplněné injekční stříkačce.
Prášek je bílý.
Rozpouštědlo je čiré a bezbarvé.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Rabipur je indikován k aktivní imunizaci proti vzteklině u jedinců ve všech věkových skupinách.
Patří sem preexpoziční profylaxe (tj. před možným rizikem expozice vzteklině), jako základní očkování nebo booster dávka, a postexpoziční profylaxe (tj. po suspektní nebo prokázané expozici vzteklině).
Vakcínu Rabipur je nutné používat na základě oficiálních doporučení.
4.2 Dávkování a způsob podání
Dávkování
Dávkování u dospělých a dětí
Doporučená jednotlivá intramuskulární (i.m.) dávka je 1,0 ml ve všech věkových skupinách. Preexpoziční profylaxe (PrEP)
Primární imunizace
U dosud neočkovaných jedinců se úvodní cyklus preexpoziční profylaxe skládá ze tří dávek (po 1,0 ml) podávaných intramuskulárně ve dnech 0, 7 a 21 (nebo 28).
Booster dávky
Jednotlivá intramuskulární booster dávka je 1,0 ml.
Vakcínu Rabipur lze použít k booster vakcinaci po předchozí imunizaci vakcínou proti vzteklině z lidských diploidních buněk (human diploid cell rabies vaccine, HDCV).
Potřebu intermitentního sérologického vyšetření na přítomnost protilátek > 0,5 IU/ml a podání booster dávek je nutné posuzovat v souladu s oficiálními doporučeními.
Zkušenosti ukazují, že podání booster dávek je obvykle nutné po každých 2 - 5 letech.
Postexpoziční profylaxe (PEP)
Postexpoziční profylaxe zahrnuje:
• lokálního ošetření rány co nejdříve po expozici,
• očkování proti vzteklině a
• podání imunoglobulinu proti vzteklině, je-li indikováno.
Indikace k postexpoziční profylaxi závisí na typu kontaktu s podezřelým zvířetem nakaženým vzteklinou, jak je uvedeno v tabulce 1, Doporučená postexpoziční profylaxe podle typu kontaktu. Postexpoziční imunizace se má zahájit co nejdříve po expozici.
Tabulka 1: Doporučená postexpoziční profylaxe podle typu kontaktu
|
Kategorie expozice |
Typ kontaktu s podezřelým nebo prokazatelně nakaženým domácím nebo divokýma) zvířetem nebo zvířetem, které nelze zajistit k provedení testů |
Doporučená postexpoziční profylaxe |
|
I |
Dotek nebo krmení zvířat Olíznutí neporušené kůže Kontakt neporušené kůže se sekrety nebo exkrety nakaženého zvířete nebo lidského případu vztekliny |
Žádná, pokud je k dispozici spolehlivá anamnéza. |
|
II |
Kousnutí bez zřetelného porušení kůže Drobné škrábance nebo abraze bez krvácení |
Okamžitě podejte vakcínub) Ukončete léčbu, pokud zvíře zůstane zdravé během pozorování po dobu 10 dnůc) nebo pokud je u zvířete potvrzeno, že laboratorní analýza provedená spolehlivou laboratoří používající vhodné diagnostické postupy je negativní. |
|
III |
Jednotlivá nebo mnohočetná kousnutíd) prostupující kůží nebo škrábance či olíznutí porušené kůže. Kontaminace sliznice slinami (např. olíznutí). Kontakt s netopýrye). |
Okamžitě podejte vakcínu proti vzteklině a imunoglobulin proti vzteklině, pokud možno co nejdříve po zahájení postexpoziční profylaxe. Imunoglobulin proti vzteklině lze podat injekčně až do 7 dní po podání první dávky vakcíny. Ukončete léčbu, pokud zvíře zůstane zdravé během pozorování po dobu 10 dnů nebo pokud je u zvířete potvrzeno, že laboratorní analýza provedená spolehlivou laboratoří používající vhodné diagnostické postupy je negativní. |
a) Kontakt s hlodavci, králíky nebo zajíci obvykle nevyžaduje antirabickou postexpoziční profylaxi.
b) Pokud je zjevně zdravý pes či kočka v nebo z oblasti s nízkým rizikem umístěn pod lékařský dohled, lze léčbu odložit.
c) Toto období dohledu se uplatňuje pouze u psů a koček. S výjimkou případu ohrožených nebo chráněných druhů se doporučuje další domácí nebo divoká zvířata, u kterých je podezření na vzteklinu, usmrtit a vyšetřit tkáně na přítomnost antigenu vztekliny příslušnými laboratorními postupy.
d) Kousnutí, zejména v oblasti hlavy, krku, obličeje, rukou a genitálií, patří mezi expozice kategorie III vzhledem k bohaté inervaci těchto oblastí.
e) Došlo-li ke kontaktu mezi člověkem a netopýrem, má se zvážit postexpoziční profylaxe, pokud exponovaná osoba není schopna vyloučit kousnutí nebo škrábnutí či expozici sliznice.
Postexpoziční profylaxe u dosud neočkovaných jedinců
• 5dávkový essenský režim (1-1-1-1-1): jedna 1,0ml intramuskulární injekce v den 0, 3, 7, 14 a 28
• 4dávkový záhřebský režim (2-1-1): dvě 1,0ml intramuskulární injekce v den 0 (jedna do každého ze dvou deltových svalů nebo stehen) následované jednou 1,0ml intramuskulární injekcí v den 7 a 21.
Postexpoziční profylaxe u dříve očkovaných jedinců
U dříve očkovaných jedinců se postexpoziční profylaxe skládá ze dvou dávek (po 1,0 ml) podávaných intramuskulárně ve dnech 0 a 3. V těchto případech není indikován imunoglobulin proti vzteklině.
Pediatričtí pacienti
Pediatričtí pacienti dostávají stejnou 1,0ml intramuskulárně dávku jako dospělí.
Starší pacienti
Starší pacienti dostávají stejnou 1,0ml intramuskulární dávku jako dospělí.
Imunokompromitovaní jedinci
U imunokompromitovaných jedinců je nutná kompletní série 5 dávek podle essenského režimu (1 -1-1-1-1) v den 0, 3, 7, 14 a 28) v kombinaci s důkladným ošetřením rány a lokální infiltrací imunoglobulinu proti vzteklině u jedinců s expozicí kategorie II a III.
Nebo lze podat dvě dávky vakcíny v den 0, to znamená, že se má podat jednorázová 1,0ml dávka vakcíny do pravého deltového svalu a další jednorázová dávka do levého deltového svalu. U malých dětí se má podat jedna dávka do anterolaterální oblasti každého stehna. To znamená celkový počet 6 dávek (2-1-1-1-1 v den 0, 3, 7, 14 a 28).
Je-li to možné, má se změřit odpověď ve smyslu množství neutralizačních protilátek proti viru vztekliny 2 až 4 týdny (nejlépe v den 14) po zahájení vakcinace, aby se vyhodnotila případná potřeba další dávky vakcíny. Imunosupresiva se nemají během postexpoziční léčby podávat, pokud to není nezbytné pro léčbu jiných onemocnění (viz bod 4.5).
Způsob podání
U dospělých a dětí ve věku > 2 let se má vakcína podávat intramuskulárně do deltového svalu. U dětí ve věku < 2 roky se doporučuje podání do anterolaterální oblasti stehna.
Vakcína se nesmí podávat intravaskulárně, viz bod 4.4.
Vakcína proti vzteklině se nesmí podávat intragluetálně nebo subkutánně, viz bod 4.4.
Návod k rekonstituci vakcíny před jejím podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Preexpoziční profylaxe (PrEP)
Závažná hypersenzitivita na léčivou látku, kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na rezidua uvedená v bodě 2 v anamnéze.
Jedinci s akutními onemocněními vyžadujícími léčbu nemají být očkováni až do uplynutí nejméně 2 týdnů od uzdravení. Málo závažné infekce nejsou kontraindikací vakcinace.
Postexpoziční profylaxe (PEP)
Vzhledem k téměř vždy fatálnímu průběhu infekce vzteklinou, neexistují žádné kontraindikace pro postexpoziční profylaxi, včetně těhotenství.
4.4 Zvláštní upozornění a opatření pro použití
Po vakcinaci přípravkem Rabipur byly hlášeny anafylaktické reakce včetně anafylaktického šoku. Jako u každé injekčně podávané vakcíny i zde je nutné vždy zajistit bezprostřední dostupnost patřičné lékařské péče a dohledu pro případ vzácné možnosti anafylaktické reakce po podání vakcíny.
Pacienti, u nichž se má za to, že jsou vystaveni riziku závažné hypersenzitivní reakce na vakcínu nebo kteroukoli složku vakcíny, mají dostat jinou vakcínu proti vzteklině, je-li k dispozici vhodný přípravek.
Byla hlášena časová souvislost výskytu encefalitidy a Guillain-Barré syndromu s použitím vakcíny Rabipur (viz také bod 4.8). Použití kortikosteroidů k léčbě nežádoucích reakcí tohoto typu může zabránit rozvoji imunity vůči vzteklině (viz bod 4.5). Před rozhodnutím o přerušení imunizace se musí pečlivě zvážit riziko rozvoje vztekliny u pacienta.
Neúmyslná intravaskulární injekce může vést k systémovým reakcím, včetně šoku. Nepodávejte intravaskulárně. Vakcína nesmí být mísena s jinými léčivými přípravky ve stejné injekční stříkačce. Pokud je kromě vakcíny Rabipur indikován ještě imunoglobulin proti vzteklině, musí být podán do jiné oblasti těla vzdálené místu vakcinace (viz bod 4.5).
V souvislosti s vakcinací může dojít k reakcím souvisejícím s úzkostí, včetně vazovagálních reakcí (synkopa), hyperventilace nebo reakcí souvisejících se stresem, jakožto psychogenní odpovědi na vpich jehly (viz bod 4.8). Je důležité zavést postupy, které zabraňují poranění v důsledku mdlob.
Vakcína proti vzteklině se nesmí podávat do gluteální oblasti nebo subkutánně, neboť vyvolání dostatečné imunitní odpovědi pak může být méně spolehlivé.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Imunosupresiva mohou narušovat rozvoj dostatečné odpovědi na vakcínu proti vzteklině. Proto se u těchto jedinců doporučuje sledovat sérologické odpovědi a v případě potřeby podat další dávky (viz bod 4.2).
Celá dávka antirabického imunoglobulinu nebo co největší množství, které je vzhledem k anatomickým poměrům možné (avšak při zamezení možnému vzniku kompartment syndromu), se má podat do rány/ran a kolem ní/nich. Zbývající imunoglobulin, pokud nějaký zbude, se má podat intramuskulární injekcí do místa vzdáleného od místa podání vakcíny, aby se zamezilo možným vzájemným interferencím se současně podávanou vakcínou proti vzteklině.
Současně s vakcínou Rabipur lze podat i jiné inaktivované vakcíny. Současně podávané vakcíny se mají vždy aplikovat do odlišných míst injekce a pokud možno do kontralaterálních končetin.
4.6 Fertilita, těhotenství a kojení
Nebyly pozorovány žádné škodlivé účinky, které by bylo možné přisoudit použití vakcíny Rabipur během těhotenství.
Vakcínu Rabipur lze podat těhotným ženám, pokud je nutná postexpoziční profylaxe.
Tato vakcína může být použita rovněž k preexpoziční profylaxi během těhotenství, pokud potenciální prospěch léčby převažuje nad jakýmkoliv možným rizikem pro plod.
Kojení
I když není známo, zda se vakcína Rabipur vylučuje do lidského mateřského mléka, nebylo zjištěno žádné riziko pro kojence. Vakcínu Rabipur lze podat kojícím ženám, pokud je nutná postexpoziční profylaxe.
Tato vakcína může být použita rovněž k preexpoziční profylaxi u kojících žen, pokud potenciální prospěch léčby převažuje nad jakýmkoliv možným rizikem pro kojence.
Fertilita
Nebyly provedeny žádné studie reprodukční a vývojové toxicity.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie s vakcínou Rabipur k vyhodnocení účinku na schopnost řídit nebo obsluhovat stroje (viz také bod 4.8).
Některé nežádoucí účinky popsané v bodě 4.8 mohou ovlivnit schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Anafylaktické reakce, včetně anafylaktického šoku, jsou velmi vzácné, ale klinicky závažné a potenciálně letální Po očkování vakcínou Rabipur se mohou vyskytnout systémové nežádoucí účinky. V klinických studiích s vakcínou Rabipur nebyla hlášená anafylaxe.
Nejčastější hlášené získané nežádoucí účinky byly bolest v místě injekce (30-85 %; hlavně bolest v důsledku injekce) nebo indurace v místě injekce (15-35 %). Většina reakcí v místě injekce nebyla závažná a vymizela během 24 až 48 hodin po injekci.
Po očkování vakcínou Rabipur se mohou vyskytnout mírné alergické reakce (tj. hypersenzitivita) včetně vyrážky a kopřivky. Vyrážka se může vyskytnout více než u 1 pacienta z 10 a kopřivka se může vyskytnout v rozmezí 1 ze 100 až 1 z 10 pacientů. Tyto reakce jsou obvykle mírné a odezní během několika dnů.
Po očkování vakcínou Rabipur hlásilo malé množství pacientů příznaky encefalitidy a Guillain-Barré syndromu.
Tabulkový přehled nežádoucích účinků
Následující nežádoucí účinky vyskytující se v souvislosti s aplikací vakcíny byly hlášeny v klinických studiích a během postmarketingového sledování. Po uvedení na trh jsou nežádoucí účinky hlášeny dobrovolně z populace neznámé velikosti, kde odhad frekvence nemůže být stanoven. Z toho důvodu sem byly tyto nežádoucí účinky zařazeny, a to vzhledem k jejich závažnosti, četnosti podávaných hlášení, příčinné souvislosti s podáním vakcíny Rabipur, nebo kombinaci těchto faktorů.
V každé skupině četnosti jsou nežádoucí účinky uvedeny podle klesající závažnosti. Kromě toho je u každého nežádoucího účinku uvedena příslušná kategorie četnosti podle této konvence
(CIOMS III): velmi časté (>1/10); časté (>1/100, <1/10); méně časté (>1/1000, <1/100); vzácné (>1/10000, <1/1000) a velmi vzácné (<1/10000).
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Poruchy krve a lymfatického systému |
Časté |
Lymfadenopatie |
|
Poruchy imunitního systému |
Vzácné |
Hypersenzitivita |
|
Velmi vzácné |
Anafylaxe včetně anafylaktického šoku * | |
|
Poruchy metabolismu a výživy |
Časté |
Snížená chuť k jídlu |
|
Poruchy nervového systému |
Velmi časté |
Bolest hlavy, závrať |
|
Vzácné |
Parestezie | |
|
Velmi vzácné |
Encefalitida*, Guillain-Barré syndrom*, presynkopa*, synkopa*, vertigo* | |
|
Gastrointestinální poruchy |
Časté | |
|
Poruchy kůže a podkožní tkáně |
Velmi časté | |
|
Časté |
Kopřivka | |
|
Vzácné |
Hyperhidróza (pocení) | |
|
Velmi vzácné |
Angioedém* | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté |
Myalgie, artralgie |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté | |
|
Vzácné |
*Nežádoucí účinky získané ze spontánních hlášení
Popis vybraných nežádoucích účinků
Během postmarketingového sledování byly většinou hlášeny bolest hlavy a závratě, tyto nežádoucí účinky byly přechodného charakteru a spontánně odezněly.
Během postmarketingového sledování byl hlášen výskyt vyrážky jako nežádoucího účinku. Její výskyt byl hlášen s omezeným nebo žádným detailním popisem, nicméně několik případů výskytu vyrážky bylo hlášeno v souvislosti s potenciální hypersenzitivní reakcí.
V místě vpichu byly hlášeny různé reakce a zahrnovaly především nežádoucí účinky jako je bolest v místě vpichu, nepříjemný pocit, indurace, zduření^ erytém a edém. Všechny tyto reakce měly příznivý vývoj, zvláště pokud byla zahájena léčba. Žádný z nich nebyl posouzen jako celulitida v místě vpichu a všechny byly přechodné povahy. Reakce v místě vpichu byly běžně hlášeny v klinických studiích s vakcínou Rabipur a postmarketingová údaje to potvrzují.
Léčba hypersenzitivních reakcí (alergické reakce), viz bod 4.4.
Jakmile se postexpoziční profylaxe zahájí, nemá se přerušit ani ukončit kvůli lokálním nebo mírným systémovým nežádoucím reakcím na vakcínu proti vzteklině.
Pediatrická populace
Očekává se, že frekvence, typ a závažnost nežádoucích účinků bude u dětí stejná, jako u dospělých.
Zvláštní skupiny pacientů
Rabipur nebyl nikdy výlučně studován u jakékoli konkrétní skupiny populace, jako např. starší pacienti, pacienti s poruchou funkce ledvin, pacienti s poruchou funkce jater a starší pacienti s jinými chorobami nebo pacienti určitého genotypu, neboť rizikové faktory zůstávají stejné ve všech populacích. Nicméně, tyto zvláštní skupiny pacientů nebyly výslovně vyloučeny z klinických studií prováděných s vakcínou Rabipur, přičemž nebyly pozorovány žádné speciální klinicky významné rozdíly (tj. v povaze, frekvenci, závažnosti nebo reverzibilitě nežádoucích účinků, nebo nutnosti dalšího sledování).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Nejsou známy žádné příznaky předávkování.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vzteklina, inaktivovaný celý virus ATC kód: J07BG01
Minimální titr protilátek proti viru vztekliny, který se doporučuje jako důkaz dostatečné imunitní odpovědi po vakcinaci činí > 0,5 IU/ml, jak uvádí WHO. U zdravých očkovaných osob by se mělo této hladiny dosáhnout u většiny jedinců do dne 14 postexpozičního režimu při současném podání imunoglobulinu proti vzteklině (RIG) nebo bez něj a bez ohledu na věk.
Preexpoziční profylaxe
V klinických studiích prováděných u dosud neimunizovaných subjektů, dosáhly téměř všechny subjekty dostatečné imunitní odpovědi (neutralizační protilátky proti viru vztekliny, RVNA > 0,5 IU/ml) 3 až 4 týdny po ukončení primární série tří injekcí vakcíny Rabipur, když se podávala podle doporučeného režimu intramuskulární cestou. V klinických studiích bylo zjištěno přetrvávání dostatečné imunitní odpovědi (RVNA > 0,5 IU/ml) po dobu až 2 let po imunizaci vakcínou Rabipur bez podání dodatečné booster dávky. Protože titr protilátek pomalu klesá, může být nutné podávat booster dávky pro udržení hladiny protilátek nad 0,5 IU/ml. Potřebu a načasování podání booster dávek se má posuzovat případ od případu, přičemž je nutno vzít v úvahu oficiální pokyny (viz také bod 4.2).
V klinické studii vyvolala booster dávka vakcíny Rabipur podaná 1 rok po primární imunizaci 10násobné nebo vyšší zvýšení geometrického průměru koncentrace (geometric mean concentration, GMC) do 30. dne. Také bylo prokázáno, že osoby, které byly dříve imunizovány vakcínou vyrobenou na lidských diploidních buňkách (human diploid cell vaccine, HDCV) projevily rychlou anamnestickou odpověď po aplikaci booster dávky vakcíny Rabipur.
Postexpoziční profylaxe
V klinických studiích vyvolala vakcína Rabipur vznik dostatečného množství neutralizačních protilátek (> 0,5 IU/ml) u téměř všech subjektů do 14 nebo 30 dnů, pokud byla podávána podle 5dávkového* (den 0, 3, 7, 14, 28; po 1,0 ml, intramuskulárně) essenského režimu doporučovaného WHO nebo 4dávkového (den 0 [2 dávky], 7, 21; po 1,0 ml, intramuskulárně) záhřebského režimu doporučovaného WHO.
* Předchozí essenský režim doporučovaný WHO se skládal z 6 dávek (den 0, 3, 7, 14, 28, 90; po
1.0 ml, intramuskulárně).
Současné podání lidského imunoglobulinu proti vzteklině (human rabies immunoglobulin, HRIG) společně s první dávkou vakcíny proti vzteklině způsobilo mírný pokles GMC (essenský režim). Nepovažovalo se to však za klinicky významné ani statisticky signifikantní.
5.2 Farmakokinetické vlastnosti
Neuplatňuje se
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické údaje zahrnující studie s jednorázovým podáním, opakovaným podáváním a studie lokální tolerance neodhalily žádné neočekávané nálezy a žádnou orgánovou toxicitu. Nebyly provedeny žádné studie genotoxicity, karcinogenity a reprodukční toxicity.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Prášek:
Trometamol
Chlorid sodný
Dihydrát dinatrium-edetátu
Kalium-hydrogen-glutamát
Polygelin
Sacharóza
Rozpouštědlo:
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být vakcína Rabipur mísena s jinými léčivými přípravky ve stejné injekční stříkačce.
6.3 Doba použitelnosti
48 měsíců
Po rozpuštění se musí vakcína použít okamžitě.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem.
Uchovávejte injekční lahvičku v krabičce, aby byl přípravek chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3. Vakcína se nesmí používat po uplynutí doby použitelnosti vyznačené na balení a vnitřním obalu.
6.5 Druh obalu a obsah balení
Balení obsahující:
1 injekční lahvičku (sklo třídy I) s lyofilizovanou vakcínou opatřenou zátkou (chlorbutylovou)
Jednu jednorázovou předplněnou injekční stříkačku (sklo třídy I) se sterilním rozpouštědlem k rekonstituci (1 ml) s pístem (brombutylovým), bez jehly a s uzávěrem hrotu (brombutylovým). Jednu malou oranžovou jehlu na injekci (25 G, 27 mm) a jednu dlouhou zelenou jehlu k rekonstituci (21 G, 40 mm)
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Pokyny pro použití jednorázové předplněné injekční stříkačky s vakcínou Rabipur:
Předplněná injekční stříkačka
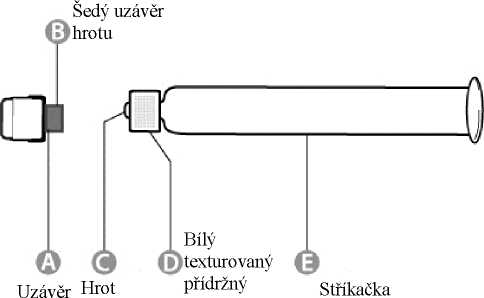
stříkačky krou&k
Plastový

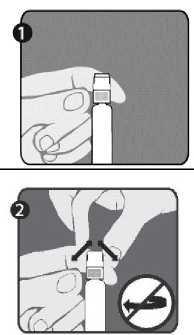
1. krok: Jednou rukou držte injekční stříkačku (E) uzávěrem nahoru. Injekční stříkačku držte za bílý texturovaný přídržný kroužek (D).
2. krok: Druhou rukou uchopte uzávěr (A) a pevně s ním kývejte dopředu a dozadu, abyste zlomili jeho spojení s přídržným kroužkem (D). Uzávěrem nekruťte ani neotáčejte.
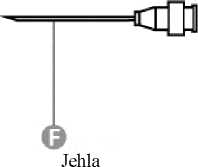
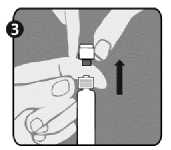
Připojení jehly (tyto pokyny platí pro zelenou i oranžovou jehlu):
|
1. krok: Otočením sejměte uzávěr ze zelené jehly pro rekonstituci. Nesundávejte plastový kryt (G). Toto je ta delší jehla ze dvou jehel. |
» I; IKlí: s__ | ||
|
2. krok: Jednou rukou pevně držte injekční stříkačku (E) za bílý texturovaný přídržný kroužek (D). Druhou rukou nasaďte jehlu (F) a otáčejte s ní ve směru hodinových ručiček, dokud se pevně nezajistí na místě. Jakmile je jehla zajištěná, sejměte plastový kryt (G). Injekční stříkačka je nyní připravena k použití. |
< |
> — -"'i |
3. krok: Tahem vzhůru sejměte uzávěr (A) a připojený šedý uzávěr hrotu (B). Dávejte pozor, abyste se nedotkli sterilního hrotu stříkačky (C).
Pokyny pro rekonstituci vakcíny Rabipur s použitím jednorázové předplněné injekční stříkačky: Vakcína se musí před rekonstitucí i po ní vizuálně zkontrolovat na přítomnost jakýchkoli cizorodých částic nebo změnu fyzikálního vzhledu. Vakcína se nesmí použít, pokud došlo k jakékoli změně vzhledu vakcíny.
Rozpuštěním bílého lyofilizovaného prášku v čirém a bezbarvém rozpouštědle injekční stříkačky vznikne čirý a bezbarvý roztok.
Prášek pro přípravu injekčního roztoku musí být rekonstituován dodaným rozpouštědlem a opatrně protřepán před podáním injekce. Rekonstituovaná vakcína se musí okamžitě použít.
Během výroby se injekční lahvička neprodyšně uzavře pod vakuem. Aby se zabránilo problémům při natahování rekonstituované vakcíny z injekční lahvičky po její rekonstituci, doporučuje se proto odšroubovat injekční stříkačku od jehly, aby se vyrovnal podtlak. Poté lze vakcínu snadno natáhnout z injekční lahvičky. Nedoporučuje se vyvíjet nadměrný tlak, neboť přetlak by způsobil potíže při natahování správného objemu vakcíny.
Po dokončení rekonstituce vakcíny, sejměte uzávěr z oranžové jehly určené k aplikaci (způsobem vysvětleným v 1. kroku pro zelenou jehlu) a nahraďte zelenou jehlu určenou k rekonstituci oranžovou jehlou určenou k aplikaci nebo jinou vhodnou jehlou.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
GSK Vaccines GmbH Emil-von-Behring-Str. 76 35041 Marburg
Německo
8. REGISTRAČNÍ ČÍSLO(A)
59/226/16-C
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 25. 5. 2016 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
17.6.2016
11