Lutrate Depot 22,5 Mg Prášek A Rozp. Pro Inj. Susp. S Prodl. Účinkem
Sp.zn.sukls109411/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Lutrate Depot 22,5 mg prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička obsahuje leuprorelini acetas 22,5 mg (což odpovídá leuprorelinum 21,42 mg). Jeden ml připravené suspenze obsahuje leuprorelini acetas 11,25 mg.
Pomocné látky se známým účinkem:
Jedna injekční lahvička obsahuje 1,6 - 2,7 mg (< 1 mmol) sodíku (jako sodnou sůl karmelosy).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční suspenzi s prodlouženým účinkem Prášek: bílý až téměř bílý prášek
Rozpouštědlo: čirý bezbarvý roztok bez částic (pH 5,0 - 7,0)
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Lutrate Depot je určen k paliativní léčbě hormonálně dependentního pokročilého karcinomu prostaty.
4.2 Dávkování a způsob podání
Dávkování
Obvyklá dávka přípravku Lutrate Depot je 22,5 mg v jedné tříměsíční depotní injekci podávané každé tři měsíce formou jednorázové intramuskulární injekce.
Přípravek Lutrate Depot musí být aplikován pod dohledem lékaře či kvalifikovaného zdravotnického pracovníka, který má potřebné znalosti k monitoringu odpovědi na léčbu.
Depotní léková forma přípravku Lutrate Depot obsahuje dávku umožňující průběžné uvolňování leuprorelin-acetátu v průběhu 3 měsíců. Lyofilizovaný prášek je nutné rekonstituovat a podávat v jedné intramuskulární injekci každé tři měsíce. Přípravek nesmí být podán intraarteriálně či intravenózně. Injekční lahvičku s mikrosférickým práškem přípravku Lutrate Depot je třeba rekonstituovat bezprostředně před aplikací intramuskulární injekce. Stejně jako u ostatních léčivých přípravků podávaných injekčně je třeba místo vpichu pravidelně měnit.
Léčba přípravkem Lutrate Depot nemá být přerušena, dojde-li k remisi či zlepšení stavu.
Odezva na léčivý přípravek Lutrate Depot by měla být sledována pomocí pravidelného měření hladin testosteronu a prostatického specifického antigenu (PSA) v séru. Klinické studie ukázaly, že se hladina testosteronu během prvních 4 dnů léčby zvýšila u většiny pacientů bez orchiektomie. V průběhu dalších 3 - 4 týdnů se hladina snížila až na kastrační úroveň. Dále se kastrační úroveň (definovaná jako koncentrace testosteronu rovná nebo nižší než 0,5 ng/ml) udržovala po celou dobu trvání terapie.
Pokud se odezva pacienta nejeví jako optimální, je vhodné ověřit, zda hladiny testosteronu v séru dosáhly kastrační úrovně či na ní setrvávají. Na počátku léčby se občas objeví přechodné zvýšení hladin kyselé fosfatázy, hodnoty se však obvykle vrátí k normálním či téměř normálním hodnotám do 4. týdne léčby.
Trvání léčby
Přípravek Lutrate Depot se podává jako intramuskulární injekce aplikovaná jednou za tři měsíce.
Obecně platí, že léčba pokročilého karcinomu prostaty přípravkem Lutrate Depot je dlouhodobá a nemá být přerušena ani při remisi nebo zlepšení stavu.
Zvláštní skupiny pacientů
Pediatrická populace
Bezpečnost a účinnost přípravku Lutrate Depot u pediatrických pacientů nebyla stanovena. Proto se nedoporučuje použití přípravku Lutrate Depot u dětí a dospívajících, dokud nebudou tato data dostupná.
Renální/hepatální nedostatečnost
Farmakokinetické vlastnosti přípravku Lutrate Depot nebyly stanoveny u pacientů s poruchou funkce jater či ledvin.
Starší pacienti
V klinických studiích provedených s přípravkem Lutrate Depot byl průměrný věk subjektů 71,0 ± 9,02 let. Údaje o přípravku tedy reflektují farmakokinetiku, účinnost a bezpečnost přípravku Lutrate Depot v této skupině pacientů.
Způsob podání
Přípravek Lutrate Depot musí být podáván pouze intramuskulárně. Nepodávejte jej žádnou jinou cestou. Pokud by byl přípravek náhodně podán subkutánně, pak musí být pacient pečlivě sledován, neboť údaje o podání přípravku Lutrate Depot jinou cestou než intramuskulární nejsou k dispozici. Informace o rekonstituci léčivého přípravku před podáním jsou uvedeny v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku, analoga hormonu uvolňujícího luteinizační hormon (LHRH) nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. V lékařské literatuře byly popsány anafylaktické reakce na syntetický LHRH nebo na analoga agonistů LHRH.
Předchozí orchiektomie.
Přípravek Lutrate Depot nesmí být užíván v monoterapii u pacientů s karcinomem prostaty a současně prokázanou kompresí míchy nebo míšními metastázami.
Přípravek Lutrate Depot není určen pro ženy.
Přípravek Lutrate Depot není určen pro pediatrické pacienty.
4.4 Zvláštní upozornění a opatření pro použití
V počátečních fázích léčby přípravkem Lutrate Depot se může, stejně jako u jiných agonistů LHRH, objevit přechodné zvýšení hladin testosteronu. V některých případech to může být spojeno se vzplanutím (flare) nebo exacerbací růstu nádoru, což má za následek dočasné zhoršení symptomů karcinomu prostaty. Tyto příznaky obvykle v průběhu léčby vymizí (viz bod 4.8). Vzplanutí samotné se může v některých případech projevit systémovými nebo neurologickými příznaky (jako je bolest kostí...). Při použití j iných agonistů LHRH byly popsány případy orchiatrofie a gynekomastie.
Léčba přípravkem má být ihned ukončena, objeví-li se u pacienta známky či symptomy naznačující anafylaxii/anafylaktickou reakci (dyspnoe, astma, rhinitis, angioneurotický edém nebo otok laryngu, hypotenze, urtikárie, vyrážka, pruritus nebo intersticiální pneumonitis). Pacienti by měli být před zahájením léčby poučeni o nutnosti přerušit léčbu a kontaktovat lékaře, jakmile se u nich objeví některý z výše uvedených symptomů. Pacienti, u nichž se již projevila hypersensitivita na leuprolid, by měli být pečlivě monitorování a přípravek Lutrate Depot by jim neměl být znovu podáván.
U pacientů léčených leuprorelin-acetátem byly pozorovány izolované případy ureterální obstrukce (s nebo bez hematurie) a komprese míchy nebo metastatické vertebrální léze, které mohou přispět k paralýze s nebo bez fatálních komplikací. Léčba pacientů s rizikem ureterální obstrukce, komprese míchy či metastatických vertebrálních lézí by měla být důkladně zvážena a pacienti by měli být v prvních týdnech léčby pečlivě monitorováni. U těchto pacientů by pak měla být zvážena profylaktická léčba antiandrogeny.
Pokud se objeví urologické/neurologické komplikace, je třeba aplikovat příslušná specifická opatření.
U pacientů léčených agonisty GnRH, jako je leuprorelin-acetát, je zvýšené riziko rozvoje deprese (která může být i závažná). Pacienti mají být s ohledem na toto riziko informováni a v případě výskytu depresivních symptomů léčeni odpovídajícím způsobem.
V lékařské literatuře bylo popsáno snížení kostní denzity u mužů, kteří podstoupili orchiektomii nebo kteří byli léčeni agonisty LHRH. Zavedení antiandrogenní terapie do léčebného režimu sice snižuje ztrátu kostní hmoty, ale zvyšuje riziko jiných nežádoucích účinků, jako jsou problémy se srážením krve či edém. Pokud jsou antiandrogeny podávány delší dobu, je třeba věnovat velkou pozornost kontraindikacím a opatřením spojeným s tímto používáním. Léčba pacientů s rizikem osteoporózy nebo s osteoporózou v anamnéze by měla být důkladně zvážena a pacienti by měli být pečlivě monitorováni v průběhu léčby leuprorelin-acetátem (viz bod 4.8).
Po podání leuprorelin-acetátu byla popsána hepatální dysfunkce a hepatitida se zvýšenými hladinami jaterních enzymů. Proto je nutné pečlivé sledování a případná aplikace příslušných opatření.
Odezva na terapii přípravkem Lutrate Depot by měla být sledována pomocí klinických parametrů a pravidelným měřením hladin testosteronu a PSA v séru.
U pacientů se mohou projevit změny metabolismu (např. intolerance glukózy nebo zhoršení již existujícího diabetu), hypertenze, změny tělesné hmotnosti nebo kardiovaskulární poruchy. Jak lze očekávat u této skupiny léků, může se rozvinout nebo zhoršit již existující diabetes, a tedy může být zapotřebí častější kontroly hladiny krevní glukózy u diabetických pacientů v průběhu léčby přípravkem Lutrate Depot. Před započetím léčby je nutno pečlivě zvážit léčbu pacientů s rizikem metabolických nebo kardiovaskulárních poruch a pak je adekvátně monitorovat v průběhu androgen-deprivační terapie. Léčba leuprorelin-acetátem má za následek potlačení hypofýzo-gonadálního systému. Výsledky diagnostických testů hypofýzo-gonádotropních a gonadálních funkcí provedených během a po léčbě leuprorelin-acetátem mohou být zkresleny.
U pacientů léčených leuprorelin-acetátem bylo hlášeno prodloužení protrombinového času. Leuprorelin-acetát by měl být podáván s opatrností pacientům s prokázanými krvácivými poruchami, trombocytopenií nebo léčených antikoagulancii.
Po podání leuprorelin-acetátu byly hlášeny křeče. Tyto případy se týkaly pacientů, kteří měli v anamnéze křeče, epilepsii, cerebrovaskulární poruchy, anomálie nebo tumory centrálního nervového systému a pacientů, kteří současně užívali přípravky, které mohou vyvolat křeče, jako je např. bupropion a selektivní inhibitory zpětného vychytávání serotoninu (SSRI). Křeče byly také hlášeny u pacientů bez přítomnosti výše uvedených podmínek.
Leuprorelin-acetát by měl být podáván s opatrností v případě kardiovaskulárního onemocnění (včetně kongestivního srdečního selhání), tromboembolismu, edému, deprese a hypofyzární apoplexie.
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedné injekční lahvičce. Je tedy v podstatě bez obsahu sodíku.
Androgen-deprivační léčba může prodlužovat QT interval.
Před zahájením léčby přípravkem Lutrate Depot by měl lékař zvážit poměr přínosů a rizik, včetně rizika torsade de pointes, u pacientů s rizikovými faktory pro prodloužení QT intervalu v anamnéze a u pacientů souběžně užívajících léčivé přípravky, které mohou prodlužovat QT interval (viz bod 4.5).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
S leuprorelin-acetátem nebyly provedeny žádné farmakokinetické studie interakcí. Vzhledem k tomu, že leuprorelin-acetát je peptid, jenž je primárně rozkládán peptidázou a nikoliv enzymy cytochromu P-450, jak je uvedeno ve specifických studiích, a také vzhledem k faktu, že léčivý přípravek se váže na plazmatické proteiny jen z přibližně 46 %, dá se předpokládat, že lékové interakce by se neměly objevovat.
Kvůli souvislosti androgen-deprivační léčby a prodloužení QT intervalu by měla být pečlivě zvážena souběžná léčba přípravkem Lutrate Depot s léčivými přípravky, o kterých je známo, že prodlužují QT interval, a léčba přípravky, které mohou vyvolat torsade de pointes, jako antiarytmika třídy IA (např. chinidin, disopyramid) nebo třídy III (např. amiodaron, sotalol, dofetilid, ibutilid), metadon, moxifloxacin, antipsychotika a další (viz bod 4.4.).
4.6 Fertilita, těhotenství a kojení
Těhotenství:
Přípravek Lutrate Depot není určen pro podávání těhotným ženám.
Injekce leuprorelin-acetátu může při podání v těhotenství způsobit poškození plodu.
Proto pokud je léčivo aplikováno během těhotenství, může dojít ke spontánnímu abortu.
Kojení:
Přípravek Lutrate Depot nemá být používán u kojících žen.
Fertilita:
Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie vlivu přípravku Lutrate Depot na schopnost řídit a obsluhovat stroje nebyly provedeny. Schopnost řídit a obsluhovat stroje však může být ovlivněna z důvodů poruch vidění a závratí.
4.8 Nežádoucí účinky
Bezpečnostní profil přípravku Lutrate Depot je založen na výsledcích klinické studie fáze III, v níž byli pacienti s karcinomem prostaty léčeni 2 intramuskulárními dávkami přípravku Lutrate Depot podanými v tříměsíčním intervalu a sledováni až po celkovou dobu 6 měsíců. Většina hlášených nežádoucích účinků přináleží zejména specifickému farmakologickému účinku leuprorelin-acetátu a je spojená s testosteron-supresní terapií.
Nejčastěji hlášené nežádoucí účinky přípravku Lutrate Depot jsou návaly horka, únava, astenie, hyperhidróza, nauzea a bolest kostí.
Následující nežádoucí účinky z klinických studií byly klasifikovány dle jednotlivých tříd orgánů a podle klesající incidence (velmi časté > 1/10, časté > 1/100 až < 1/10, méně časté > 1/1 000 až < 1/100, vzácné > 1/10 000 až < 1/1 000 a velmi vzácné < 1/10 000).
Tabulka 1
Frekvence výskytu nežádoucích účinků během terapie přípravkem Lutrate Depot
|
Třída orgánových systémů |
Frekvence výskytu |
Nežádoucí účinek |
|
Poruchy metabolismu a výživy |
Časté |
Snížená chuť k jídlu |
|
Méně časté |
Hypercholesterolémie | |
|
Psychiatrické poruchy |
Časté |
Insomnie, snížené libido, při dlouhodobém používání změny nálady a deprese |
|
Méně časté |
Poruchy spánku, emoční změny, úzkost, vztek, při krátkodobém používání změny nálady a deprese | |
|
Poruchy nervového systému |
Časté |
Závratě |
|
Méně časté |
Poruchy chuti, mravenčení, bolest hlavy, letargie | |
|
Poruchy oka |
Méně časté |
Rozostřené vidění |
|
Respirační, hrudní a mediastinální poruchy |
Méně časté |
Pleuritida |
|
Není známo |
Pneumonitida, intersticiální onemocnění plic | |
|
Poruchy ucha a labyrintu |
Méně časté |
Tinnitus |
|
Cévní poruchy |
Velmi časté | |
|
Časté |
Návaly | |
|
Gastrointestinální poruchy |
Časté | |
|
Méně časté |
Bolest v horní části břicha, zácpa | |
|
Poruchy kůže a podkožní tkáně |
Časté |
Hyperhidróza, pruritus, studený pot |
|
Méně časté |
Pupínky, vyrážka, generalizovaný pruritus, noční pocení | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté |
Bolest kostí, artralgie |
|
Méně časté |
Bolest zad, muskuloskeletální bolest, bolest krku | |
|
Poruchy ledvin a močových cest |
Časté |
Polakisurie, nykturie, bolest močových cest, snížení proudu moči |
|
Poruchy reprodukčního systému a prsu |
Časté |
Erektilní dysfunkce |
|
Méně časté |
Bolestivost prsních bradavek, pánevní bolest, atrofie varlat, poruchy varlat | |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Únava, asténie, bolest, lokální nežádoucí účinky (viz tabulka 2) |
|
Méně časté |
Pocit horka, hyperhidróza | |
|
Vyšetření |
Časté |
Zvýšená alanin-aminotrasferáza, zvýšená aspartam-aminotransferáza, zvýšené hodnoty triglyceridů, kreatinin fosfokinázy a glukózy v krvi |
|
Méně časté |
Zvýšené krevní hodnoty vápníku, kreatininu a laktát dehydrogenátu, snížení nebo zvýšení draslíku v krvi, zvýšená močovina v krvi, prodloužení nebo zkrácení QT intervalu na elektrokardiogramu (viz bod 4.4 a 4.5), inverze T křivky na elektrokardiogramu, zvýšená gama-glutamyltransferáza, snížení glomerulární filtrace, snížený hematokrit, abnormální hematologické testy, snížený hemoglobin, zvýšený průměrný objem buněk, snížený počet červených krvinek, zvýšený objem zbytkové moči |
S ohledem na závažnost, 84,7 % všech nežádoucích účinků spojených s léčbou bylo mírného nebo středního stupně. Nejčastěji hlášenými nežádoucími účinky byly návaly horka (77,3 %), 57,7 % návalů horka bylo hlášeno jako mírné a 17,2 % jako střední závažnosti. 5 případů návalů horka (3,1 %) bylo hlášeno jako závažné.
Během studie bylo 24 pacienty (14,7 %) hlášeno celkem 38 lokálních nežádoucích účinků v místě aplikace.
Lokální nežádoucí účinky po podání přípravku Lutrate Depot jsou podobné lokálním nežádoucím účinkům souvisejícím s podobnými přípravky podávanými formou intramuskulární injekce. Nejčastěji hlášené nežádoucí účinky byly bolest, erytém a indurace v místě vpichu. Méně časté nežádoucí účinky byly diskomfort, kopřivka a pocit tepla v místě vpichu, bolest v místě napíchnutí cévy, artralgie, muskuloskeletální bolest a hemoragie v místě vpichu (Tabulka 2).
Tabulka 2
Četnost výskytu lokálních nežádoucích účinků u pacientů během terapie přípravkem Lutrate Depot
|
Primární třída orgánových systémů* Celkové poruchy a reakce v místě aplikace - frekvence |
Pacienti s lokálními nežádoucí účinky |
% |
|
Velmi časté |
Bolest v místě vpichu |
10,4 |
|
Časté |
Erytém v místě vpichu |
3,1 |
|
Zatvrdnutí v místě vpichu |
2,5 | |
|
Méně časté |
Diskomfort v místě vpichu |
0,6 |
|
Kopřivka v místě vpichu |
0,6 | |
|
Pocit tepla v místě vpichu |
0,6 | |
|
Hemoragie v místě vpichu |
0,6 | |
|
Artralgie |
0,6 | |
|
Muskuloskeletální bolest |
0,6 | |
|
Bolest v místě napíchnutí cévy |
0,6 |
* Subjekty mohou být zařazeny pod více než jednu kategorii.
Uvedené reakce byly hlášeny jako nezávazné a mírné nebo střední. Žádný pacient nepřerušil léčbu z důvodu lokálních nežádoucích účinků.
Další nežádoucí účinky hlášené v průběhu léčby leuprorelin-acetátem zahrnovaly:
Periferní edém, pulmonální embolismus, palpitaci, myalgii, svalovou slabost, třesavku, periferní vertigo, vyrážku, amnézii, poruchy vidění a změny citlivosti kůže. Vzácně byl po podání krátkodobě i dlouhodobě působících agonistů LHRH hlášen infarkt preexistujícího adenomu hypofýzy. Vzácně byly hlášeny případy trombocytopenie a leukopenie. Hlášeny byly změny glukózové tolerance.
Změny v hustotě kostí
V lékařské literatuře bylo popsáno snížení kostní denzity u mužů, kteří podstoupili orchiektomii nebo kteří byli léčeni agonisty LHRH. Při dlouhodobé léčbě leuprorelinem lze očekávat nárůst příznaků osteoporózy. Údaje o zvýšeném riziku zlomenin v důsledku osteoporózy jsou uvedeny v bodě 4.4.
Exacerbace příznaků a projevů onemocnění
Léčba leuprorelin-acetátem může způsobit zhoršení příznaků a projevů onemocnění během prvních několika týdnů. Pokud dojde ke zhoršení stavů jako např. vertebrálních metastáz a/nebo obstrukce močových cest nebo hematurie, mohou nastat neurologické potíže, jako je slabost a/nebo parestézie dolních končetin nebo zhoršení příznaků týkajících se močových cest (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48 100 41 Praha 10
Webové stránky: http://www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Klinická data o akutním předávkování přípravkem Lutrate Depot nebo leuprorelin-acetátem nejsou dostupná. V klinických studiích při subkutánním denním podávání leuprorelinu pacientům s karcinomem prostaty nevyvolaly dávky 20 mg/den podávané po dobu až 2 let žádné jiné nežádoucí účinky než ty, které byly pozorovány při dávce 1 mg/den.
Ve studiích se zvířaty vyvolaly dávky až 500násobně vyšší než humánní doporučená denní dávka dyspnoe, sníženou aktivitu a lokální podráždění v místě vpichu.
V případě předávkování by měli být pacienti pečlivě monitorováni a léčba by měla být symptomatická a podpůrná.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Endokrinní terapie. Hormony a příbuzné látky. Analogy gonadotropin-releasing hormonu, ATC kód: L02AE02.
Chemický název leuprorelin-acetátu je 5-oxo-L-prolyl-L-histidyl-L-tryptophyl-L-seryl-L-tyrosyl-D-leucyl-L-leucyl-L-arginyl-L-prolyl-ethylamid.
Po perorálním podání je leuprorelin-acetát neaktivní vzhledem ke špatné membránové permeabilitě a téměř kompletní inaktivaci intestinálními proteolytickými enzymy.
Leuprorelin-acetát je silný agonista LHRH při krátkodobé nebo intermitentní léčbě, avšak při kontinuálním podávání analoga LHRH indukují inhibici gonadotropinové sekrece a supresi testikulární steroidogeneze.
Po navázání na LHRH receptory hypofýzy vyvolá leuprorelin-acetát počáteční zvýšení cirkulujících hladin luteinizačního hormonu (LH) a folikuly stimulujícího hormonu (FSH), což vede k rychlému vzestupu hodnot testosteronu a dihydrotestosteronu. Avšak po 5 až 8 dnech od podání přípravku způsobí analoga LHRH desensitizaci LHRH receptorového komplexu a/nebo potlačení (down-regulaci) funkce adenohypofýzy. Vzhledem k tomu, že se na povrchu buněk nachází méně receptorů, je buněčná stimulace snížena a syntéza a sekrece gonadotropinu je nižší. Po několika týdnech terapie agonistou LHRH je sekrece LH a FSH nakonec potlačena. V důsledku toho Leydigovy buňky ve varlatech přestávají produkovat testosteron a koncentrace testosteronu v séru v průběhu 2 až 4 týdnů po zahájení léčby klesá na kastrační úroveň (méně než 0,5 ng/ml).
Do otevřené, multicentrické klinické studie s opakovanými dávkami přípravku Lutrate Depot bylo zahrnuto 163 pacientů s karcinomem prostaty. Ve studii byla hodnocena účinnost a bezpečnost přípravku Lutrate Depot při podávání pacientům s karcinomem prostaty, kteří mohli mít prospěch z androgen-deprivační terapie. Přípravek Lutrate Depot byl podáván intramuskulárně ve 2 dávkách s 3měsíčním intervalem.
Hladiny testosteronu byly monitorovány v různých dnech v průběhu 168 dnů. Schéma vzorkování testosteronu bylo v den 0 (1 a 4 hodiny), 2, 14, 28, 56, 84 před dávkou, 84 (1 a 4 hodiny), 86, 112 a 168. Primární cílový parametr účinnosti byl definován jako hodnota testosteronu < 0,5 ng/ml a žádné chybějící údaje z hodnocení ve dnech 28, 84 a 168. Jestliže byla hodnota testosteronu vyšší než 0,5 ng/ml nebo chyběly hodnoty testosteronu v klíčových bodech (tj. den 28, 84 a 168), pak byla léčba pacienta klasifikována jako selhání, pokud však nebyly chybějící údaje důsledkem událostí, jako je například úmrtí bez souvislosti s hodnoceným přípravkem. Zejména v případě chybějící údajů v klíčových bodech (den 28, 84 a 168) v důsledku nežádoucích účinků souvisejících se studií byl takový případ klasifikován jako selhání.
Střední hladiny testosteronu po první injekci rychle vzrostly z výchozí hladiny (4,09 ± 1,79 ng/ml) a dosáhly maximálních hladin (Cmax) 6,33 ± 3,40 ng/ml druhý den. Po dosažení maxima, hladiny testosteronu klesaly a do 28. dne 98,8 % (159/161) hodnotitelných pacientů dosáhlo kastrační úrovně (definována jako testosteron méně než 0,5 ng/ml). Navíc, ve stejném bodě 77,0 % pacientů dosáhlo přísnější hladiny testosteronu < 0,2 ng/ml (obrázek 1). Do 168. dne dosáhlo 99,4 % hodnotitelných pacientů (150/151) hladiny testosteronu pod 0,5 ng/ml a 90,7 % dosáhlo hladiny < 0,2 ng/ml. Vzhledem ke stanovenému primárnímu cílovému parametru účinnosti (viz výše) byla míra pacientů udržující si kastrační hladiny v průběhu studie 98,1 % (158/161).
Obrázek 1
Střední (± SD) plasmatická hladina testosteronu v průběhu léčby 2 i.m. injekcemi přípravku Lutrate Depot podanými s 3měsíčním intervalem
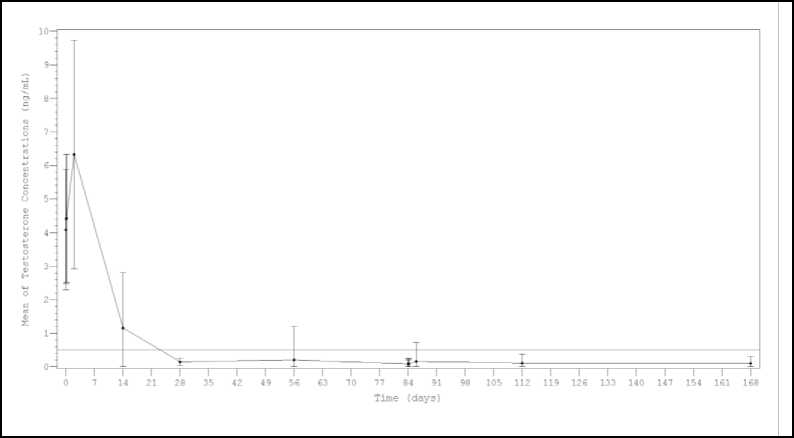
Mean of testosterone concentrations (ng/mL) - Střední hodnoty koncentrací testosteronu (ng/ml) Time (days) - Čas (dny)
Výsledky provedené analýzy senzitivity za předpokladu, že jednotlivá zvýšení testosteronu (escapes) nebo chybějící údaje byly považovány za selhání, ukázaly kastrační hodnoty kolem nebo nad 92 % v každém časovém bodě (den 28, 97,5 % (157/161); den 56, 93,2 % (150/161); den 84před dávkou, 96.9 % (156/161); den 84^ hodina po dávce, 91,9 % (148/161); den 844 hodiny po dávce, 91,9 % (148/161); den 86, 93,8 % (151/161); den 112, 92,5 % (149/161) a den 168, 93,2 % (150/161)).
Frekvence zvýšených hladin testosteronu (escapes) ihned po druhém podání byla 6,8 % (11/161) a frekvence přetrvávající odpovědi (breakthrough) byla 6,2 % (10/161). Žádné přechodné zvýšení nebylo spojeno se zvýšením LH, klinickými projevy nebo zvýšením PSA.
Nebyly hlášeny žádné nežádoucí účinky spojené s léčbou, které by naznačovaly klinické známky flare testosteronu (retence moči, komprese míchy nebo zhoršení bolesti kostí) u žádného pacienta se zvýšenou hladinou testosteronu.
Sekundární cílový parametr účinnosti zahrnoval měření sérových koncentrací LH, FSH a PSA. Do 14 dnů po první injekci přípravku Lutrate Depot, klesla průměrná sérová hladina LH a FSH pod výchozí koncentrace. Od 28. dne koncentrace zůstávaly hluboko pod výchozí hodnotou koncentrace až do konce studie. Střední sérové hladiny PSA v průběhu léčby postupně klesaly (první měsíc) a dále zůstávaly pod výchozí hladinou až do konce studie. V průběhu studie byla však dle očekávání pozorována široká interindividuální variabilita v koncentracích PSA.
5.2 Farmakokinetické vlastnosti
Absorpce
Po dvou postupných injekcích přípravku Lutrate Depot podávaných s 3měsíčním intervalem pacientům s karcinomem prostaty (N = 30) byla maximální plasmatická koncentrace leuprorelin-acetátu v těchto 2 cyklech podobná. Po prvním podání (Den 0 - 84) byla Cmax 46,79 ± 18,008 ng/ml. Střední čas pro dosažení Cmax (Tmax) byl 0,07 dne, což odpovídá 1,68 hod (rozmezí 1,008 - 4,008 hod).
Distribuce v organismu
Studie distribuce nebyly s přípravkem Lutrate Depot provedeny. Avšak, u zdravých mužských dobrovolníků byl průměrný distribuční objem v ustáleném stavu leuprorelin-acetátu po i.v. bolusu 1,0 mg 27 l. Při hodnocení in vitro kolísala vazba na lidské plazmatické proteiny od 43 % do 49 %.
Eliminace z organismu
Studie metabolismu nebo exkrece nebyly s přípravkem Lutrate Depot provedeny.
Předpokládá se, že leuprorelin je metabolizován na menší inaktivní peptidy, které mohou být vyloučeny nebo dále katabolizovány.
Podání dávky 1,0 mg leuprorelin-acetátu zdravým mužským dobrovolníkům jako i.v. bolus ukázalo, že střední systémová clearance byla 7,6 l/h s terminálním eliminačním poločasem přibližně 3 hodiny -založeno na 2kompartmentovém modelu.
Po podání leuprorelin-acetátu 3 pacientům bylo méně než 5 % dávky vyloučeno močí v nezměněné formě a ve formě metabolitu M-I.
Zvláštní skupiny pacientů
Renální/hepatální nedostatečnost
Farmakokinetika léčivého přípravku nebyla stanovena u pacientů s poruchou funkce ledvin nebo jater.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních studií bezpečnosti, farmakologie, toxicity po opakovaném podání a genotoxicity provedených s leuprorelin-acetátem neprokázaly žádné zvláštní nebezpečí pro humánní použití.
Dle očekávání v souladu se známými farmakologickými vlastnostmi, prokázaly ne-klinické studie reverzibilní účinky na reprodukční systém. Ve studiích reprodukční toxicity nebyla zjištěna žádná teratogenita leuprorelin-acetátu. U králíků však byla pozorována embryotoxicita/letalita.
Studie kancerogenity provedené na potkanech, jimž byl leuprorelin-acetát podáván subkutánně (0,6 - 4 mg/kg/den), ukázaly nárůst hypofyzárních adenomů v závislosti na dávce. Dále bylo pozorováno signifikantní zvýšení, ale nezávislé na dávce, výskytu adenomů pankreatických Langerhansových buněk u samic a testikulárních intersticiálních adenomů u samců, přičemž nejvyšší incidence byla zjištěna u skupiny, jíž byla podávána nízká dávka. Podávání leuprorelin-acetátu vedlo k inhibici růstu určitých hormon-dependentních nádorů (prostatické tumory u potkaních samců Noble a Dunning a DMBA-indukované tumory mléčných žláz u potkaních samic). Ve studiích kancerogenity na myších však tyto účinky pozorovány nebyly. Studie kancerogenity s přípravkem Lutrate Depot nebyly provedeny.
Studie in vitro a in vivo ukázaly, že leuprorelin-acetát není mutagenní. Studie mutagenity s přípravkem Lutrate Depot nebyly provedeny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Lyofilizát (injekční lahvička):
Polysorbát 80 Mannitol (E421)
Sodná sůl karmelosy (E466)
Triethyl-citrát Kyselina polymléčná
Rozpouštědlo (předplněná injekce):
Mannitol (E421)
Hydroxid sodný (k úpravě pH)
Kyselina chlorovodíková 35 % (k úpravě pH)
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
Pro rekonstituci přípravku Lutrate Depot nesmí být použito jiné rozpouštědlo, než sterilní rozpouštědlo dodávané s přípravkem.
6.3 Doba použitelnosti
3 roky (neotevřené)
Po rekonstituci rozpouštědlem použijte vzniklou suspenzi okamžitě.
6.4 Zvláštní opatření pro uchovávání Uchovávejte při teplotě do 25 °C. Chraňte před mrazem.
6.5 Druh obalu a obsah balení
Komerční kit obsahuje:
1. Jednu (1) skleněnou injekční lahvičku (sklo hydrolytické třídy I) obsahující 22,5 mg leuprorelin-acetátu ve formě lyofilizovaného prášku, injekční lahvička je uzavřená elastomerovou zátkou a hliníkovým uzávěrem s plastovým odtrhovacím krytem
2. Jednu (1) skleněnou předplněnou injekční stříkačku (sklo hydrolytické třídy I) obsahující 2 ml rozpouštědla, uzavřenou elastomerovým krytem.
3. Jeden (1) adaptační systém - polykarbonát/HDPE včetně jedné (1) sterilní jehly velikosti 20G.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Způsob podání
Injekční lahvička s přípravkem Lutrate Depot ve formě mikrosférického prášku se rekonstituuje těsně před podáním intramuskulární injekce. Nutné je zajištění aseptické techniky.
Rekonstituovaný přípravek je mléčně bílá suspenze.
Pro rekonstituci přípravku Lutrate Depot nesmí být použito žádné jiné rozpouštědlo než rozpouštědlo přiložené v balení.
Přípravek Lutrate Depot rekonstituujte dle následujících instrukcí:
2

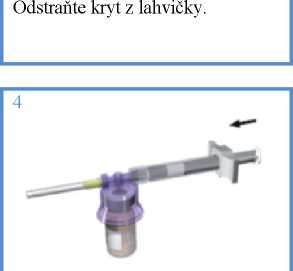
Držte stříkačku, dobře spojenou s lahvičkou, ve vzpřímené poloze a zvolna stlačujte píst, abyste přemístili všechno rozpouštědlo do injekční lahvičky.
Nasaďte adaptační systém (fialový) na injekční lahvičku až do slyšitelného zacvaknutí.
3
Připojte bílou úchytku k injekční stříkačce s rozpouštědlem. Sejměte gumový kryt ze stříkačky a připojte ji k adaptačnímu systému.
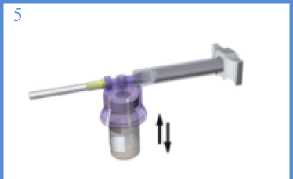
S injekční lahvičkou, stále spojenou se stříkačkou, jemně třepejte po dobu asi jedné minuty do získání homogenní mléčně bílé suspenze.
6

Otočte celý systém dnem vzhůru a opatrně vytahujte píst, abyste natáhli suspenzi léčiva z injekční lahvičky do injekční stříkačky.
7

Otáčením horní části adaptačního systému proti směru hodinových ručiček odpojte stříkačku a jehlu. Léčivý přípravek je připraven k aplikaci.
8
Očistěte místo vpichu tampóny vlhčenými alkoholem a nechte kůži oschnout. Aplikujte injekci suspenze intramuskulárně do vnějšího horního kvadrantu hýžďového svalu.
Na stěnách injekční lahvičky mohou ulpět zbytky přípravku, což není na závadu. Během výroby přípravku je injekční lahvička naplněna nadbytkem produktu, aby se zajistila konečná dávka 22,5 mg leuprorelin-acetátu.
Přípravek je určen k jednorázovému podání. Veškerý zbylý roztok musí být zlikvidován.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Angelini Pharma Osterreich GmbH Gewerbestrasse 18 - 20 Gewerbegebiet Klein-Engersdorf 2102 Bisamberg Rakousko
8. REGISTRAČNÍ ČÍSLO 44/301/15-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 8.7.2015
10. DATUM REVIZE TEXTU
29.7.2015
12