Gammagard S/D
sp.zn. sukls132128/2016 sukls173503/2016
Příbalová informace: informace pro uživatele
GAMMAGARD S/D
Prášek a rozpouštědlo pro infuzní roztok Immunoglobulinum humanum normále ad usum intravenosum (IVIg)
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek GAMMAGARD S/D a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek GAMMAGARD S/D používat
3. Jak se přípravek GAMMAGARD S/D používá
4. Možné nežádoucí účinky
5. Jak přípravek GAMMAGARD S/D uchovávat
6. Obsah balení a další informace
1. Co je přípravek GAMMAGARD S/D a k čemu se používá
Přípravek GAMMAGARD S/D patří do skupiny léčiv nazývaných imunoglobuliny. Tato léčiva obsahují lidské protilátky, které jsou přítomny v lidské krvi. Protilátky pomáhají Vašemu tělu bojovat s infekcemi. Léčiva jako je přípravek GAMMAGARD S/D se používají tehdy, když nemáte v krvi dostatečné množství protilátek. Takoví pacienti jsou náchylní k častým infekcím. Přípravek GAMMAGARD S/D lze také použít, pokud potřebujete doplňující protilátky k léčbě určitých zánětlivých onemocnění (autoimunních onemocnění).
Přípravek GAMMAGARD S/D se používá k:
Léčbě pacientů s nedostatečným množstvím protilátek (substituční léčba). Existuje šest skupin:
1. Pacienti s vrozeným nedostatkem protilátek (syndromy primárního imunodeficitu-PID), například:
- vrozená agamaglobulinémie nebo hypogamaglobulinémie
- běžný variabilní imunodeficit
- těžké kombinované imunodeficity
- Wiskott-Aldrichův syndrom
2. Pacienti s nádorem krve (chronická lymfatická leukémie), který vede ke snížené tvorbě protilátek a opakovaným infekcím tam, kde selhala preventivní léčba antibiotiky
3. Pacienti s nádorem kostní dřeně (mnohočetný myelom) a sníženou tvorbou protilátek s opakovanými infekcemi, kteří nereagují na vakcinaci proti určitým typům bakterií (pneumokoky)
4. Děti a adolescenti (věk 0 - 18 let) s vrozeným AIDS, kteří trpí častými infekcemi
5. Pacienti se sníženou tvorbou protilátek po transplantaci buněk kostní dřeně od jiné osoby
6. Nezralé děti s nízkou porodní hmotností a rizikem infekce
Léčbě pacientů s určitými zánětlivými onemocněními (imunomodulace). Existují tři skupiny:
1. Pacienti, kteří mají nedostatek krevních destiček (primámí/idiopatická trombocytopenická purpura, ITP) a kteří j sou vystaveni vysokému riziku krvácení nebo podstoupí v blízké budoucnosti chirurgický výkon
2. Pacienti s onemocněním charakterizovaným mnohočetnými záněty nervů v celém těle (Guillain-Barrého syndrom)
3. Pacienti s onemocněním, které způsobuje mnohočetné záněty různých tělesných orgánů (Kawasakiho choroba)
2. Čemu musíte věnovat pozornost, než začnete přípravek GAMMAGARD S/D používat
Nepoužívejte přípravek GAMMAGARD S/D:
• jestliže jste alergický(á) na imunoglobuliny nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
• jestliže trpíte deficitem (nedostatkem) imunoglobulinu A. Můžete mít ve Vaší krvi protilátky proti imunoglobulinu A. GAMMAGARD S/D však obsahuje pouze velmi malé množství IgA (méně než 3 pg/ml v 5% roztoku).
Upozornění a opatření
Před použitím přípravku GAMMAGARD S/D se poraďte se svým lékařem nebo lékárníkem.
Zvláštní opatrnosti při použití přípravku GAMMAGARD S/D je zapotřebí:
Potřebná doba monitorování během infuze
- Během infuze přípravku GAMMAGARD S/D budete pečlivě sledován(a), aby se vyloučila jakákoli reakce. Váš lékař se vždy ujistí, že rychlost infuze přípravku GAMMAGARD S/D je pro Vás vhodná.
- pokud je rychlost podání přípravku GAMMAGARD S/D příliš vysoká
- trpíte-li stavem s nízkou hladinou protilátek v krvi (hypogamaglobulinémie nebo agamaglobulinémie)
- pokud jste dosud nebyl(a) tímto přípravkem léčen(a)
- pokud od jeho posledního podání uplynula dlouhá doba (například několik týdnů)
- V takových případech budete během celé infuze a po dobu jedné hodiny po ní pečlivě sledován(a).
- pokud Vám byl přípravek GAMMAGARD S/D j iž dříve podán a poslední dávku j ste dostal(a) nedávno, budete sledován (a) pouze během infuze a nejméně 20 minut po infuzi.
Kdy může být nutné zpomalení nebo úplné zastavení infuze
Vzácně se může stát, že Vaše tělo bude citlivé na léčiva obsahující protilátky. K takové situaci může především dojít, pokud trpíte nedostatkem imunoglobulinu A. V těchto vzácných případech se u Vás mohou vyskytnout alergické reakce, například náhlý pokles krevního tlaku nebo šok, i když jste už byl(a) v minulosti přípravky obsahujícími protilátky léčen(a)
- Pokud se u Vás vyskytne některý z následujících nežádoucích účinků, oznamte to ihned svému lékaři nebo zdravotní sestře:
o náhlé sípání, ztížené dýchání nebo svíravý pocit na hrudi
o horečka
o otok víček, obličeje, rtů nebo krevních cév
o boule na kůži nebo svědivé červené skvrny
o svědění celého těla
Dle rozhodnutí Vašeho ošetřujícího lékaře může být infuzní rychlost zpomalena nebo může být infuze zastavena.
Zvláštní skupiny pacientů
- Váš lékař bude zvláště pozorný, pokud máte nadváhu, pokročilý věk, cukrovku nebo pokud jste imobilizován(a).
Váš lékař Vás bude pečlivě sledovat pokud:
o máte vysoký krevní tlak
o nízký objem krve (hypovolemii)
o zvýšenou viskozitu krve nebo potíže s cévami (cévní onemocnění).
V těchto situacích mohou imunoglobuliny zvýšit riziko vzniku srdeční příhody, mozkových příhod, plicní embolie nebo hluboké žilní trombózy, ačkoli k tomu dochází jen ve velmi vzácných případech.
Informujte svého lékaře, pokud trpíte cukrovkou. Přípravek GAMMAGARD S/D neobsahuje sacharózu ani maltózu. Tento léčivý přípravek obsahuje jako pomocnou látku 20 mg glukózy v jednom ml (400 mg/g IgG), což by mohlo ovlivnit hladinu cukru ve Vaší krvi. Pacient o hmotnosti 70 kg, kterému je podána infuze 1 g/kg přípravku GAMMAGARD S/D, by měl obdržet 28 gramů glukózy (112 kalorií).
- Váš lékař bude také zvlášť opatrný pokud
o máte nebo jste dříve měl(a) potíže s ledvinami nebo
o užíváte léčivé přípravky, které mohou Vaše ledviny poškodit (nefrotoxická léčiva),
protože existuje vzácná možnost akutního selhání ledvin. Informujte prosím svého lékaře, pokud trpíte onemocněním ledvin. o Obsah proteinu může vést k vyšší viskozitě krve.
Informace o zdrojovém materiálu přípravku GAMMAGARD S/D
Přípravek GAMMAGARD S/D je vyroben z lidské plazmy (tekuté složky krve). Při výrobě léčivých přípravků z lidské krve nebo plazmy je dodržována řada opatření zabraňujících přenosu infekce na pacienty. Patří sem pečlivý výběr dárců krve a plazmy, který vylučuje možné přenašeče infekčních onemocnění, a testování každého vzorku plazmy na přítomnost virů a infekcí. Do procesu zpracování krve a plazmy zahrnují výrobci kroky, při nichž jsou inaktivovány nebo odstraněny viry. Přes všechna tato opatření při přípravě léků vyráběných z lidské krve nebo plazmy nelze možnost přenosu infekce zcela vyloučit. To platí i pro jakékoli neznámé nebo vznikající viry či jiné infekce.
Přijatá opatření při výrobě přípravku GAMMAGARD S/D jsou pokládána za účinná u tzv. obalených virů, jako je virus lidské imunodeficience (HIV), virus hepatitidy B a virus hepatitidy C, a u neobalených virů hepatitidy A a parvoviru B19. Přípravek GAMMAGARD S/D také obsahuje určité protilátky, které mohou předcházet infekci virem hepatitidy A a parvovirem B19.
Další léčivé přípravky a přípravek GAMMAGARD S/D
Informujte, prosím, svého lékaře
• o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat nebo
• o jakémkoli očkování, které jste podstoupil(a) během posledních šesti týdnů.
Infuze imunoglobulinů jako je přípravek GAMMAGARD S/D může narušit účinnost některých živých virových vakcín, např. proti spalničkám, zarděnkám, příušnicím a planým neštovicím. Po podání přípravku GAMMAGARD S/D proto možná budete muset počkat až 3 měsíce před podáním živé atenuované vakcíny, která obsahuje živý oslabený virus. Před vakcinací proti spalničkám možná budete muset počkat po podání přípravku GAMMAGARD S/D až 1 rok.
Vliv na vyšetření krve
Přípravek GAMMAGARD S/D obsahuje širokou paletu různých protilátek. Některé z nich mohou ovlivnit výsledky krevních testů. Pokud je Vám odebírána krev, informujte, prosím, osobu, která odběr provádí, nebo svého lékaře o tom, že jste užíval(a) přípravek GAMMAGARD S/D.
Těhotenství a kojení
• Informujte, prosím, svého lékaře, pokud jste těhotná nebo kojíte. Váš lékař rozhodne, zda můžete přípravek GAMMAGARD S/D během těhotenství a kojení používat.
• Nebyly prováděny klinické studie s přípravkem GAMMAGARD S/D u těhotných a kojících žen. Léčiva s obsahem protilátek však byla po léta používána u těhotných a kojících žen a neočekává se jejich škodlivý vliv na průběh těhotenství nebo na dítě.
• Pokud kojíte a užíváte přípravek GAMMAGARD S/D, mohou se protilátky z léčiva objevit také v mateřském mléce. Proto může být vaše dítě chráněno před určitými infekcemi.
Řízení dopravních prostředků a obsluha strojů
U pacientů se během léčby přípravkem GAMMAGARD S/D mohou objevit reakce (např. závrať nebo nevolnost) ovlivňující schopnost řídit a obsluhovat stroje. Pokud se to stane, měl(a) byste počkat, až tyto reakce pominou.
Přípravek GAMMAGARD S/D obsahuje glukózu a sodík
Informujte svého lékaře, pokud jste diabetik. Přípravek GAMMAGARD S/D obsahuje max. 0,4 g glukózy, která by mohla ovlivnit hladiny Vašeho krevního cukru a kterou je třeba vzít v úvahu u pacientů s cukrovkou.
Přípravek GAMMAGARD S/D obsahuje 3,4 mg/ml sodíku. To je třeba vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku.
3. Jak se přípravek GAMMAGARD S/D používá
Přípravek GAMMAGARD S/D je určen k intravenóznímu podání (infuzí do žíly). Aplikaci provádí Váš lékař nebo zdravotní sestra. Dávkování a četnost infuzí se bude měnit podle Vašeho stavu a tělesné hmotnosti.
Na začátku infuze budete dostávat přípravek GAMMAGARD S/D pomalu. Podle toho, jak se cítíte, může potom Váš lékař postupně zvyšovat rychlost infuze.
Použití u dětí
U dětí (věk 0 - 18 let) platí stejné indikace, dávky a četnost infuzí jako u dospělých.
Jestliže jste použil(a) více přípravku GAMMAGARD S/D, než jste měl(a)
Předávkování může vést ke zhoustnutí krve (hyperviskozitě). Čím hustší bude Vaše krev, tím hůře bude protékat cévami Vašeho těla. V důsledku toho budou životně důležité orgány jako mozek, plíce atd. zásobovány menším množstvím kyslíku. K takové situaci může dojít především tehdy, jste-li rizikový pacient, například pokud jste v pokročilém věku nebo pokud máte potíže se srdcem nebo s ledvinami. Věnujte pozornost dostatečnému příjmu tekutin, aby nedošlo k dehydrataci, a informujte svého lékaře, pokud máte nějaké zdravotní obtíže.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Možné nežádoucí účinky však lze omezit zpomalením rychlosti infuze.
Po léčbě imunoglobuliny (léčivé přípravky jako je přípravek GAMMAGARD S/D) se obecně mohou objevit následující nežádoucí účinky:
• Časté nebo méně časté nežádoucí účinky (které se objevují u méně než 1 z 10, ale u více než 1 z 1000 pacientů) jsou zimnice, bolest hlavy, horečka, zvracení, alergické reakce, nevolnost, bolest kloubů, nízký krevní tlak a mírná bolest dolní části zad, anorexie.
• Vzácné nežádoucí účinky, které se objevují méně než 1 z 1 000 pacientů, jsou:
- případy náhlého poklesu krevního tlaku,
- případy ekzému a podobných reakcí (přechodné kožní reakce)
• Velmi vzácné nežádoucí účinky, které se objevují u méně než 1 z 10 000 pacientů nebo které nelze z dostupných údajů určit, jsou:
- ojedinělé případy alergických reakcí (anafylaktický šok), a to i tehdy, pokud se neobjevily reakce po předchozích infuzích,
- případy přechodné mozkové horečky (reverzibilní aseptická meningitida),
- izolované případy přechodného poklesu počtu červených krvinek (reverzibilní hemolytická anémie/hemolýza),
- přechodný vzestup hodnot jatemích testů (jatemí transaminázy), vzestup kreatininu v séru a selhání ledvin,
- tvorba sraženin v žilách (tromboembolické reakce), které mohou vést k srdeční příhodě, mozkové mrtvici, plicnímu postižení (embolie plic) a hluboká žilní trombóza.
Níže je uveden seznam nežádoucích účinků, které hlásili někteří pacienti během testování přípravku
GAMMAGARD S/D v klinických studiích a nežádoucích účinků hlášených z postmarketingové fáze:
• Velmi časté nežádoucí účinky (pozorované u více než 1 z 10 pacientů): žádné
• Časté nežádoucí účinky (pozorované u méně než 1 z 10 pacientů):
Bolest hlavy, zrudnutí, nevolnost, zvracení, únava, zimnice, horečka
• Méně časté nežádoucí účinky (pozorované u méně než 1 ze 100 pacientů):
Chřipka, úzkost, rozrušení, neobvyklá ospalost, zastřené vidění, pocit nepravidelné srdeční akce, dušnost, krvácení z nosu, průjem, bolest v horní části břicha, žaludeční nevolnost, zánět v ústech, svědění, kopřivka, studený pot, nadměrné pocení, bolest zad, svalová křeč, bolest končetiny, bolest na hrudi, nepříjemný pocit na hrudi, neobvyklý pocit, pocit chladu, pocit horka, onemocnění podobné chřipce, zarudnutí v místě vpichu, prosakování v místě vpichu, bolest v místě vpichu, pocit nemoci nebo nemoc, bolest, vysoký krevní tlak, kolísání krevního tlaku, ztráta chuti k jídlu
• Četnost není známa (z dostupných údajů nelze určit):
Zánět mozkových blan nezpůsobený bakteriální infekcí, rozpad červených krvinek, snížení počtu červených krvinek, snížení počtu krevních destiček, zduření lymfatických uzlin, alergické reakce různého stupně závažnosti včetně alergického šoku, neklid, závrať, abnormální pocit na kůži, mimovolný třes, křeče, krvácení do mozku, migréna, ztráta vědomí, světloplachost, poruchy vidění, bolest očí, uzávěr centrální oční žíly, srdeční infarkt, namodralý odstín kůže, zrychlená srdeční akce, zpomalená srdeční akce, vysoký krevní tlak, bledost, nízký krevní tlak, zánět žil, uzávěr krevních cév, kašel, napětí v krku, snížení hladiny kyslíku v krvi, dýchavičnost, sípot, křeč dýchacích cest, uzávěr krevních cév v plicích, tekutina v plicích, poruchy trávení, bolest břicha, zánět jater (nepřenosný), zarudnutí kůže, kožní výsevy, zánět kůže, alergický otok hlubokých kožních vrstev, bolest kloubů a svalů, selhání ledvin, celková slabost, otok tělesných tkání, reakce v místě injekce a infuze, zimnice, pozitivita Coombsova testu
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi.
Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové
informaci. Nežádoucí účinky můžete hlásit také přímo na adresu: Státní ústav pro kontrolu léčiv,
Šrobárova 48, 100 41 Praha 10, webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek. Nahlášením
nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek GAMMAGARD S/D uchovávat
• Uchovávejte tento přípravek mimo dohled a dosah dětí.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
• Nepoužívejte, pokud si všimnete cizorodých částic nebo změny barvy.
• Uchovávejte při teplotě do 25°C.
• Chraňte před mrazem.
• Uchovávejte v krabičce, aby byl přípravek chráněn před světlem.
6. Obsah balení a další informace Co přípravek GAMMAGARD S/D obsahuje
• Léčivou látkou je Immunoglobulinum humanum normale ad usum intravenosum (IVIg) 5 g
nebo 10 g v jedné injekční lahvičce. Přípravek GAMMAGARD S/D se rekonstituuje ve vodě na
injekci na 5% (50 mg/ml) nebo 10% (100 mg/ml) roztok proteinu. Nejméně 90% proteinu představuje imunoglobulin G (IgG).
• Pomocné látky jsou roztok lidského albuminu, glycin, chlorid sodný, monohydrát glukózy a voda na injekci.
Jak přípravek GAMMAGARD S/D vypadá a co obsahuje toto balení
Přípravek GAMMAGARD S/D je lyofilizovaný bílý nebo nažloutlý prášek, bez viditelných cizorodých částic. Přípravek GAMMAGARD S/D je dostupný ve velikostech balení 5 g a 10 g.
Každé balení obsahuje
• jednu injekční lahvičku s práškem 5 g nebo 10 g
• 96 ml nebo 192 ml vody na injekci v injekční lahvičce
• sterilní převodní zařízení a
• sterilní infuzní set s filtrem.
Držitel rozhodnutí o registraci a výrobce Držitel rozhodnutí o registraci
Do 30.11.2016
BAXTER CZECH spol. s.r.o.
Karla Engliše 3201/6 150 00 Praha 5 Česká republika
Od 1.12.2016
Baxalta Innovations GmbH Industriestrasse 67 A-1221 Vídeň Rakousko
Výrobce
Baxalta Belgium Manufacturing S.A.
Bd. R. Branquart 80 B-7860 Lessines Belgie
Tato příbalová informace byla naposledy revidována: 10.8.2016
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách SÚKL.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Zvláštní opatření pro uchovávání
Je-li rekonstituce prováděna asepticky mimo sterilní laminární box, měl by být přípravek podán co nejdříve, nejpozději do 2 hodin po rekonstituci. Je-li rekonstituce prováděna asepticky ve sterilním laminárním boxu, může být rekonstituovaný přípravek uchováván chlazený (2-8°C) po dobu až 24 hodin. Nejsou-li splněny tyto podmínky, nelze udržet sterilitu rekonstituovaného přípravku. Částečně spotřebované lahvičky je třeba zlikvidovat.
Rekonstituce - použijte aseptickou techniku
Zahřejte přípravek GAMMAGARD S/D a vodu na injekci (rozpouštědlo) na pokojovou teplotu. Tato teplota se musí udržovat až do úplného rozpuštění přípravku.
A. 5% roztok:
1. Odstraňte ochranné kryty z injekčních lahviček
2. Sejměte ochranný kryt z jednoho konce převodního zařízení. Nedotýkejte se přitom hrotu.
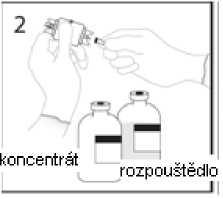
3a. Umístěte injekční lahvičku s rozpouštědlem na vodorovný povrch a propíchněte odkrytým hrotem uzávěr injekční lahvičky s rozpouštědlem v jeho středu.
UPOZORNĚNÍ: Není-li uzávěr injekční lahvičky propíchnut středem, může dojít k vytlačení uzávěru.
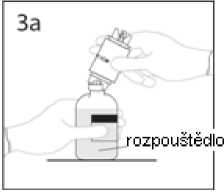
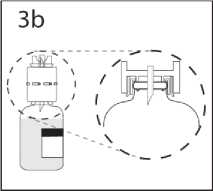
3b. Převodní zařízení pevně zatlačte dolů, aby v něm injekční lahvička pevně držela.
Převodní zařízení s připojenou injekční lahvičkou přidržte a sejměte kryt z druhého hrotu převodního zařízení. Nedotýkejte se přitom hrotu.
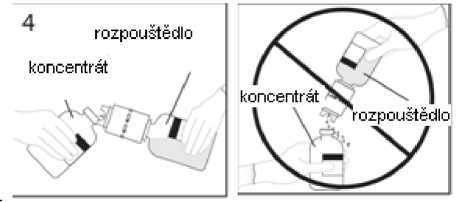
4. Injekční lahvičku s rozpouštědlem a připojenou převodní jehlou přidržte v úhlu k injekční lahvičce s práškem, abyste předešli vylití rozpouštědla.
Poznámka: nedržte injekční lahvičku s rozpouštědlem dnem vzhůru, aby nedošlo k vylití rozpouštědla
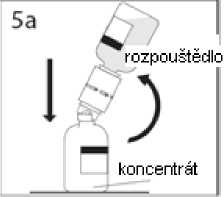
5a. Propíchněte injekční lahvičku s práškem středem uzávěru a současně rychle obraťte injekční lahvičku s rozpouštědlem dnem vzhůru, abyste zamezili vylití rozpouštědla.
UPOZORNĚNÍ: Není-li uzávěr injekční lahvičky propíchnut středem, může dojít k vytlačení uzávěru a ztrátě vakua.
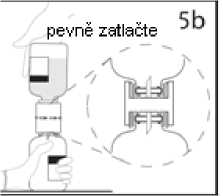
Převodní zařízení pevně zatlačte dolů, aby v něm injekční lahvička pevně držela.
5b.
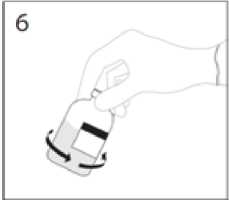
6. Když je přesun rozpouštědla ukončen, vytáhněte převodní zařízení a prázdnou injekční lahvičku s rozpouštědlem z injekční lahvičky s práškem. Injekční lahvičkou s práškem ihned jemně otáčejte, abyste obsah řádně promíchali.
UPOZORNĚNÍ: Netřepejte. Zabraňte zpěnění.
Jehlu, injekční stříkačku a zbytek rozpouštědla po použití zlikvidujte.
B. 10% roztok:
4. Odstraňte ochranné kryty z injekčních lahviček a očistěte uzávěry dezinfekčním roztokem.
5. Pro přípravu 10% roztoku je nutné odstranit polovinu objemu rozpouštědla. Objem rozpouštědla, který je třeba odstranit z injekční lahvičky s rozpouštědlem před napojením převodního zařízení je uveden v tabulce 2. Aseptickým postupem natáhněte nepotřebný objem rozpouštědla pomocí podkožní jehly do injekční stříkačky. Naplněnou injekční stříkačku a jehlu zlikvidujte.
6. S použitím zbývajícího objemu rozpouštědla pokračujte v krocích 2-6, jak jsou popsány v oddílu A.
TABULKA 2
Objem rozpouštědla, který je třeba odstranit
Koncentrace injekční lahvička 5 g injekčnílahvička 10 g
5% K rekonstituci 5% roztoku neodstraňujte žádné rozpouštědlo
10% 48 ml 96 ml
Podání - použijte aseptickou techniku.
Postupujte podle návodu na použití infuzního setu, který je součástí každého balení. Pokud použijete
jiný infuzní set, ujistěte se, že souprava obsahuje podobný filtr.
Návod k použití přípravku, zacházení s ním a k jeho likvidaci
• K úplnému rozpuštění by mělo dojít do 30 minut.
• Přípravek je třeba před použitím zahřát na pokojovou nebo tělesnou teplotu.
• Rekonstituovaný přípravek by měl tvořit čirý až lehce opalescentní, bezbarvý až světle žlutý roztok. Nepoužívejte roztoky, které jsou zakalené nebo obsahují depozita. Rekonstituované přípravky musí být před podáním vizuálně zkontrolovány, zda neobsahují částice nebo zda nemají změněnou barvu.
• Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
• Po jednorázovém použití zlikvidujte převodní zařízení.
Způsob podání
Pro intravenózní podání.
Pokud je to možné, doporučuje se podávat 10% roztok do antekubitálních žil. To může u pacienta snížit pravděpodobnost vzniku nepříjemných pocitů v místě vpichu.
Přípravek GAMMAGARD S/D 5% (50 mg/ml) má být podáván intravenózně úvodní rychlostí 0,5 ml/kg TH/hod. Obecně se doporučuje pomalejší zahájení infuze u pacientů, kteří začínají s léčbou přípravkem GAMMAGARD S/D nebo jsou převáděni z jiného intravenózního imunoglobulinu. Pokud dobře snášeli několik infuzí střední rychlosti, lze zrychlit až na maximální infuzní rychlost.
Pokud je dobře snášen, je možno rychlost podání postupně zvyšovat na maximální rychlost 4 ml/kg TH/hod. Pacientům, kteří snášejí infuzi 5% roztoku GAMMAGARD S/D při rychlosti podání 4 ml/kg TH/hod, je možno infundovat 10% koncentraci při počáteční rychlosti 0,5 ml/kg TH/hod. Pokud se neobjeví žádné nežádoucí účinky, je možno rychlost postupně zvyšovat až na maximální rychlost podání 8 ml/kg TH/hod.
Zvláštní upozornění
• Dojde-li k výskytu nežádoucí reakce v souvislosti s infuzí, je třeba snížit rychlost podávání infuze nebo ji zastavit.
• Při každé aplikaci přípravku GAMMAGARD S/D doporučujeme zaznamenat název a číslo šarže přípravku.
Inkompatibility
Přípravek GAMMAGARD S/D nesmí být mísen s jinými léčivými přípravky. Doporučuje se, aby přípravek GAMMAGARD S/D byl podáván odděleně od jiných léčivých přípravků, které pacient může dostávat.
Doporučené dávkování
|
Indikace |
Dávka |
Frekvence injekcí |
|
Substituční léčba u primárního imunodeficitu |
úvodní dávka: 0,4-0,8 g/kg TH poté: 0,2-0,8 g/kg TH |
každé 3-4 týdny pro zajištění minimální předinfuzní hladiny IgG alespoň 5-6 g/l |
|
Substituční léčba u sekundárního imunodeficitu |
0,2-0,4 g/kg TH |
každé 3-4 týdny pro zajištění minimální předinfuzní hladiny IgG alespoň 5-6 g/l |
|
Vrozený AIDS |
0,2-0,4 g/kg TH |
každé 3-4 týdny |
|
Nezralé děti s nízkou porodní hmotností (novorozenci mladší než 7 dnů) |
0,5 g/kg TH |
dvě injekce s odstupem 1 týdne, poté celkem 5 infuzí každých 14 dnů nebo do doby propuštění z nemocnice |
|
Hypogamaglobulinémie (< 4 g/l) u pacientů po alogenní transplantaci hematopoetických kmenových buněk |
0,2 - 0,4 g/kg TH |
každé 3-4 týdny pro zajištění minimální hladiny IgG nad 5 g/l |
|
- léčba infekcí a profylaxe reakce štěpu proti hostiteli |
0,2 - 0,4 g/kg TH |
každý týden ode dne 7 až do 3 měsíců po transplantaci |
|
- přetrvávající nedostatečná tvorba protilátek |
0,2 - 0,4 g/kg TH |
každý měsíc, dokud se hladiny protilátek nevrátí k normálu |
|
Imunomodulace: | ||
|
Primární imunitní trombocytopenie (Idiopatická trombocytopenická purpura) |
0,8-1 g/kg TH nebo 0,4 g/kg TH/d |
v den 1; je-li to možné, opakovat jednou během tří dnů po dobu 2-5 dnů |
|
Guillain-Barrého syndrom |
0,4 g/kg TH/d |
po dobu 5 dnů |
|
Kawasakiho choroba |
1,6-2 g/kg TH nebo 2 g/kg TH |
v rozdělených dávkách po dobu 2-5 dnů v kombinaci s kyselinou acetylsalicylovou v jedné dávce v kombinaci s kyselinou acetylsalicylovou |
10/10