Braltus 10 Mikrogramů/Dávka
sp. zn. sukls179422/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Braltus 10 mikrogramů/dávka Prášek k inhalaci v tvrdé tobolce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ"
Jedna tobolka obsahuje tiotropii bromidum 16 mikrogramů , což odpovídá tiotropium 13 mikrogramů. Jedna podaná dávka (dávka uvolněná z náustku inhalátoru Zonda) je tiotropium 10 mikrogramů.
Pomocná látka se známým účinkem
Jedna tobolka obsahuje 18 miligramů monohydrátu laktózy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek k inhalaci v tvrdé tobolce.
Bezbarvá, transparetní tobolka velikosti 3, obsahující bílý prášek.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Braltus je indikován k udržovací bronchodilatační léčbě ke zmírnění příznaků u pacientů s chronickou obstrukční plicní nemocí (CHOPN).
Přípravek Braltus je indikován k použití u dospělých.
4.2 Dávkování a způsob podání
Dávkování
Léčivý přípravek je určen k inhalačnímu podání.
Doporučené dávkování Dospělí 18 let věku a starší:
• Inhalace obsahu jedné tobolky j ednou denně pomocí Zonda inhalátoru.
• Inhalace má být každý den vždy ve stejnou denní dobu.
• Doporučená dávka nemá být překračována.
• Uvolněná dávka z j edné tobolky (10 mikrogramů) j e dostatečná a je standardní dávkou pro léčbu přípravkem Braltus.
• Tobolky přípravku Braltus jsou určeny pouze k inhalaci, nesmí být polykány.
• Tobolky přípravku Braltus musí být inhalovány pouze pomocí Zonda inhalátoru.
Zvláštní skupiny pacientů:
Starší pacienti mohou užívat tiotropium-bromid v doporučených dávkách.
Pacienti s mírnou poruchou funkce ledvin (clearance kreatininu > 50 ml/min) mohou užívat tiotropium-bromid v doporučených dávkách. Dávkování u pacientů se středně těžkým až těžkým postižením renálních funkcí (clearance kreatininu < 50 ml/min) viz bod 4.4. a bod 5.2.
Pacienti s poruchou jaterních funkcí mohou užívat tiotropium-bromid v doporučených dávkách (viz bod 5.2).
Pediatrická populace:
Přípravek Braltus nemá být používán u dětí a dospívajících do 18 let věku. Bezpečnost a účinnost nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Neexistuje žádné relevantní použití přípravku Braltus u pediatrické populace s CHOPN v indikaci.
Bezpečnost a účinnost tiotropium-bromidu u dětí a dospívajících do 18 let věku s cystickou fibrózou nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Instrukce pro používání a manipulaci
Lékař nebo jiný zdravotnický pracovník musí pacienta zacvičit v používání inhalátoru, aby bylo zajištěno řádné podávání léčivého přípravku.
Zonda inhalátor je navržen speciálně pro užívání přípravku Braltus, a nesmí být proto používán k aplikaci jiných léků. Tobolky přípravku Braltus musí být vdechnuty pouze pomocí Zonda inhalátoru. Pacienti nesmí používat jakékoli jiné inhalátory k aplikaci tobolek přípravku Braltus.
Zonda inhalátor má být používán pouze s konkrétní lahvičkou poskytnutých tobolek. Nepoužívejte inhalátor společně s další lahvičkou tobolek. Zařízení Zonda inhalátoru se nesmí používat po 15 použitích (pro balení po 15 tobolkách) nebo po 30 použitích (pro balení po 30 tobolkách), je třeba ho zlikvidovat.

|
1 |
Víčko |
|
2 |
Náustek |
|
3 |
Spodní část |
|
4 |
Prorážecí tlačítko |
|
5 |
Centrální komůrka |
1. Odklopte víčko směrem nahoru.
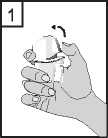
2. Držte spodní část inhalátoru pevně a otevřete náustek směrem nahoru, ve směru šipky.
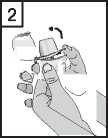
3. Vyjměte jednu tobolku přípravku Braltus z lahvičky bezprostředně před použitím a poté lahvičku zase dobře uzavřete. Umístěte tobolku do přihrádky ve tvaru tobolky ve spodní části inhalátoru. Neuchovávejte tobolky v Zonda inhalátoru.
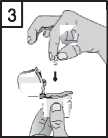
4. Nikdy nevkládejte tobolku přímo do náustku.
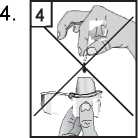
5. Uzavřete pevně náustek až do jeho zaklapnutí, horní víčko ponechte odklopené.
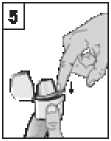
6. Držte inhalátor náustkem vzhůru a v plném rozsahu stiskněte pouze jednou prorážecí tlačítko směrem dovnitř, a poté jej uvolněte. Dojde k proděravění tobolky, a tím k uvolnění léku pro vdechnutí.
0

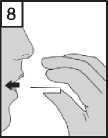
7. Úplně vydechněte. Je důležité, abyste nikdy nevydechoval(a) do náustku.

8. Vložte inhalátor do úst a hlavu držte ve vzpřímené poloze. Sevřete rty náustek a pomalu a hluboce se nadechněte tak, abyste slyšel(a) nebo cítil(a), jak tobolka uvnitř vibruje. Poté zadržte dech po dobu, kterou jste schopni bez potíží vydržet a současně vyjměte inhalátor z úst.
Začněte opět normálně dýchat. Opakujte ještě jednou kroky 7 a 8, čímž dojde k úplnému spotřebování obsahu tobolky.
9. Po použití otevřete opět náustek a vysypte prázdnou tobolku. Před uložením Zonda inhalátoru uzavřete náustek a víčko.
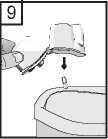
Tobolky přípravku Braltus obsahují jen malé množství prášku, proto se mohou jevit jako pouze částečně naplněné.
Pokud je to nutné, může pacient po použití otřít náustek inhalátoru suchým hadříkem.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku tiotropium bromid, atropin nebo jeho deriváty, např. ipratropium nebo oxitropium nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1, včetně monohydrátu laktózy, který obsahuje mléčný protein.
4.4 Zvláštní upozornění a opatření pro použití
Tiotropium-bromid, bronchodilatancium podávané jednou denně k udržovací léčbě, nelze použít jako zahajovací léčbu akutních záchvatů bronchospasmu, tj. jako úlevovou terapii.
Po podání tiotropium-bromidu, inhalačního prášku, se mohou vyskytnout časné alergické reakce.
Stejně jako jiné anticholinergní látky je i tiotropium-bromid nutno podávat s opatrností u pacientů s glaukomem s úzkým úhlem, hyperplazií prostaty nebo obstrukcí hrdla močového měchýře (viz bod 4.8).
Stejně jako u jiných inhalačních léků může také Braltus vést k paradoxnímu bronchospazmu, s okamžitým zesílením sípání a dušnosti po podání. Paradoxní bronchospasmus reaguje na léčbu rychle působícím bronchodilatanciem a měl by být okamžitě léčen. Pokud dojde k paradoxnímu bronchospazmu, má být léčba přípravkem Braltus okamžitě přerušena, pacient vyšetřen a pokud je to nezbytné, léčba nahrazena jinou.
Tiotropium je nutno podávat s opatrností pacientům s nedávno prodělaným infarktem myokardu (před méně než 6 měsíci); u jakékoli nestabilní nebo život ohrožující srdeční arytmie nebo srdeční arytmie vyžadující intervenci nebo změnu farmakoterapie v průběhu posledního roku; při hospitalizaci pro srdeční selhání (NYHA třídy III nebo IV) během posledního roku. Tito pacienti byli vyloučeni z klinických studií a na tyto stavy může mít vliv anticholinergní mechanizmus účinku.
Vzhledem k tomu, že u pacientů se středně těžkým až těžkým postižením renálních funkcí (clearance kreatininu < 50 ml/min) dochází ke zvyšování plazmatické koncentrace, může být tiotropium-bromid těmto pacientům podáván jen v případech, kdy očekávaný přínos léčby převyšuje její potenciální rizika. S léčbou pacientů s těžkým postižením renálních funkcí nejsou dlouhodobé zkušenosti (viz bod 5.2).
Pacienti musí být upozorněni, aby jim prášek obsažený v tobolce nevnikl při aplikaci do očí. Musí být poučeni o tom, že by mohlo dojít k vyvolání nebo ke zhoršení glaukomu s úzkým úhlem, bolestem očí nebo očním obtížím, přechodnému rozmazanému vidění, vizuálnímu haló nebo duhovému vidění spojenému se zarudnutím očí v důsledku překrvení spojivky a otokem rohovky. Pokud se některé z kombinací těchto očních příznaků objeví, musí pacienti užívání tiotropium-bromidu ukončit a ihned vyhledat pomoc očního lékaře.
Sucho v ústech, které se vyskytuje při léčbě anticholinergiky, může být při dlouhodobé expozici spojeno se zubním kazem.
Tiotropium-bromid nesmí být užíván častěji než jednou denně (viz bod 4.9).
Jedna tobolka přípravku Braltus obsahuje 18 mg monohydrátu laktózy. Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným deficitem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat. Laktóza může obsahovat stopové množství mléčných proteinů, které mohou vyvolat reakce u pacientů se závažnou přecitlivělostí nebo alergií na mléčné bílkoviny.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Ačkoliv nebyly prováděny oficiální studie zabývající se lékovými interakcemi, byl tiotropium-bromid podáván současně s jinými léky bez klinických příznaků lékových interakcí. Mezi takové léky patří beta2-mimetika, methylxantiny, perorální a inhalační kortikosteroidy, obvykle užívané při léčbě CHOPN.
Nebylo zjištěno, že podávání dlouhodobě působících beta2-agonistů nebo inhalačních kortikosteroidů mění míru expozice tiotropia.
Současné podávání tiotropium-bromidu s jinými léky obsahujícími anticholinergika nebylo zkoumáno, a proto se nedoporučuje.
4.6 Fertilita, těhotenství a kojení
Klinické údaje týkající se podávání tiotropium-bromidu během těhotenství nejsou k dispozici. Studie na zvířatech nenaznačily žádné přímé nebo nepřímé škodlivé účinky na reprodukční toxicitu u klinicky relevantních dávek (viz bod 5.3). Jako preventivní opatření se doporučuje vyvarovat se užívání přípravku Braltus během těhotenství.
Kojení
Není známo, zda se tiotropium-bromid vylučuje do lidského mateřského mléka. Přestože ze studií prováděných na hlodavcích v laktačním období vyplynulo, že do mateřského mléka je vylučováno pouze malé množství tiotropium-bromidu, nedoporučuje se jeho užívání v období kojení. Tiotropium-bromid je dlouhodobě působící látka. Při rozhodování, zda-li pokračovat či přerušit kojení nebo zda-li pokračovat v léčbě přípravkem Braltus či ji ukončit, je třeba vzít v úvahu přínos kojení pro dítě a prospěch léčby přípravkem Braltus pro matku.
Fertilita
Klinické údaje týkající se fertility nejsou pro tiotropium dosud k dispozici. Studie provedená s tiotropiem, která neměla klinický charakter, neprokázala žádné známky nežádoucích účinků na fertilitu (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie zkoumající vliv na schopnost řídit motorová vozidla a obsluhovat stroje nebyly provedeny. Výskyt závratí, rozmazané vidění nebo bolest hlavy mohou ovlivňovat schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Mnoho uvedených nežádoucích účinků může být připsáno anticholinergním účinkům tiotropium-bromidu.
Četnosti přiřazené nežádoucím účinkům uvedeným níže byly stanoveny na základě hrubého výskytu nežádoucích účinků léčiva (tj. příhod přičítaným účinkům tiotropia) pozorovaných ve skupině s tiotropiem (9 647 pacientů) z celkem 28 klinických studií kontrolovaných placebem. Doba léčby se pohybovala v rozmezí od 4 týdnů do 4 let.
Četnost výskytu nežádoucích účinků je definována následujícím způsobem: velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000), není známo (z dostupných údajů nelze určit).
|
Třída orgánových systémů / Preferovaný termín MedDRA Poruchv metabolismu a výživy |
Frekvence výskytu |
|
Dehydratace |
Není známo |
|
Poruchy nervového systému Závrať Poruchy vnímání chuti |
Méně časté Méně časté Méně časté Vzácné |
|
Poruchy oka Rozmazané vidění Glaukom Zvýšený nitrooční tlak |
Méně časté Vzácné Vzácné |
|
Srdeční poruchy Fibrilace síní Supraventrikulární tachykardie Palpitace |
Méně časté Vzácné Vzácné Vzácné |
|
Respirační, hrudní a mediastinální poruchy Faryngitida Dysfonie Bronchospasmus Epistaxe Sinusitida |
Méně časté Méně časté Méně časté Vzácné Vzácné Vzácné Vzácné |
|
Gastrointestinální poruchy Sucho v ústech Reflexní choroba jícnu Zácpa Orofaryngeální kandidóza Střevní obstrukce, včetně paralytického ileu Gingivitida Glositida Dysfagie Stomatitida Zubní kazy |
Časté Méně časté Méně časté Méně časté Vzácné Vzácné Vzácné Vzácné Vzácné Vzácné Není známo |
|
Poruchy kůže a podkožní tkáně, poruchy imunitního systému Urticaria Pruritus Přecitlivělost (včetně náhlých reakcí) Angioedém Anafylaktická reakce Kožní infekce, vředy na kůži Suchá kůže |
Méně časté Vzácné Vzácné Vzácné Vzácné Není známo Není známo Není známo |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně Otoky kloubů |
Není známo |
|
Poruchy ledvin a močových cest Dysurie Retence moči Infekce močových cest |
Méně časté Méně časté Vzácné |
Alergické reakce
Laktóza může obsahovat stopové množství mléčných proteinů, které mohou vyvolat reakce u pacientů se závažnou přecitlivělostí nebo alergií na mléčné bílkoviny.
Léčba tiotropium-bromidem musí být okamžitě přerušena, pokud se vyskytne přecitlivělost nebo alergická reakce a je třeba pacienta léčit náhradní léčbou.
Paradoxní bronchospasmus
Stejně jako u jiných inhalačních léků může také Braltus vést k paradoxnímu bronchospazmu, s okamžitým zesílením sípání a dušnosti po podání.. Paradoxní bronchospasmus reaguje na léčbu rychle působícím bronchodilatanciem a měl by být okamžitě léčen. Pokud dojde k paradoxnímu bronchospazmu, má být léčba přípravkem Braltus okamžitě přerušena, pacient vyšetřen a pokud je to nezbytné, léčba nahrazena jinou.
Popis vybraných nežádoucích účinků
Nejčastěji zaznamenanými nežádoucími účinky v kontrolovaných klinických studiích byly anticholinergní nežádoucí účinky, jako je sucho v ústech, které se vyskytlo u přibližně 4% pacientů.
Ve 28 klinických studiích vedlo sucho v ústech k přerušení léčby u 18 z 9647 pacientů (0,2%) léčených tiotropiem.
Závažné nežádoucí účinky související s anticholinergními účinky zahrnují glaukom, zácpu a střevní obstrukci včetně paralytického ileu a retenci moči.
Zvláštní skupiny pacientů
Výskyt anticholinergních nežádoucích účinků se může zvyšovat s rostoucím věkem pacientů.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Vysoké dávky tiotropium-bromidu mohou vyvolat anticholinergní příznaky a projevy.
Avšak nebyly zaznamenány žádné systémové anticholinergní nežádoucí účinky po inhalaci jednotlivé dávky až 340 pg tiotropium-bromidu u zdravých dobrovolníků. Kromě sucha v ústech nebyly dále po 7denním podávání dávek až 170 pg tiotropium-bromidu zdravým dobrovolníkům zaznamenány žádné významné nežádoucí účinky. Ve studii s opakovaným podáváním u pacientů s CHOPN s maximální denní dávkou 43 pg tiotropium-bromidu po dobu více než čtyř týdnů nebyl pozorován žádný závažný nežádoucí účinek.
Akutní intoxikace po náhodném perorálním požití tobolek tiotropium-bromidu je nepravděpodobná vzhledem k nízké biologické dostupnosti při perorálním podání.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: jiné léky na léčbu obstrukce dýchacích cest, inhalační přípravky, anticholinergika.
ATC kód: R03B B04 Mechanismus účinku
Tiotropium-bromid je dlouhodobě působící specifický antagonista muskarinového receptoru, v klinické medicíně často označovaný jako anticholinergikum. Vazbou na muskarinové receptory hladké svaloviny průdušek snižuje tiotropium-bromid cholinergní (bronchokonstrikční) účinky acetylcholinu, který se uvolňuje z nervových zakončení parasympatiku. Má podobnou afinitu k jednotlivým subtypům muskarinových receptorů M1 až M5. V dýchacích cestách tiotropium-bromid kompetitivně a reverzibilně antagonizuje M3 receptory, což vede k jejich uvolnění. Účinek byl závislý na dávce a trval déle než 24 hodin. Dlouhodobé trvání účinku je pravděpodobně dáno velmi pomalou disociací z receptoru M3 s významně delším poločasem disociace než u ipratropia. Tiotropium-bromid je jako dusíkaté kvartérní anticholinergikum při inhalačním podání topicky (broncho-) selektivní a vykazuje široké terapeutické rozmezí předtím, než dojde k výskytu systémových anticholinergních účinků.
Farmakodynamické účinky
Bronchodilatace je účinkem primárně lokálním (na dýchací cesty), nikoliv systémovým. Disociace z receptorů M2 je rychlejší než z receptorů M3, z čehož byla ve funkčních in vitro studiích vyvozena (za kinetické kontroly) receptorová selektivita k subtypu M3 oproti subtypu M2. Klinickým korelátem vysoké účinnosti a pomalé receptorové disociace je významná a dlouhodobá bronchodilatace pacientů s CHOPN.
Srdeční elektrofyziologie
Elektrofyziologie: ve studii zaměřené na QT interval, která zahrnovala 53 zdravých dobrovolníků, nevedlo podávání tiotropia v dávce 18 pg a 54 pg (tj. trojnásobek terapeutické dávky) po dobu 12 dní k významnému prodloužení intervalu QT na EKG.
Klinická účinnost a bezpečnost
Klinický vývojový program zahrnoval čtyři jednoleté a dvě šestiměsíční randomizované dvojitě slepé studie prováděné u 2663 pacientů (1308 užívalo tiotropium-bromid). Jednoroční program se skládal ze dvou studií kontrolovaných placebem a dvou studií s aktivní kontrolou (ipratropium). Obě šestiměsíční studie byly kontrolovány salmeterolem a placebem. V těchto studiích byly hodnoceny plicní funkce a ukazatele zdravotního stavu jako dušnost, exacerbace a kvalita života v souvislosti se zdravotním stavem.
Plicní funkce
Ve výše uvedených studiích zajistilo podávání tiotropium-bromidu v jedné denní dávce během 30 minut po aplikaci první dávky významné zlepšení plicních funkcí (usilovně vydechnutý objem za 1 sekundu - FEV1 a usilovná vitální kapacita - FVC) trvající 24 hodin. Farmakodynamického rovnovážného stavu bylo dosaženo během jednoho týdne s převažující bronchodilatací pozorovanou třetí den. Tiotropium-bromid významně zlepšil ranní a večerní hodnoty PEFR (vrcholová výdechová rychlost) hodnocené v denních záznamech pacientů. Bronchodilatační účinek tiotropium-bromidu přetrval po dobu jednoho roku podávání bez známek vzniku tolerance.
Randomizovaná klinická studie kontrolovaná placebem, provedená u 105 pacientů s CHOPN, prokázala, že bronchodilatace přetrvává v průběhu 24hodinového dávkovacího intervalu v porovnání s placebem bez ohledu na to, zda byl lék podáván ráno nebo večer.
Dusnost, tolerance zátěže
Tiotropium-bromid vedl k významnému zlepšení dušnosti pacientů (hodnoceno indexem TDI -Transition Dyspnea Index). Toto zlepšení přetrvávalo po celou dobu léčby.
Vliv zlepšení dušnosti na toleranci zátěže byl zkoumán ve dvou randomizovaných, dvojitě slepých studiích, kontrolovaných placebem, u 433 pacientů se středně těžkou až těžkou CHOPN. V těchto studiích 6týdenní léčba tiotropium-bromidem významně prodloužila dobu výdrže zátěže při bicyklové ergometrii se 75% maximálním funkčním zatížením až do jeho ukončení z důvodu objevení příznaků o 19,7% (Studie A) a o 28,3% (Studie B) ve srovnání s placebem.
Kvalita života ve vztahu ke zdraví
V 9 měsíců trvající randomizované, dvojitě zaslepené, placebem kontrolované studii u 492 pacientů zlepšilo tiotropium kvalitu života ve vztahu ke zdraví, což bylo hodnoceno celkovým skóre SGRQ (= St. George’s Respiratory Questionnaire). Podíl pacientů léčených tiotropiem, který dosáhl významného zlepšení v celkovém skóre SGRQ (tj. > 4 jednotky), byl o 10,9 % vyšší v porovnání s placebem (59,1 % ve skupině léčené tiotropiem oproti 48,2 % ve skupině léčené placebem, p = 0,029). Průměrný rozdíl mezi skupinami činil 4,19 jednotky (p = 0,001; interval spolehlivosti: 1,69 - 6,68). Zlepšení v oddílech dotazníku SGRQ bylo 8,19 jednotky pro „příznaky“, 3,91 jednotky pro “aktivitu” a 3,61 jednotky pro “dopad na denní život”. Zlepšení ve všech těchto oddílech bylo statisticky významné.
Exacerbace CHOPN
V randomizované, dvojitě slepé studii, kontrolované placebem, u 1829 pacientů se středně těžkou až velmi těžkou CHOPN, tiotropium-bromid statisticky významně snížil podíl pacientů s exacerbacemi CHOPN (z 32,2% na 27,8%) a statisticky významně snížil počet exacerbací o 19% (z 1,05 na 0,85 příhod na rok expozice pacienta). Navíc ve skupině s tiotropium-bromidem bylo hospitalizováno pro exacerbaci CHOPN 7,0% pacientů a ve skupině s placebem 9,5% pacientů (p=0,056). Počet hospitalizací pro CHOPN byl snížen o 30% (z 0,25 na 0,18 příhod na rok expozice pacienta).
Randomizovaná dvojitě zaslepená, dvojitě zamaskovaná (double-dummy) studie trvající jeden rok s paralelním uspořádáním skupin srovnávala účinek léčby tiotropiem v dávce 18 mikrogramů jednou denně s léčbou salmeterolem HFA pMDI v dávce 50 mikrogramů dvakrát denně pokud jde o výskyt středně závažných a závažných exacerbací, a to u 7 376 pacientů s CHOPN a anamnézou exacerbací v předchozím roce.
Tabulka 1: Souhrn konečných ukazatelů exacerbace
|
Konečný ukazatel |
Tiotropium 18 mikrogramů4 prášek k inhalaci4 n = 3 707 |
Salmeterol 50 mikrogramů (HFA pMDI) n = 3 669 |
Poměr (95% CI) |
Hodnota p |
|
Čas(dny) do první exacerbace1 |
187 |
145 |
0,83 (0,77 - 0,90) |
<0,001 |
|
Čas do první závažné exacerbace (s hospitalizací)2 |
0,72 (0,61 - 0,85) |
<0,001 | ||
|
Pacienti s > 1 3 exacerbací, n (%) |
1 277 (34,4) |
1,414 (38,5) |
0,90 (0,85 - 0,95) |
<0,001 |
|
Pacienti s > 1 závažnou exacerbací (s hospitalizací), n (%)3 |
262 (7,1) |
336 (9,2) |
0,77 (0,66 - 0,89) |
<0,001 |
Čas (ve dnech) se vztahuje na 1. kvartil pacientů. Analýza času do nežádoucí příhody byla provedena za použití Coxova regresního modelu proporčních rizik (proportional hazards) s centrem a léčbou jako nezávislou proměnnou (složeně); poměr se vztahuje na poměr rizika (hazard ratio).
2
3
4
Analýza času do nežádoucí příhody byla provedena za použití Coxova regresního modelu proporčních rizik (proportional hazards) s centrem a léčbou jako nezávislou proměnnou (složeně); poměr se vztahuje na poměr rizika (hazard ratio). Čas (ve dnech) pro 1. kvartil pacientů není možné vypočítat, protože podíl pacientů se závažnou exacerbací je příliš nízký.
Počet pacientů s nežádoucí příhodou byl analyzován za použití Cochran-Mantel-Haenszelova testu se stratifikací podle skladebného centra; poměr se vztahuje na relativní riziko (risk ratio).
Inhalace prášku tiotropium 18 mikrogramů odpovídá 10 mikrogramů tiotropia
Ve srovnání se salmeterolem tiotropium-bromid prodloužil čas do první exacerbace (187 dní oproti 145 dnům) se snížením rizika o 17 % (poměr rizik 0,83; 95% interval spolehlivosti (CI), 0,77 až 0,90; p<0,001). Tiotropium-bromid také prodloužilo čas do první závažné exacerbace (s hospitalizací) (poměr rizik 0,72; 95% CI, 0,61 až 0,85; p<0,001).
Dlouhodobé klinické studie (delší než lroční, až 4roční)
Ve čtyři roky trvající randomizované dvojitě zaslepené placebem kontrolované klinické studii provedené u 5993 pacientů (3006 pacientů používalo placebo a 2987 pacientů používalo tiotropium) udrželo tiotropium, ve srovnání s placebem, zlepšené FEV1 po celou dobu 4 let. Větší podíl pacientů dokončil > 45 měsíců léčby ve skupině s tiotropium-bromidem ve srovnání se skupinou s placebem (63,8 % vs. 55,4 %, p<0,001). Roční míra poklesu FEV1 ve srovnání s placebem byla u tiotropia a placeba podobná. Během léčby kleslo riziko úmrtí o 16%. Incidence úmrtí byla 4,79 na 100 paciento-roků ve skupině placeba oproti 4,10 na 100 paciento-roků ve skupině tiotropia (poměr rizika (tiotropium/placebo) = 0,84, 95% CI = 0,73; 0,97). Léčba tiotropiem vedla ke snížení rizika respiračního selhání (jak bylo zjištěno při hlášení nežádoucích účinků) o 19 % (2,09 oproti 1,68 případů na 100 paciento-roků, relativní riziko (tiotropium/placebo) = 0,81, 95% CI = 0,65; 0,999).
Aktivní látkou kontrolovaná studie s tiotropiem
Za účelem srovnání účinnosti a bezpečnosti tiotropium-bromidu prášku k inhalaci a tiotropium-bromidu roztoku k inhalaci (5694 pacientů používalo prášek k inhalaci; 5711 pacientů používalo roztok k inhalaci) byla provedena dlouhodobá rozsáhlá randomizovaná dvojitě zaslepená aktivní látkou kontrolovaná studie s délkou trvání až 3 roky. Primárními cíli byly čas do první exacerbace CHOPN, čas do úmrtí ze všech příčin, a v podstudii (u 906 pacientů) byl hodnocen parametr trough FEV1 (hodnota před podáním dávky).
Čas do první exacerbace CHOPN byl v průběhu studie u tiotropia prášku k inhalaci a tiotropia roztoku k inhalaci numericky srovnatelný (poměr rizik (prášek k inhalaci/roztok k inhalaci) 1,02 s 95% intervalem spolehlivosti 0,97 až 1,08). Medián počtu dní do první exacerbace CHOPN byl 719 dní pro tiotropium prášek k inhalaci a 756 dní u tiotropia roztoku k inhalaci.
Bronchodilatační účinek tiotropia prášku k inhalaci se udržel po dobu 120 týdnů a byl srovnatelný s účinkem pozorovaným u tiotropia roztoku k inhalaci. Průměrný rozdíl v parametru trough FEVi mezi tiotropiem prášku k inhalaci a tiotropiem roztoku k inhalaci byl 0,010 litru (95% interval spolehlivosti -0,018 až 0,038 litru).
V postmarketingové studii srovnávající tiotropium roztok k inhalaci a tiotropium prášek k inhalaci byla mortalita ze všech příčin včetně následného sledování vitálního stavu u obou lékových forem srovnatelná (poměr rizik (tiotropium roztok k inhalaci/tiotropium prášek k inhalaci) 1,04, 95% interval spolehlivosti 0,91 - 1,19).
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s tiotropiem u všech podskupin pediatrické populace v indikaci CHOPN a cystická fibróza (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Tiotropium-bromid je achirální kvartémí amoniová sloučenina špatně rozpustná ve vodě. Podává se ve formě prášku k inhalaci. Při inhalačním podání se obecně většina podané dávky ukládá v gastrointestinálním traktu a v menší míře v cílovém orgánu - plicích. Četné níže uvedené farmakokinetické údaje byly zjištěny při podávání dávek vyšších, než jsou doporučené léčebné dávky.
Absorpce
Absolutní biologická dostupnost 19,5 % po inhalaci prášku u mladých zdravých dobrovolníků ukazuje, že podíl, který se dostává do plic, má vysokou biologickou dostupnost. Perorální roztoky tiotropia mají absolutní biologickou dostupnost 2-3 %. Maximální plazmatické koncentrace tiotropia byly zaznamenány 5-7 minut po inhalaci.
Za rovnovážného stavu byly vrcholové plazmatické hladiny tiotropia u pacientů s CHOPN 12,9 pg/ml a rychle klesaly multikompartmentovým způsobem. Plazmatické koncentrace v rovnovážném stavu činily 1,71 pg/ml. Systémová expozice tiotropia po inhalaci tiotropia prášku k inhalaci byla podobná expozici tiotropia roztoku k inhalaci.
Distribuce
Tiotropium je ze 72 % vázáno na plazmatické proteiny a jeho distribuční objem je 32 l/kg. Lokální koncentrace v plicích nejsou známy, ale způsob podávání vede k podstatně vyšším koncentracím v plicích. Studie u potkanů ukázaly, že tiotropium-bromid neproniká ve významném množství přes hematoencefalickou bariéru.
Biotransformace
Rozsah biotransformace je nízký. To je zřejmé z vylučování močí ze 74 % nezměněné sloučeniny po intravenózním podání mladým zdravým dobrovolníkům. Ester tiotropium-bromidu je neenzymaticky štěpen na alkohol (N-methylskopin) a na kyselinu (dithienylglykolová kyselina), které na muskarinové receptory nepůsobí.
Studie in vitro s jaterními mikrozomy a lidskými hepatocyty ukazují, že jistá část léku (< 20 % dávky po intravenózním podání) je metabolizována oxidací závislou na cytochromu P 450 (CYP) a následnou konjugací s glutathionem na řadu metabolitů II. řádu.
In vitro studie s jaterními mikrozomy ukazují, že tuto enzymatickou cestu lze inhibovat inhibitory CYP 2D6 (a 3A4), chinidinem, ketokonazolem a gestodenem. CYP 2D6 a 3A4 jsou tedy zapojeny do metabolické cesty, která odpovídá za vylučování menšího podílu dávky. Tiotropium-bromid dokonce i v koncentracích překračujících terapeutické koncentrace neinhibuje CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 a 3A jaterních mikrozomů lidí.
Eliminace
Efektivní poločas tiotropia nastává u pacientů s CHOPN mezi 27-45 hodinami. Celková clearance po intravenózním podání u mladých zdravých dobrovolníků byla 880 ml/min. Intravenózně podané tiotropium je vylučováno hlavně močí v nezměněné formě (74 %). U pacientů s CHOPN v rovnovážném stavu po inhalačním podání prášku činí vylučování močí 7 % (1,3 pg) nezměněné účinné látky po 24 hodinách, zbytek představuje zejména nevstřebaný lék ze střeva, vylučovaný stolicí. Renální clearance tiotropia překračuje clearance kreatininu, což svědčí o jeho sekreci do moči. Při dlouhodobém inhalačním podávání jednou denně u pacientů s CHOPN bylo dosaženo farmakokinetického rovnovážného stavu do 7. dne bez jeho další kumulace.
Linearita/nelinearita
Tiotropium vykazuje v terapeutickém rozmezí lineární farmakokinetiku nezávislou na lékové formě. Zvláštní skupiny pacientů
Starší pacienti: Jak lze očekávat u všech přednostně renálně vylučovaných léků, je pokročilý věk spojený s poklesem renální clearance tiotropia (z 365 ml/min u pacientů s CHOPN ve věku < 65 let, na 271 ml/min u pacientů s CHOPN ve věku > 65 let). Pokročilý věk nevedl k odpovídajícímu zvýšení AUCo_6,ss nebo hodnot Cmax,ss.
Pacienti s poruchou funkce ledvin: Při inhalačním podávání tiotropia jednou denně u pacientů s CHOPN v rovnovážném stavu měla mírná porucha funkce ledvin (clearance kreatininu CLCr 50-80 ml/min) za následek lehké zvýšení hodnoty AUC0-6,ss (o 1,8 - 30 % vyšší) a podobně byla ovlivněna i hodnota Cmax,ss ve srovnání s pacienty s normální funkcí ledvin (CLCr > 80 ml/min).
U pacientů s CHOPN se středně těžkou až těžkou poruchou funkce ledvin (CLCr < 50 ml/min) vedlo intravenózní podání tiotropia ke zdvojnásobení jeho celkové expozice (82% nárůst AUC0-4h a 52% nárůst Cmax) ve srovnání s pacienty s CHOPN s normální funkcí ledvin, což bylo potvrzeno plazmatickými koncentracemi po inhalaci prášku.
Pacienti s poruchou funkce jater: Nepředpokládá se, že by jaterní insuficience měla nějaký významný vliv na farmakokinetiku tiotropia. Tiotropium je přednostně eliminováno renálním vylučováním (74 % u mladých zdravých dobrovolníků) a prostým neenzymatickým esterickým štěpením na farmakologicky neaktivní metabolity.
Japonští pacienti s CHOPN: Ve zkřížené srovnávací studii byla průměrná vrcholová plazmatická koncentrace tiotropia v rovnovážném stavu 10 minut po podání dávky inhalačně o 20 % až 70 % vyšší u japonských pacientů s CHOPN, v porovnání s bělošskou populací. Nebyl však zaznamenán žádný signál vyšší mortality nebo kardiálního rizika u japonských pacientů ve srovnání s bělošskou populací. Pro další etnika nebo rasy jsou k dispozici jen nedostačující farmakokinetické údaje.
Pediatrická populace: Viz bod 4.2.
Farmakokinetické/farmakodynamické vztahy
Neexistuje žádná přímá souvislost mezi farmakokinetickými a farmakodynamickými vlastnostmi.
5.3 Předklinické údaje vztahující se k bezpečnosti
Mnoho účinků pozorovaných v průběhu konvenčních studií zabývajících se farmakologickou bezpečností, toxicitou při opakovaném podávání a reprodukční toxicitou může být vysvětleno anticholinergními vlastnostmi tiotropium-bromidu. Typickými účinky pozorovanými u zvířat byla snížená konzumace potravy, snížení přírůstku tělesné hmotnosti, sucho v ústech a nosu, snížená tvorba slz a slin, mydriáza a zrychlení srdeční frekvence. Dalšími významnými změnami zaznamenanými v průběhu studií toxicity při opakovaném podávání bylo mírné podráždění dýchacích cest u potkanů a myší projevující se rinitidou a změnami epitelu nosní dutiny a hrtanu, prostatitida spolu s proteinovými depozity a litiáza močového měchýře potkanů.
Škodlivé účinky ve vztahu k březosti, vývoji embrya/plodu, porodu nebo postnatálnímu vývoji bylo možno zaznamenat pouze při dávkách toxických pro matky. Tiotropium-bromid nebyl teratogenní pro potkany ani pro králíky. Obecně studie reprodukce a fertility u potkanů nenaznačily žádný nežádoucí účinek na plodnost nebo páření léčených rodičů či jejich potomků při jakékoli dávce.
Respirační (podráždění) a urogenitální (prostatitida) změny a reprodukční toxicita byly při lokální i systémové expozici více než pětkrát vyšší než při expozici terapeutické. Studie zabývající se genotoxicitou a kancerogenním potenciálem neodhalily pro člověka žádné zvláštní riziko.
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Monohydrát laktózy (obsahuje mléčné proteiny) Tobolka se skládá z hypromelózy.
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
24 měsíců
Po prvním otevření: 30 dní (lahvička s 15 tobolkami) nebo 60 dní (lahvička se 30 tobolkami)
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v dobře uzavřené lahvičce. Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
Chraňte před chladem nebo mrazem.
6.5 Druh obalu a obsah balení
Lahvička z polyethylenu s vysokou hustotou (HDPE) s polypropylenovým (PP) šroubovacím uzávěrem s bezpečnostním kroužkem z polyethylenu (PE) a vysoušecí kapsle z polyethylenu o nízké hustotě (LDPE) obsahující silikagel. Každá lahvička obsahuje 15 nebo 30 tobolek, dodávané v krabičce se Zonda inhalátorem.
Zonda inhalátor je jednodávkové inhalační zařízení se zeleným tělem a víčkem a bílým tlačítkem, vyrobené z akrylonitrilbutadienstyrénového (ABS) plastu a nerezové oceli.
Multipack obsahující buď 60 tobolek (2 balení po 30) a 2 Zonda inhalátory nebo 90 tobolek (3 balení po 30) a 3 Zonda inhalátory.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Teva Pharmaceuticals CR, s.r.o.
Radlická 3185/1c Praha 150 00 Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
14/314/16-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20.7.2016 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
20.7.2016
13