Berotec N 100 Mcg
sp.zn. sukls193224/2011 a sukls157616/2012
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU Berotec N 100 mcg
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 odměřená dávka obsahuje:
Fenoteroli hydrobromidum 0,1 mg
Pomocné látky se známým účinkem:
1 odměřená dávka obsahuje až 15,597 mg ethanolu.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Roztok k inhalaci v tlakovém obalu.
Popis přípravku: čirá, bezbarvá až světle žlutá nebo světlehnědá kapalina, bez viditelných částic
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
■ Symptomatická léčba akutních astmatických záchvatů a jiných stavů s reverzibilním zúžením dýchacích cest, jako je např. chronická obstrukční bronchitida. U pacientů s astmatickými záchvaty nebo u pacientů s chronickou obstrukční plicní nemocí (CHOPN) reagující na léčbu kortikosteroidními přípravky je třeba uvažovat i o současné aplikaci protizánětlivé léčby.
■ Profylaxe astmatu vyvolaného fyzickou námahou.
4.2 Dávkování a způsob podání
Dávkování je nutno individuálně upravit. Přípravek je určen pro dospělé i děti. Není-li lékařem předepsáno jinak, je doporučeno následující dávkování:
a) Akutní astmatické záchvaty a jiné stavy spojené s reverzibilním zúžením dýchacích cest
1 odměřená dávka (vdech) je dostatečná dávka, která ve většině případů vede k okamžitému ústupu obtíží. Pokud nedojde ke zlepšení dýchání do pěti minut, je možno dávku zopakovat s maximem 8 odměřených dávek (vdechů) denně.
Pokud nedojde k ústupu záchvatu po aplikaci dvou vdechů, je možno aplikovat další dávky.
V těchto případech by měl pacient ihned vyhledat lékařskou pomoc (viz bod 4.4 Zvláštní upozornění a opatření pro použití).
b) Profylaxe astmatu vyvolaného tělesnou námahou
1 - 2 odměřené dávky před tělesnou námahou, maximálně 8 vdechů denně.
U dětí je doporučeno použít přípravek Berotec N 100 mcg, roztok k inhalaci v tlakovém obalu, pouze po poradě s lékařem a pod dozorem dospělé osoby.
Způsob použití
Správný způsob použití inhalátoru je předpokladem úspěšné léčby.
Před prvním použitím stiskněte dvakrát dávkovací ventil.
Před každým použitím dodržujte následující postup:
1. Odstraňte ochranný kryt.
2. Zhluboka vydechněte.
3. Inhalátor držte v poloze zobrazené na obrázku č. 1, ústní nástavec sevřete rty. Dno tlakového obalu (kovové tlakové nádobky) a šipka na ní směřuje vzhůru.

4. Zhluboka se nadechněte a na začátku tohoto nádechu stiskněte rázně dávkovací ventil, který uvolní jednu odměřenou dávku. Zadržte dech na několik sekund (nejlépe 5-10 s), vyjměte ústní nástavec z úst a vydechněte. Při podání druhé dávky, pokud je to potřebné, postupujte stejným způsobem (viz body 2 - 4).
5. Po použití nasaďte zpět ochranný kryt.
6. Pokud nebyl přípravek použit 3 dny, je třeba před aplikací 1x stisknout dávkovací ventil.
Kovová tlaková nádobka je neprůhledná, nelze tedy sledovat hladinu přípravku a zrakem zjistit, kdy je spotřebován. Přípravek obsahuje 200 dávek léku. Poté, co byly aplikovány, může nádobka stále ještě obsahovat určité množství tekutiny. Je však nutno užít nové balení přípravku, protože při dalších aplikacích by dávka inhalovaného léku nemusela být správná.
Množství zbývajícího léku lze ověřit následovně:
Vyjměte kovovou tlakovou nádobku s roztokem k inhalaci z umělohmotného ústního nástavce a vložte ji do větší nádoby naplněné vodou. Obsah roztoku v kovové tlakové nádobce lze odhadnout podle pozice, kterou tato nádobka ve vodní lázni zaujme (viz obr. 2).
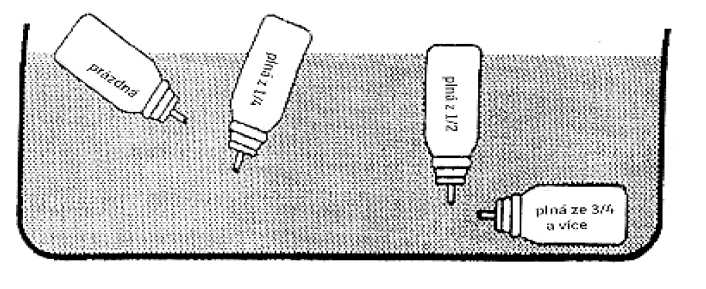
Obr. 2
Čištění ústního nástavce inhalátoru provádějte nejméně jednou týdně. Je důležité udržovat ústní nástavec inhalátoru v čistotě, aby nedošlo k poruše funkce spreje ucpáním nečistotami.
Při čištění nejprve sejměte ochranný kryt a vyjměte kovovou tlakovou nádobku z inhalátoru. Proplachujte teplou vodou ústní nástavec inhalátoru tak dlouho, dokud nejsou viditelné žádné nečistoty.
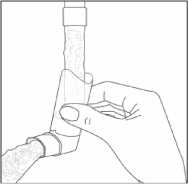
Obr. 3
Po vyčištění ústní nástavec inhalátoru vytřepejte a nechte volně uschnout na vzduchu. Při sušení nepoužívejte teplo.
Jakmile ústní nástavec inhalátoru vyschne, složte ochranný kryt a kovovou tlakovou nádobku opět dohromady.
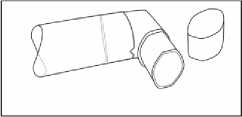
Obr. 4
Varování: Umělohmotný ústní nástavec inhalátoru byl vyroben pouze pro použití s roztokem k inhalaci v tlakovém obalu Berotec N 100 mcg tak, aby vždy byla zajištěna inhalace optimálního množství přípravku. Ústní nástavec inhalátoru proto nesmí být používán s jinými roztoky k inhalaci a roztok k inhalaci v tlakovém obalu Berotec N 100 mcg nesmí být používán s jiným ústním nástavcem, než který je dodáván spolu s přípravkem.
Kovová tlaková nádobka je pod stálým tlakem, nesmí být otevírána násilím a vystavena teplotě nad 50°C.
4.3 Kontraindikace
Hypertrofická obstrukční kardiomyopatie, tachyarytmie. Hypersenzitivita na léčivou látku fenoterol-hydrobromid nebo kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Jiné přípravky s beta2-agonisty se mohou podávat spolu s přípravkem Berotec N 100 mcg pouze pod lékařským dohledem. Bronchodilatancia s obsahem anticholinergních látek lze však inhalovat současně.
Při následujících onemocněních může být Berotec N 100 mcg aplikován pouze po pečlivém zvážení terapeutického prospěchu a rizika, zvláště při podávání dávek vyšších než doporučených: nedostatečně kontrolovaný diabetes mellitus, nedávný infarkt myokardu, těžké organické srdeční nebo cévní onemocnění, hypertyreóza, feochromocytom.
Při akutní a rychle se zhoršující dyspnoe musí být okamžitě vyhledána odborná lékařská pomoc. Dlouhodobé podávání:
■ Podávání podle potřeby (při rozvoji příznaků) je vhodnější, než podávání pravidelné.
■ Musí být zváženo současné podávání nebo zvýšení dávek protizánětlivých léků (např. inhalačních kortikosteroidů) k potlačení zánětu v dýchacích cestách a k zabránění dlouhodobého plicního postižení.
Pokud se bronchiální obstrukce zhoršuje, je nevhodné a případně i riskantní podávat po delší dobu vyšší než doporučené dávky přípravků obsahujících beta2-agonisty, jako je Berotec N 100 mcg. Pravidelné užívání zvyšujících se dávek beta2-agonistů může znamenat ztrátu kontroly nad průběhem onemocnění. V takovém případě je vhodné přehodnotit léčbu a zejména zvážit, zda je protizánětlivá léčba dostatečná. Takto je možno předejít případnému život ohrožujícímu zhoršení kontroly onemocnění.
Při podávání beta2-agonistů může dojít k závažné hypokalemii. Zvýšenou pozornost je třeba věnovat stavům těžkého astmatu, kde může být tento účinek umocněn současným podáváním xantinových derivátů, kortikosteroidů a diuretik. Vliv hypokalemie na srdeční rytmus může být zvýrazněn současnou hypoxií. Hypokalemie může zvýšit sklon k arytmiím u pacientů léčených digoxinem.
V uvedených situacích se doporučuje pravidelné monitorování hladiny draslíku v séru.
Kardiovaskulární účinky se mohou vyskytovat u sympatomimetik, včetně přípravku Berotec N 100 mcg. Existují důkazy z post-marketingových dat a publikované literatury o vzácných výskytech ischemie myokardu spojené s P-agonisty. Pacienti se závažným srdečním onemocněním (např. ischemickou chorobou srdeční, arytmií nebo závažným srdečním selháním), kteří užívají Berotec N 100 mcg, musí být upozorněni, aby vyhledali lékařskou pomoc, pokud se u nich objeví bolest na hrudi nebo jiné symptomy zhoršení srdečního onemocnění. Musí se dávat pozor na hodnocení takových příznaků, jako je dyspnoe a bolest na hrudi, protože mohou být respiračního nebo kardiálního původu.
Použití přípravku Berotec N 100 mcg může vést k pozitivním nálezům fenoterolu v testech pro neterapeutické zneužití návykových látek, např. v rámci zvýšení atletického výkonu (doping).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Ostatní beta-agonisté, látky s anticholinergním účinkem a xantinové deriváty (např. theofylin) mohou zvyšovat bronchodilatační účinek fenoterol-hydrobromidu. Při současném podávání jiných beta-agonistů, systémově působících anticholinergních látek a xantinových derivátů (např. theofylinu) mohou být zvýrazněny nežádoucí účinky.
K významnému oslabení bronchodilatačního účinku může docházet při současném podávání beta-blokátorů.
Účinek beta-agonistů může být zvýšen u pacientů léčených inhibitory monoaminooxidázy nebo tricyklickými antidepresivy, proto je v těchto případech nutná zvýšená opatrnost.
Inhalace celkových anestetik na bázi halogenovaných uhlovodíků, jako je halothan, trichloretylen a enfluran, může zvýšit vnímavost ke kardiovaskulárním účinkům beta-agonistů.
4.6 Fertilita, těhotenství a kojení
Výsledky předklinických studií spolu se zkušenostmi získanými při léčbě pacientů potvrdily, že podávání fenoterol-hydrobromidu v těhotenství nemá škodlivý vliv. Je však doporučena obvyklá opatrnost při podávání léků v těhotenství, zejména v prvním trimestru.
Je třeba počítat s tím, že fenoterol-hydrobromid inhibuje děložní kontrakce.
Předklinické studie ukázaly, že fenoterol-hydrobromid je vylučován do mateřského mléka.
Bezpečnost přípravku pro podávání během kojení nebyla stanovena.
Klinické údaje pro fenoterol vztahující se k plodnosti nejsou k dispozici. Neklinické studie s fenoterolem neprokázaly žádný negativní vliv na plodnost.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie vlivu přípravku Berotec N 100 mcg na schopnost řídit dopravní prostředky a obsluhovat stroje.
Pacienti by však měli být poučeni, že ve studiích po uvedení přípravku na trh byly hlášeny příznaky závratí. Proto se při řízení vozidel a obsluze strojů doporučuje opatrnost. Pokud pacienti pocítí závratě, měli by se vyhnout potenciálně nebezpečným činnostem, jako je řízení vozidel a obsluha strojů.
4.8 Nežádoucí účinky
Tak jako ostatní beta-agonisté, také Berotec N 100 mcg může způsobit následující nežádoucí účinky včetně závažné hypokalemie. Tak jako při každé inhalační terapii, také u přípravku Berotec N 100 mcg se mohou objevit příznaky lokálního podráždění.
Nežádoucí účinky byly rozděleny podle výskytu za použití následující konvence:
velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1000 až < 1/100);
vzácné (> 1/10 000 až < 1/1000); velmi vzácné (< 1/10 000); není známo (z dostupných údajů nelze
určit).
Vyšetření
Není známo: snížení diastolického tlaku krve, zvýšení systolického tlaku krve
Srdeční poruchy Méně časté: arytmie
Není známo: ischemie myokardu, tachykardie, palpitace
Poruchy nervového systému Časté: tremor
Není známo: bolest hlavy, závratě
Respirační, hrudní a mediastinální poruchy Časté: kašel
Méně časté: paradoxní bronchospazmus Není známo: podráždění hrdla
Gastrointestinální poruchy Méně časté: nauzea, zvracení
Poruchy kůže a podkožní tkáně Méně časté: svědění
Není známo: hyperhidróza, kožní reakce jako kožní vyrážka, kopřivka
Poruchy svalové a kosterní soustavy a pojivové tkáně
Není známo: bolestivost svalů, svalové křeče, pocit slabosti ve svalech
Poruchy metabolismu a výživy Méně časté: hypokalemie
Poruchy imunitního systému Není známo: hypersenzitivita
Psychiatrické poruchy Méně časté: neklid Není známo: nervozita
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Příznaky
Příznaky předávkování odpovídají příznakům vystupňované beta-mimetické stimulace, tj. příznakům
uvedeným mezi nežádoucími účinky. Mezi nejvýraznější patří tachykardie, palpitace, třes, hypertenze, hypotenze, rozšíření tlakové amplitudy, anginózní bolesti, arytmie a návaly.
Při aplikaci dávek vyšších než jsou dávky terapeutické doporučené pro schválené indikace přípravku Berotec N 100 mcg byla pozorována metabolická acidóza.
Terapie
Podávání sedativ, anxiolytik a v závažných případech intenzivní léčba.
Vhodnými antidoty jsou beta-blokátory, zejména beta1-selektivní. Avšak vzhledem k riziku zhoršení bronchiální obstrukce u pacientů trpících astmatem musí být dávka stanovena opatrně.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Sympatomimetika inhalační, Selektivní agonisté beta2-adrenergních receptorů; ATC kód: R03AC04.
Berotec N 100 mcg je účinný bronchodilatátor, který se užívá k léčbě akutního astmatu a dalších stavů spojených s reverzibilním zúžením dýchacích cest, jako je chronická obstrukční plicní bronchitida s plicním emfyzémem nebo bez něj. Po perorálním podání působí Berotec N 100 mcg během několika minut a účinek trvá až 8 hodin.
Po inhalaci fenoterol-hydrobromidu při obstrukčních plicních onemocněních nastává bronchodilatace během několika minut. Bronchodilatační účinek trvá 3-5 hodin.
Ve studiích trvajících až tři měsíce u dospělých pacientů s astmatem nebo s CHOPN a u dětí s astmatem byla prokázána rovnocenná terapeutická účinnost bezfreonové formy a freonové formy přípravku.
Fenoterol-hydrobromid je přímo působící beta-agonista, který v terapeutických dávkách selektivně stimuluje beta2-receptory. Při vyšší dávce stimuluje též beta1-receptory (např. je-li podáván k tokolýze). Stimulace beta2-receptorů aktivuje adenylátcyklázu přes stimulační protein GS. Zvýšení nitrobuněčné koncentrace cAMP aktivuje proteinkinázu A, která fosforyluje cílové bílkoviny v buňkách hladké svaloviny. Následně pak dochází k fosforylaci kinázy lehkého řetězce myosinu, inhibici hydrolýzy fosfoinositidu a otevření vysoce vodivých draslíkových kanálů aktivovaných kalciem. Existují určité důkazy, že tzv. „maxi-K kanál,, může být přímo aktivován GS proteinem.
Fenoterol-hydrobromid uvolňuje bronchiální a cévní hladkou svalovinu a chrání ji proti bronchokonstrikčním podnětům, jako je histamin, methacholin, studený vzduch a alergen (časná odpověď). Po podání fenoterolu při akutním záchvatu je inhibováno uvolňování bronchokonstrikčních a prozánětlivých látek z žírných buněk. Dále bylo prokázáno po aplikaci fenoterol-hydrobromidu (0,6 mg) zvýšení mukociliární aktivity.
Vyšší plazmatické koncentrace, které jsou častěji dosahovány po perorálním nebo ještě více po nitrožilním podání, snižují děložní motilitu. Při podání vyšších dávek byly rovněž pozorovány následující metabolické účinky: lipolýza, glykogenolýza, hyperglykémie a hypokalemie, která je způsobena zvýšenou absorpcí draslíkových iontů především v kosterních svalech. Beta-adrenergní účinek na srdeční sval (zvýšená srdeční frekvence a kontraktilita) je způsoben vaskulárním účinkem fenoterol-hydrobromidu, srdeční mimetickou stimulací, a při vyšší než terapeutické dávce i stimulací beta1-receptorů.
Bylo hlášeno prodloužení QTc intervalu, stejně jako u jiných beta-agonistů. U fenoterolu se jednalo o jednotlivé případy, které byly pozorovány v dávkách vyšších než doporučených. Systémová expozice by však po podání nebulizátory (ampule s jednotlivou dávkou roztoku pro inhalaci) mohla být vyšší než u dávek doporučených k aplikaci inhalátorem. Klinická významnost nebyla stanovena. Třes představuje častěji se vyskytující účinek beta-agonistů. Systémové účinky beta-agonistů na kosterní svalstvo podléhají rozvoji tolerance na rozdíl od účinků na hladkou svalovinu bronchů.
V klinických studiích vykázal fenoterol-hydrobromid vysokou účinnost u manifestních bronchospazmů. Zabraňuje bronchokonstrikci vyvolané různými podněty, jako je fyzická námaha, studený vzduch, a zabraňuje časné odpovědi po expozici alergenu.
5.2 Farmakokinetické vlastnosti
Farmakokinetika fenoterolu byla studována po intravenózním, inhalačním a perorálním podání. Terapeutický účinek přípravku Berotec N 100 mcg je dán jeho lokálním působením v dýchacích cestách. Z toho důvodu plazmatická koncentrace léčivé látky nutně nesouvisí s bronchodilatačním účinkem.
Absorpce
Po inhalaci se v závislosti na způsobu jejího provedení a použitém inhalačním systému dostává do dolních dýchacích cest okolo 10-30% léčivé látky uvolněné z aerosolu, zbytek je zachycen v horních cestách dýchacích a v ústech a následně spolknut.
Absolutní biologická dostupnost po inhalaci z dávkovače přípravku Berotec N 100 mcg je 18,7%. Absorpce z plic probíhá ve dvou fázích, 30% fenoterol-hydrobromidu je absorbováno rychle s poločasem 11 minut, 70% je absorbováno pomaleji s poločasem 120 minut.
Maximální plasmatické koncentrace (Cmax) 45,3 pg/ml byly pozorovány 15 minut po jediné inhalaci 100 pg fenoterolu, pomocí inhalátoru odměřujícího dávku s freonem jako pohonným plynem, u pacientů s bronchiálním astmatem. Studie u zdravých dobrovolníků, v nichž byla krev odebírána častěji pro farmakokinetická sledování, však naznačily, že maximální plasmatické koncentrace je dosaženo dříve, 2 až 3,5 minuty po podání. Maximální plasmatické koncentrace po inhalaci jediné dávky 200 pg fenoterolu, pomocí inhalátoru odměřujícího dávku s norfluranem jako pohonným plynem (HFA-MDI), byly nižší a byly pozorovány později ve srovnání s inhalací, kde jako pohonný plyn byl freon (CFC-MDI) (CFC-MDI: Cmax 165 pg/ml, tmax 3,5 min; HFA-MDI: Cmax 66,9 pg/ml, tmax 15 min).
Po perorálním podání je absorbováno přibližně 60% fenoterol-hydrobromidu. Absorbované množství podléhá z velké míry metabolismu při prvním průchodu játry, takže perorální biologická dostupnost klesá asi na 1,5%. Z tohoto důvodu spolknutá část účinné látky téměř nepřispívá k systémové plazmatické hladině po inhalaci.
Distribuce
Fenoterol se distribuuje rozsáhle v celém těle. Distribuční objem v rovnovážném stavu po intravenózním podání (Vss) je 1,9-2,7 l/kg. Časový průběh distribuce fenoterolu v plasmě po intravenózním podání odpovídá 3kompartmentovému modelu s poločasy ta = 0,42 minuty, tp = 14,3 minuty a tY = 3,2 hodiny. Vazba na plasmatické proteiny je 40 až 55%.
Metabolismus
Fenoterol je u člověka rozsáhle metabolizován glukuronidací a konjugací se sulfáty.
Po perorálním podání je fenoterol metabolizován převážně konjugací se sulfáty. Tato metabolická inaktivace začíná již ve střevní stěně.
Exkrece
Biotransformace včetně biliární exkrece je zodpovědná za větší část (přibližně 85%) průměrné celkové clearance, jež je po intravenózním podání 1,1-1,8 l/min. Renální clearance fenoterolu (0,27 ml/min) odpovídá asi 15 % průměrné celkové clearance systémově dostupné dávky. Vezme-li se v úvahu frakce léčiva navázaného na plasmatické proteiny, pak hodnota renální clearance naznačuje, že kromě glomerulární filtrace dochází též k tubulární sekreci fenoterolu.
Celková radioaktivita vyloučená močí je po perorálním podání přibližně 39% dávky, po intravenózním podání 65% dávky; celková radioaktivita vyloučená stolicí v průběhu 48 hodin je po perorálním podání 40,2% dávky, po intravenózním podání 14,8% dávky. 0,38% dávky je vyloučeno jako fenoterol v nezměněné formě močí po perorálním podání, zatímco po intravenózním podání je močí v nezměněné formě vyloučeno 15% dávky fenoterolu. Po inhalaci inhalátorem odměřujícím dávku jsou močí vyloučena v nezměněné formě 2% dávky v průběhu 24 hodin.
V nemetabolizovaném stavu může fenoterol-hydrobromid procházet placentou a do mateřského mléka.
Neexistují dostatečné údaje o účincích fenoterol-hydrobromidu na metabolický stav diabetu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Studie toxicity při podávání opakovaných dávek přípravku Berotec N 100 mcg, roztok k inhalaci, prokázaly podobné toxikologické profily bezfreonové a freonové formy přípravku.
Perorální LD50 byly zjištěny v rozmezí 1600 až 7400 mg/kg u dospělých myší, potkanů a králíků a v rozmezí 150 až 433 mg/kg u psů. Intravenózní LD50 pro myši, potkany, králíky a psy se pohybovaly v rozmezí 30 až 81 mg/kg. Akutní toxicita po inhalačním podání byla velmi nízká u potkanů, psů a opic. V závislosti na uspořádání pokusu nebyla mortalita pozorována po inhalační dávce 0,58 - 670 mg/kg.
Studie dlouhodobé toxicity byly prováděny u myší, potkanů a psů po dobu až 78 týdnů při různých způsobech podávání - inhalačně, perorálně, subkutánně, intravenózně a intraperitoneálně. V těchto studiích byly u příslušného druhu shledány výsledky typicky odpovídající podávání beta-agonistů (např. deplece jaterního glykogenu, snížení sérové hladiny draslíku, tachykardie). V dávkách od 1 mg/kg/den byly při různém způsobu podávání u potkanů, myší a králíků pozorovány nálezy typu hypertrofie myokardu a/nebo myokardiální léze. U psů, kteří jsou nejcitlivějším druhem na účinek beta-agonistů, byly léze tohoto typu zastiženy v inhalačních dávkách od 0,019 mg/kg/den. výše.
Studie subakutní toxicity při inhalačním podávání opicím neprokázaly žádné toxické účinky v přímém vztahu k podávané látce.
Ve studiích reprodukční toxicity po inhalačním podávání potkanům a králíkům nebyly prokázány žádné teratogenní nebo embryotoxické účinky. Fertilita a schopnost odchovu mláďat nebyly porušeny. Při perorálním podávání neměly dávky až do 40 mg/kg/den žádný nepříznivý vliv na plodnost potkaních samců a samic. Perorální dávky až 25 mg/kg/den u králíků a až 38,5 mg/kg/den u myší nevedly k teratogenním nebo embryotoxickým účinkům. U potkanů byl pozorován tokolytický účinek při perorálních dávkách 3,5 mg/kg/den, při dávce 25 mg/kg/den se objevila mírně vyšší fetální a neonatální mortalita. Extrémně vysoké dávky 300 mg/kg/den při perorálním podání a 20 mg/kg/den při intravenózním podání vedly ke zvýšení četnosti malformací.
V testech in vitro ani in vivo nebyla shledána mutagenní aktivita fenoterol-hydrobromidu.
Ve studiích kancerogenity po perorálním podání u myší po dobu 18 měsíců, u potkanů po dobu 24 měsíců a po inhalačním podání u potkanů po dobu 24 měsíců bylo prokázáno, že při perorální dávce 25 mg/kg/den vedl fenoterol-hydrobromid ke zvýšenému výskytu leiomyomů dělohy s různou mitotickou aktivitou u myší a mesovariálních leiomyomů u potkanů.
Tyto účinky jsou dány lokálním působením beta-agonistů na hladkou svalovinu dělohy u myší a potkanů. Podle současného výzkumu nelze tyto výsledky aplikovat na člověka. Všechny ostatní zjištěné nádory byly považovány za běžné typy nádorů, které se spontánně objevují u zkoumaných kmenů experimentálních zvířat. U těchto nádorů nedošlo k biologicky významnému zvýšení incidence, které by vyplývalo z podávání fenoterolu.
Byla prokázána dobrá a rovnocenná snášenlivost přípravků bezfreonové a freonové formy v dýchacích cestách.
Studie lokální snášenlivosti prokázaly dobrou toleranci fenoterol-hydrobromidu při různých cestách podání (intravenózní, intraarteriální, kožní, oční).
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Norfluran, bezvodý ethanol, čištěná voda, kyselina citrónová
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25°C.
Chraňte před přímým slunečním světlem, horkem a mrazem.
6.5 Druh obalu a obsah balení
Kovový tlakový obal s dávkovacím ventilem, vložený do rozprašovače z umělé hmoty. Velikost balení: 10 ml, 200 odměřených dávek
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim International GmbH Ingelheim am Rhein, Německo
8. REGISTRAČNÍ ČÍSLO
14/079/02-C
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
3.4.2002 / 22.10.2014
10. DATUM REVIZE TEXTU
22.10.2014
9/9