Antithrombin Iii Nf Baxter
zastaralé informace, vyhledat novějšíPříloha č. 1 ke sdělení sp.zn. sukls116308/2012
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE
ANTITHROMBIN III NF BAXTER
Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné příznaky jako Vy.
- Pokud se kterýkoli z nežádoucích účinků vyskytne v závažné míře, nebo pokud si všimnete jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci, prosím, sdělte to svému lékaři nebo lékárníkovi.
V příbalové informaci naleznete:
1. Co je přípravek ANTITHROMBIN III NF BAXTER a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek ANTITHROMBIN III NF BAXTER používat
3. Jak se přípravek ANTITHROMBIN III NF BAXTER používá
4. Možné nežádoucí účinky
5. Jak přípravek ANTITHROMBIN III NF BAXTER uchovávat
6. Další informace
1. CO JE PŘÍPRAVEK ANTITHROMBIN III NF BAXTER A K ČEMU SE POUŽÍVÁ
Přípravek ANTITHROMBIN III NF BAXTER patří do farmakoterapeutické skupiny zvané antitrombotika.
Přípravek ANTITHROMBIN III NF BAXTER se používá k léčbě vrozeného nebo získaného nedostatku
antithrombinu, který se může vyskytnout u velkého množství různých klinických poruch.
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE PŘÍPRAVEK ANTITHROMBIN III NF BAXTER POUŽÍVAT
Nepoužívejte přípravek ANTITHROMBIN III NF BAXTER
- Jestliže jste přecitlivělý/á (alergický/á) na antithrombin nebo na kteroukoli pomocnou látku přípravku ANTITHROMBIN III NF BAXTER.
- Jestliže máte v anamnéze heparinem vyvolanou trombocytopenii (tj. pokles krevních destiček).
Zvláštní opatrnosti při použití přípravku ANTITHROMBIN III NF BAXTER je zapotřebí
- Prosím sdělte ihned svému lékaři, jestliže zaznamenáte první známky alergické reakce (např. vyrážku, generalizovanou kopřivku, pocit svírání hrudníku, sípání, nízký krevní tlak, projevující se slabostí, pocitem na omdlení).
- Prosím informujte svého lékaře o všech lécích obsahujících heparin (např. pro léčbu trombózy), které užíváte nebo jste užíval(a) v nedávné době, protože účinek antithrombinu je heparinem značně zesílen.
- Přípravek ANTITHROMBIN III NF BAXTER se vyrábí z lidské plazmy. Při podávání léčivých přípravků, připravených z lidské krve nebo plazmy, nelze zcela vyloučit riziko přenosu infekce. To se vztahuje i na patogeny dosud neznámé povahy. Riziko přenosu infekce je však sníženo pečlivým výběrem dárců a jednotlivých odběrů, testováním shromážděné plazmy a procesy inaktivace a odstranění virů.
Vzájemné působení s dalšími léčivými přípravky
Prosím informujte svého lékaře o všech lécích obsahujících heparin (např. pro léčbu trombózy), které užíváte
nebo jste užíval(a) v nedávné době, protože účinek antithrombinu se heparinem značně zesiluje.
Prosím informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užíval(a) v nedávné
době, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Používání přípravku ANTITHROMBIN III NF BAXTER s jídlem a pitím
Přípravku se netýká.
Těhotenství a kojení
Prosím informujte svého lékaře, pokud jste těhotná nebo kojíte. Váš lékař rozhodne, zda lze přípravek ANTITHROMBIN III NF BAXTER používat během těhotenství nebo kojení.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
Nebyly pozorovány žádné účinky na schopnost řídit a obsluhovat stroje. Neobsluhujte žádné přístroje nebo stroje.
Důležitá informace o některých složkách přípravku ANTITHROMBIN III NF BAXTER
Tento přípravek obsahuje přibližně 3,77 mg sodíku/ml. Tato informace může být důležitá u pacientů na dietě s kontrolovaným příjmem sodíku.
3. JAK SE PŘÍPRAVKU ANTITHROMBIN III NF BAXTER POUŽÍVÁ
Přípravek ANTITHROMBIN III NF BAXTER Vám bude podán pouze pod lékařským dohledem. Dávka bude záviset na Vaší tělesné hmotnosti a individuální potřebě. Váš lékař stanoví dávku, kterou byste měl(a) dostat.
Přípravek ANTITHROMBIN III NF BAXTER Vám bude podáván infuzí do některé žíly.
Použití u dětí
Není k dispozici dostatek údajů k tomu, aby mohlo být doporučeno podávání přípravku ANTITHROMBIN III NF BAXTER dětem do 6 let.
Jestliže jste použil(a) více přípravku ANTITHROMBIN III NF BAXTER než jste měl(a)
Příznaky předávkování antithrombinem nebyly zaznamenány.
Jestliže jste zapomněl(a) použít ANTITHROMBIN III NF BAXTER
Přípravku se netýká.
Jestliže jste přestal(a) používat přípravek ANTITHROMBIN III NF BAXTER
Přípravku se netýká.
4. MOŽNÉ NEŽÁDOUCÍ ÚČINKY
Podobně jako všechny léky může mít i přípravek ANTITHROMBIN III NF BAXTER nežádoucí účinky, které se ale nemusí vyskytnout u každého.
- Hypersenzitivita nebo alergické reakce (k nimž může patřit angioedém, pálení a píchání v místě infuze, zimnice, zčervenání, generalizovaná kopřivka, bolest hlavy, vyrážka, nízký krevní tlak, otupělost, nevolnost, neklid, zvýšená srdeční frekvence, pocit svírání hrudníku, brnění, zvracení, sípání) byly pozorovány vzácně a mohou v některých případech přejít až do závažné anafylaxe (včetně šoku).
- Ve vzácných případech se objevila horečka.
- Ve vzácných případech by se mohla objevit heparinem vyvolaná a protilátkami zprostředkovaná trombocytopenie (snížení počtu krevních destiček). Může být zaznamenán počet destiček nižší než 100 000/pl nebo pokles počtu destiček o 50 %.
Po uvedení přípravku ANTITHROMBIN III NF BAXTER na trh byly zaznamenány následující nežádoucí účinky: třes a návaly horka.
Pokud se kterýkoli z nežádoucích účinků vyskytne v závažné míře, nebo pokud si všimnete jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci, prosím, sdělte to svému lékaři nebo lékárníkovi.
5. JAK PŘÍPRAVEK ANTITHROMBIN III NF BAXTER UCHOVÁVAT
Uchovávejte mimo dosah a dohled dětí.
Uchovávejte v chladničce (2°C - 8°C).
Přípravek ANTITHROMBIN III NF BAXTER nepoužívejte po uplynutí doby použitelnosti uvedené na štítku a krabičce.
Přípravek ANTITHROMBIN III NF BAXTER nepoužívejte, pokud si všimnete, že jsou roztoky zakalené nebo obsahují usazeniny.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. DALŠÍ INFORMACE
Co přípravek ANTITHROMBIN III NF BAXTER obsahuje
- Léčivou látkou je antithrombin z lidské plazmy.
1 ml rozpuštěného přípravku obsahuje antithrombinum III 50 IU
proteinum 20-50mg
- Pomocnými látkami jsou glukóza, chlorid sodný, dihydrát citronanu sodného, trometamol a voda na injekci
Jak přípravek ANTITHROMBIN III NF BAXTER vypadá a co obsahuje toto balení
Přípravek ANTITHROMBIN III NF BAXTER je dodáván jako prášek pro přípravu infuzního roztoku, obsahující nominálně 500 IU (1000 IU) antithrombinu z lidské plazmy v jedné injekční lahvičce.
Přípravek obsahuje přibližně 50 IU/ml (500 IU/10 ml, 1000 IU/20 ml) antithrombinu z lidské plazmy po rekonstituci v 10 ml (20 ml) vody na injekci.
Přípravek ANTITHROMBIN III NF BAXTER je bledě žlutá až bledě zelená drobivá pevná látka nebo prášek.
Každé balení také obsahuje:
- 1 převodní jehlu
- 1 filtrační jehlu
- 1 zavzdušňovací jehlu
- 1 jehlu k jednorázovému použití
- 1 infuzní set
Velikost balení:
1x 500 IU + 10 ml rozpouštědla 1x 1000 IU + 20 ml rozpouštědla
Držitel rozhodnutí o registraci a výrobce
Baxter AG Industriestrasse 67 A-1221 Vídeň, Rakousko
Tato příbalová informace byla naposledy schválena: 6.6.2012
Následující informace je určena pouze pro zdravotnické pracovníky:
Dávkování a způsob podání
Léčba by měla být zahájena pod dohledem lékaře se zkušenostmi s léčbou pacientů s nedostatkem antithrombinu.
Dávkování
Při vrozeném nedostatku by mělo být dávkování přizpůsobeno potřebám každého pacienta a měla by se zvážit rodinná anamnéza s ohledem na tromboembolické příhody, aktuální klinické rizikové faktory a výsledky laboratorních vyšetření.
Dávkování a délka trvání substituční terapie u získaného nedostatku závisí na plazmatické hladině antithrombinu, přítomnosti známek zvýšeného obratu, základním onemocnění a závažnosti klinického stavu. Množství, jež má být podáno, a frekvence podání by měly být vždy založeny na klinické účinnosti a laboratorním hodnocení v jednotlivém případě.
Počet podaných jednotek antithrombinu se vyjadřuje v mezinárodních jednotkách (IU), jež se vztahují k současnému standardu WHO pro antithrombin. Aktivita antithrombinu v plazmě se vyjadřuje buď v procentech (vzhledem k normální lidské plazmě) nebo v mezinárodních jednotkách (vzhledem k mezinárodnímu standardu pro antithrombin v plazmě).
Jedna mezinárodní jednotka (IU) aktivity antithrombinu je ekvivalentní množství antithrombinu v jednom mililitru normální lidské plazmy. Výpočet požadované dávky antithrombinu je založen na empirickém zjištění, že 1 mezinárodní jednotka (IU) antithrombinu na kilogram tělesné hmotnosti zvyšuje aktivitu antithrombinu v plazmě zhruba o 2 %.
Úvodní dávka se stanoví pomocí následujícího vzorce:
Požadovaný počet jednotek = tělesná hmotnost (kg) x (cílová hladina - skutečná aktivita antithrombinu [%]) x 0,5
Úvodní cílová aktivita antithrombinu závisí na klinickém stavu. Je-li stanovena indikace pro substituci antithrombinu, mělo by být dávkování dostatečné, aby byla dosažena cílová aktivita antithrombinu a aby byla udržena účinná hladina. Dávkování by mělo být stanoveno a monitorováno na základě laboratorních testů aktivity antithrombinu, které by měly být prováděny do stabilizace pacienta minimálně dvakrát denně, poté jednou denně, nejlépe bezprostředně před následující infuzí. Úprava dávkování by měla zohlednit jak známky zvýšeného obratu antithrombinu podle laboratorních hodnot, tak i klinický průběh. Aktivita antithrombinu by měla být po dobu trvání léčby udržována nad 80 %, pokud by klinické údaje nesvědčily pro jinou účinnou hladinu.
Obvyklá počáteční dávka při vrozeném nedostatku bývá 30-50 IU/kg.
Poté by měly být dávkování a frekvence i doba trvání léčby upraveny podle biologických údajů a klinické situace.
Pediatrická populace
Není k dispozici dostatek údajů k tomu, aby mohlo být doporučeno podávání přípravku ANTITHROMBIN III NF BAXTER dětem do 6 let.
Způsob podání
Rekonstituujte přípravek podle pokynů. Přípravek by měl být podáván intravenózně.
Maximální rychlost podání je 5 ml/min.
Návod k použití
Přípravek ANTITHROMBIN III NF BAXTER má být rekonstituován bezprostředně před použitím a podáván pouze pomocí přiloženého infuzního setu. Během celého procesu rekonstituce je třeba používat aseptickou techniku. Roztok má být ihned použit (přípravek neobsahuje konzervační látky).
Stránka 4 z 5
Rekonstituovaný přípravek má být před podáním vizuálně zkontrolován s ohledem na přítomnost částic či
změnu zabarvení. Roztok je čirý nebo lehce opalescentní. Zakalené roztoky nebo roztoky obsahující
usazeniny nepoužívejte.
Veškerý nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Rekonstituce prášku:
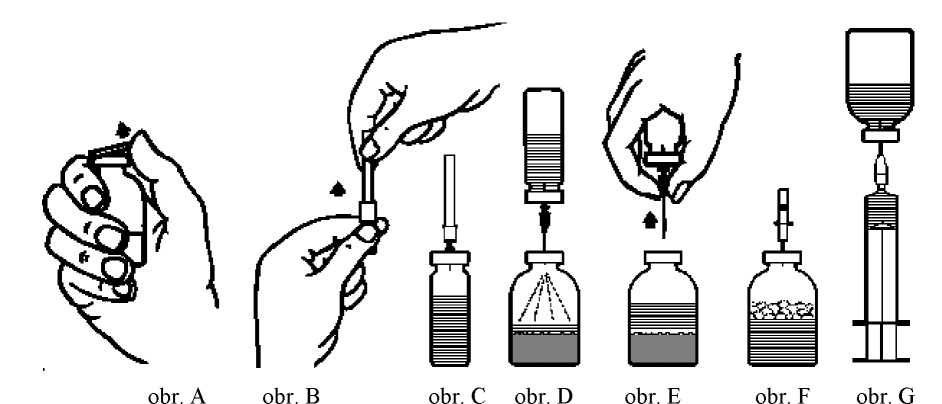
1. Zahřejte neotevřenou lahvičku s rozpouštědlem (voda na injekci) na pokojovou teplotu (max. 37oC).
2. Odstraňte ochranná víčka z lahviček s koncentrátem a rozpouštědlem (obr. A) a dezinfikujte pryžové zátky obou lahviček.
3. Sejměte ochranný kryt z jednoho konce přiložené převodní jehly pootočením a povytažením (obr. B). Zapíchněte tento konec jehly skrze pryžovou zátku do lahvičky s rozpouštědlem (obr. C).
4. Sejměte ochranný kryt z druhého konce převodní jehly tak, abyste se přitom nedotkli odkrytého konce.
5. Obraťte lahvičku s rozpouštědlem nad lahvičku s koncentrátem a propíchněte převodní jehlou pryžovou zátku lahvičky s koncentrátem (obr. D). Rozpouštědlo přejde pomocí vakua do lahvičky s koncentrátem.
6. Oddělte obě lahvičky vyjmutím jehly z lahvičky s koncentrátem (obr. E). Lehce protřepejte nebo promíchejte, abyste urychlili rozpouštění.
7. Po úplném rozpuštění koncentrátu vpíchněte do lahvičky přiloženou zavzdušňovací jehlu (obr. F), čímž odstraníte případně vzniklou pěnu. Zavzdušňovací jehlu vyjměte.
Podání:
8. Pootočením a povytažením sejměte ochranný kryt z přiložené filtrační jehly a nasaďte ji na sterilní jednorázovou stříkačku. Natáhněte roztok do stříkačky (obr. G).
9. Odpojte filtrační jehlu od stříkačky a roztok aplikujte pomalu intravenózně (max. rychlost 5 ml/min) pomocí přiložené jehly k jednorázovému použití (nebo pomocí přiloženého infuzního setu).
Pokud se neprovádí filtrace během rekonstituce, je třeba použít infuzní set s odpovídajícím filtrem (max. rychlost infuze 5 ml/min).
Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky.
Zvláštní upozornění a opatření pro použití
Stejně jako u jiných intravenózních proteinových přípravků jsou možné hypersenzitivní alergické reakce. Pacienti musí být po celou dobu infuze pečlivě monitorováni a všechny příznaky se musí pečlivě sledovat. Pacienti by měli být seznámeni s prvními známkami hypersenzitivních reakcí, k nimž patří vyrážka, generalizovaná kopřivka, tíže na hrudi, sípání, hypotenze a anafylaxe. Objeví-li se po podání tyto symptomy, měli by kontaktovat svého lékaře.
V případě šoku je třeba zahájit standardní léčbu.
Stránka 5 z 5