Amiped
sp. zn. sukls217535/2011
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Amiped infuzní roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Infuzní roztok obsahuje:
|
Aminokyseliny: |
v 1 ml |
ve 100 ml |
v 250 ml |
|
Isoleucinum |
5,10 mg |
0,51 g |
1,28 g |
|
Leucinum |
7,60 mg |
0,76 g |
1,90 g |
|
Lysinum monohydricum (ekvivalent lysinum) |
9,88 mg (8,80 mg) |
0,99 g (0,88 g) |
2,47 g (2,20 g) |
|
Methioninum |
2,00 mg |
0,20 g |
0,50 g |
|
Phenylalaninum |
3,10 mg |
0,31 g |
0,78 g |
|
Threoninum |
5,10 mg |
0,51 g |
1,28 g |
|
Tryptophanum |
4,00 mg |
0,40 g |
1,00 g |
|
Valinum |
6,10 mg |
0,61 g |
1,53 g |
|
Argininum |
9,10 mg |
0,91 g |
2,28 g |
|
Histidinum |
4,60 mg |
0,46 g |
1,15 g |
|
Alaninum |
15,90 mg |
1,59 g |
3,98 g |
|
Glycinum |
2,00 mg |
0,20 g |
0,50 g |
|
Acidum asparticum |
6,60 mg |
0,66 g |
1,65 g |
|
Acidum glutamicum |
9,30 mg |
0,93 g |
2,33 g |
|
Prolinum |
6,10 mg |
0,61 g |
1,53 g |
|
Serinum |
2,00 mg |
0,20 g |
0,50 g |
|
Acetyltyrosinum (ekvivalent tyrosinum) |
1,30 mg (1,06 mg) |
0,13 g (0,11 g) |
0,33 g (0,27 g) |
|
Acetylcysteinum (ekvivalent cysteinum) |
0,700 mg (0,520 mg) |
0,070 g (0,052 g) |
0,175 g (0,13 g) |
|
Taurinum |
0,300 mg |
0,030 g |
0,075 g |
|
v 1 ml |
ve 100 ml |
v 250 ml | |
|
Obsah aminokyselin |
0,1 g |
10 g |
25 g |
|
Obsah dusíku |
0,0152g |
1,52 g |
3,8 g |
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Infuzní roztok
Čirý, bezbarvý až světle žlutý roztok
|
Energie [kJ/l (kcal/l)] |
1700 (400) |
|
Teoretická osmolarita [mOsm/l] |
790 |
|
Acidita (titrace na hodnotu pH 7,4) |
23 mmol |
|
PH_ |
přibl. 6,1 |
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přísun aminokyselin jako součást parenterální výživy v kombinaci s energetickými roztoky (glukózy a lipidů) a elektrolyty pro novorozence, donošené i nedonošené, kojence, batolata a děti, pokud perorální nebo enterální výživa není možná, je nedostatečná, či pokud je kontraindikována.
4.2 Dávkování a způsob podání
Dávkování
Pediatrická populace
Dávkování pro věkové skupiny uvedené níže odpovídá doporučeným průměrným hodnotám. Přesné dávkování nutno individuálně upravit v podle věku, vývojového stupně, převládajícího onemocnění a typu léčby.
Podávání má začínat rychlostí infuze nižší než je cílová a v průběhu první hodiny by se rychlost infuze měla zvýšit na cílovou hodnotu.
Parenterální přísun aminokyselin považovaný za adekvátní pro většinu pediatrických pacientů:
Nedonošení novorozenci: 1,5 až 4,0 g aminokyselin/kg tělesné hmotnosti/den =15 až 40 ml/kg tělesné hmotnosti/den
Donošení novorozenci (0 až 27 dní): 1,5 až 3,0 g/kg tělesné hmotnosti/den = 15 až 30 ml/kg tělesné hmotnosti/den
Kojenci a batolata (od 28 dnů do 23 měsíců): 1,0 až 2,5 g/kg tělesné hmotnosti/den = 10 až 25 ml/kg tělesné hmotnosti/den
Děti (od 2 do 11 let): 1,0 až 2,0 g/kg tělesné hmotnosti/den = 10 až 20 ml/kg tělesné hmotnosti/den U kriticky nemocných dětí může být vhodný příjem aminokyselin i vyšší (až do 3,0 g aminokyselin/kg tělesné hmotnosti/den).
Maximální rychlost infuze je 0,1 g aminokyselin/kg tělesné hmotnosti za hodinu, což odpovídá přibližně 1 ml/kg tělesné hmotnosti za hodinu.
Způsob podání Intravenózní podání.
Vzhledem ke své vysoké osmolaritě se neředěný přípravek Amiped může podávat pouze do centrální žíly. Dostatečným zředěním, například vodou na injekci nebo vhodným roztokem, se však osmolarita přípravku Amiped snižuje a umožňuje periferní infuzi.
Pokud je současný přísun energie a elektrolytů přiměřený, nejsou žádná omezení režimu podání přípravku jako součást parenterální výživy.
Přípravek Amiped představuje pouze základ parenterální výživy. U pacientů, kterým je podávána pouze samotná parenterální výživa, se požaduje současná náhrada zdrojů energie (s přihlédnutím k požadavkům na esenciální mastné kyseliny), elektrolytů, vitamínů a stopových prvků.
4.3 Kontraindikace
• Hypersenzitivita na léčivou látku(y) nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
• Stavy hyperhydratace, hypokalémie
• Vrozené poruchy metabolismu aminokyselin
• Akutní metabolické poruchy v důsledku hypoxie a acidózy
• Život ohrožující oběhová nestabilita
• Akutní plicní edém
• Dekompenzovaná srdeční nedostatečnost
Podobně jako u všech roztoků obsahujících aminokyseliny, mezi kontraindikace přípravku Amiped patří závažná jaterní nedostatečnost, hepatální kóma a závažná renální nedostatečnost, pokud není přítomna renální substituční léčba.
4.4 Zvláštní upozornění a opatření pro použití
Při zvýšené osmolaritě séra je nutno postupovat opatrně.
Pokud je nutné omezit příjem tekutin, například při hyponatrémii, je nutno postupovat opatrně.
Nezbytné je zejména častější monitorování klinického stavu a příslušných laboratorních hodnot u pacientů:
• s poruchami metabolismu aminokyselin.
• s jaterními poruchami z důvodu rizika recidivy nebo exacerbace existujících neurologických poruch spojených s hyperamonémií.
• s renální nedostatečností, zejména za přítomnosti hyperkalémie nebo s rizikovými faktory vzniku nebo exacerbace metabolické acidózy nebo s hyperazotemií v důsledku zhoršené renální clearance.
Dávkování je nutno upravit podle věku, stavu výživy a základního onemocnění .Viz bod 4.2.
Kromě toho je nutné léčbu doplnit poskytnutím pomocných zdrojů energie (glukózy a lipidů), vitamínů a stopových prvků.
V případě potřeby mikroživin se musí používat pediatrické přípravky.
Před podáním do periferní žíly se musí přípravek Amiped dostatečně zředit vhodným roztokem. Viz bod 4.2.
Rovnováha tekutin a elektrolytů, osmolarita séra, acidobazická rovnováha, hladina glukózy v krvi, renální funkce a jaterní hodnoty musí být monitorovány po celou dobu trvání parenterální léčby, přičemž četnost monitorování je určována závažností základního onemocnění a klinickým stavem pacienta.
Měla by se stanovit koncentrace dusíku močoviny a amoniaku v séru.
Během dlouhodobého užívání (několik týdnů) nutno důkladněji monitorovat krevní obraz a koagulační faktory.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nej sou známy.
4.6 Fertilita, těhotenství a kojení
Přípravek Amiped je určen k použití pouze u dětí.
4.7 Účinky na schopnost řídit a obsluhovat stroje Není relevantní.
4.8 Nežádoucí účinky
Mohou se vyskytnout nežádoucí účinky, které však nesouvisejí specificky s tímto přípravkem, ale s parenterální výživou obecně, zejména na začátku parenterální výživy.
Méně časté (> 1/1000 až < 1/100):
Gastrointestinální poruchy: nevolnost, zvracení
Celkové poruchy a reakce v místě aplikace: bolesti hlavy, třesení, horečka
Vzhledem k vysoké osmolaritě roztoku se může vyskytnout tromboflebitida, pokud je přípravek podáván do periferní žíly bez dostatečného zředění.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu :
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek.
4.9 Předávkování
Příznaky
Příliš vysoká rychlost infuze může vést k reakcím z intolerance, které se projeví v podobě nevolnosti, zvracení, zrudnutí hlavy, pocitu tepla, renálních ztrát aminokyselin s následným narušením rovnováhy aminokyselin.
Léčba
Při výskytu reakcí z intolerance se infuze aminokyselin musí dočasně přerušit a později se v ní může pokračovat se sníženou rychlostí.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Roztoky pro parenterální výživu, aminokyseliny ATC kód: B05BA01
Mechanismus účinku
Infuzní roztok obsahuje 19 aminokyselin pro pokrytí kvalitativních potřeb bílkovin dítěte:
- všechny esenciální a semiesenciální aminokyseliny pro děti
V porovnání s běžnými roztoky aminokyselin přípravek Amiped obsahuje:
- relativně vysoký podíl lysinu
- taurin
- relativně nízký podíl methoninu
- nízký podíl fenylalaninu a prolinu.
Roztok neobsahuje žádné další elektrolyty, aby se vyloučil účinek na léčbu dětí elektrolyty během resuscitace.
Farmakodynamické účinky
Aminokyseliny tvoří stavební kameny syntézy bílkovin. Čisté roztoky aminokyselin se podávají jako součást parenterální nutriční terapie spolu se zdroji energie a dalších živin, jako jsou elektrolyty, stopové prvky, vitamíny a tekutiny pro udržení a zlepšení stavu výživy organismu nebo k minimalizaci ztrát látek.
5.2 Farmakokinetické vlastnosti
Absorpce
Přípravek Amiped se podává intravenózní infuzí. Všechny substráty jsou proto okamžitě k dispozici pro metabolismus.
Distribuce
Koncentrace volných aminokyselin v plazmě se vyznačují značnými fluktuacemi. Platí to pro jednotlivé aminokyseliny i pro souhrn koncentrací aminokyselin. Vzájemné vztahy mezi aminokyselinami však naopak zůstávají relativně konstantní, bez ohledu na celkovou koncentraci aminokyselin nebo absolutní hladiny koncentrací jednotlivých aminokyselin. Zdá se, že organismus se snaží zachovat každou „aminokyselinu“ ve smyslu substrátu na konstantní úrovni v rámci fyziologických referenčních hodnot a v maximální možné míře zabránit imbalancím ve skladbě aminokyselin. Ve většině případů, kdy jsou zachovány kompenzační možnosti organismu, dokonce i radikální změny v příjmu substrátu vedou pouze k narušení homeostázy aminokyselin v krvi. Typické patologické změny v profilu plazmových aminokyselin se očekávají pouze tehdy, pokud dojde k závažnému narušení regulačních ukazatelů základních metabolických orgánů, např. jater nebo ledvin. V případě potřeby lze takové změny léčit, pokud jde o obnovení homeostázy, a to použitím roztoků aminokyselin se specifickým složením.
Při patologických stavech bez vnějšího zdroje aminokyselin dochází ke značným typickým změnám skladby plazmatických aminokyselin, což zpravidla ovlivňuje absolutní koncentraci jednotlivých aminokyselin, jakož i jejich procentuální složení v plazmě.
Biotransformace
Aminokyseliny jako celek tvoří komplexní systém látek, které se vzájemně ovlivňují. Na jedné straně existuje přímá metabolická závislost mezi jednotlivými aminokyselinami (například produkce tyrosinu hydroxylací fenylalaninu). Na druhé straně mohou jiné metabolické mechanismy v organismu vykazovat citlivou reakci na posun ve skladbě aminokyselin, a to změnou koncentrace jednotlivých aminokyselin nebo skupin aminokyselin (například změny poměru aromatických aminokyselin a aminokyselin s rozvětveným řetězcem). Kromě toho mohou mít změny vztahů v rámci skupiny aminokyselin s podobnou chemickou konfigurací a podobným metabolickým chováním vliv na celkový metabolismus organismu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické studie s přípravkem Amiped nebyly provedeny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Monohydrát kyseliny citronové (na úpravu pH)
Voda na injekci
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.3.
6.3 Doba použitelnosti
- Neotevřené (vak v přebalu):
2 roky
- Po prvním otevření:
Přípravek by měl být použit okamžitě.
- Po smíchání s jinými složkami parenterální výživy:
Přípravek Amiped se smí smísit s jinými i.v. roztoky pouze tehdy, pokud byla předem prokázána jejich kompatibilita.
Na požádání může výrobce poskytnout údaje o kompatibilitě pro různé přísady (např. glukóza, lipidy, elektrolyty, stopové prvky, vitaminy) a o odpovídající době použitelnosti těchto přísad.
Chemická a fyzikální stabilita při použití po smíchání s těmito roztoky byla prokázána po dobu 24 hodin při teplotě 2 až 8 °C plus po dobu 24 hodin při teplotě 37 °C.
Z mikrobiologického hlediska by měl být přípravek použit okamžitě. Není-li použit okamžitě, za dobu a podmínky uchovávání před použitím odpovídá uživatel.
6.4 Zvláštní opatření pro uchovávání
Chraňte před mrazem. Při náhodném zmrazení vak zlikvidujte.
Podmínky uchovávání po přimísení přísad viz bod 6.3.
6.5 Druh obalu a obsah balení
Přípravek Amiped se dodává v pružných vacích vyrobených z vícevrstvé fólie (polypropylen, styren-ethylen-butylen-styren (SEBS) a kopolyester-ether). Vnitřní vrstva, která je v kontaktu s roztokem, je z polypropylenu. Vaky obsahují 100 ml nebo 250 ml.
Vak je zabalen v ochranném přebalu. Mezi vak a přebal je vložen absorbér kyslíku (sáček s inertním materiálem obsahuje práškový hydroxid železitý).
V kartonových krabicích obsahujících 12 stejných vaků jsou různé velikosti balení. Velikost balení: 12 x 100 ml a 12 x 250 ml.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky na likvidaci obalu, přebalu a absorbéru kyslíku.
Nepoužívejte, jestliže byl již přebal dříve otevřen nebo poškozen. Používejte pouze nepoškozené vaky, ve kterých je roztok aminokyseliny čirý a bez částic.
Přípravek Amiped se dodává v obalech pro jednorázové použití. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Před infuzí by se měl roztok vždy nechat ohřát na pokojovou teplotu.
Je nezbytné, aby se jakákoliv směs připravovala za dodržení přísných aseptických technik, protože tato směs živin podporuje růst mikroorganismů.
Amiped: Zacházení
Obrázek A: Vak a přebal
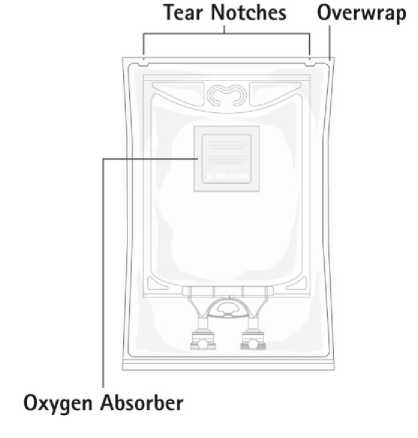
Tear Notches = zářezy k roztržení
Overwrap = přebal
Oxygen absorber = absorbér kyslíku
Obrázek B: Vak
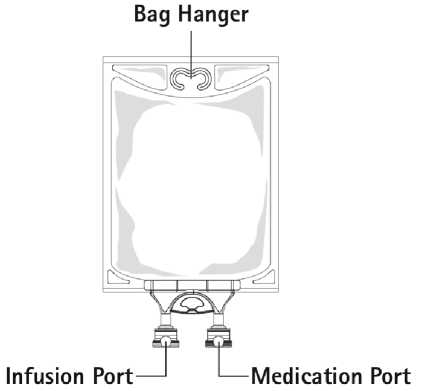
Bag hanger = otvor na zavěšení vaku Infusion port = infuzní port Medication port = medikační port.
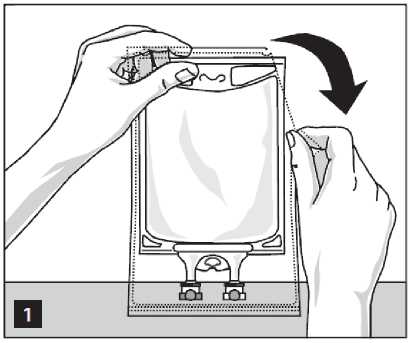
Otevírání:
Vyjměte vak z z jeho ochranného přebalu - začněte roztržením od zářezů nahoře a vyjměte obal s roztokem (obrázek 1).
Zlikvidujte přebal a absorbér kyslíku.
Zkontrolujte netěsnosti. Pokud vak netěsní, přípravek zlikvidujte, protože mohlo dojít k narušení sterility.
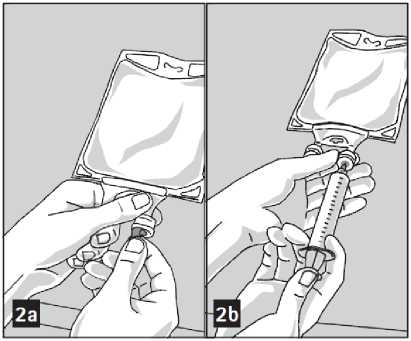
Přidání léku:
Směsi se musí připravovat za dodržení přísných aseptických technik.
Přes medikační port (s transparentním zbarvením) lze přidávat kompatibilní doplňkové léky.
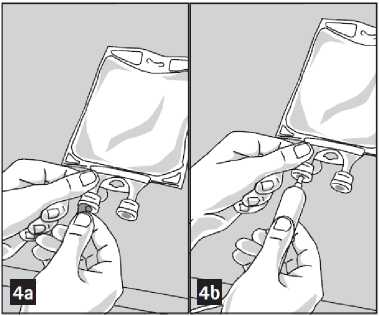
1. Odstraněním hliníkové fólie připravte medikační port (transparentní zbarvení) (obrázek 2a). Upozornění: Plocha pod fólií medikačního portu je sterilní.
2. Propíchněte opětovně uzavíratelný medikační port a vstříkněte přísadu (přísady) (obrázek 2b).
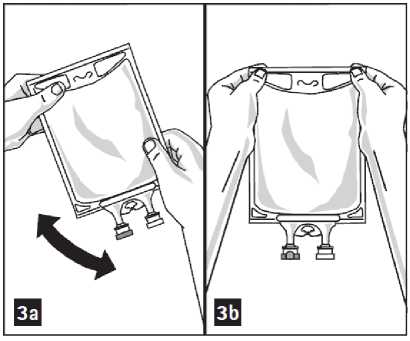
3. Roztok a lék důkladně promíchejte (obrázek 3a).
4. Před opětovným propíchnutím se může medikační port přetřít tampónem navlhčeným dezinfekčním prostředkem (např. isopropanolem).
5. Vizuálně zkontrolujte, zda směs neobsahuje částice (obrázek 3b).
Příprava k podání:
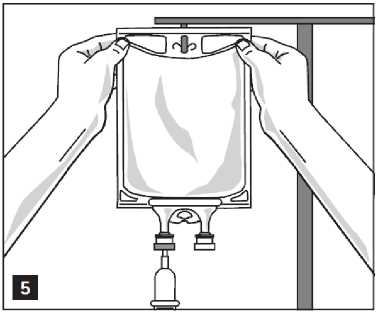
1. Z infuzního portu na spodní straně obalu (obrázek 4a) odstraňte hliníkovou fólii (zelené zbarvení) a nasaďte aplikační soupravu (obrázek 4b): používejte neodvzdušněnou infuzní soupravu nebo zavřete odvzdušňovací otvor odvzdušněné soupravy. Postupujte podle návodu k použití infuzní soupravy. Upozornění: Plocha pod fólií infuzního portu je sterilní.
2. Vak zavěste na infuzní stojan (obrázek 5).
Další informace:
Obal neobsahuje PVC, DEHP ani latex.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
B. Braun Melsungen AG Carl-Braun-StraBe 1 34212 Melsungen Německo
Poštovní adresa:
34209 Melsungen Německo
Tel.: +49/5661/71-0 Fax: +49/5661/71-4567
8. REGISTRAČNÍ ČÍSLO(A)
76/482/13-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
11.12.2013
10. DATUM REVIZE TEXTU
11.12.2013
10