2,5%Glucose+0,45% Sodium Chloride In Water For Injection Fresenius
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
2,5 % Glucose + 0,45% Sodium Chloride in Water for Injection Fresenius Infuzní roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2,75 g 2,50 g 0,45 g
ad 100 ml
Glucosum monohydricum
(ekvivalent glucosum anhydricum (dextrosum))
Natrii chloridum
293 mosm/l 77 mmol/l 77 mmol/l 139 mmol/l
3,5 - 6,5
+
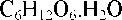
Ph
Voda na injekci Teoretická osmolarita Na+
Cl-
3. LÉKOVÁ FORMA
Infuzní roztok
Popis přípravku: čirý, bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Roztok glukózy a chloridu sodného je indikován v případech nutnosti expanze ECT (extracelulární tekutiny), zvláště když ztráta Cl- je větší nebo stejná jako ztráta Na+ a v případě potřeby dodávky cukrů, jako zdroje energie. Dehydratace při pocení, zvracení, kdy lze očekávat velké ztráty HCl s následnou metabolickou alkalózou.
Používá se při náhradě ztráty izotonické tekutiny v průběhu nebo po operacích.
Hypertonická dehydratace.
4.2 Dávkování a způsob podání
Individuální podle rozhodnutí lékaře. Dávkování se řídí podle věku, váhy, klinického stavu nemocného, laboratorních výsledků plazmatických hladin natria a chloridů, bilance objemu tekutin. Maximální dávka je 2000 ml/24 hod. Podává se v intravenózní infuzi.
4.3 Kontraindikace
Renální insuficience, kardiální edémy, hepatální insuficience, dekompenzovaný diabetes mellitus, intrakraniální, intraspinální krvácení v průběhu neurochirurgických operací, hypernatrémie, hypotonická dehydratace.
4.4 Zvláštní upozornění a opatření pro použití
Používat pouze čirý roztok bez viditelných partikulí a při nepoškozeném obalu.
Nepoužívat nespotřebovanou část.
Podávání roztoku chloridu sodného a glukózy v průběhu operace nebo po operaci může způsobit nadměrné zvýšení natria v séru, které je způsobeno činností homeostatických mechanizmů, které vedou k zadržení natria v organizmu. Rovněž může dojít k nadměrnému zvýšení glykémie, což je způsobeno rezistencí na inzulin v průběhu a po operaci.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Interakce nejsou dosud známy.
4.6 Fertilita, těhotenství a kojení
Přípravek může být podáván v době těhotenství a kojení.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Tento léčivý přípravek nemůže změnit schopnost reakce a tím snížit způsobilost k řízení motorových vozidel a ovládání strojů.
4.8 Nežádoucí účinky
Níže uvedené nežádoucí účinky se vyskytují s četností není známo (z dostupných údajů nelze určit).
Nežádoucí účinky, které mohou souviset s technikou aplikace nebo přípravkem samotným, zahrnují febrilie, infekci v místě aplikace, flebitidu nebo tromboflebitidu šířící se od místa aplikace, hypervolémii nebo paravazální aplikaci. Při výskytu přerušíme podávání, zabezpečíme nemocného a uchováme roztok pro případné testování.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41, Praha 10
Webové stránky: http: //www .sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Nadměrné podání NaCl (izotonické koncentrace) při snížené schopnosti ledvin vylučovat Na+, může dojít k extracelulární hyperhydrataci a k tvorbě edémů. Předávkování glukózou je možné pouze při nesprávném použití roztoku (nepoznaný diabetes mellitus, špatný celkový stav po operaci) a projeví se ketoacidemií, osmotickou diurézou s intracelulární nebo globální dehydratací.
Léčba předávkování je podpůrná a symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Infundabilium.
ATC kód: B05BB02
5.1 Farmakodynamické vlastnosti
Sterilní, apyrogenní, izoosmotický, hypoionní roztok s obsahem glukózy a chloridu sodného. Neobsahuje žádné antimikrobiální, bakteriostatické a stabilizující přísady. Roztok je vhodný pro vyrovnání ztrát sodíku a vody za současného přísunu glukózy, zejména při depleci Cl-, která je větší nebo stejná jako deplece Na+.
5.2 Farmakokinetické vlastnosti
Elektrolyty se v organismu distribuují dle koncentračních gradientů v ECT, volná voda se distribuuje dle koncentračního spádu ve všech kompartmentech. Iontová rovnováha je závislá na vylučování jednotlivých iontů ledvinami a podléhá zejména mineralokortikoidní regulaci. Vodní homeostáza je řízena ADH.
5.3 Předklinické údaje vztahující se k bezpečnosti
Jedná se o zcela bezpečný přípravek bez toxických, kancerogenních, mutagenních a teratogenních účinků.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Voda na injekci.
6.2 Inkompatibility
Kompatibilita s jinými přípravky, které jsou přidávané do infúze, musí být před použitím ověřena.
6.3 Doba použitelnosti
4 roky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C. Uchovávejte lahev v kartonové krabici, aby byl léčivý přípravek chráněn před světlem. Chraňte před chladem a mrazem.
6.5 Druh obalu a obsah balení
Skleněná infuzní lahev, pryžová zátka, hliníková pertle, karton.
Velikost balení: 1 x 100 ml, 1 x 250 ml, 1 x 500 ml, 1 x 1000 ml, 20 x 100 ml, 12 x 250 ml,
16 x 250 ml, 12 x 500 ml, 6 x 1000 ml.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Fresenius Kabi Italia S.r.l., Verona, Itálie
8. REGISTRAČNÍ ČÍSLO(A)
76/091/99-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 10. 2. 1999
Datum posledního prodloužení registrace: 21. 11. 2012
10. DATUM REVIZE TEXTU
29.4.2015