Xeomin 50 Jednotek Prášek Pro Injekční Roztok
sp.zn.sukls188541/2014
Příbalová informace: informace pro uživatele
XEOMIN 50 jednotek prášek pro injekční roztok
Clostridium botulini neurotoxinum typus A (150 kD), bez komplexotvorných proteinů (Botulini toxinum typus A sine complex proteine)
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
• Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek XEOMIN a k čemu se používá.
2. Čemu musíte věnovat pozornost, než začnete přípravek XEOMIN používat
3. Jak se přípravek XEOMIN používá
4. Možné nežádoucí účinky
5. Jak přípravek XEOMIN uchovávat
6. Obsah balení a další informace
1. Co je přípravek XEOMIN a k čemu se používá
XEOMIN je léčivý přípravek uvolňující svaly.
XEOMIN se používá k léčbě následujících onemocnění u dospělých:
• spasmy očních víček (blefarospasmus)
• spasmy krku a ramen způsobující stočení hlavy k jedné straně (spastická tortikolis)
• zvýšené svalové napětí / nekontrolovatelná svalová ztuhlost v paži nebo ruce po cévní mozkové příhodě (spasticita horních končetin projevující se ohnutým zápěstím a sevřenou pěstí)
2. Čemu musíte věnovat pozornost, než začnete přípravek XEOMIN používat Nepoužívejte přípravek XEOMIN
• jestliže jste alergický(á) na botulotoxin typu A nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6)
• jestliže trpíte generalizovanou poruchou (rozšířenou na celé tělo) svalové aktivity (např. myastenia gravis, Lambert-Eatonův syndrom)
• jestliže máte zánět v navrhovaných místech vpichu.
Upozornění a opatření
Mohou se vyskytnout nežádoucí účinky v důsledku chybného umístění injekce botulotoxinu typu A, kdy dochází k přechodnému ochrnutí okolních svalových skupin. Velmi vzácně byly hlášeny 2 nežádoucí účinky, které mohou souviset se šířením botulotoxinu do vzdálených míst od místa injekce (např. nadměrná svalová slabost, obtíže s polykáním nebo nechtěné vdechnutí jídla či nápoje do dýchacích cest). Pacienti, kterým jsou podávány doporučené dávky, mohou zaznamenat nadměrnou
svalovou slabost. Pokud je dávka příliš vysoká nebo pokud se injekce podává příliš často, může se zvýšit riziko tvorby protilátek. Tvorba protilátek může způsobit selhání léčby botulotoxinem typu A bez ohledu na důvod jeho použití.
Před užitím použitím přípravku XEOMIN se poraďte se svým lékařem nebo lékárníkem:
• jestliže trpíte j akoukoliv krvácivou poruchou
• jestliže užíváte látky, které brání srážení krve (antikoagulační léčba)
• jestliže trpíte významným oslabením nebo sníženým objemem svalové hmoty ve svalech, do nichž bude podávána injekce
• jestliže trpíte amyotrofickou laterální sklerózou (ALS), což je onemocnění, které může způsobit celkový úbytek svalů
• jestliže trpíte jakýmkoli jiným onemocněním, které narušuje vzájemné působení mezi nervy a kosterním svalstvem (periferní neuromuskulární dysfunkce)
• jestliže máte nebo jste měl (a) potíže s polykáním
• jestliže jste v minulosti měl(a) obtíže po podání injekcí botulotoxinu typu A
• jestliže máte podstoupit operaci.
Opakovaná aplikace přípravku XEOMIN
• Pokud dostáváte opakované injekce přípravku XEOMIN, účinek přípravku se může zvýšit nebo snížit. Možnými příčinami jsou: různé postupy používané Vaším lékařem při přípravě injekčního roztoku
• různé léčebné intervaly
• injekce do jiného svalu
• lehké odchylky v účinnosti léčivé látky přípravku XEOMIN
• ztráta odezvy/selhání terapie v průběhu léčby.
Jestliže jste měl (a) před léčbou po dlouhou dobu málo tělesného pohybu, měl (a) byste po aplikaci přípravku XEOMIN začínat s jakoukoliv tělesnou aktivitou postupně.
Informujte lékaře a okamžitě vyhledejte lékařskou pomoc, pokud se u Vás vyskytnou následující příznaky:
- potíže s dýcháním, polykáním nebo mluvením
- kopřivka, otok, včetně otoku tváře nebo hrdla, sípání, pocit na omdlení a dušnost (možné příznaky
závažných alergických reakcí)
Spasmy očních víček (blefarospasmus)
Před podáním přípravku XEOMIN se poraďte s lékařem, pokud:
• jste podstoupil (a) oční chirurgický zákrok. Váš lékař přijme dodatečná opatření.
• je u vás riziko vzniku onemocnění nazývaného glaukom s úzkým úhlem. Toto onemocnění může způsobit zvýšení nitroočního tlaku a vést k poškození optického nervu. Váš lékař bude vědět, zda u Vás toto riziko existuje.
Během léčby přípravkem XEOMIN se mohou v měkkých tkáních víček objevit malá bodová krvácení. Lékař může jejich tvorbu omezit působením jemného tlaku na místo vpichu bezprostředně po injekci.
Po aplikaci může přípravek XEOMIN způsobit méně časté mrkání, což může prodloužit expozici přední průhledné části oka (rohovky). Tato expozice může poškodit povrch Vašich očí a může dojít k zánětu (korneální ulcerace).
Stočení hlavy k jedné straně krku (spastická tortikolis)
Po aplikaci injekce se mohou objevit mírné až závažné polykací obtíže. Mohou způsobovat problémy s dýcháním a zvyšují riziko vdechnutí cizího tělesa nebo tekutiny. Cizí látky v plicích mohou vyvolat zánět nebo infekci (pneumonie). Vás lékař Vám poskytne další léčbu, bude-li to nutné (např. ve formě umělé výživy).
Polykací obtíže mohou trvat až dva či tři týdny po aplikaci injekce, u jednoho pacienta je známa doba
trvání až po dobu 5 měsíců.
Zvýšené svalové napětí/ nekontrolovatelná svalová ztuhlost v paži nebo ruce po cévní mozkové příhodě (spasticita horních končetin)
Přípravek XEOMIN může být používán k léčbě zvýšeného napětí / nekontrolovatelné svalové ztuhlosti v části horní končetiny, např. loktu, předloktí nebo ruky. Přípravek XEOMIN je účinný v kombinaci s běžnými standardními léčebnými metodami. Musí být používán spolu s těmito dalšími metodami.
Není pravděpodobné, že léčba tímto přípravkem zlepší rozsah pohybu kloubů, jejichž přilehlé svaly ztratily pružnost.
Děti a dospívající
Nepodávejte tento léčivý přípravek dětem ve věku 0 - 17 let, neboť použití přípravku XEOMIN u dětí a dospívajících nebylo zkoumáno a proto není pro tuto populaci přípravek doporučen.
Další léčivé přípravky a přípravek XEOMIN
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Účinek přípravku XEOMIN může být zvýšen:
• léky užívanými k léčbě některých infekčních onemocnění (spektinomycin nebo aminoglykosidová antibiotika [např. neomycin, kanamycin, tobramycin])
• dalšími léčivými přípravky, které uvolňují svaly (např. svalová relaxancia tubokurarinového typu). Tyto léky se používají např. při celkové anestezii. Před operací sdělte anesteziologovi, že Vám byl podán přípravek XEOMIN.
V takových případech je nutno přípravek XEOMIN používat s opatrností.
Účinek přípravku XEOMIN může být snížen:
• některými léky na malárii a revmatismus (nazývanými aminochinoliny).
Těhotenství, kojení a plodnost
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek používat.
Přípravek XEOMIN by Vám neměl být během těhotenství podáván, pokud lékař nerozhodne, že to je nezbytné a že možný prospěch léčby převažuje nad možným rizikem pro plod.
XEOMIN se nedoporučuje, pokud kojíte.
Řízení dopravních prostředků a obsluha strojů
Pokud se u Vás vyskytne pokles očních víček, únava (slabost), svalová slabost, závratě nebo poruchy zraku, neměl(a) byste řídit či vykonávat jiné potenciálně nebezpečné činnosti. V případě pochybností se poraďte s lékařem.
3. Jak se přípravek XEOMIN používá
Přípravek XEOMIN mohou podávat pouze lékaři s dostatečnými zkušenostmi s léčbou botulotoxinem.
Optimální dávka a počet míst vpichu v léčeném svalu určí lékař individuálně. Pokud nebude dosaženo požadovaného léčebného účinku, výsledky počáteční léčby přípravkem XEOMIN bude nutné přehodnotit a dávka bude upravována, dokud nebude terapeutického účinku dosaženo.
Pokud máte pocit, že účinek přípravku XEOMIN je příliš silný nebo příliš slabý, informujte o tom svého lékaře. Jestliže nebude zřejmý žádný léčivý účinek, je třeba zvážit alternativní léčbu.
Spasmy očních víček (blefarospasmus)
Obvykle je první nástup účinku pozorován během čtyř dnů po aplikaci. Účinek každé léčby většinou trvá 3 až 4 měsíce, ovšem může trvat významně delší nebo kratší dobu. Léčbu lze v případě potřeby opakovat. Doporučená úvodní dávka je až 25 jednotek na jedno oko a celková doporučená dávka na dalších léčebných sezeních je až 100 jednotek při jednom sezení.
Obvykle se nedosahuje žádného dalšího prospěchu tím, že se léčba provádí častěji než každé tři měsíce.
Stočení hlavy k jedné straně krku (spastická tortikolis)
Obvykle je první nástup účinku pozorován během sedmi dnů po aplikaci. Účinek každé léčby většinou trvá 3 až 4 měsíce, ovšem může trvat významně delší nebo kratší dobu. Nedoporučují se kratší intervaly mezi léčebnými sezeními než 10 týdnů. Doporučená dávka do jednoho místa vpichu injekce je 50 jednotek a nejvyšší dávka při prvním sezení je 200 jednotek. Při následujících cyklech Vám může lékař podat až 300 jednotek podle Vaší odpovědi na léčbu.
Zvýšené svalové napětí/ nekontrolovatelná svalová ztuhlost v paži nebo ruce po cévní mozkové příhodě (spasticita horních končetin)
Pacienti hlásili první nástup účinku 4 dny po aplikaci. Zlepšení svalového napětí bylo nejlépe vnímáno po dobu 4 týdnů. Obvykle účinek léčby přetrvává 12 týdnů. Doporučená dávka je do 400 jednotek na léčebné sezení. Interval mezi jednotlivými sezení musí být nejméně 12 týdnů.
Rozpuštěný přípravek XEOMIN je určený k injekci do svalu.
Pokud Vám bylo podáno více přípravku XEOMIN než bylo třeba
Příznaky předávkování:
Příznaky předávkování nejsou po injekci bezprostředně patrné a mohou zahrnovat celkovou slabost, pokleslé oční víčko, dvojité vidění, obtíže s dýcháním, obtíže s řečí a ochabnutí dýchacích svalů nebo obtíže s polykáním, které mohou způsobit zápal plic.
Opatření při předávkování:
V případě, že cítíte příznaky předávkování, vyhledejte okamžitě lékařskou pohotovost nebo o to požádejte své příbuzné a nechte se hospitalizovat. Lékařský dohled a řízené dýchání může být nutné i několik dnů.
Máte-li jakékoli další otázky týkající se používání tohoto léčivého přípravku, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Nežádoucí účinky jako nadměrná svalová slabost nebo obtíže s polykáním jsou způsobeny ochabnutím svalů vzdálených od místa vpichu přípravku XEOMIN. Obtíže při polykání mohou způsobit vdechnutí cizorodých předmětů, což může vyvolat zánět plic a v některých případech i smrt.
Přípravek XEOMIN může vyvolat alergickou reakci. Vzácně byly hlášeny závažné okamžité alergické reakce (anafylaxe) nebo alergické reakce na sérum v přípravku (sérová nemoc), které způsobily např. dýchací obtíže (dušnost), kopřivku nebo otok měkkých tkání. Některé z těchto reakcí byly pozorovány po použití běžných botulotoxinů typu A. Vyskytly se v případě, kdy byl toxin podán samotný nebo v kombinaci s jinými přípravky, o nichž je známo, že způsobují podobné reakce. Alergická reakce může vyvolat některé z následujících příznaků:
• obtíže při dýchání, polykání nebo řeči v důsledku otoku obličeje, rtů, úst nebo hrdla
• otok rukou, nohou či kolem kotníků.
Jestliže se u vás objeví uvedené nežádoucí účinky, prosím, ihned informujte svého lékaře nebo o to požádejte své blízké a navštivte nejbližší lékařskou pohotovost.
Obvykle jsou nežádoucí účinky pozorovány během prvního týdne po léčbě a jsou přechodné. Tyto nežádoucí účinky mohou souviset s přípravkem, způsobem vpichu injekce nebo obojím. Nežádoucí účinky se mohou omezit na oblast okolo místa vpichu (např. místní svalová slabost, místní bolest, zánět, mravenčení (parestézie), snížené vnímání dotyku (hypestézie), napětí, otok (celkový), otok měkkých tkání, zčervenání kůže (erytém), svědění, místní infekce, krevní výron, krvácení a/nebo tvorba modřin).
Vpich injekční jehly může způsobit bolest. Tato bolest nebo úzkost z aplikace mohou vyvolat mdloby nebo nízký krevní tlak.
Spasmy očních víček (blefarospasmus)
Při léčbě přípravkem XEOMIN byly hlášeny následující nežádoucí účinky:
Velmi časté (mohou postihnout více než 1 z 10 osob): pokleslé oční víčko (ptóza), suché oči
Časté (mohou postihnout až 1 z 10 osob):
rozostřené vidění, poškození zraku, zdvojené vidění (diplopie), zvýšené slzení, sucho v ústech, obtíže při polykání (dysfagie), bolest hlavy, bolest v místě vpichu injekce, únava, svalová slabost, ochabnutí lícních svalů (faciální paréza), vyrážka
Stočení hlavy k jedné straně krku (spastická tortikolis)
Při léčbě přípravkem XEOMIN byly hlášeny následující nežádoucí účinky:
Velmi časté (mohou postihnout více než 1 z 10 osob): obtíže při polykání (dysfagie)
Časté (mohou postihnout až 1 z 10 osob):
bolest šíje, svalová slabost, bolest svalů a kostí (myalgie), ztuhlost svalů a kostí, svalová křeč, bolest hlavy, závrať, bolest v místě vpichu injekce, slabost (astenie), sucho v ústech, nevolnost, zvýšené pocení (hyperhidróza), infekce horních cest dýchacích, pocit na omdlení (pre-synkopa)
Méně časté (mohou postihnout až 1 ze 100 osob): poruchy řeči (dysfonie), dušnost, vyrážka
Léčba stočené hlavy k jedné straně krku může způsobit polykací obtíže s různými stupni závažnosti. To může vést k vdechnutí cizího tělesa, které si může vyžádat lékařský zásah. Polykací obtíže mohou přetrvávat dva či tři týdny po injekci, ale v jednom případě bylo hlášeno trvání po dobu 5 měsíců. Ukazuje se, že polykací obtíže závisí na dávce.
Zvýšené svalové napětí/ nekontrolovatelná svalová ztuhlost v paži nebo ruce po cévní mozkové příhodě (spasticita horních končetin)
Při léčbě přípravkem XEOMIN byly hlášeny následující nežádoucí účinky:
Časté (mohou postihnout až 1 z 10 osob):
bolest hlavy, snížená či neobvyklá citlivost kůže včetně částečné ztráty citu nebo vnímání tepla (dysestézie, hypestézie), svalová slabost, pocit horka, bolest v místě vpichu injekce, bolest končetin, obtíže při polykání (dysfagie)
Méně časté (mohou postihnout až 1 ze 100 osob): únava (astenie), bolest svalů (myalgie)
Některé nežádoucí účinky mohou souviset s onemocněním.
Zkušenosti po uvedení na trh
Byly hlášeny příznaky podobné chřipce a reakce z přecitlivělosti, jako je otok, otok měkkých tkání (edém), zčervenání, svědění, vyrážka (místí nebo celková) a dušnost.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo na adresu
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek XEOMIN uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti vyznačené na krabičce a štítku injekční lahvičky za "EXP". Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Neotevřená injekční lahvička: Uchovávejte při teplotě do 25 °C.
Rekonstituovaný (naředěný) roztok: Chemická a fyzikální stabilita po otevření před použitím byla prokázána na dobu 24 hodin při teplotě 2 °C-8 °C.
Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li použit okamžitě, doba a podmínky uchovávání přípravku po otevření před použitím jsou v odpovědnosti uživatele a normálně by doba neměla být delší než 24 hodin při 2 °C-8 °C, pokud rekonstituce neproběhla za kontrolovaných a validovaných aseptických podmínek.
Váš lékař nesmí přípravek XEOMIN použít, pokud je roztok zakalený nebo obsahuje viditelné částice.
Pokyny k likvidaci přípravku j sou uvedeny v informaci pro zdravotnické pracovníky na konci této příbalové informace.
6. Obsah balení a další informace Co obsahuje XEOMIN
- Léčivou látkou je Clostridium botulini neurotoxinum typus A (150 kD), bez komplexotvorných proteinů.
1 injekční lahvička obsahuje 50 jednotek Clostridium botulini neurotoxinum typus A (150 kD), bez komplexotvorných proteinů. Kvůli rozdílům v analýze účinnosti jsou tyto jednotky specifické pro přípravek XEOMIN a nevztahují se na další přípravky s botulotoxinem.
- Pomocnými látkami jsou: lidský albumin, sacharóza.
Jak XEOMIN vypadá a co obsahuje toto balení
XEOMIN je dodáván jako prášek pro přípravu injekčního roztoku. Prášek je bílý. Po rozpuštění prášku vzniká čirý, bezbarvý roztok neobsahující částice.
Velikosti balení: 1, 2, 3 nebo 6 lahviček.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci
Merz Pharmaceuticals GmbH Eckenheimer LandstraBe 100 60318 Frankfurt/Main P.O. Box 11 13 53 60048 Frankfurt/Main Německo
Tel.: +49-69/15 03-1 Fax: +49-69/15 03-200
Výrobce
Merz Pharma GmbH & Co. KGaA Eckenheimer LandstraBe 100 60318 Frankfurt/Main P.O. Box 11 13 53 60048 Frankfurt/Main Německo
Tel.: +49-69/15 03-1 Fax: +49-69/15 03-200
Tento léčivý přípravek je v členských zemích EHP registrován pod následujícími názvy:
XEOMIN: Rakousko, Bulharsko, Kypr, Chorvatsko, Česká republika, Dánsko, Estonsko,
Německo, Řecko, Finsko, Francie, Maďarsko, Irsko, Island, Itálie, Lotyšsko, Lichtenštejnsko, Litva, Lucembursko, Malta, Nizozemsko, Norsko, Polsko, Portugalsko, Rumunsko, Slovensko, Slovinsko, Španělsko, Velká Británie XEOMEEN: Belgie
Tato příbalová informace byla naposledy revidována 9.12.2015.
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Pokyny pro rekonstituci injekčního roztoku
XEOMIN se před použitím rekonstituuje roztokem chloridu sodného 9 mg/ml (0,9 %) pro injekce.
XEOMIN může být podán k zamýšlenému účelu pouze k léčbě jednoho pacienta při jednom sezení.
Při správné praxi se přípravek rekonstituuje a injekční stříkačka plní nad plastem potaženou papírovou utěrkou, která zachytí případné rozlití roztoku. Správné množství rozpouštědla se vtáhne do injekční stříkačky (viz tabulka ředění). Po vertikálním nasazení jehly přes gumovou zátku se rozpouštědlo aplikuje zvolna do injekční lahvičky, aby se zabránilo tvorbě pěny. Doporučuje se krátká zkosená jehla velikosti 20-27 G. Injekční lahvička musí být zlikvidována, pokud rozpouštědlo není vtaženo vakuem do lahvičky. Stříkačka se vyjme z lahvičky a přípravek XEOMIN se smíchá s rozpouštědlem opatrným kroužením lahvičky a jejím otáčením nahoru a dolů - netřepejte silně. V případě potřeby se jehla použitá k rekonstituci ponechá v lahvičce a požadované množství roztoku se natáhne novou sterilní jehlou vhodnou k podání injekce. V případě potřeby se jehla použitá k rekonstituci ponechá v lahvičce a požadované množství roztoku se natáhne novou sterilní jehlou vhodnou k podání injekce.
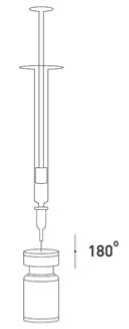
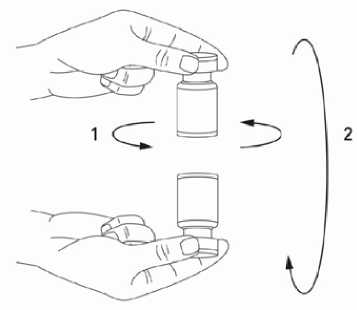
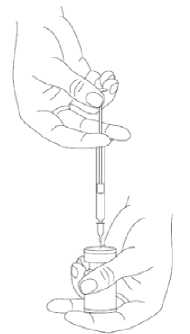
Rekonstituovaný XEOMIN je čirý, bezbarvý roztok bez viditelných částic.
XEOMIN se nesmí používat, pokud je rekonstituovaný roztok zakalený nebo obsahuje vločky či částice.
Doporučená naředění jsou uvedena v následující tabulce:
|
Přidané rozpouštědlo (chlorid sodný 9 mg/ml (0,9 %) injekční roztok) |
Výsledná dávka v jednotkách na 0,1 ml |
|
0,25 ml |
20,0 U |
|
0,5 ml |
10,0 U |
|
1,0 ml |
5,0 U |
|
2,0 ml |
2,5 U |
|
4,0 ml |
1,25 U |
Pokyny pro likvidaci
Veškerý injekční roztok, který je uchováván více než 24 hodin, i veškerý nepoužitý injekční roztok musí být zlikvidován.
Pokyny pro bezpečnou manipulaci s injekčními lahvičkami, stříkačkami a použitým materiálem
Všechny použité lahvičky, zbývající rekonstituovaný roztok v lahvičce a/nebo stříkačky je nutné autoklávovat. Alternativně lze zbývající XEOMIN deaktivovat přidáním jednoho z následujících roztoků: 70% ethanol, 50% isopropanol, 0,1% SDS (aniontový detergent), naředěný roztok hydroxidu sodného (0,1 N NaOH) nebo naředěným roztokem chlornanu sodného (nejméně 0,1 % NaOCl).
Po deaktivaci použitých injekčních lahviček, stříkaček a materiálu tyto nesmí být vyprázdněny, a musí být vyhozeny do příslušných nádob a zlikvidovány v souladu s místními požadavky.
Doporučení v případě nehody při manipulaci s botulotoxinem
- Veškerý vysypaný nebo vylitý přípravek je nutné otřít: buď se použije absorpční materiál napuštěný některým z uvedených roztoků v případě prášku, nebo suchým absorpčním materiálem v případě vylití rekonstituovaného přípravku.
- Kontaminované povrchy se musí vyčistit absorpčním materiálem napuštěným některým z uvedených roztoků a poté osušit.
- Jestliže je injekční lahvička rozbitá, opatrně posbírejte kusy skla a vytřete přípravek, jak je výše uvedeno, dejte pozor, abyste se nepořezali.
- Při kontaktu přípravku s pokožkou opláchněte postiženou plochu velkým množstvím vody.
- Při vniknutí do očí důkladně oči propláchněte velkým množstvím vody nebo roztokem pro
výplach očí.
- Jestliže se přípravek dostane do kontaktu s poraněním, s pořezanou nebo porušenou pokožkou, omyjte ránu velkým množstvím vody a podnikněte příslušná lékařská opatření podle podané dávky.
Tyto pokyny pro zacházení a likvidaci přípravku musí být přísně dodržovány.
9