Vertisan 24 Mg Tablety
zastaralé informace, vyhledat novějšíSp.zn.sukls31637/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Vertisan 24 mg tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tableta obsahuje betahistini dihydrochloridum 24 mg.
Pomocná látka se známým účinkem: monohydrát laktosy 142,5 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tableta
Bílé kulaté tablety s půlící rýhou o průměru 10 mm.
Tabletu lze rozdělit na stejné dávky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Betahistin je indikován k léčbě Menierova syndromu, mezi jehož symptomy patří vertigo
(často doprovázené nauzeou a/nebo zvracením), tinnitus a ztráta sluchu.
4.2 Dávkování a způsob podání
Dávkování
Obvyklá denní dávka je 24-48 mg betahistin-dihydrochloridu rozdělená do 2 až 3 stejných dávek.
Způsob podání
Tablety by se měly polykat nerozkousané, během jídla nebo po jídle, a zapíjet vodou.
Trvání léčby závisí na obrazu a průběhu choroby. Obvykle se jedná o dlouhodobou léčbu.
Děti a dospívající
Podávání betahistinu dětem a dospívajícím do 18 let se vzhledem k chybějícím údajům o bezpečnosti a účinnosti nedoporučuje.
4.3 Kontraindikace
Betahistin je kontraindikován v následujících případech:
• hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1,
• feochromocytom,
• těhotenství a kojení (viz bod 4.6).
4.4 Zvláštní upozornění a opatření pro použití
Doporučuje se pečlivě sledovat pacienty s anamnézou peptického vředu, i když studie u zdravých subjektů neprokázaly zvýšení sekrece žaludeční kyseliny po podání betahistin-dihydrochloridu.
Opatrnosti je zapotřebí u pacientů s bronchiálním astmatem.
Doporučuje se opatrně předepisovat betahistin pacientům s kopřivkou, vyrážkou nebo alergickou rýmou, z důvodu možného zhoršení těchto projevů.
Při léčbě pacientů s výraznou hypotenzí se doporučuje postupovat s opatrností.
Betahistin se nesmí podávat pacientům, kteří zároveň užívají antihistaminika (viz bod 4.5).
Tento přípravek obsahuje laktosu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktosy, vrozeným deficitem laktasy nebo malabsorpcí glukosy a galaktosy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Žádné studie interakcí nebyly provedeny u následujících léčivých přípravků, které se rovněž používají k léčbě onemocnění uvedených v bodě 4.1: vazodilatancia, psychotropní léčivé přípravky, zejména sedativa, trankvilizéry a neuroleptika, parasympatolytika a vitamíny.
Betahistin se nesmí užívat spolu s antihistaminiky, protože ve studiích na zvířatech bylo prokázáno vzájemné snížení účinnosti obou látek.
Poznámka:
Pokud se betahistin nasazuje následně po léčbě antihistaminiky a léčba těmito přípravky je ukončena náhle, mohou se vzhledem k sedativním účinkům antihistaminik objevit příznaky z vysazení, jako jsou poruchy spánku a agitace. Léčba antihistaminiky by proto měla být ukončena postupně během přibližně 6 dnů.
4.6 Fertilita, těhotenství a kojení
Betahistin je v těhotenství a během kojení kontraindikován, protože údaje ze studií na zvířatech jsou nedostatečné a s podáváním přípravku pacientkám během těhotenství a kojení nejsou žádné zkušenosti (viz bod 4.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Dlouhodobé studie hodnotící účinky betahistinu na schopnost řídit a používat stroje nebyly provedeny.
4.8 Nežádoucí účinky
Bylo hlášeno relativně málo nežádoucích účinků. Nežádoucí příhody jsou uvedeny níže podle tříd orgánových systémů a frekvence.
Frekvence výskytu je definována jako:
Velmi časté (>1/10)
Časté (>1/100 až <1/10)
Méně časté (>1/1 000 až <1/100)
Vzácné (>1/10 000 až <1/1 000)
Velmi vzácné (<1/10 000)
Není známo (z dostupných údajů nelze určit)
Poruchy imunitního systému:
Není známo: anafylaxe
Poruchy kůže a podkožní tkáně
Velmi vzácné: přechodná kopřivka, kožní vyrážka a pruritus
Poruchy nervového systému:
Vzácné: pocit tlaku v hlavě
Není známo: bolesti hlavy a občasná ospalost
Srdeční poruchy:
Vzácné: palpitace, pocit tísně na hrudi Respirační, hrudní a mediastinální poruchy:
Vzácné: zhoršení existujícího bronchiálního astmatu
Gastrointestinální poruchy:
Vzácné: říhání, pálení žáhy, dyskomfort a bolesti žaludku, flatulence Není známo: nauzea, zvracení
Celkové poruchy a reakce v místě aplikace:
Vzácné: pocit horka Poznámka:
Žaludečním obtížím se lze obvykle vyhnout užíváním Vertisanu s jídlem nebo po jídle nebo snížením dávky.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Příznaky předávkování:
V případě předávkování se mohou objevit následující symptomy analogické účinkům histaminu:
bolesti hlavy, zarudnutí v obličeji, vertigo, tachykardie, hypotenze, bronchiální spazmus, edém, zejména edém sliznic v oblasti horních cest dýchacích (Quinckeho edém).
Bylo hlášeno jen velmi málo případů předávkování. Ve většině případů se neobjevily žádné známky toxicity. Dávky přesahující 200 mg vedly u několika pacientů k mírným až ke středním příznakům. Pouze u jednoho pacienta se objevily křeče po požití 728 mg betahistinu. Ve všech případech se pacienti plně zotavili.
Léčba předávkování:
Specifické antidotum není známo. Kromě celkových opatření zaměřených na eliminaci toxinu (výplach žaludku, podání živočišného uhlí) je léčba symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: jiná léčiva nervového systému; antivertiginóza ATC kód: N07CA01
Betahistin patří do skupiny beta-2 pyridylalkylaminů.
Betahistin je strukturální analog endogenního histaminu.
Přesný biochemický mechanizmus účinku betahistinu ani jeho receptorová specificita a afinita nebyly dosud objasněny.
Farmakodynamické studie s betahistinem na zvířatech demonstrovaly převážně agonistické působení léčivé látky na Hj-receptory. Na základě studií na zvířatech byly vysloveny různé hypotézy o mechanizmu účinku betahistinu na vestibulární funkce.
5.2 Farmakokinetické vlastnosti
Farmakokinetický(é)/farmakodynamický(é) vztah(v) Údaje o farmakokinetice betahistinu u člověka jsou nedostatečné.
Absorpce
Po perorálním podání se betahistin rychle a úplně vstřebává.
Biotransformace a eliminace
Vylučuje se téměř zcela močí během 24 hodin ve formě metabolitu - kyseliny 2-pyridyloctové. Žádný nezměněný betahistin nebyl dosud detekován.
Biologická dostupnost
Randomizovaná jednorázová bioekvivalenční studie tablet Vertisanu 24 mg byla provedena v roce 2009 na 36 subjektech. Testované a referenční přípravky byly podávány perorálně po lehké snídani. Primárním parametrem vyhodnocení byla plazmatická hladina metabolitu kyseliny 2-pyridyloctové (viz obrázek a tabulka níže).
Linearita/nelinearita
Výsledky potvrdily bioekvivalenci tablet Vertisanu 24 mg a referenčního přípravku (CI
93,4 %) v rámci úzkých limitních hodnot plochy pod křivkou (AUC, 90-110 %) i konvenčních limitních hodnot pro maximální plazmatickou koncentraci (Cmax 80-125 %)
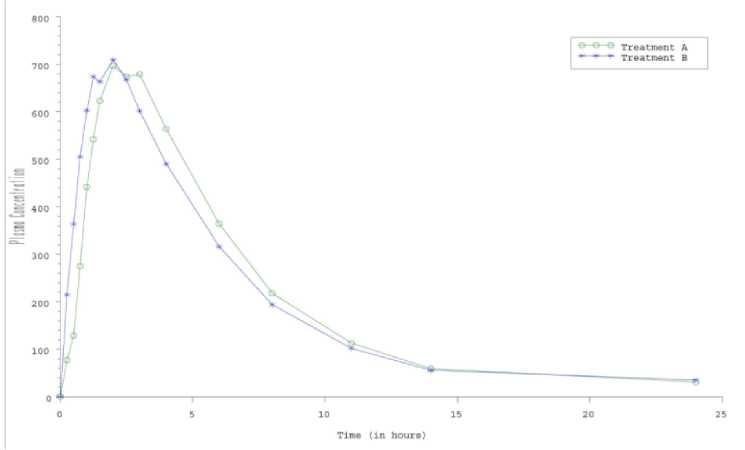
Obr. 1. Průměrné plazmatické koncentrace kyseliny 2-pyridyloctové v čase po jednorázové dávce (1 tableta) léčiva A (Vertisan 24 mg tablety), nebo léčiva B (referenční tablety 24 mg).
|
Parametr |
Testovaný |
Referenční |
Testovaný / referenční |
|
přípravek (A)* |
přípravek (B)* |
přípravek** | |
|
Max. plazmatická |
818,0 |
875,9 |
0,93 |
|
koncentrace (Cmax) [ng/ml] |
(± 352,3) |
(± 352,7) |
(0,87-0,99) |
|
Plocha pod křivkou |
4557,3 |
4375,4 |
1,00 |
|
(AUC0-J [ng/ml.h] |
(± 2759,0) |
(± 2091,1) |
(0,95-1,07) |
|
Eliminační poločas |
3,15 |
3,10 |
1,02 |
|
(tv/2) [h] |
(± 0,78) |
(± 0,78) |
(0,96-1,08) |
* Aritmetický průměr (± SD), ** Bodový odhad (CI 93,4 %)
Tab. 1: Shrnutí statistiky primárních farmakokinetických parametrů.
5.3 Předklinické údaje vztahující se k bezpečnosti
Studie toxicity po opakovaném podání v trvání 6 měsíců u psů a 18 měsíců u albinotických potkanů neodhalily žádné klinicky významné škodlivé účinky v dávkovém rozmezí 2,5 až 120 mg/kg. Betahistin nemá mutagenní potenciál a nebyly zjištěny žádné důkazy kancerogenity u potkanů. Testy provedené u březích samic králíků neprokázaly žádný důkaz teratogenních účinků.
6. FARMACEUTICKÉ ÚDAJE
6.1
Seznam pomocných látek
Monohydrát laktosy Kukuřičný škrob
Mikrokrystalická celulosa Kyselina citrónová Povidon 25 Krospovidon typ A Hydrogenovaný rostlinný olej
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 ° C.
6.5 Druh obalu a obsah balení
Tablety jsou baleny v PVC/PE/PVDC-Al blistru.
Jsou k dispozici balení obsahující 20, 24, 30, 48, 50, 60, 96 a 100 tablet. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
HENNIG ARZNEIMITTEL GmbH & Co. KG
LiebigstraBe 1-2
65439 Florsheim am Main
Německo
tel: +49 6145 508 0 fax: +49 6145 508 140 info@hennig-am.de
8. REGISTRAČNÍ ČÍSLO(A)
83/812/11 -C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 14/12/2011
Datum posledního prodloužení registrace: 10/08/2012
10. DATUM REVIZE TEXTU
4.4.2014
6