Varilrix
sp.zn. sukls146011/2014 a sukls35098/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU Varilrix
Prášek a rozpouštědlo pro injekční roztok. Vakcína proti planým neštovicím
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Po rekonstituci 1 dávka (0,5 ml) obsahuje:
Virus varicellae vivum attenuatum* 103,3 PFU**
* živý oslabený virus varicella zoster, kmen Oka, získaný reprodukcí na tkáňové kultuře MRC5 lidských diploidních buněk ** plaque-forming units
Úplný seznam pomocných látek viz bod 6.1.
Varilrix vyhovuje požadavkům Světové zdravotnické organizace kladeným na biologické látky a vakcíny proti varicelle.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok.
Popis přípravku:
Lyofilizát je lehce krémový až žlutavý nebo narůžovělý.
Rozpouštědlo je čirý a bezbarvý roztok.
Barva rozpuštěné vakcíny kolísá od jasně broskvové do růžové, závisí na možné variabilitě pH a nemá vliv na kvalitu vakcíny.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Zdraví _ jedinci
Varilrix je určený k aktivní imunizaci zdravých jedinců proti varicelle od věku 9 měsíců.
Doporučuje se očkovat zdravé, k infekci vnímavé jedince, kteří jsou v blízkém kontaktu s pacienty, u nichž lze předpokládat, že by varicella mohla mít těžký průběh. Cílem očkování je snížení rizika a přenosu infekce divokým kmenem varicelly na tyto osoby. Za osoby v blízkém kontaktu jsou obvykle považováni rodiče, sourozenci a ošetřující zdravotnický personál pacientů ohrožených infekcí.
Pacienti s vysokým rizikem těžkého _průběhu varicelly
Pacienti trpící leukémií, pacienti léčení imunosupresivy (včetně kortikosteroidní terapie) při léčbě zhoubných solidních tumorů, při léčbě závažných chronických onemocnění (jako jsou: chronické selhání ledvin, autoimunní onemocnění, kolagenózy, těžké bronchiální astma) nebo pacienti po orgánové transplantaci, jsou náchylní k onemocnění varicellou s těžkým průběhem. Bylo prokázáno, že u těchto pacientů snižuje očkování kmenem Oka výskyt komplikací varicelly.
Údaje z klinického hodnocení přípravku Varilrix u pacientů s vysokým rizikem těžkého průběhu
varicelly jsou omezené, jejich očkování připadá v úvahu tehdy, jsou-li splněny následující podmínky:
■ U pacientů v akutní fázi leukémie musí být udržovací chemoterapie přerušena v období jeden týden před a jeden týden po očkování. Pacienti by neměli být očkováni v období, kdy podstupují radioterapii. Obecně platí, že pacienti mají být očkováni ve stadiu úplné hematologické remise onemocnění.
■ Celkový počet lymfocytů musí být nejméně 1 200/mm3, nebo pacienti nesmí mít nález svědčící o ztrátě buněčné imunity.
■ Pacienti s plánovanou orgánovou transplantací (např. transplantace ledvin) musí být očkováni několik týdnů před zahájením imunosupresivní léčby.
4.2 Dávkování a způsob podání
0,5 ml rekonstituované vakcíny odpovídá jedné imunizační dávce.
Dávkování
Zdraví jedinci
Děti ve věku od 9 měsíců do 12 let včetně
Dětem ve věku od 9 měsíců do 12 let včetně by měly být k dosažení dostatečné ochrany před varicellou podány 2 dávky vakcíny Varilrix (viz bod 5.1).
Je vhodné podatdruhou dávku nejméně 6 týdnů po podání první dávky. Druhá dávka se v žádném případě nesmí podat v době kratší než 4 týdny po podání první dávky.
Dospívající ve věku od 13 let výše a dospělí
Od věku 13 let výše se očkuje dvěma dávkami. Druhou dávku je vhodné podat nejméně 6 týdnů po podání první dávky. Druhá dávka se v žádném případě nesmí podat v době kratší než 4 týdny po podání první dávky.
Vysoce rizikoví pacienti
U vysoce rizikových pacientů je možné, že k dosažení ochrany před varicellou bude nutné očkovat další dávkou vakcíny.
Zaměnitelnost
• Osobám, které byly dříve očkovány jednou dávkou jiné vakcíny proti varicelle, lze podat jednu
dávku vakcíny Varilrix.
• Po podání jedné dávky vakcíny Varilrix lze podat jednu dávku jiné vakcíny proti varicelle. Způsob podání
Varilrix je určen pro subkutánní aplikaci, přednostně se podává do horní části paže (do oblasti deltového svalu).
Pro informaci jak vakcínu připravit nebo rekonstituovat se, prosím, podívejte do bodu 6.6.
4.3 Kontraindikace
Varilrix je kontraindikován u osob se závažnou humorální nebo celulární imunodeficiencí, jako jsou:
• Pacienti s primárními, nebo získanými imunodeficitními stavy s celkovým počtem lymfocytů menším než 1 200/mm3.
• Pacienti s jiným nálezem svědčícím pro ztrátu buněčné imunity (např. pacienti s leukémií, lymfomy, krevní dyskrazií, HIV infekcí ve stavu klinické manifestace).
• Pacienti pod imunosupresivní terapií včetně těch, kteří dostávají vysoké dávky kortikosteroidů. Viz bod 4.4.
Závažná humorální nebo buněčná (primární nebo získaná) imunodeficience, např. závažná kombinovaná imunodeficience, agamaglobulinemie a AIDS nebo symptomatická HIV infekce nebo věkově specifický procentuální podíl CD4+ T-lymfocytů u dětí mladších 12 měsíců: CD4+ <25 %; u dětí mezi 12 - 35 měsíci: CD4+ <20 %; u dětí mezi 36 - 59 měsíci: CD4+ <15 % (viz bod 4.4).
Varilrix je kontraindikován u osob se známou přecitlivělostí na neomycin nebo na kteroukoli složku této vakcíny. Výskyt kontaktní dermatitidy po neomycinu v anamnéze však není kontraindikací.
Varilrix je kontraindikován u osob se zjevnými známkami hypersenzitivity po předchozím podání vakcíny proti varicelle.
U těhotných žen je podání vakcíny Varilrix kontraindikováno. Ženám, které plánují těhotenství, by se mělo doporučit oddálení otěhotnění o 1 měsíc po očkování. (viz bod 4.6).
4.4 Zvláštní upozornění a opatření pro použití
Podobně jako u jiných vakcín musí být očkování vakcínou Varilrix odloženo, jestliže pacient trpí závažným akutním horečnatým onemocněním. U zdravých jedinců však mírná forma infekce není kontraindikací pro očkování.
Synkopa (krátkodobá ztráta vědomí) se může dostavit v průběhu, nebo před očkováním jako psychogenní reakce na injekční stříkačku s jehlou. Je důležité na to myslet při výběru místa podání vakcíny tak, aby nedošlo k poranění při krátkodobé ztrátě vědomí.
Podobně jako je tomu u jiných vakcín, musí být pro případ rozvoje anafylaktické reakce po očkování touto vakcínou okamžitě zajištěna odpovídající terapie a dohled. Z tohoto důvodu musí také zůstat očkovaní jedinci ještě 30 minut po aplikaci vakcíny pod lékařským dohledem.
Před aplikací vakcíny je nutné vyčkat, až se alkohol nebo jiná antiseptika použitá k dezinfekci místa vpichu odpaří z kůže, aby nedošlo k inaktivaci atenuovaných virů obsažených ve vakcíně.
Určitého stupně ochrany může být dosaženo podáním vakcíny až do 72 hodin po expozici přirozenému viru varicelly.
Podobně jako u jiných vakcín, protektivní imunitní odpověď nemusí být dosažena u všech očkovaných.
Tak jako u jiných vakcín proti varicelle se i u osob, které byly v minulosti očkovány vakcínou Varilrix, objevily případy onemocnění varicellou. Ve srovnání s neočkovanými jedinci infekce probíhá mírně s menším počtem kožních lézí a s nižší horečkou..
Bylo popsáno velmi malé množství případů, kdy došlo k přenosu Oka viru z očkovaných jedinců na séronegativní osoby s objevením se vyrážky. Přenos Oka viru z očkovaného, u kterého nedošlo k rozvoji vyrážky, na séronegativní kontakty nelze vyloučit.
Mírný stupeň vyrážky u zdravých kontaktů ukazuje, že virus zůstává atenuovaný i po pasáži přes lidského hostitele.
U imunokompromitovaných jedinců jsou omezené údaje o podání vakcíny Varilrix, proto je třeba s opatrností zvážit očkování těchto pacientů a očkovat pouze na základě vyjádření lékaře, jestliže přínos převáží nad riziky.
Imunokompromitovaní pacienti, u kterých není kontraindikace k podání této vakcíny (viz bod 4.3), nemusí na očkování odpovědět tak dobře, jako imunokompetentní pacienti. Někteří z těchto pacientů proto v případě kontaktu mohou navzdory očkování onemocnět planými neštovicemi. Imunokompromitovaní pacienti musí být pečlivě sledováni pro možný výskyt příznaků planých neštovic.
Existuje velmi málo hlášení o diseminovaných planých neštovicích se zasažením vnitřních orgánů v návaznosti na očkování vakcínou obsahující Oka kmen. Tato hlášení pocházejí hlavně od imunokompromitovaných jedinců.
Varilrix nesmí být za žádných okolností aplikován intravenózně a intradermálně.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
V případě, že se má provést tuberkulinový test, měl by se test provést před nebo současně s aplikací vakcíny, protože bylo zjištěno, že vakcíny obsahující živý virus mohou způsobit dočasný pokles citlivosti kožního tuberkulinového testu. Jelikož toto snížení citlivosti po aplikaci vakcíny může trvat až 6 týdnů, neměl by se po tuto dobu tuberkulinový test provádět, jelikož by se mohly získat falešně negativní výsledky.
Očkování jedinců, kterým byly podány imunoglobuliny nebo krevní transfúze, musí být odloženo nejméně o 3 měsíce. Je totiž pravděpodobné, že očkování nebude úspěšné, protože tyto osoby mohou pasivně získat protilátky proti varicelle.
Po užití salicylátů v průběhu infekce způsobené přirozeným kmenem varicelly byl popsán případ výskytu Reyeova syndromu, proto se po dobu 6 týdnů po očkování proti varicelle salicyláty nemají užívat.
Zdraví _ jedinci
Varilrix může být podán současně s jinými vakcínami. Jednotlivé injekční vakcíny však musí být aplikovány do různých míst.
Očkování proti spalničkám vyvolává krátkodobý útlum buňkami zprostředkované imunity. Z tohoto důvodu, pokud není vakcína obsahující spalničkový virus podána současně s přípravkem Varilrix, měl by být mezi podáním obou vakcín dodržen nejméně měsíční interval.
Vysoce rizikoví pacienti
Varilrix nesmí být podán současně s jinými živými, atenuovanými vakcínami.
Inaktivované vakcíny mohou být aplikovány vzhledem k podání vakcíny Varilrix kdykoliv, pokud nebyly zjištěny specifické důvody ke kontraindikaci. Vždy však platí, že jednotlivé injekční vakcíny musí být aplikovány do různých míst.
4.6 Fertilita, těhotenství a kojení Fertilita
Vakcína Varilrix nebyla zahrnuta do studií fertility.
Těhotenství
Těhotné ženy nesmí být očkovány vakcínou Varilrix.
Po dobu 1 měsíce po očkování je třeba se vyhnout otěhotnění.
Ženám, které těhotenství plánují, by se mělo doporučit oddálení otěhotnění.
Nejsou k dispozici odpovídající data týkající se podání vakcíny Varilrix ženám v období těhotenství a studie reprodukční toxicity u zvířat nebyly provedeny.
Kojení
O použití vakcíny u kojících žen nejsou žádné údaje.
4.7 Účinky na schopnost řídit a obsluhovat stroje Není relevantní.
4.8 Nežádoucí účinky Klinické studie Zdraví jedinci
Více než 7 900 jedinců se účastnilo klinických studií s cílem zhodnotit reaktogenitu vakcíny podané samostatně nebo současně s jinými vakcínami.
Bezpečnostní profil uvedený níže je založen na informacích získaných po podání 5 369 dávek vakcíny Varilrix v monoterapii dětem, dospívajícím a dospělým.
Četnost nežádoucích účinků je definována následujícím způsobem:
Velmi časté: Časté:
Méně časté: Vzácné:
Velmi vzácné:
> 1/10
> 1/100 až < 1/10
> 1/1 000 až < 1/100
> 1/10 000 až < 1/1 000 < 1/10 000
Infekce a infestace
Méně časté: infekce horních cest dýchacích, faryngitida.
Poruchy krve a lymfatického systému Méně časté: lymfadenopatie.
Psychiatrické poruchy Méně časté: podrážděnost.
Poruchy nervového systému Méně časté: bolest hlavy, somnolence.
Poruchy oka Vzácné: konjunktivitida.
Respirační, hrudní a mediastinální poruchy Méně časté: kašel, rinitida.
Gastrointestinální poruchy Méně časté: nauzea, zvracení;
Vzácné: bolest břicha, průjem.
Poruchy kůže a podkožní tkáně Časté: vyrážka;
Méně časté: vyrážka podobná varicelle, svědění; Vzácné: kopřivka.
Poruchy svalové a kosterní soustavy a pojivové tkáně Méně časté: artralgie, myalgie.
Celkové poruchy a reakce v místě aplikace
Velmi časté: bolest, zarudnutí;
Časté: otok v místě vpichu*, horečka (měřeno v ústech či v podpaží > 37,5 °C nebo v konečníku > 38,0 °C)*;
Méně časté: horečka (měřeno v ústech či v podpaží > 39,0 °C nebo v konečníku > 39,5 °C), únava, malátnost.
Ve srovnání s první dávkou byl po druhé dávce pozorován vyšší výskyt bolesti, zarudnutí a otoku.
*Ve studiích prováděných na dospívajících a dospělých byly velmi často hlášeny v místě vpichu injekce otok a horečka. Otok byl velmi často hlášen po podání druhé dávky u dětí mladších než 13 let.
Nebyl pozorován žádný rozdíl ve výskytu nežádoucích účinků mezi původně séropozitivními a séronegativními osobami.
Vysoce rizikoví _pacienti
Údaje z klinických studií týkající se pacientů s vysokým rizikem těžkého průběhu varicelly jsou pouze omezené. Reakce na očkování (především papulo-vezikulární exantém a horečka) jsou obvykle mírné. Stejně jako u zdravých osob jsou zarudnutí, otok a bolest v místě vpichu injekce pouze přechodné a mírné.
Postmarketingové sledování
V průběhu sledování bezpečnosti vakcíny po jejím uvedení na trh byly hlášeny následující další nežádoucí účinky:
Infekce a infestace Vzácné: herpes zoster.
Poruchy krve a lymfatického systému Vzácné: trombocytopenie.
Poruchy imunitního systému
Vzácné: hypersenzitivita, anafylaktické reakce.
Poruchy nervového systému
Vzácné: encefalitida, cerebrovaskulární příhoda, cerebelitida, příznaky podobné cerebelitidě (včetně přechodné poruchy chůze a přechodné ataxie).
Cévní poruchy
Vzácné: vaskulitidy (zahrnují Henoch-Schonleinovu purpuru a Kawasakiho nemoc).
Poruchy kůže a podkožní tkáně Vzácné: erythema multiforme.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv,
Šrobárova 48,
100 41 Praha 10,
webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek.
4.9 Předávkování
Byly hlášeny případy náhodného podání více dávek vakcíny Varilrix, než je doporučeno. V některých případech byly hlášeny tyto nežádoucí účinky: letargie a křeče. V jiných případech hlášených jako předávkování se nežádoucí účinky spojené s očkováním nevyskytly.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: virové vakcíny. ATC kód: J07BK01. Vakcína proti varicelle.
Mechanismus účinku
U vnímavých jedinců vakcína Varilrix vyvolává oslabenou, klinicky inaparentní formu varicelly. Přítomnost protilátek je považována za indikátor ochrany proti infekci.
Účinnost a efektivita
Účinnost vakcín proti planým neštovicím firmy GlaxoSmithKline (GSK) Oka/RIT v prevenci onemocnění potvrzenými planými neštovicemi (PCR nebo expozicí planým neštovicím) byla zhodnocena ve velké aktivně kontrolované klinické studii u dětí ve věku 12 - 22 měsíců, které obdržely jednu dávku vakcíny Varilrix (N = 2 263) nebo dvě dávky vakcíny obsahující Oka/RIT (N = 2 279).
Pozorovaná účinnost vakcíny byla proti epidemiologicky potvrzeným planým neštovicím jakékoli závažnosti 65,4 % (97,5 % CI: 57,2 - 72,1 %) a proti středně závažným nebo závažným potvrzeným planým neštovicím 90,7 % (97,5 % CI: 85,9 % - 93,9 %) po jedné dávce vakcíny Varilrix a 94,9 % (97,5 % CI: 92,4 - 96,6 %) a 99,5 % (97,5 % CI: 97,5 - 99,9 %) po dvou dávkách vakcíny obsahující Oka/RIT (průměrná doba sledování byla 35 měsíců).
V předchozí studii specificky navržené k hodnocení účinnosti jedné dávky vakcíny Varilrix byly sledovány po dobu přibližně 2,5 let po očkování děti ve věku 10 až 30 měsíců. Protektivní účinnost proti běžným klinickým případům varicelly (> 30 vesikul) byla 100% a proti jakémukoli sérologicky potvrzenému případu varicelly (nejméně 1 vesikula nebo papula) byla 88% (95 % CI: 71,0 - 95,2 %).
Účinnost jedné dávky vakcíny Varilrix byla předpokládaná u různých souborů (epidemie, studie případů a kontrol a databázové studie) a pohybovala se v rozmezí od 20 % - 92 % proti jakémukoliv onemocnění varicellou a od 86 % - 100 % proti středně těžké až těžké formě nemoci.
Účinek jedné dávky vakcíny Varilrix celkově snižuje hospitalizace u varicelly o 81 % a ambulantní návštěvy dětí o 87 %.
Údaje naznačují, že po podání dvou dávek vakcíny je vyšší účinnost a dochází ke snížení počtu průlomových onemocnění varicellou než po podání jedné dávky.
Imunitní odpověď
Zdraví jedinci
6 týdnů po očkování dětí ve věku 11 až 21 měsíců byla po očkování jednou dávkou vakcíny zjištěna metodou ELISA (50 mIU/ml) sérokonverze u více než 89,6 % očkovaných a 100 % po očkování dvěmi dávkami.
6 týdnů po očkování dětí ve věku 9 měsíců až 12 let byla po podání jedné dávky zjištěna metodou imunofluorescence (IFA) sérokonverze u více než 98 % očkovaných. U dětí očkovaných jednou dávkou ve věku 12 - 15 měsíců přetrvávaly protilátky nejméně 7 let po očkování.
U dětí ve věku 9 měsíců až 6 let byla 6 týdnů po očkování druhou dávkou sérokonverze měřená metodou IFA u 100 % očkovaných. Po podání druhé dávky bylo pozorováno zřetelné zvýšení titru protilátek (5 až 26 násobné zvýšení geometrických středních titrů protilátek - GMT).
U jedinců ve věku 13 let a více byla 6 týdnů po očkování druhou dávkou měřená metodou IFA sérokonverze u 100 % očkovaných. Jeden rok po očkování byly všechny vyšetřené osoby stále séropozitivní.
V klinických studiích byla většina očkovaných osob, které byly následně vystavené divokému typu viru, buď úplně ochráněna před klinickými projevy varicelly, nebo prodělala jen mírnou formu onemocnění (s malým počtem vezikul a bez horečky).
Pro stanovení míry ochrany proti takovým komplikacím varicelly jako jsou encefalitida, hepatitida nebo pneumonie, nejsou k dispozici dostatečné údaje.
Vysoce rizikoví _pacienti
O vysoce rizikových pacientech jsou z klinických studií k dispozici pouze velmi omezené údaje.
V souhrnu byla u těchto pacientů dosažena sérokonverze > 80 %.
U vysoce rizikových pacientů se po očkování doporučuje sledovat hladiny virově specifických protilátek proti varicelle, aby bylo možné včas zjistit ty pacienty, u nichž by mělo být provedeno přeočkování.
5.2 Farmakokinetické vlastnosti
Nejsou u vakcín požadovány.
Klinické studie
Viz „Farmakodynamické vlastnosti“.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Vakcína: aminokyseliny, lidský albumin, monohydrát laktosy, neomycin-sulfát, mannitol, sorbitol. Rozpouštědlo: voda na injekci.
6.2 Inkompatibility
Vakcína Varilrix se nesmí mísit s jinými vakcínami v téže injekční stříkačce.
6.3 Doba použitelnosti
Při uchovávání za předepsaných teplotních podmínek + 2 až + 8 °C je doba použitelnosti vakcíny 2 roky.
Po rekonstituci se může vakcína uchovávat 90 minut při pokojové teplotě (25 °C) a 8 hodin v chladničce (2 °C - 8 °C).
6.4 Zvláštní opatření pro uchovávání
Lyofilizovanou vakcínu uchovávejte v chladničce (2 °C až 8 °C).
Rozpouštědlo může být uchováváno v chladničce, nebo při těplotě do 25 °C.
Lyofilizovaná vakcína se nepoškodí případným zmrazením.
Uchovávejte lyofilizovanou vakcínu v krabičce, aby byla chráněna před světlem.
Při distribuci vakcíny Varilrix je nutné dodržovat stejné podmínky, jaké platí pro uchovávání.
Po rekonstituci se doporučuje podat vakcínu okamžitě (viz bod 6.3).
6.5 Druh obalu a obsah balení Druh obalu
a) Lahvička z bezbarvého skla obsahující lyofilizát, opatřená pryžovou zátkou, Al pertlem
a odklápěcím PP (“flip-off’) víčkem + ampule z bezbarvého skla typu I obsahující rozpouštědlo, krabička.
b) Lahvička z bezbarvého skla obsahující lyofilizát, opatřená pryžovou zátkou, Al pertlem
a odklápěcím PP (“flip-off’) víčkem + předplněná injekční stříkačka z bezbarvého skla obsahující rozpouštědlo bez jehly, s pryžovým pístem a pryžovým krytem konusu. Injekční stříkačka může a nemusí být opatřena PP back-stop mechanismem bránícím vytažení pístu z válce stříkačky, krabička.
c) Lahvička z bezbarvého skla obsahující lyofilizát, opatřená pryžovou zátkou, Al pertlem
a odklápěcím PP (“flip-off’) víčkem + předplněná injekční stříkačka z bezbarvého skla obsahující rozpouštědlo s fixní jehlou chráněnou pryžovým krytem, opatřená pryžovým pístem, krabička.
d) Lahvička z bezbarvého skla obsahující lyofilizát, opatřená pryžovou zátkou, Al pertlem
a odklápěcím PP (“flip-off’) víčkem + předplněná injekční stříkačka z bezbarvého skla obsahující rozpouštědlo, s pryžovým pístem a pryžovým krytem konusu + 2 přiložené jehly zatavené v PP pouzdrech. Injekční stříkačka může a nemusí být opatřena PP back-stop mechanismem bránícím vytažení pístu z válce stříkačky, krabička.
Velikost balení:
a,b,c,d) 1x 0,5 ml/dávka, 10x 0,5 ml/dávka, 25x 0,5 ml/dávka, 100x 0,5 ml/dávka.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
V souvislosti s malými odchylkami pH může barva rekonstituované vakcíny kolísat od jasně broskvové do růžové.
Rozpouštědlo i rekonstituovaná vakcína musí být před použitím opticky zkontrolovány na přítomnost cizorodých částic a na změnu vzhledu. Pokud rozpouštědlo a rekonstituovaná vakcína vzhledově nevyhovují, musí být vyřazeny.
Návod pro rekonstituci vakcíny přiloženým rozpouštědlem v ampuli
Vakcína musí být rekonstituována přidáním celého obsahu rozpouštědla z ampule do lahvičky obsahující lyofilizát. Po smíchání obou částí vakcíny musí být směs řádně protřepána, aby se lyofilizát úplně rozpustil.
Po rekonstituci je nutné vakcínu okamžitě použít.
K podání vakcíny je nutné použít novou jehlu.
Celý obsah lahvičky je nutné aplikovat najednou.
Návod pro rekonstituci vakcíny přiloženým rozpouštědlem v předplněné injekční stříkačce
Varilrix musí být rekonstituován přidáním celého obsahu rozpouštědla z předplněné injekční stříkačky do injekční lahvičky obsahující prášek.
Připojení jehly k injekční stříkačce viz obrázek níže.
Injekční stříkačka dodávaná s vakcínou Varilrix však může být lehce odlišná (bez šroubovacího závitu) od injekční stříkačky popsané na obrázku.
V tomto případě připojte jehlu bez šroubování.
Jehla
Stříkačka
Krytjehly

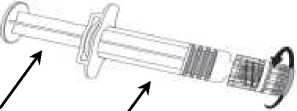
Tělo stříkačky
Píst stříkačky
Kryt stříkačky
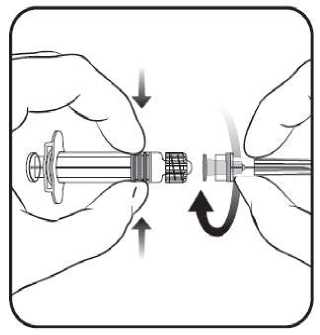
1. Držte tělo stříkačky jednou rukou (nedržte stříkačku za píst), kryt stříkačky odšroubujte otáčením proti směru hodinových ručiček.
2. Abyste připojil(a) jehlu ke stříkačce, našroubujte jehlu na stříkačku ve směru hodinových ručiček, dokud neucítíte, že je pevně připojena (viz obrázek).
3. Pak odstraňte ochranný kryt j ehly, což může j ít někdy trochu obtížně.
Přidejte rozpouštědlo k prášku. Po přidání rozpouštědla k prášku směs protřepávejte, dokud se všechen prášek úplně nerozpustí v rozpouštědle.
Po rekonstituci je nutné vakcínu okamžitě použít.
K podání vakcíny je nutné použít novou jehlu.
1) Na původní jehlu vraťte ochranný kryt jehly a pevně jej na jehlu natlačte.
2) Následně jednou rukou uchopte tělo stříkačky (aniž byste ji drželi za píst) a druhou rukou jehlu s krytem odšroubujte otáčením proti směru hodinových ručiček.
3) Novou jehlu na stříkačku nasaďte stejným způsobem popsaným výše pro připojení původní jehly.
Celý obsah lahvičky je nutné aplikovat najednou.
Veškerý nepoužitý léčivý přípravek nebo odpadní materiál musí být znehodnocen v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals S.A., rue de l'Institut 89, 1330 Rixensart, Belgie.
8. REGISTRAČNÍ ČÍSLO(A)
59/336/02-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 18.12.2002
Datum posledního prodloužení registrace: 7.8.2013
10. DATUM REVIZE TEXTU
13.4.2015
11