Vancomycin Mylan 500 Mg
Sp. zn. sukls211423/2014, sukls211424/2014
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Vancomycin Mylan 500 mg Vancomycin Mylan 1000 mg
prášek pro infuzní roztok
vancomycini hydrochloridum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, nebo lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, nebo lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je Vancomycin Mylan a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Vancomycin Mylan používat
3. Jak se Vancomycin Mylan používá
4. Možné nežádoucí účinky
5 Jak Vancomycin Mylan uchovávat 6. Obsah balení a další informace
1. Co je Vancomycin Mylan a k čemu se používá
Vankomycin Mylan patří do skupiny antibiotik zvaných glykopeptidová antibiotika, která ničí bakterie způsobující řadu infekcí včetně zápalu plic, onemocnění kůže, kostí a srdečních chlopní.
Vankomycin Mylan se používá k léčbě
• závažných bakteriálních infekcí citlivých na vankomycin a rezistentních na ostatní antibiotika
• infekcí u pacientů alergických na peniciliny a cefalosporiny
Používá se také k prevenci infekcí před některými chirurgickými výkony.
Vankomycin Mylan se může užít i perorálně (ústy) k léčbě závažných infekcí zažívacího taktu způsobených bakteriemi citlivými na vankomycin.
2. Čemu musíte věnovat pozornost, než začnete Vancomycin Mylan používat Neužívejte Vancomycin Mylan
• jestliže jste alergický/á na vankomycin nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před užitím vankomycinu se poraďte se svým lékařem nebo lékárníkem nebo zdravotní sestrou.
• jestliže máte ledvinové obtíže
• jestliže máte sluchové obtíže, jako je například hluchota
• jestliže máte málo krevních buněk
• jestliže j ste těhotná nebo pokud těhotenství plánujete
• jestliže kojíte
• jestliže jste starší pacient/ka a Váš věk přesahuje 60 let
• jestliže je pacientem předčasně narozené dítě nebo dítě
• jestliže je u Vás plánována operace
• jestliže jste alergický/á na antibiotikum teikoplanin (zvyšuje se tím riziko Vaší alergie na vankomycin).
V případě, že se u Vás projeví těžká alergická reakce, Váš lékař ukončí léčbu vankomycinem a poskytne Vám jinou léčbu.
Jestliže Vám byla infuze podána příliš rychle, mohou se u Vás objevit některé nežádoucí účinky, jako nízký krevní tlak nebo vyrážka. Po ukončení infuze obvykle tyto reakce rychle ustoupí.
Vankomycin musí být podáván s opatrností u pacientů s poruchou funkce ledvin nebo u pacientů současně léčených jinými léky toxickými pro ledviny z důvodu výrazně vyšší pravděpodobnosti vývoje toxických reakcí. Pro snížení tohoto rizika by u Vás má být pravidelně sledována funkce ledvin a je nutné se držet doporučených dávkovacích schémat.
Po nadměrně vysoké dávce vankomycinu nebo v případě současné léčby jiným přípravkem s toxickými účinky na sluch, může dojít u pacientů s předchozími poruchami sluchu k rozvoji přechodné nebo trvalé ztrátě sluchu, které může předcházet vznik ušního šelestu. Aby se snížilo toto riziko, mají být pravidelně prováděny krevní testy a sledovány sluchové funkce.
Pokud je Vám vankomycin podáván dlouhodobě, budou Vám pravidelně prováděny krevní testy. Také byste měl/a být sledován/a z důvodu možné superinfekce (nová infekce vyskytující se navíc k současné infekci), nebo závažného průjmu (někdy i s krvácením do stolice).
Další léčivé přípravky a přípravek Vancomycin Mylan
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu.
Následující přípravky mohou s vankomycinem reagovat, pokud jsou užívány současně:
• přípravky k léčbě bakteriálních infekcí (streptomycin, neomycin, gentamicin, kanamycin, amikacin, bacitracin, tobramycin, polymyxin B, kolistin)
• přípravky k léčbě tuberkulózy (viomycin)
• přípravky k léčbě houbových (plísňových) infekcí (amfotericin B)
• přípravky k léčbě rakoviny (cisplatina)
a dále také:
přípravky používané k uvolnění svalů v průběhu celkové anestezie celková anestetika (jestliže podstupujete celkovou anestezii).
Může být nutné, aby Váš lékař sledoval hladinu léku v krvi a upravil dávkování vankomycinu, jestliže je podáván současně s jinými léky.
Těhotenství a kojení
Jestliže jste těhotná anebo jestliže plánujete těhotenství, řekněte to svému lékaři. Vankomycin se v období těhotenství smí podávat pouze, pokud je to jednoznačně nezbytné.
Jestliže kojíte, oznamte to svému lékaři, protože vankomycin přestupuje do mateřského mléka. Váš lékař rozhodne, zda je léčba vankomycinem jednoznačně nutná anebo zda máte ukončit kojení.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento lék užívat.
Řízení dopravních prostředků a obsluha strojů
Vancomycin Mylan nemá žádný nebo pouze zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
3. Jak se Vancomycin Mylan používá
Vancomycin Mylan Vám bude podávat zdravotnický personál během hospitalizace. Váš lékař rozhodne, jaké množství tohoto léku máte každý den dostávat a jak dlouho léčení potrvá.
Dávkování
Dávka, kterou budete dostávat, závisí
• na Vašem věku,
• na infekci, kterou trpíte,
• na tom, jak dobře fungují Vaše ledviny,
• na stavu Vašeho sluchu,
• na tom, jaké další léky případně užíváte.
Dospělí:
Obvyklá dávka je 2000 mg denně (respektive 30 mg na kilogram tělesné hmotnosti), rozdělených do 2 až 4 jednotlivých dávek, tj. buď 500 mg každých 6 hodin nebo 1000 mg každých 12 hodin.
Děti:
Tito pacienti dostanou menší dávku, v závislosti na tělesné hmotnosti.
Pacienti s poruchou funkce ledvin nebo jater, starší pacienti a nedonošení novorozenci:
Lékař sníží dávku anebo prodlouží interval mezi jednotlivými dávkami.
Je možné, že v průběhu léčby Vám budou prováděny krevní testy, že budete požádán(a) o vzorky moči a pravděpodobně Vám bude provedeno i vyšetření sluchu, aby se vyloučila přítomnost možných nežádoucích účinků.
Jak se Vám lék bude podávat
Při intravenózní infuzi přípravek přitéká z infuzní lahve anebo z infuzního sáčku hadičkou a jehlou zavedenou do žíly. Váš lékař anebo sestra Vám vankomycin vždy podá do žíly, nikoli do svalu.
Vancomycin Mylan se před podáním naředí a bude pak pomalu do Vaší žíly přitékat po dobu nejméně 60 minut.
Pokud se vankomycin podává k léčbě onemocnění zažívacího traktu (onemocnění zvaného pseudomembranózní kolitida), musí se léčivý přípravek podávat ve formě roztoku ústy.
Délka léčby
Délka léčby záleží na infekci, kterou trpíte, a může trvat řadu týdnů.
Jestliže jste užil(a) více přípravku Vancomycin Mylan než jste měl(a)
Protože Vám tento lék bude podáván při pobytu v nemocnici, je nepravděpodobné, že by Vám byla podána příliš velká dávka vankomycinu. Máte-li však přesto jakékoli pochyby, řekněte o nich svému lékaři nebo sestře.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. MOŽNÉ NEŽÁDOUCÍ ÚČINKY
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Těžké anafylaktoidní reakce jsou možné během nebo krátce po rychlé nitrožilní infuzi. Po zastavení infuze reakce vymizí (vzácný nežádoucí účinek).
Pokud zaznamenáte některý z následujících projevů, musíte ihned kontaktovat svého lékaře:
• alergická reakce: kopřivka, otok obličeje, rtů, jazyka nebo hrdla, potíže s dýcháním nebo polykáním nebo závratě.
Nežádoucí účinky vankomycinu zahrnují:
Časté nežádoucí účinky (postihují 1 až 10 pacientů ze 100):
• snížení krevního tlaku, otoky, zarudnutí a bolesti podél žil
• dušnost, sípání způsobené turbulentním prouděním vzduchu v horních dýchacích cestách
• celková vyrážka a zánět sliznice (která vytváří kluzký sekret zvaný hlen a vystýlá mnoho tělních dutin a dutých orgánů) svědění, svědivá vyrážka
• zčervenání horní poloviny těla a obličeje, bolesti a křeče hrudních a zádových svalů
• poruchy ledvin, které se mohou primárně projevit zvýšením koncentrace kreatininu a močoviny v krvi
Méně časté nežádoucí účinky (postihují 1 až 10 pacientů z 1 000):
• přechodná nebo trvalá ztráta sluchu
Vzácné nežádoucí účinky (postihují 1 až 10 pacientů z 10 000):
• zvýšený nebo snížený (někdy velmi silně snížený) výdej moči, stopy krve v moči
• zvýšení počtu bílých krvinek v krvi (eozinofilie), nebo snížení počtu některých krevních buněk, které mohou způsobit krvácení nebo modřiny snadněji než je obvyklé (trombocytopenie), časté infekce jako je horečka, silná zimnice, bolesti v krku nebo vřídky v ústech (neutropenie a
agranulocytóza)
• ušní šelesty (např. pískání)
• pocit slabosti
• červená nebo purpurová kůže (možné známky zánětu cév)
• nevolnost
Velmi vzácné nežádoucí účinky (postihují méně než 1 pacienta z 10 000):
• vzácné onemocnění kůže s těžkými puchýři a krvácení ze rtů, očí, úst, nosu a pohlavních orgánů (Stevens-Johnsonův syndrom)
• odlupování nebo olupování kůže (exfoliativní dermatitida)
• závažná kožní reakce, která začíná tvorbou bolestivých červených oblastí, pak velkými puchýři a končí odlupováním vrstev kůže. To je doprovázeno horečkou a zimnicí, bolestmi svalů a celkovým pocitem nevolnosti (Lyellův syndrom)
• poléková autoimunitní zpuchýřující choroba (bulózní dermatitida vyvolaná IgA)
• srdeční zástava
• zánět střev vyvolávající bolesti v břiše nebo krvavý průjem Není známo (z dostupných dat nelze určit)
Léková reakce, která způsobuje vyrážku, horečku, záněty vnitřních orgánů, účinky na krev a obecná onemocnění (DRESS).
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek.
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Vancomycin Mylan uchovávat
Uchovávejte mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti (EXP), uvedené na lahvičce a na krabičce. Doba použitelnosti se vztahuje k poslednímu dni daného měsíce.
Prášek
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Údaje o stabilitě rekonstituovaného a dále naředěného přípravku jsou uvedeny v informaci pro zdravotnické pracovníky.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co Vancomycin Mylan obsahuje
Léčivá látka je vancomycini hydrochloridum.
Jedna injekční lahvička přípravku Vancomycin Mylan 500 mg obsahuje vancomycini hydrochloridum 500 mg, což odpovídá 500 000 IU.
Jedna injekční lahvička přípravku Vancomycin Mylan 1000 mg obsahuje vancomycini hydrochloridum 1g, což odpovídá 1 000 000 IU.
Pomocnou látkou je roztok kyseliny chlorovodíkové 0,5 mol/l (k úpravě pH)
Jak Vancomycin Mylan vypadá a co obsahuje toto balení
Bílý až téměř bílý prášek pro infuzní roztok.
Velikost balení: 1, 5, 10 nebo 20 injekčních lahviček.
Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce Držitel rozhodnutí o registraci
Mylan S.A.S., 117 allée des Parcs, 69 800 Saint Priest, Francie Výrobce:
Biologici Italia Laboratories S.R.L (Itálie),
Mylan S.A.S. (Francie),
Vianex S.A. Plant C (Řecko)
Tento léčivý přípravek je v členských státech EHP registrován pod těmito názvy:
Rakousko: Vancomycin Arcana 500 mg and 1 g - Pulver zur Herstellung einer Infusionslosung Belgie: Vancomycine Mylan 500 mg & 1 g poeder voor oplossing voor infusie Kypr: Vancomycin Mylan 500 mg and 1 g
Česká Republika: Vancomycin Mylan 500 mg, & 1 g, prášek pro přípravu infuzního roztoku
Řecko: Vancomycin / Generics 500mg & 1g powder for solution for infusion
Irsko: Vancomycin Mylan 500 mg, 1g, powder for solution for infusion
Itálie: Vancomicina Mylan
Polsko: Vancomycin Mylan
Slovenská republika: Vancomycin Mylan
Slovinsko: Vankomycin Mylan 1 g prašek za raztopino za infundiranje
Tato příbalová informace byla naposledy revidována: 13.7.2016
Následující informace je určena pouze pro zdravotnické pracovníky:
Toto je výtah ze souhrnu údajů o přípravku, který má sloužit jako pomůcka při podávání přípravku Vancomycin Mylan. Při určování vhodnosti použití u určitého pacienta je třeba, aby byl předepisující lékař obeznámen se souhrnem údajů o přípravku v plném znění.
ZPŮSOB PODÁNÍ
Pouze k intravenózní infuzi. Není určeno k nitrosvalovému podání.
Parenterálně se vankomycin může podávat pouze jako pomalá intravenózní infuze (ne více než 10 mg/min - po dobu nejméně 60 min), která je dostatečně zředěná (alespoň 100 ml na 500 mg nebo nejméně 200 ml na 1000 mg). pH roztoku po rekonstituci je 2,8 - 4,5.
Připravený roztok může být také použit pro perorální podání.
Léčebné indikace pro intravenózní a perorální podání jsou různé. Obě cesty podání nelze zaměnit.
DÁVKOVÁNÍ Intravenózní podání
Infuze má trvat nejméně 60 minut. U dospělých, pokud se použijí dávky nad 500 mg, se doporučuje rychlost infuze maximálně 10 mg/min. Výskyt příhod souvisejících s infuzí závisí jak na koncentraci, tak na rychlosti podání vankomycinu.
Terapeutické podání
Délka léčby se řídí závažnosti infekce a její klinickou a bakteriologickou progresí.
Pacienti s normální funkcí ledvin a jater
Dospělí a děti starší 12 let:
Doporučená intravenózní denní dávka je 2000 mg (2g). Podává se rozděleně v dávkách 500 mg každých 6 hodin anebo 1000 mg každých 12 hodin.
Pro léčbu bakteriální endokarditidy je obecně uznávaný dávkovací režim 1000 mg vankomycinu intravenózně každých 12 hodin po dobu 4 týdnů buď samostatně, nebo v kombinaci s jinými antibiotiky (gentamicin plus rifampicin, gentamicin nebo streptomycin).
Enterokoková endokarditida se léčí po dobu 6 týdnů vankomycinem v kombinaci s aminoglykosidy -podle národních standardních postupů.
Perioperační profylaxe: dospělí pacienti dostávají 1000 mg vankomycinu intravenózně (před uvedením do anestezie) a v závislosti na délce a typu operace může být podána dávka 1000 mg vankomycinu i.v. 12 hodin po operaci.
Děti od věku 1 měsíce do 12 let:
Doporučená intravenózní dávka je 10 mg/kg každých 6 hodin nebo 20 mg/kg každých 12 hodin. Novorozenci a kojenci:
Doporučená úvodní dávka je 15 mg/kg, potom 10 mg/kg každých 12 hodin v průběhu prvního týdne života a potom každých 8 hodin do dosažení věku 1 měsíc. Je doporučována pečlivá kontrola hladin vankomycinu v séru (viz níže).
Starší pacienti:
Nižší udržovací dávky mohou být nutné vzhledem ke snížení funkce ledvin související s věkem.
Obézní pacienti:
Může být potřebná úprava obvyklého denního dávkování.
Pacienti s jaterní insuficiencí
Neexistuje žádný důkaz o tom, že by dávka měla být u pacientů s jaterní insuficiencí snížena.
Pacienti s poruchou funkce ledvin
U těchto pacientů musí být dávka upravena a následující nomogram může posloužit jako vodítko. Doporučuje se pečlivé sledování sérové koncentrace vankomycinu (viz níže).
Clearance kreatininu (ml/s)
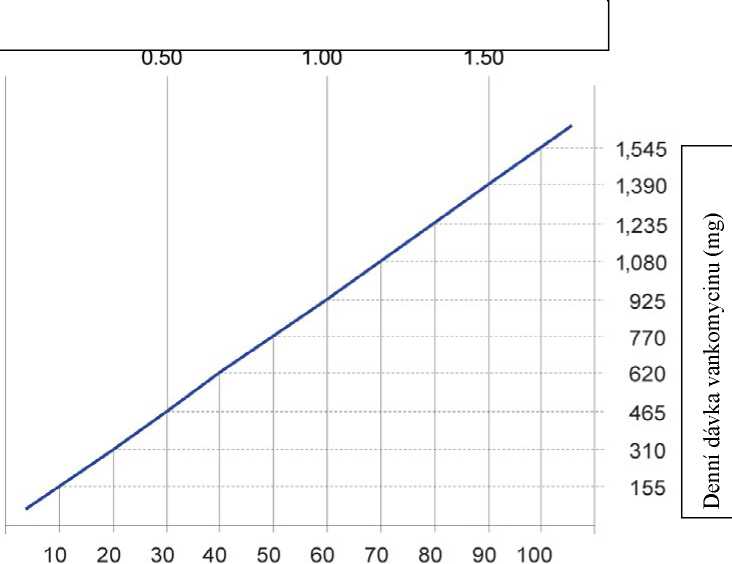
Clearance kreatininu (ml/min)
Dávkovací nomogram pro dospělé pacienty s poruchou funkce ledvin
U pacientů s mírným nebo středně těžkým renálním selháváním nemá být počáteční dávka nižší než 15 mg/kg. U pacientů se závažným renálním selháváním je vhodnější podávat udržovací dávku mezi 250 mg a 1000 mg v odstupu několika dnů, spíše než podávat nižší denní dávky.
U pacientů s anurií (praktickou absencí renálních funkcí) se podává dávka 15 mg/kg tělesné hmotnosti, dokud není dosaženo terapeutické sérové koncentrace vankomycinu. Udržovací dávky jsou 1,9 mg/kg tělesné hmotnosti/24 hodin.
K usnadnění postupu je možné aplikovat pacientům se závažným postižením funkce ledvin jednu udržovací dávku 250 mg až 1000 mg vždy jednou za několik dní, spíše než každodenně.
Dávkování v případě hemodialýzy:
U pacientů s nefunkčními ledvinami, podstupujících pravidelně hemodialýzu je možné následující dávkování: saturační dávka 1000 mg vankomycinu, udržovací dávka 1000 mg podaná každý sedmý až desátý den.
Pokud se používají při hemodialýze polysulfonové membrány (dialýza s vysokým průtokem), je poločas vankomycinu snížen. U pravidelně hemodialyzovaných pacientů mohou být proto nutné přídatné udržovací dávky.
Monitorování koncentrací vankomycinu v séru:
Sérové koncentrace vankomycinu mají být sledovány od druhého dne léčby bezprostředně před další dávkou a jednu hodinu po infuzi. Terapeutická hladina vankomycinu v krvi jednu hodinu po ukončení infuze má být mezi 30 a 40 mg/l (maximum 50 mg/l), minimální hladina (krátce před další dávkou) pak mezi 5 a 10 mg/l.
Koncentrace vankomycinu v séru má být běžně kontrolována dvakrát nebo třikrát týdně.
Perorální podání
Léčba kolitidy způsobené C. difficile
Dospělí: Obvyklá denní dávka je 0,5 až 2g rozdělené do 4 dávek (125 mg-500 mg na jednu dávku) po dobu 7 až 10 dnů.
Děti: V terapii dětské pseudomembranózní kolitidy se obvykle podává dávka 40 mg/kg, rozdělená do čtyř dávek. Maximální dávka je 250mg/dávku podávaná po dobu 7 až 10 dní.
ZACHÁZENÍ S PŘÍPRAVKEM Příprava infuzního roztoku
Vancomycin Mylan 500 mg: Obsah jedné lahvičky se rozpustí v 10 ml vody na injekci.
Vancomycin Mylan 1000 mg: Obsah jedné lahvičky se rozpustí ve 20 ml vody na injekci.
Jeden ml rekonstituovaného roztoku obsahuje 50 mg vankomycinu.
Roztok připravený tímto způsobem za aseptických podmínek lze uchovávat po dobu 48 hodin při teplotě 25 °C a po dobu 96 hodin při teplotě 2-8 °C.
Po rekonstituci je nutné roztok dále naředit. Vhodná rozpouštědla pro další ředění vankomycinu jsou voda na injekci, 5% roztok glukózy a 0,9% roztok chloridu sodného.
V závislosti na způsobu podání se liší i způsob ředění.
Intermitentní infuze:
Vancomycin Mylan 500 mg: Rekonstituovaný roztok obsahující 500 mg vankomycinu (50 mg/ml) se musí dále zředit nejméně 100 ml některého z ředících roztoků, uvedených výše (na 5 mg/ml). Vancomycin Mylan 1000 mg: Rekonstituovaný roztok obsahující 1000 mg vankomycinu (50 mg/ml) se musí dále zředit nejméně 200 ml některého z ředících roztoků, uvedených výše (na 5 mg/ml).
Koncentrace vankomycinu v infuzním roztoku nemá přesáhnout 5mg/ml.
Požadovaná dávka se podává intravenózní infuzí rychlostí ne více než 10 mg/min po dobu alespoň 60 minut.
Kontinuální infuze:
1000 mg až 2000 mg vankomycinu (což odpovídá 2 až 4 lahvičkám rekonstituovaného roztoku) se naředí v dostatečném množství některého výše uvedených vhodných rozpouštědel tak, aby bylo možné podat požadovanou denní dávku v infuzi trvající 24 hodin.
Doba použitelnosti rekonstituovaného roztoku
Chemická a fyzikální stabilita přípravku po rekonstituci ve vodě na injekci byla prokázána po dobu 48 hodin při teplotě 25 °C a po dobu 96 hodin při teplotě 2-8 °C.
Z mikrobiologického hlediska má být infuzní roztok použit okamžitě. Pokud není použit okamžitě, doba a podmínky uchovávání přípravku po otevření před použitím jsou v odpovědnosti uživatele a normálně by tato doba neměla být delší než 24 hodin při teplotě 2° až 8 °C, pokud rekonstituce neproběhla za kontrolovaných a validovaných aseptických podmínek.
U rekonstituovaného a ředěného roztoku musí být před použitím vizuálně zkontrolována případná přítomnost částic a změna zabarvení. Lze použít pouze čirý a bezbarvý roztok bez částic.
Příprava perorálního roztoku
Rekonstituovaný roztok lze dále naředit 30 ml vody a pacient/ka roztok buď vypije, nebo mu/jí může být podán nazogastrickou sondou.
Likvidace
Lahvičky jsou určeny pouze pro jednorázové použití. Nepoužitý přípravek musí být zlikvidován. Všechen nepoužitý přípravek nebo odpadní materiál musí být zlikvidovány v souladu s místními požadavky.