Ultra Technekow Fm
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls162785/2010
Souhrn údajů o přípravku
1. NÁZEV PŘÍPRAVKU
UltraTechneKow FM
Katalogové číslo Mallinckrodt Medical: DRN 4329 Nechráněný název: Generátor technecia-99m
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Technetium-99m získané z 99Mo/99mTc generátoru se přeměňuje za emise záření gama s energií 140 keV a poločasem 6 hodin na technecium-99, považované za stabilní (poločas 2,13 x 105 let). Sterilní generátor obsahuje mateřský radionuklid molybden-99, adsorbovaný na kolonu s oxidem hlinitým. Molybden-99 na koloně je v rovnováze s vytvořeným dceřinným izotopem technecia-99m. Generátory jsou dodávány v následujících aktivitách Molybdenu-99:
Aktivity k referenčnímu datu:
|
GBq |
GBq |
|
2,15 |
12,90 |
|
4,30 |
17,20 |
|
6,45 |
21,50 |
|
8,60 |
25,80 |
|
10,75 |
30,10 |
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Radionuklidový generátor.
4. KLINICKÉ ÚDAJE
4.1. Terapeutické indikace
Tento přípravek je určen pouze k diagnostickým účelům.
Eluát z generátoru (technecistan-(99mTc) sodný lékopisné kvality) je možné použít na značení rozličných nosičových sloučenin, dodávaných jako kity, a k přímé aplikaci pacientovi.
Po i.v. podání pacientovi je možné technecistan-(99mTc) sodný využít diagnosticky v následujících oblastech:
a) Scintigrafie štítné žlázy: zobrazení štítné žlázy, měření akumulace ve štítné žláze, získání informací o velikosti, poloze, uzlech a funkci štítné žlázy při thyroidálních chorobách.
b) Scintigrafie slinných žláz: hodnocení funkce slinných žláz a průchodnosti kanálků
c) Lokalizace ektopické žaludeční sliznice: Meckelův divertikl
d) Scintigrafie mozku: zjišťování poruchy hematoencefalické bariéry způsobené tumorem, infarktem, krvácením a edémem, nejsou-li jiné metody dostupné
Při značení červených krvinek izotopem technecia-99m, po předchozí aplikaci redukčního činidla:
e) Scintigrafie srdečních dutin a scintigrafie cév:
Angiokardioscintigrafie:
- hodnocení ejekční frakce komor
- hodnocení globálního a regionálního pohybu srdeční stěny
- zobrazení fází kontrakcí myokardu
Zobrazení orgánové perfúze a cévních abnormalit.
f) Diagnóza a lokalizace okultního krvácení do GIT:
Po instilaci sterilního roztoku technecistanu-(99mTc) sodného do oka:
g) Scintigrafie slzných kanálků: hodnocení průchodnosti slzných kanálků
4.2. Dávkování a způsob podání
Technecistan-(99mTc) sodný se běžně aplikuje intravenózně v širokém rozmezí aktivity, v závislosti na vyšetření a použitém zařízení.
Odlišné dávky mohou být odůvodněné. Aplikující lékař má respektovat národní diagnostické referenční úrovně, dle znění příslušné legislativy v platném znění.
V určitých indikacích bývá nutná příprava pacienta na vyšetření pomocí přípravků pro blokádu štítné žlázy nebo aplikací redukčních činidel.
Doporučené dávky jsou následující:
Pro dospělé a starší osoby:
Scintigrafie štítné žlázy: 18,5 - 80 MBq Zobrazení se provádí za 20 minut po i.v. aplikaci.
Scintigrafie slinných žláz: 40 MBq
Zobrazení se provádí ihned po i.v. aplikaci a dále v pravidelných intervalech až do 15. minuty.
Scintigrafie Meckelova divertiklu: 400 MBq
Zobrazení se provádí ihned po i.v. aplikaci a dále v pravidelných intervalech až do 30. minuty.
Scintigrafie mozku: 370 - 800 MBq
Rychlá sekvenční zobrazení se snímají během první minuty po aplikaci, statické zobrazení se provádí po 1 až 4 hodinách. Štítná žláza a choroidální plexus má být blokován v zájmu zamezení nespecifického vychytávání 99mTc.
Scintigrafie srdečních dutin a cév: 740 - 925 MBq
Červené krvinky jsou označeny metodikou in vivo nebo in vitro po předchozí aplikaci redukčního činidla. Dynamická zobrazení se provádějí během první minuty po i.v. aplikaci, následují zobrazení v průběhu 30 minut.
Krvácení do GIT: 740 - 925 MBq
Červené krvinky jsou označeny metodikou in vivo nebo in vitro po předchozí aplikaci redukčního činidla. Dynamická zobrazení se provádějí během první minuty po i.v. aplikaci, statická zobrazení ve vhodných intervalech až do 24 hodin.
Scintigrafie slzných kanálků: 2 - 4 MBq do každého oka.
Kapky jsou instilovány do oka a během 2 minut se provádí dynamické zobrazení, statická zobrazení následují ve vhodných intervalech během 20 minut.
Dávkování u dětí:
Aktivita pro aplikaci dětem se určuje dle tělesné hmotnosti dítěte nebo dle povrchu těla.
Doporučuje se využít přepočet podle Pediatric Task Group EANM, určený jako podíl dávky pro dospělé dle tělesné hmotnosti podle následující tabulky:
Podíl dávky pro dospělé:
3 kg = 0,1 10 kg = 0,27 18 kg = 0,44 26 kg = 0,56 34 kg = 0,68 42 kg = 0,78 50 kg = 0,88 64-66kg= 0,98
4 kg = 0,14 12 kg = 0,32 20 kg = 0,46 28 kg = 0,58 36 kg = 0,71 44 kg = 0,80 52-54kg= 0,90 68 kg = 0,99
6 kg = 0,19 14 kg = 0,36 22 kg = 0,50 30 kg = 0,62 38 kg = 0,73 46 kg = 0,82 56-58kg= 0,92
8 kg = 0,23 16 kg = 0,40 24 kg = 0,53 32 kg = 0,65 40 kg = 0,76 48 kg = 0,85 60-62kg= 0,96
U dětí do jednoho roku je minimální dávka pro přímou aplikaci technecistanu 20 MBq
(pro scintigrafii štítné žlázy 10 MBq) a pro aplikaci značených erytrocytů 80 MBq, což zabezpečí potřebnou
kvalitu zobrazení.
4.3. Kontraindikace
Hypersenzitivita na léčivou látku nebo kteroukoli pomocnou látku tohoto přípravku.
4.4. Zvláštní upozornění a opatření pro použití
Manipulace s radiofarmaky je možná pouze kvalifikovaným personálem s příslušným povolením pro využívání radioizotopů.
Manipulace s radiofarmaky a jejich aplikace je možná pouze osobami patřičně kvalifikovanými na pracovištích k tomu určených. Při skladování, přípravě a aplikaci radiofarmak a likvidaci odpadu je nutno dbát jak zásad ochrany zdraví před ionizujícím zářením vyplývajících z příslušných předpisů a vyhlášek, tak pokynů místních orgánů hygienické služby.
Příprava radiofarmak musí být v souladu jak s příslušnými předpisy pro ochranu zdraví před ionizujícím zářením, tak s požadavky na kvalitu IVLP. Je nutné dodržovat zásady aseptické práce a správné výrobní praxe pro radiofarmaka.
Akumulace technecistanu-(99mTc) sodného v plexus choroideus během scintigrafie mozku může být chybně interpretována jako poškození hematoencefalické bariéry (falešně pozitivní nález). Pro zamezení takových falešně pozitivních nálezů, a snížení akumulace technecistanu-(99mTc) sodného a tím i ozáření štítné žlázy a slinných žláz, se doporučuje podání chloristanu sodného před provedením scintigrafie mozku (viz též bod 5.2). Blokace štítné žlázy a slinných žláz pomocí chloristanu sodného má být provedena také v případě scintigrafie slzných kanálků.
4.5. Interakce s jinými léčivými přípravky a jiné formy interakce
Interakce byly hlášeny v případě scintigrafie mozku, kde může být zvýšeno vychytávání technecistanu(99mTc) sodného ve stěnách mozkových komor vlivem ventrikulitidy indukované metotrexátem. Při scintigrafii v abdominální oblasti mohou určité léčivé látky jako např. atropin, isoprenalin a analgetika způsobit zpomalení vyprazdňování žaludku a redistribuci technecistanu.
4.6. Fertilita, těhotenství a kojení
Technecium-99m (jako technecistan-(99mTc) sodný) prochází placentární bariérou.
Pokud je nezbytné aplikovat radioaktivní látku ženám v reprodukčním věku, je nutno vždy pátrat po možném těhotenství. Každá žena, které vynechala menstruace, je v tomto kontextu považována za těhotnou pokud se neprokáže opak. Kde trvá nejistota, radiační zátěž pacientky musí být minimalizována při zachování klinického přínosu vyšetření. Je nutno uvážit alternativní metodiky bez ionizujícího záření.
Aplikace radiofarmaka těhotným ženám způsobí i radiační zátěž plodu. Proto se nezbytná vyšetření provádějí v případě, že předpokládaný přínos vyšetření převáží možná rizika pro matku a plod.
Přímá aplikace 800 MBq technecistanu-(99mTc) sodného představuje radiační zátěž na dělohu ve výši 6,5 mGy. Při premedikaci pacientky blokující látkou představuje aplikace 800 MBq dávku pro dělohu 4,8 mGy.
Aplikace 925 MBq erytrocytů značených techneciem-99m představuje dávku pro dělohu 3,6 mGy. Jako potenciálně rizikové pro plod jsou již považovány dávky okolo 0,5 mGy.
Kojení
Před aplikací kojícím ženám je nutné uvážit, zda je možné vyšetření odložit na dobu, kdy bude kojení ukončeno a zda je vzhledem k možnosti sekrece do mateřského mléka dané radiofarmakum vhodné. Je-li aplikace nezbytná, je nutné přerušit kojení nejméně na 12 hodin a mléko, které se v prsu vytvoří, je nutno odsát a znehodnotit. Kojení je možné obnovit za předpokladu, že úroveň v mléku nezpůsobí radiační zátěž dítěte větší než 1 mSv.
4.7. Účinky na schopnost řídit a obsluhovat stroje
Ultra TechneKow FM nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8. Nežádoucí účinky
Údaje o nežádoucích účincích jsou dostupné z jednotlivých hlášení. Hlášené nežádoucí účinky zahrnovaly anafylaktoidní reakce, reakce vegetativního nervového systému a také různé podoby reakce v místě aplikace. Technecistan-(99mTc) sodný získaný z přípravku UltraTechneKow FM je používán pro značení rozličných sloučenin. Tyto léčivé látky mají obecně vyšší potenciál pro výskyt nežádoucích účinků než technecium-99m, proto mají hlášené nežádoucí účinky spíše souvislost s těmito značenými sloučeninami než s techneciem-99m. Charakter případných nežádoucích účinků po i.v. aplikaci radiofarmak značených techneciem-99m je závislý na konkrétní látce, která byla použita pro značení. Informace tedy mají být dostupné u výrobce dané léčivé látky určené ke značení.
Anafylaktoidní reakce:
Anafylaktoidní reakce byly hlášeny po i.v. aplikaci technecistanu-(99mTc) sodného a zahrnují různé kožní a dýchací symptomy, jako je kožní podráždění, otoky či dýchací obtíže.
Reakce vegetativního nervového systému:
Ojediněle byly hlášeny těžké vegetativní reakce, většinou zahrnující gastrointestinální reakce, jako je nauzea a zvracení. Jiná hlášení zahrnují vasovagové reakce, jako je bolest hlavy a závratě. Vegetativní reakce bývají spíše připisovány vyšetření jako takovému, než techneciu-99m, zejména u anxiozních pacientů.
Celkové poruchy a reakce v místě aplikace:
Hlášení zahrnují také popisy reakcí v místě aplikace. Tyto reakce souvisejí s extravazální aplikací radiofarmaka a dle obdržených hlášení se projevují od lokálního otoku až po celulitidu. V závislosti na aplikované aktivitě a značené sloučenině může vyžadovat rozsáhlejší extravazální depozice radiofarmaka chirurgické řešení.
Následující tabulka shrnuje pozorované nežádoucí účinky a symptomy. Údaje pocházejí pouze z jednotlivých hlášení, nelze tedy určit jejich frekvenci.
Poruchy imunitního systému
Frekvence není známa*): anafylaktoidní reakce (např. poruchy dýchání, bezvědomí, kopřivka, zarudnutí kůže, vyrážka, svědění, otok v různé lokalizaci např. otok obličeje)_
Poruchy nervového systému
Frekvence není známa*): vasovagové reakce (např. synkopa, tachykardie, bradykardie, závratě, bolest hlavy,
poruchy zraku, návaly horka)_
Gastrointestinální poruchy
Frekvence není známa*): zvracení, nauzea, průjem_
Celkové poruchy a reakce v místě aplikace
Frekvence není známa*): reakce v místě aplikace (např. celulitida, bolestivost, zarudnutí kůže, otoky)_
*) údaje pocházejí z jednotlivých hlášení
Vystavení pacienta ionizujícímu záření musí být vždy odůvodněné v souvislosti s přínosem vyšetření. Aplikovaná aktivita musí být co nejmenší aniž je ovlivněn správný výsledek vyšetření.
Vystavení účinkům ionizujícího záření je vždy spojeno s rizikem vzniku nádorových procesů a s možným vznikem dědičných poškození. Pro vyšetřovací metody nukleární medicíny je frekvence těchto nežádoucích účinků nízká vzhledem k nízké radiační zátěži pacientů.
Pro většinu vyšetření metodami nukleární medicíny je efektivní dávkový ekvivalent nižší než 20 mSv. Nicméně v daných klinických souvislostech mohou být i vyšší dávky odůvodněné.
Přípravek neobsahuje pomocné látky s vlastnostmi nebo účinky, které jsou podstatné pro bezpečné a účinné použití přípravku.
4.9. Předávkování
V případě předávkování aktivitou technecia-99m je možné snížit absorbovanou dávku zvýšením eliminace radionuklidu z organismu podporou diurézy s častým močením a podporou vylučování stolice.
Významně omezené možnosti jsou pro léčbu předávkování značenými erytrocyty, protože je jejich eliminace závislá na fyziologickém procesu hemolýzy.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1. Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Různá diagnostická radiofarmaka pro vyšetření štítné žlázy Kód ATC: V09F X01
V rámci aplikovaných dávek pro diagnostické účely nebyl pozorován žádný farmakologický účinek.
5.2. Farmakokinetické vlastnosti
Ion technecistanu má podobnou biodistribuci jako jodidový nebo chloristanový ion a přechodně se vychytává v slinných žlázách, v plexus choroidalis, žaludku (žaludeční mukóze) a ve štítné žláze a z těchto oblastí se vylučuje ve stejné formě. Ion technecistanu se navíc akumuluje v oblastech se zvýšeným prokrvením nebo s abnormální cévní permeabilitou, zejména pokud byla provedena premedikace blokováním žláz. Technecistan-99m je selektivně vylučován z cerebrospinální tekutiny.
Po intravenózní aplikaci je technecistan-(99mTc) sodný rozptýlen v cévním systému, odkud je vylučován třemi hlavními mechanismy:
- rychlé odstranění závislé na difúzní rovnováze s intersticiální tekutinou
- pomalejší způsob odstraňování závislý na koncentraci technecistanu ve tkáních žláz, zejména ve štítné žláze, slinných žlázách a žlázách žaludečního fundu, kde pracuje iontovýměnná pumpa
- pomalé odstraňování glomerulární filtrací ledvinami, závislé na množství vyloučené moči
Plazmatická clearence má poločas asi 3 hodiny.
Exkrece prvních 24 hodin po aplikaci spočívá zejména ve vylučování ledvinami (asi
25 %), vylučování stolicí následuje během dalších 48 hodin. Během prvních 50 hodin je vyloučeno asi 50 %
aplikované aktivity.
V případě premedikace látkami blokujícími vychytávání technecistanu-(99mTc) ve žlázách je způsob vylučování totožný, pouze je zvýšena hodnota renální clearance.
Je-li technecistan-(99mTc) aplikován krátce po předchozí aplikaci redukčních látek jako např. cínatý ion/medronát, což způsobí obsazení erytrocytů cínem, je asi 95 % aktivity vychytáno a navázáno na erytrocyty. Veškerý nenavázaný technecistan-(99mTc) je vyloučen ledvinami, aktivita v plazmě představuje méně než 5 % intravaskulární aktivity.
Technecium navázané na erytrocyty je uvolňováno velice pomalu, a množství uvolněného technecia z cirkulujících erytrocytů je považováno za velice nízké.
5.3. Předklinické údaje vztahující se k bezpečnosti
a) Nejsou k dispozici informace o akutní, subakutní a chronické toxicitě po jednorázové ani opakované
aplikaci. Množství technecistanu-(99mTc) sodného aplikovaného pro diagnostické účely je tak nízké, že s výjímkou alergických reakcí nebyly popsány jiné nežádoucí účinky.
b) Toxicita na reprodukční systém:
Průnik přes placentární bariéru intravenózně aplikovaného technecistanu-(99mTc) sodného byl sledován u myší. V děloze u březích samic, kde nebyla provedena premedikace chloristanem, bylo nalezeno až 60% aplikované aktivity. Studie prováděné na myších během březosti, březosti a kojení a během kojení samotného prokázaly u novorozených jedinců změny, které zahrnovaly pokles hmotnosti, bezsrstnost a sterilitu.
6. FARMACEUTICKÉ ÚDAJE
6.1. Seznam pomocných látek
Chlorid sodný, voda pro injekce.
6.2. Inkompatibility
Dosud nejsou známy.
6.3. Doba použitelnosti
Datum použitelnosti je 9 dní od data kalibrace.
Eluát je použitelný 8 hodin.
6.4. Zvláštní opatření pro uchovávání
Uchovávat do teploty 25°C, nechladit.
Generátory je nutné uchovávat v ochranném stínění UltraTechneKow Safe (s odpovídajícím množstvím vrstvy olova pro odstínění) nebo v jiném vhodném laboratorním stínění.
Uchovávání musí být v souladu s příslušnými předpisy pro skladování radioaktivních látek.
6.5. Druh obalu a velikost balení a zvláštní vybavení pro použití, podání nebo implantaci Generátor
Generátor je tvořen pouzdrem obsahujícím kolonu s oxidem hlinitým s navázaným Molybdenem-99 a upevněnou mezi dvěma filtry.
Jedna strana pouzdra je spojena se stíněnou sterilní vstupní jehlou pro eluční činidlo. Opačná strana je spojena s podobně stíněnou sterilní výstupní jehlou pro získávání eluátu.
Druhá jehla na straně elučního činidla slouží za sterilních podmínek jako kompenzace podtlaku vznikajícího při eluci v eluční lahvičce.
Kolona generátoru je stíněna vhodným množstvím olova v závislosti na aktivitě Molybdenu-99. Stíněný generátor včetně místa pro připojení elučního činidla a včetně elučního mechanismu jsou součástí balení v hermeticky uzavřeném plechovém obalu.
Po připojení elučního roztoku a evakuované lahvičky na jehly v určených místech dojde k eluci generátoru. Evakuovanou lahvičku je možno naplnit pouze částečně nebo v jejím plném objemu.
Velikosti balení: 2,15; 4,30; 6,45; 8,60; 10,75; 12,90; 17,20; 21,50; 25,80; 30.10 GBq Na trhu nemusí být všechny velikosti balení.
Příslušenství
Při prvním dodání generátoru UltraTechneKow FM je součástí dodávky:
- 1 ks stínění TechneVial nebo UltraVial
- 1 ks stínění sterilní lahvičky (nebylo-li již dodáno spolu se stíněním UltraTechneKow Safe).
Každé balení generátoru UltraTechneKow FM obsahuje:
- 7 sterilních evakuovaných lahviček TechneVial pro eluci 5, 11 nebo 25 ml
- 1 sterilní lahvičku určenou k ochraně eluční jehly
- 1 lahvičku Eluent vial se 100 ml sterilního 0,9 % roztoku chloridu sodného
- 7 dezinfekčních tamponů
- 7 štítků se symbolem radioaktivity
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Mallinckrodt Medical B.V.
Westerduinweg 3 1755 LE PETTEN Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
88/419/92-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
8.7.1992 / 9.7.1997/ 30.4.2002 / 9.5.2007
10. DATUM POSLEDNÍ REVIZE TEXTU
3.10.2010
11. DOZIMETRIE
V následující tabulce jsou uvedeny absorbované dávky po aplikaci technecistanu-(99mTc) sodného dle ICRP 80:
1) Bez provedení premedikace blokující látkou:
|
Orgán |
Absorbovaná dávka na jednotku aplikované aktivity (mGy/MBq) | ||||
|
dospělý |
15 let |
10 let |
5 let |
1 rok | |
|
Nadledviny |
0.0037 |
0.0047 |
0.0072 |
0.011 |
0.019 |
|
Stěna moč.měchýře |
0.018 |
0.023 |
0.030 |
0.033 |
0.060 |
|
Povrch kostí |
0.0054 |
0.0066 |
0.0097 |
0.014 |
0.026 |
|
Mozek |
0.0020 |
0.0025 |
0.0041 |
0.0066 |
0.012 |
|
Prsní žlázy |
0.0018 |
0.0023 |
0.0034 |
0.0056 |
0.011 |
|
Žlučník |
0.0074 |
0.0099 |
0.016 |
0.023 |
0.035 |
|
GIT: | |||||
|
- stěna žaludku |
0.026 |
0.034 |
0.048 |
0.078 |
0.16 |
|
- tenké střevo |
0.016 |
0.020 |
0.031 |
0.047 |
0.082 |
|
- tlusté střevo: |
0.042 |
0.054 |
0.088 |
0.14 |
0.27 |
|
- stěna vzestupného tračníku |
0.057 |
0.073 |
0.12 |
0.20 |
0.38 |
|
- stěna sestupného tračníku |
0.021 |
0.028 |
0.045 |
0.072 |
0.13 |
|
Srdce |
0.0031 |
0.0040 |
0.0061 |
0.0092 |
0.017 |
|
Ledviny |
0.0050 |
0.0060 |
0.0087 |
0.013 |
0.021 |
|
Játra |
0.0038 |
0.0048 |
0.0081 |
0.013 |
0.022 |
|
Plíce |
0.0026 |
0.0034 |
0.0051 |
0.0079 |
0.014 |
|
Svaly |
0.0032 |
0.0040 |
0.0060 |
0.0090 |
0.016 |
|
Jícen |
0.0024 |
0.0032 |
0.0047 |
0.0075 |
0.014 |
|
Vaječníky |
0.010 |
0.013 |
0.018 |
0.026 |
0.045 |
|
Slinivka břišní |
0.0056 |
0.0073 |
0.011 |
0.016 |
0.027 |
|
Červená kostní dřeň |
0.0036 |
0.0045 |
0.0066 |
0.0090 |
0.015 |
|
Slinné žlázy |
0.0093 |
0.012 |
0.017 |
0.024 |
0.039 |
|
Kůže |
0.0018 |
0.0022 |
0.0035 |
0.0056 |
0.010 |
|
Slezina |
0.0043 |
0.0054 |
0.0081 |
0.012 |
0.021 |
|
Varlata |
0.0028 |
0.0037 |
0.0058 |
0.0087 |
0.016 |
|
Thymus |
0.0024 |
0.0032 |
0.0047 |
0.0075 |
0.014 |
|
Štítná žláza |
0.022 |
0.036 |
0.055 |
0.12 |
0.22 |
|
Děloha |
0.0081 |
0.010 |
0.015 |
0.022 |
0.037 |
|
Ostatní tkáně |
0.0035 |
0.0043 |
0.0064 |
0.0096 |
0.017 |
|
Efektivní dávka (mSv/MBq) |
0.013 |
0.017 |
0.026 |
0.042 |
0.079 |
2) Při provedení premedikace blokující látkou:
|
Orgán |
Absorbovaná dávka na jednotku aplikované aktivity (mGy/MBq) | ||||
|
dospělý |
15 let |
10 let |
5 let |
1 rok | |
|
Nadledviny |
0.0029 |
0.0037 |
0.0056 |
0.0086 |
0.016 |
|
Stěna moč.měchýře |
0.030 |
0.038 |
0.048 |
0.050 |
0.091 |
|
Povrch kostí |
0.0044 |
0.0054 |
0.0081 |
0.012 |
0.022 |
|
Mozek |
0.0020 |
0.0026 |
0.0042 |
0.0071 |
0.012 |
|
Prsní žlázy |
0.0017 |
0.0022 |
0.0032 |
0.0052 |
0.010 |
|
Žlučník |
0.0030 |
0.0042 |
0.0070 |
0.010 |
0.013 |
|
GIT: | |||||
|
- stěna žaludku |
0.0027 |
0.0036 |
0.0059 |
0.0086 |
0.015 |
|
- tenké střevo |
0.0035 |
0.0044 |
0.0067 |
0.010 |
0.018 |
|
Orgán |
Absorbovaná dávka na jednotku aplikované aktivity (mGy/MBq) | ||||
|
- tlusté střevo: |
0.0036 |
0.0048 |
0.0071 |
0.010 |
0.018 |
|
- stěna vzestupného tračníku |
0.0032 |
0.0043 |
0.0064 |
0.010 |
0.017 |
|
- stěna sestupného tračníku |
0.0042 |
0.0054 |
0.0081 |
0.011 |
0.019 |
|
Srdce |
0.0027 |
0.0034 |
0.0052 |
0.0081 |
0.014 |
|
Ledviny |
0.0044 |
0.0054 |
0.0077 |
0.011 |
0.019 |
|
Játra |
0.0026 |
0.0034 |
0.0053 |
0.0082 |
0.015 |
|
Plíce |
00023 |
0.0031 |
0.0046 |
0.0074 |
0.013 |
|
Svaly |
0.0025 |
0.0031 |
0.0047 |
0.0072 |
0.013 |
|
Jícen |
0.0024 |
0.0031 |
0.0046 |
0.0075 |
0.014 |
|
Vaječníky |
0.0043 |
0.0054 |
0.0078 |
0.011 |
0.019 |
|
Slinivka břišní |
0.0030 |
0.0039 |
0.0059 |
0.0093 |
0.016 |
|
Červená kostní dřeň |
0.0025 |
0.0032 |
0.0049 |
0.0072 |
0.013 |
|
Kůže |
0.0016 |
0.0020 |
0.0032 |
0.0052 |
0.0097 |
|
Slezina |
0.0026 |
0.0034 |
0.0054 |
0.0083 |
0.015 |
|
Varlata |
0.0030 |
0.0040 |
0.0060 |
0.0087 |
0.016 |
|
Thymus |
0.0024 |
0.0031 |
0.0046 |
0.0075 |
0.014 |
|
Štítná žláza |
0.0024 |
0.0031 |
0.0050 |
0.0084 |
0.015 |
|
Děloha |
0.0060 |
0.0073 |
0.011 |
0.014 |
0.023 |
|
Ostatní tkáně |
0.0025 |
0.0031 |
0.0048 |
0.0073 |
0.013 |
|
Efektivní dávka (mSv/MBq) |
0.0042 |
0.0054 |
0.0077 |
0.011 |
0.019 |
Po aplikaci 800 MBq technecistanu-(99mTc) sodného je efektivní dávka 10,4 mSv. Při provedení premedikace blokující látkou je po aplikaci 800 MBq efektivní dávka 3,36 mSv.
Absorbovaná dávka pro oční čočku po aplikaci technecistanu-(99mTc) sodného pro scintigrafii slzných kanálků je 0,038 mGy/MBq.
3) Absorbovaná dávka po i.v. aplikaci červených krvinek značených techneciem-99m:
|
Orgán |
Absorbovaná dávka na jednotku aplikované aktivity (mGy/MBq) | ||||
|
dospělý |
15 let |
10 let |
5 let |
1 rok | |
|
Nadledviny |
0.0099 |
0.012 |
0.020 |
0.030 |
0.056 |
|
Stěna moč.měchýře |
0.0085 |
0.011 |
0.014 |
0.017 |
0.031 |
|
Povrch kostí |
0.0074 |
0.012 |
0.019 |
0.036 |
0.074 |
|
Mozek |
0.0036 |
0.0046 |
0.0075 |
0.012 |
0.022 |
|
Prsní žlázy |
0,0035 |
0,0041 |
0,0070 |
0,011 |
0,019 |
|
Žlučník |
0.0065 |
0.0081 |
0.013 |
0.020 |
0.030 |
|
GIT: | |||||
|
- stěna žaludku |
0.0046 |
0.0059 |
0.0097 |
0.014 |
0.025 |
|
- tenké střevo |
0.0039 |
0.0049 |
0.0078 |
0.012 |
0.021 |
|
- tlusté střevo: |
0.0037 |
0.0048 |
0.0075 |
0.012 |
0.020 |
|
- stěna vzestupného tračníku |
0.0040 |
0.0051 |
0.0080 |
0.013 |
0.022 |
|
Orgán |
Absorbovaná dávka na jednotku aplikované aktivity (mGy/MBq) | ||||
|
- stěna sestupného tračníku |
0.0034 |
0.0044 |
0.0069 |
0.010 |
0.018 |
|
Srdce |
0.023 |
0.029 |
0.043 |
0.066 |
0.11 |
|
Ledviny |
0.018 |
0.022 |
0.036 |
0.057 |
0.11 |
|
Játra |
0.013 |
0.017 |
0.026 |
0.040 |
0.072 |
|
Plíce |
0.018 |
0.022 |
0.035 |
0.056 |
0.11 |
|
Svaly |
0.0033 |
0.0040 |
0.0061 |
0.0094 |
0.017 |
|
Jícen |
0.0061 |
0.0070 |
0.0098 |
0.015 |
0.023 |
|
Vaječníky |
0.0037 |
0.0048 |
0.0070 |
0.011 |
0.019 |
|
Slinivka břišní |
0.0066 |
0.0081 |
0.013 |
0.019 |
0.033 |
|
Červená kostní dřeň |
0.0061 |
0.0076 |
0.012 |
0.020 |
0.037 |
|
Kůže |
0.0020 |
0.0024 |
0.0038 |
0.0062 |
0.012 |
|
Slezina |
0.014 |
0.017 |
0.027 |
0.043 |
0.081 |
|
Varlata |
0.0023 |
0.0030 |
0.0044 |
0.0069 |
0.013 |
|
Thymus |
0.0061 |
0.0070 |
0.0098 |
0.015 |
0.023 |
|
Štítná žláza |
0.0057 |
0.0071 |
0.012 |
0.019 |
0.036 |
|
Děloha |
0.0039 |
0.0049 |
0.0074 |
0.011 |
0.019 |
|
Ostatní tkáně |
0.0035 |
0.0045 |
0.0073 |
0.013 |
0.023 |
|
Efektivní dávka (mSv/MBq) |
0.0070 |
0.0089 |
0.014 |
0.021 |
0.039 |
Po aplikaci 925 MBq značených červených krvinek techneciem-99m je absorbovaná dávka 6,48 mSv.
12. NÁVOD PRO PŘÍPRAVU RADIOFARMAK
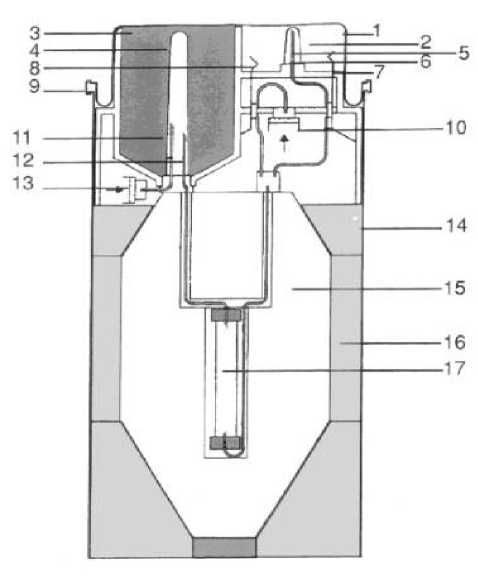
Schéma generátoru UltraTechneKow FM:
1. Víčko generátoru
2. Eluční pozice
3. Připojení elučního činidla
4. Plastová krytka jehly elučního činidla
5. Plastová krytka eluční jehly
6. Eluční jehla
7. Bezpečnostní ventil
8. Ventil pro parciální eluci
9. Pákový kroužek pro uzavření víčka
10. Filtr vzduchu pro parciální eluci
11. Jehla pro vstup sterilního vzduchu
12. Jehla pro vstup elučního činidla
13. Odvzdušňovací filtr pro eluční činidlo
14. Kontejner generátoru
15. Olověné stínění
16. Držák stínění
17. Kolona generátoru
Návod k použití
Eluci je možné provádět pouze v prostorách zaručujících sterilitu generátoru.
Přípravné kroky
1. Uvolněte objímku a sejměte víčko generátoru. Uschovejte oba díly.
2. Umístěte UltraTechnekow FM do olověného stínění UltraTechneKow Safe (nebo jiného vhodného stínění) s eluční (jednoduchou) jehlou vpředu.
Upozornění: Jehly generátoru chráněné krytkami jsou sterilní a horní část generátoru pod víčkem je dostatečné čistoty. Není tedy nutná další dezinfekce povrchu, naopak může nadměrné použití dezinfekčních látek s obsahem alkoholu negativně ovlivnit výtěžnost technecistanu-(99mTc) sodného při eluci!
3. Odstraňte kryt lahvičky s elučním činidlem, proveďte dezinfekci pryžové zátky tamponem
z příslušenství, odstraňte a uschovejte plastikový kryt dvojité jehly a mírným stlačením napojte lahvičku s elučním činidlem na jehly v místě k tomu určeném.
4. Odstraňte kryt sterilní lahvičky a vložte lahvičku do stíněného kontejneru.
5. Odstraňte (a uschovejte) plastikový kryt eluční (jednoduché) jehly a napojte sterilní lahvičku ve stínění na jehlu elučního mechanismu.
Provedení eluce
1. Odstraňte kryt evakuované lahvičky TechneVial, proveďte dezinfekci pryžové zátky, po odpaření dezinfekčního roztoku vložte lahvičku do stíněného kontejneru UltraVial Shield. (Lahvička TechneVial může obsahovat malý zbytek vody z procesu sterilizace.)
2. Kontejner se sterilní lahvičkou vyjměte a na eluční jehlu napojte kontejner UltraVial s evakuovanou lahvičkou tak, aby osvětlené okénko kontejneru směřovalo kupředu.
3. Od tohoto okamžiku je možné provést přerušení eluce podle požadovaného objemu resp. objemové koncentrace technecistanu.
Eluci vždy ukončete otočením elučního kontejnerku UltraVial Shield o 90° vpravo, stlačením dolů a několikasekundovým vyčkáním (lahvička se tak naplní sterilním vzduchem).
4. Kontejner UltraVial Shield vyměňte za ochrannou sterilní lahvičku umístěnou ve stíněném kontejneru. Eluci nikdy nepřerušujte pouhým vyjmutím kontejnerku UltraVial Shield bez otočení o 90° vpravo !
Nepoužívejte eluát, který není čirý a bezbarvý.
Likvidace a sběr využitých generátorů:
1. Odstraňte použitou sterilní lahvičku a lahvičku s elučním činidlem.
2. Zakryjte vstupní jehlu původní krytkou.
3. Proveďte eluci zbývajícího objemu tekutiny z kolony (viz provedení eluce). Generátor je po tomto kroku suchý.
4. Zakryjte výstupní jehlu původní krytkou.
5. Generátor uzavřete původním víčkem s objímkou.
6. Generátor uskladněte na vhodném místě, kde jeho aktivita poklesne na úroveň, která umožní jeho bezpečnou likvidaci.
Poznámka: Existuje možnost vrácení exspirovaných generátorů výrobci. Pro bližší informace kontaktujte distributora přípravku.
Aplikace radiofarmak představuje riziko pro personál jak z hlediska vystavení radiaci, tak kontaminace stopami moči, zvratků a pod. Je nutné dodržovat příslušné předpisy pro ochranu zdraví před ionizujícím zářením.
Likvidace odpadu musí být v souladu s příslušnými předpisy pro radioaktivní materiál.
12 / 12