Tropivent 20 Mikrogramů/Dávka
zastaralé informace, vyhledat novějšíSp.zn.sukls169174/2013
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Tropivent 20 mikrogramů/dávka roztok k inhalaci v tlakovém obalu
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna odměřená dávka (z ventilu) obsahuje ipratropii bromidum monohydricum 21 mikrogramů, což odpovídá ipratropii bromidum 20 mikrogramů. To odpovídá dodané dávce (z aktuátoru) ipratropii bromidum 17 mikrogramů.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA Roztok k inhalaci v tlakovém obalu.
Tlaková nádobka z nerezové oceli obsahující čirý a bezbarvý roztok, opatřena odměřovacím ventilem na 50 pl s průhledným plastovým aktuátorem (s náustkem) se zeleným polypropylenovým krytem proti prachu.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Tropivent je bronchodilatační přípravek indikovaný k léčbě reverzibilního bronchospasmu. U chronické obstrukční plicní nemoci (CHOPN) je indikován k podávání podle potřeby nebo k pravidelnému podávání k prevenci nebo oslabení symptomů. U astmatu jej lze používat jako alternativu ke krátkodobě působícím p2-agonistům, pokud pacient p2-agonisty netoleruje.
Tropivent je indikován u dětí ve věku 6 až 12 let, dospívajících a dospělých.
4.2 Dávkování a způsob podání
Dávkování
Dospělí (včetně starších pacientů):
Obvykle 1 nebo 2 dávky třikrát nebo čtyřikrát denně, i když někteří pacienti mohou k tomu, aby se během léčby dosáhlo maximálního přínosu, potřebovat až 4 dávky najednou.
Pediatrická populace
• 6 až 12 let:
Obvykle 1 nebo 2 dávky třikrát denně.
• Mladší 6 let:
0 používání ipratropium bromidu u dětí mladších 6 let není k dispozici dostatek údajů. Tropivent se smí používat pouze na základě doporučení lékaře a pod dohledem dospělého.
Obecně platí, že se nesmí překročit celková denní dávka 12 inhalací.
Pokud léčba nevede k významnému zlepšení, pokud se pacientův stav zhorší nebo pokud je zjevná snížená odpověď na léčbu, je nutno vyhledat radu lékaře. Při akutní nebo rychle se zhoršující dušnosti (obtížemi s dechem) je nutno lékaře konzultovat ihned.
Léčba těžkých akutních exacerbací astmatu
Ipratropium-bromid podávaný pomocí distanční vložky lze při léčbě akutních těžkých exacerbací astmatu v domácím prostředí přidat ke krátkodobě působícím bronchodilatanciím. Obě skupiny bronchodilatačních přípravků se musí podávat pomocí distanční vložky. Ohledně dalších indikací a dalších léčebných doporučení prosím nahlédněte do národních pokynů.
Způsob podání Inhalační podání.
K úspěšné léčbě je nezbytné správné podávání ipratropium-bromidu z inhalátoru.
Podrobný návod k použití je uveden v příbalové informaci.
Předtím, než se inhalátor použije poprvé nebo vždy, když nebyl používán po dobu 3 dnů nebo déle, je nutno stříknout zkušebně dvakrát do vzduchu, aby se zjistilo, zda řádně funguje a zda je připraven k použití.
Přípravek Tropivent obsahuje roztok, takže není třeba inhalátorem před použitím třepat.
K dosažení optimálních výsledků je nutné, aby byla nádobka před použitím měla pokojovou teplotu. Pokud je inhalátor velmi chladný, vyjměte kovovou nádobku z plastového krytu a před použitím ji nejméně 2 minuty zahřívejte v rukách. K jejímu zahřívání nikdy nepoužívejte nic jiného.
Před každým použitím inhalátoru je nutno dodržet následující pokyny:
1 Sejměte z náustku ochranný kryt (Obr. 1).
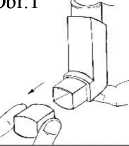
2 Inhalátor držte svisle, přičemž dolní část nádobky je nahoře (Obr. 1), palec dejte pod náustek a ukazováček/prostředníček na horní část inhalátoru. Pohodlně vydechněte, ale nedýchejte do náustku (Obr. 2).
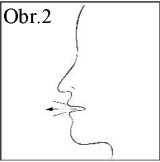
3 Náustek vložte do úst mezi zuby a sevřete kolem něj rty, ale nekousejte do něj.
4 Pomalu a hluboce se nadechněte, přičemž současně silně stlačte vršek inhalátoru; tím se uvolní jedna odměřená dávka (Obr. 3).
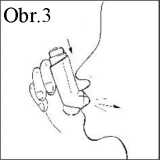
5 Na 10 sekund nebo tak dlouho, jak to pro Vás bude pohodlné, zadržte dech (Obr. 4), poté náustek
vyjměte z úst a pomalu vydechněte.
|
Obr.4 | |
|
n < | |
|
% |
i |
|
v i | |
6 Pokud je potřebná druhá inhalace, musíte vyčkat nejméně 1 minutu a pak opakujte kroky 2 až 5.
7 Po použití na náustek vždy dejte kryt.
Pacientům, kteří nemají dostatečnou sílu v ruce, se může inhalátor lépe držet oběma rukama. Oba ukazováčky vložte na vršek inhalátoru a oba palce na základnu pod náustkem.
Inhalátor se dá používat spolu s distanční vložkou Aerochamber Plus. To může být užitečné u pacientů, např. dětí nebo starších lidí, pro které je obtížné synchronizovat vdechování a aktivaci inhalátoru.
Nádobka není průhledná. Proto není možné zjistit, zda je prázdná. Inhalátor dodá 200 dávek. Po jejich využití (obvykle po 3 až 4 týdnech pravidelného používání) se může zdát, že inhalátor stále obsahuje malé množství tekutiny. Inhalátor je však nutno vyměnit, aby se zajistilo, že každá odměřená dávka bude obsahovat správné množství léčivého přípravku..
UPOZORNĚNÍ:
Plastový náustek byl speciálně navržen k používání s přípravkem Tropivent, aby se zajistilo, že každá odměřená dávka bude obsahovat správné množství léčivého přípravku. Náustek se nikdy nesmí používat u žádného jiného inhalátoru s odměřenou dávkou, ani se přípravek Tropivent nesmí používat s žádným jiným náustkem, než s náustkem dodávaným s tímto přípravkem.
Čištění
Náustek má být vždy čistý. K jeho čištění se musí sejmout nádobka i kryt proti prachu. Náustek se poté musí omýt teplou mýdlovou vodou, opláchnout a nechat uschnout na vzduchu bez zahřívání. Je nutno dbát na to, aby se důkladně propláchl malý otvor v náustku. Nádobku a kryt proti prachu se poté, co náustek uschne, musí vrátit zpátky.
Je důležité, aby se inhalátor pravidelně čistil. Čištění se musí provádět nejméně jednou týdně. Jinak nemusí správně fungovat.
4.3 Kontraindikace
Hypersenzitivita na ipratropium-bromid, atropin nebo jeho deriváty nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Po podání ipratropium-bromidu byly pozorovány hypersenzitivní reakce, které se projevují jako kopřivka, angioedém, vyrážka, bronchospasmus, orofaryngeální edém a anafylaktické reakce.
Opatrnost se doporučuje při používání anticholinergních látek u pacientů s dispozicí ke vzniku glaukomu s úzkým úhlem nebo u pacientů s glaukomem s úzkým úhlem, se stávajícími obstrukcemi močových cest (např. hyperplazie prostaty nebo obstrukce hrdla močového měchýře).
Protože pacienti s cystickou fibrózou mohou mít sklon k poruchám gastrointestinální motility, musí se ipratropium-bromid, jako jiná anticholinergika, u těchto pacientů používat opatrně.
Existují ojedinělé zprávy o očních komplikacích (např. mydriáza, zvýšený nitrooční tlak, glaukom s úzkým úhlem, bolestivost očí) v případech, kdy se do kontaktu s očima dostal aerosolový ipratropium-bromid, buď samotný, nebo v kombinaci s adrenergními beta2-agonisty. Pacienty je tedy nutno poučit o správném podávání přípravku Tropivent a varovat před náhodným uvolněním jeho obsahu do oka. Protože se inhalátor aplikuje náustkem a ovládá rukou, je riziko, že se aerosol dostane do oka, omezené. U citlivých jedinců je při prevenci akutního glaukomu s úzkým úhlem účinná antiglaukomová terapie, přičemž pacienty, kteří mohou mít sklon ke glaukomu, je nutno specificky upozornit na nutnost si oči chránit.
Bolesti očí nebo nepříjemné pocity v očích, rozmazané vidění, vizuální halo nebo barevné vidění spojené se zčervenáním očí, které je způsobeno překrvením spojivek, a otok rohovky, mohou být příznaky akutního glaukomu s úzkým úhlem. Pokud se objeví jakákoli kombinace uvedených symptomů, je nutno zahájit léčbu kapkami s miotickým účinkem a ihned vyhledat pomoc specialisty.
Pacienty je nutno při zahájení léčby informovat, že nástup účinku ipratropium-bromidu je pomalejší, než nástup účinku inhalačních sympatomimetických bronchodilatancií.
Stejně jako u jiné inhalační terapie, může se po podání dávky vyskytnout inhalací navozená bronchokonstrikce s okamžitým zesílením sípání. Tento stav je nutno ihned léčit pomocí rychle působícího inhalačního bronchodilatačního přípravku. Tropivent se má ihned vysadit, pacient se má vyšetřit a, pokud je to nezbytné, musí se nasadit alternativní léčba.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Existují důkazy, že podávání ipratropium-bromidu s beta-agonisty a xantinovými přípravky může zesilovat bronchodilatační účinek.
4.6 Fertilita, těhotenství a kojení
Nejsou k dispozici žádné údaje o používání ipratropium-bromidu u těhotných žen.
Studie na zvířatech neukazují na přímé ani nepřímé škodlivé účinky, pokud jde o reprodukční toxicitu (viz bod 5.3).
Ipratropium-bromid se smí v těhotenství používat pouze, pokud je to přísně indikováno.
Kojení
Není známo, zda se ipratropium-bromid vylučuje do mateřského mléka, není však pravděpodobné, že by se ipratropium-bromid dostal ke kojenci ve významné míře. Proto lze zvážit podávání ipratropium-bromidu během kojení.
Fertilita
Studie na zvířatech nenaznačují nepříznivý vliv ipratropium-bromidu na fertilitu. Klinické údaje nejsou k dispozici.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie o účincích na schopnost řídit a obsluhovat stroje. Nicméně pacienti musí být poučeni, že se u nich během léčby přípravkem Tropivent mohou vyskytnout nežádoucí účinky jako závrať, poruchy akomodace, mydriáza a rozmazané vidění. Pokud se u pacientů vyskytnou výše uvedené nežádoucí účinky, mají se vyvarovat potenciálně nebezpečných úkonů, jako je řízení vozidel nebo obsluha strojů.
4.8 Nežádoucí účinky
Mnohé z uvedených nežádoucích účinků lze přiřadit anticholinergním vlastnostem přípravku Tropivent. Tak jako při každé inhalační terapii, také u přípravku Tropivent se mohou objevit příznaky lokálního podráždění. Nežádoucí účinky byly zjištěny z údajů získaných v klinických studiích a během poregistračního sledování přípravku (farmakovigilance).
Mezi nejčastějšími nežádoucími účinky hlášenými v klinických studiích byly bolesti hlavy, podráždění v krku, kašel, sucho v ústech, poruchy gastrointestinální motility (včetně zácpy, průjmu a zvracení), nauzea a závratě.
|
Třídy orgánových systémů |
Nežádoucí účinek |
Četnost |
|
Poruchy imunitního systému |
Hypersenzitivita |
Méně časté |
|
Anafylaktická reakce |
Méně časté | |
|
Angioedém jazyka, rtů a obličeje |
Méně časté | |
|
Poruchy nervového systému |
Bolesti hlavy |
Časté |
|
Závratě |
Časté | |
|
Poruchy oka |
Rozmazané vidění |
Méně časté |
|
Mydriáza (1) |
Méně časté | |
|
Zvýšený nitrooční tlak (1) |
Méně časté | |
|
Glaukom (1) |
Méně časté | |
|
Bolest očí (1) |
Méně časté | |
|
Vizuální halo |
Méně časté | |
|
Hyperemie spojivky |
Méně časté | |
|
Otok rohovky |
Méně časté | |
|
Poruchy akomodace |
Vzácné | |
|
Srdeční poruchy |
Palpitace |
Méně časté |
|
Supraventrikulární tachykardie |
Méně časté | |
|
Fibrilace síní |
Vzácné | |
|
Zrychlená srdeční frekvence |
Vzácné | |
|
Respirační, hrudní a |
Podráždění v krku |
Časté |
|
mediastinální poruchy |
Časté | |
|
Bronchospasmus |
Méně časté | |
|
Paradoxní bronchospasmus (2) |
Méně časté | |
|
Laryngospasmus |
Méně časté | |
|
Faryngeální edém |
Méně časté | |
|
Sucho v krku |
Méně časté | |
|
Gastrointestinální poruchy |
Sucho v ústech |
Časté |
|
Ústní edém |
Méně časté | |
|
Poruchy vnímání chutí |
Méně časté | |
|
Časté | ||
|
Poruchy gastrointestinální motility |
Časté | |
|
Méně časté | ||
|
Zácpa |
Méně časté | |
|
Méně časté |
|
Stomatitida |
Méně časté | |
|
Poruchy kůže a podkožní tkáně |
Méně časté | |
|
Méně časté | ||
|
Kopřivka |
Vzácné | |
|
Poruchy ledvin a močových cest |
Retence moči (3) |
Méně časté |
(1) Pokud se do kontaktu s očima dostal aerosolizovaný ipratropium-bromid, buď samotný, nebo v kombinaci s adrenergním beta2-agonistou, byly hlášeny oční komplikace - viz bod 4.4.
(2) Tak, jako u jiné inhalační terapie, může se po podání dávky vyskytnout inhalací navozená bronchokonstrikce s okamžitým zesílením sípání. Tu je nutno ihned léčit pomocí rychle působícího inhalačního bronchodilatačního přípravku. Tropivent se musí ihned vysadit, pacient vyšetřit a, pokud je to nezbytné, musí se nasadit alternativní léčba.
(3) Riziko retence moči může být zvýšeno u pacientů se stávající obstrukcí hrdla močového měchýře. Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10 Webové stránky: www .sukl .cz/nahlasit-nezadouci-ucinek.
4.9 Předávkování
Specifické příznaky předávkování nebyly zaznamenány. Vzhledem ke značné terapeutické šíři a topickému podávání ipratropium-bromidu nelze očekávat závažné anticholinergní příznaky. Stejně jako u jiných anticholinergik se dají očekávat příznaky a známky předávkování jako sucho v ústech, poruchy akomodace a tachykardie.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Jiná inhalační léčiva onemocnění spojených s obstrukcí dýchacích cest,
anticholinergika
ATC kód: R03BB01
Ve studiích trvajících až tři měsíce u dospělých pacientů s astmatem nebo s CHOPN a u dětí s astmatem byla prokázána rovnocenná terapeutická účinnost bezfreonové a freonové formy přípravku.
Ipratropium-bromid je kvarterní amoniová sloučenina s anticholinergními (parasympatolytickými) vlastnostmi. Z preklinických studií se zdá, že inhibuje vagově zprostředkované reflexy antagonizací účinků acetylcholinu, což je transmiter uvolňovaný z vagového nervu. Anticholinergika zabraňují zvýšení intracelulárních koncentrací Ca 2+, což je způsobeno interakcí acetylcholinu s muskarinovým receptorem v hladké svalovině bronchů. Uvolnění Ca je zprostředkováno sekundárním přenašečem, který se skládá sestávajícím z IP3 (inositoltrifosfát) a DAG (diacylglycerol).
Bronchodilatace po podání ipratropium-bromidu je indukována lokálním (nikoli systémovým) působením takových koncentrací léčivé látky, které dostačují k anticholinergnímu účinku na hladkou svalovinu bronchů.
V klinických studiích využívajících inhalátory s odměřenou dávkou u pacientů s reverzibilním bronchospasmem souvisejícím s astmatem nebo s chronickou obstrukční plicní nemocí se významná zlepšení plicních funkcí (FEV1 se zvýšila o 15 % nebo více) dostavila do 15 minut, maxima se dosáhlo za 1 až 2 hodiny a přetrvávala přibližně 4 hodiny.
Předklinické a klinické důkazy nenaznačují žádné škodlivé účinky ipratropium bromidu na sekreci sliznic dýchacích cest, mukociliární aktivitu nebo výměnu plynů.
5.2 Farmakokinetické vlastnosti
Absorpce
Terapeutické účinky přípravku Tropivent jsou dány lokálním působením v dýchacích cestách. Časové průběhy bronchodilace a systémová farmakokinetika neprobíhají paralelně.
Po inhalaci se 10 až 30 % dávky obvykle ukládá v plicích, v závislosti na formě, zařízení a inhalační technice. Velká část dávky se spolkne a prochází gastrointestinálním traktem.
Část dávky, která se ukládá v plicích se rychle (během minut) dostává do oběhu.
Na základě kumulativní renální exkrece se celková systémová biologická dostupnost perorální a inhalační dávky ipratropium-bromid odhaduje na 2 %, respektive 7 až 28 %.
S ohledem na tuto skutečnost polknutý díl dávky ipratropium-bromidu k systémové expozici významným způsobem nepřispívá.
U zdravých dobrovolníků byla provedena dvoustupňová zkřížená farmakokinetická studie s cílem porovnat systémovou expozici ipratropiu po inhalaci přípravků Tropivent a Atrovent, s distanční vložkou AeroChamber Plus a bez ní. 90% interval spolehlivosti u Cmax a AUC0-t byl ve standardním rozmezí 80 až 125 %, což prokazuje ekvivalenci přípravku Tropivent s přípravkem Atrovent s distanční vložkou AeroChamber Plus a bez ní. Použití distanční vložky AeroChamber Plus zvyšovalo
9
u zdravých dobrovolníků v porovnání s podáváním pomocí pMDI samotného střední hodnotu systémové (což se rovná plicní absorpci) biologické dostupnosti ipratropia o 50 %.
Distribuce
Léčivo se na plasmatické proteiny váže minimálně (méně než 20 %). Kvarterní amin ipratropiového iontu neprostupuje hematoencefalickou bariérou. Distribuční objem je 338 litrů.
Biotransformace
Po intravenózním podání se přibližně 60 % dávky metabolizuje, zejména konjugací (40 %), zatímco po inhalaci se přibližně 77 % systémově dostupné dávky metabolizuje hydrolýzou esterové vazby (41 %) a konjugací (36 %).
Eliminace
Farmakokinetické parametry léčivé látky se vypočítávají z plazmatických hladin po intravenózním podání. Plazmatické hladiny ipratropium-bromidu vykázaly rychlý pokles a dvoufázový průběh. Poločas terminální eliminační fáze byl přibližně 1,6 hodiny. Hlavní metabolity v moči se na muskarinové receptory váží špatně a je nutno je považovat za neúčinné. Celková clearance léčivé látky je 2,3 l/min. Okolo 40 % clearance je renální (0,9 l/min) a 60 % jaterní (1,4 l/min). Kumulativní renální exkrece (0 až 24 hodin) mateřské sloučeniny je přibližně 46 % intravenózně podané dávky, méně než 1 % perorální dávky a přibližně 3 až 13 % inhalované dávky.
5.3 Předklinické údaje vtahující se k bezpečnosti
Neklinické údaje založené na konvenčních studiích bezpečnostní farmakologie, toxicity po opakovaných dávkách, genotoxicity, karcinogenního potenciálu a toxicity na reprodukci neodhalují žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
norfluran bezvodý ethanol čištěná voda
bezvodá kyselina citrónová
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Chraňte před přímým slunečním světlem.
Chraňte před mrazem.
Uchovávejte při teplotě do 30 °C.
Nádobka obsahuje tekutinu pod tlakem. Nevystavujte teplotám vyšším než 50 °C. Nádobku nepropichujte ani nevhazujte do ohně, ani když je prázdná.
6.5 Druh obalu a obsah balení
19ml tlaková nádobka z nerezové oceli opatřena odměřovacím ventilem na 50 pl a průhledným plastovým aktuátorem zahrnujícím náustek se zeleným krytem proti prachu.
Odměrná tryska obsahuje hliník, nerezovou ocel, polyester a polymer EPDM (ethylen-propylen-dien monomer) polymer.
Jedna tlaková nádobka obsahuje 200 dávek.
Tento léčivý přípravek je k dispozici v krabičkách obsahujících 1, 2, 3, 4, 5, 6 a 10 nádobek.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky na likvidaci.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Sandoz s.r.o., U Nákladového nádraží 10, 130 00 Praha 3, Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
14/148/15-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 18.3.2015
10. DATUM REVIZE TEXTU
18.3.2015
11