Staloral 300
sp.zn. sukls51779/2016
Souhrn údajů o přípravku
1. NÁZEV PŘÍPRAVKU
Staloral 300
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna lahvička obsahuje 10 nebo 300 IR/ml (standardizovaný extrakt alergenů) jednoho extraktu
alergenu nebo směsi různých extraktů alergenů (seznam extraktů alergenů je uvedený níže).
Léčivé látky j sou ve formě alergenového extraktu s mannitolem sušeného mrazem nebo glycerinového
roztoku alergenového extraktu s mannitolem.
IR (Index reaktivity): Alergenový extrakt má hodnotu 100 IR/ml, jestliže při kožním testu provedeném pomocí Stallerpointu u 30 pokusných osob senzibilizovaných vůči danému alergenu vyvolá vznik pupenu o průměru 7 mm (geometrický průměr). Kožní reaktivita u těchto subjektů se nezávisle ověřuje mírou jejich pozitivní odpovědi na prick test provedený 9% kodeinfosfátem nebo dihydrochloridem histaminu 10 mg/ml.
Jednotlivé alergeny nebo směsi alergenů jsou uvedeny v tabulce:
|
PYLY (POLLEN) | ||
|
PLEVELY (Allergena mucorum pollen) |
TRÁVY (Allergena graminis pollen) |
DŘEVINY (Allergena arboris pollen) |
|
- Ambrosie peřenolistá (Ambrosia elatior) |
- Bojínek luční (Phleum pratense) |
- Bříza bělokorá (Betula alba) |
|
- Drnavec lékařský (Parietaria officinalis) |
- Jílek vytrvalý (Lolium perenne) |
- Habr obecný (Carpinus betulus) |
|
- Pelyněk obecný (Artemisia vulgaris) |
- Lipnice luční (Poa pratensis) |
■ Jasan ztepilý (Fraxinus excelsior) |
|
- Slanobýl draselný (Salsola kali) |
- Srha laločnatá (Dactylis glomerata) |
■ - Líska obecná (Coryllus avelana) |
|
- Tomka vonná (Anthoxanthum odoratum) |
■ Olivovník evropský (Olea europea) | |
|
- Troskut prstnatý (Cynodon dactylon) |
■ Olše lepkavá (Alnus glutinosa) | |
|
- Žito seté (Secale cereale) |
■ Jalovec (Juniperus ashei) | |
|
■ 3 trávy (srha, jílek, bojínek) ■ 5 trav (srha, lipnice, jílek, tomka, bojínek) ■ 4 obilniny (ječmen, kukuřice, oves, pšenice) ■ 5 trav/4 obilniny |
Břízovité (olše, bříza, líska, habr) | |
ROZTOČI
(Allergena acarorum)
- Dermatophagoides pteronyssinus
- Dermatophagoides farinae
- Blomia tropicalis
- Dermatophagoides pteronyssinus,
Dermatophagoides ^ farinae_
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA Sublingvální roztok.
Popis přípravku: bezbarvý až nahnědlý roztok podle koncentrace alergenu.
4. KLINICKÉ ÚDAJE
4.1. Terapeutické indikace
Alergie 1. typu (podle Gellovy a Coombsovy klasifikace) manifestující se především rýmou, konjunktivitidou, rinokonjunktivitidou nebo astmatem (mírné až střední intenzity) sezónní nebo celoroční povahy.
Specifická imunoterapie působí prevenci vzniku klinických projevů alergické reakce, navozené kontaktem senzibilizovaného organismu s alergenem.
4.2. Dávkování a způsob podání
Je třeba uvážit výhody časného zahájení alergenové imunoterapie při rozvoji onemocnění.
Alergenová imunoterapie není doporučena pro děti do 5 let.
Dávkování musí být přizpůsobeno snášenlivosti léčby a výskytu přidružených onemocnění (např. respirační infekce).
U sezónních alergií je doporučeno zahájit léčbu před očekávaným nástupem pylové sezóny a měla by pokračovat až do konce pylové sezóny.
U celoročních alergií je doporučena udržovací léčba po celý rok.
Léčba je rozdělena do dvou fází:
- iniciální léčba, ve které je dávka alergenového extraktu postupně zvyšována a
- udržovací léčba, ve které je užívána konstantní dávka.
1. Iniciální léčba: vzestupné dávky
Dávka se zvyšuje každý den až do dosažení optimální dávky (udržovací dávka).
Příklad režimu léčby je následující:
|
1. týden |
2. týden | ||||
|
10 IR/ml |
300 IR/ml | ||||
|
modrý uzávěr |
fialový uzávěr | ||||
|
Den |
Počet dávek |
Dávka (IR) |
Den |
Počet dávek |
Dávka (IR) |
|
1 |
1 |
2 |
6 |
1 |
60 |
|
2 |
2 |
4 |
7 |
2 |
120 |
|
3 |
3 |
6 |
8 |
3 |
180 |
|
4 |
4 |
8 |
9 |
4 |
240 |
|
5 |
5 |
10 | |||
Poznámka: Uvedený léčebný plán je pouze orientační a měl by být modifikován na základě klinického stavu pacienta a jeho reaktivity.
2. Udržovací léčba: konstantní dávky
Po ukončení iniciální fáze je užívána udržovací dávka:
- buď denně: 120 až 240 IR odpovídajících 2 až 4 dílčím dávkám roztoku s koncentrací 300 IR/ml
nebo
- 3x týdně: 240 IR odpovídajících 4 dílčím dávkám roztoku s koncentrací 300 IR/ml Obecně pacientům denní užívání vyhovuje více než užívání 3x týdně, proto je doporučeno.
Klinické studie s přípravkem Staloral 300 potvrdily, že denní dávky 300 IR jsou dobře snášeny.
Doba léčby
Alergenová imunoterapie by měla pokračovat po dobu 3-5 let.
Pokud se neprojevilo významné zlepšení příznaků, léčba by měla být přehodnocena po 1 roce (u celoroční alergie) nebo po první pylové sezóně (u sezónní alergie).
Dočasné přerušení léčby
Při přerušení léčby na dobu kratší než 1 týden je doporučeno pokračovat s poslední dávkou.
Při přerušení léčby na dobu delší než 1 týden je doporučeno znovu zahájit léčbu a dávku zvyšovat podle iniciačního schématu až do dosažení udržovací dávky.
Způsob podání
Je doporučeno užívat dávku během dne, s prázdnými ústy, bez jídla a nápojů.
Roztok se aplikuje přímo pod jazyk a nechá se tam 2 minuty, pak se spolkne.
Při užívání dětmi je třeba dohled dospělé osoby.
Před každým použitím léku zkontrolujte:
- datum spotřeby
- zda lahvička odpovídá Vašemu předpisu (složení, jméno pacienta, koncentrace, dávkování)
Lahvičky jsou z důvodů bezpečnosti a neporušenosti obalu pevně uzavřeny plastovým a hliníkovým uzávěrem.
Při prvním použití přípravku z lahvičky postupujte následovně:
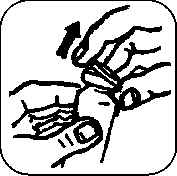
1. Sundejte barevnou plastovou část víčka
2. Zatáhněte za kovové ouško a sundejte hliníkový uzávěr
3. Odstraňte šedou zátku
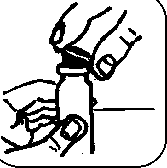

4. Vyjměte dávkovači pumpičku z ochranného obalu. Postavte lahvičku na rovný povrch, jednou rukou ji pevně držte a upevněte pumpičku na lahvičku silným tlakem směrem dolů.
5. Sejměte fialový bezpečnostní kroužek.
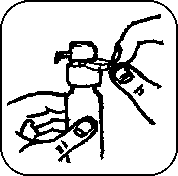
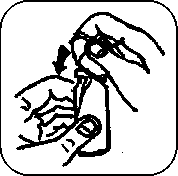
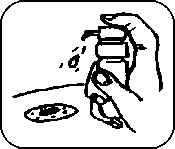
6. 5x pevně pumpičku stiskněte, tak ji naplníte. (Po pěti stiscích pumpička dávkuje plnou jednotlivou dávku přípravku.)
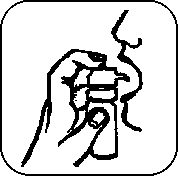
7. Vložte náustek do úst pod jazyk. Pevně stiskněte dávkovač, aby se uvolnila požadovaná dávka. Postup opakujte tolikrát, aby bylo dosaženo celkové denní dávky předepsané lékařem. Přípravek nechejte působit pod jazykem 2 minuty a pak jej spolkněte.
8. Náustek po použití očistěte a znovu nasaďte na dávkovací pumpičku fialový bezpečnostní kroužek.
Při dalších použitích lahvičky s nainstalovanou pumpičkou sejměte fialový bezpečnostní kroužek a dále postupujte podle bodů 7 a 8.
4.3. Kontraindikace
- Hypersenzitivita na kteroukoliv pomocnou látku uvedenou v bodě 6.1;
- Onemocnění z imunitního deficitu nebo aktivní formy autoimunitní poruchy;
- Maligní onemocnění;
- Nekontrolované nebo závažné astma (FEVi< 70 % náležité hodnoty);
- Záněty v ústní dutině, jako lichen planus, vředy v ústní dutině nebo orální mykóza.
4.4. Zvláštní upozornění a opatření pro použití
Před zahájením léčby by měly být v případě nutnosti příznaky alergie stabilizovány vhodnou symptomatickou léčbou. Iniciace léčby by měla být odložena v případě výskytu významných klinických příznaků alergického onemocnění.
V souvislosti se sublingvální imunoterapií byla hlášena eozinofilní ezofagitida. Pokud se během léčby přípravkem Staloral 300 vyskytnou závažné nebo přetrvávající gastroezofageální příznaky, včetně dysfagie nebo bolesti na hrudi, léčba musí být přerušena a pacient vyšetřen svým lékařem. Léčba může být obnovena pouze podle pokynů lékaře.
Při výskytu alergenem vyvolaných příznaků je nutné použít léčbu, např. kortikosteroidy, H1-antihistaminiky a beta-2-mimetiky.
Alergenová imunoterapie u pacientů léčených tricyklickými antidepresivy a inhibitory monoaminooxidázy (IMAO) musí být pečlivě zvážena.
V případech mykózy, aftů, lézí na sliznici, ztráty zubu nebo chirurgického zákroku v dutině ústní, včetně vytrhnutí zubu, musí být léčba přípravkem Staloral 300 zastavena až do úplného zhojení.
Pacienti užívající beta-adrenergní blokátory nemusejí odpovídat na běžné dávky adrenalinu používané k léčbě závažných systémových reakcí, včetně anafylaxe. Beta-adrenergní blokátory antagonizují kardiostimulační a bronchodilatační účinky adrenalinu.
Tento přípravek obsahuje 590 mg chloridu sodného v lahvičce (v 10 ml roztoku). To musí být vzato v úvahu u pacientů dodržujících dietu s přísným omezením sodíku, především u dětí.
Pacienti musí informovat lékaře o každém nedávném přidruženém onemocnění a jakémkoli zhoršení alergického onemocnění.
4.5. Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí.
V klinických studiích s přípravkem Staloral 300 nebyly žádné interakce hlášeny.
Při závažných alergických reakcích může být nutné použití adrenalinu. Riziko nežádoucích účinků adrenalinu může u pacientů léčených tricyklickými antidepresivy a inhibitory monoaminooxidázy (IMAO) být zvýšeno s možnými smrtelnými následky. Před zahájením léčby je toto riziko nutné brát do úvahy.
Klinické zkušenosti se současnou vakcinací při léčbě přípravkem Staloral 300 nejsou dostupné. Vakcinace by měla proběhnout bez přerušení léčby přípravkem Staloral 300 po lékařském zhodnocení celkového stavu pacienta.
4.6. Fertilita, těhotenství a kojení
Klinické údaje o užívání přípravku Staloral 300 u těhotných žen nejsou k dispozici.
Studie na zvířatech reprodukční toxicitu nenaznačují.
Jako preventivní opatření je vhodné vyhnout se zahájení léčby přípravkem Staloral 300 v těhotenství. Jestliže dojde během léčby k otěhotnění, lze pokračovat v léčbě za pečlivého dohledu.
Kojení
Není známo, zda se přípravek Staloral 300 vylučuje do mateřského mléka.
Nebyly provedeny žádné studie na zvířatech zkoumající vylučování přípravku Staloral 300 do mléka. Riziko u novorozence/kojence nemůže být vyloučeno.
Na základě posouzení prospěšnosti léčby pro matku a prospěšnosti kojení pro dítě musí být rozhodnuto, zda přerušit kojení nebo léčbu přípravkem Staloral 300.
Fertilita
S přípravkem Staloral 300 nebyly provedeny žádné studie fertility na zvířatech. Nicméně histopatologická vyšetření samčích a samičích reprodukčních orgánů ve studiích toxicity po opakovaných dávkách extraktů alergenů pylů a roztočů obsažených v přípravku Staloral 300 neukázala žádné nežádoucí nálezy.
4.7. Účinky na schopnost řídit a obsluhovat stroje
5/8
Staloral 300 nemá žádný vliv na schopnost řídit motorové vozidlo nebo obsluhovat stroje.
4.8. Nežádoucí účinky
Při léčbě jsou pacienti vystaveni alergenům, které mohou vyvolat reakci okamžitě po požití nebo opožděnou.
Tak jako u každé alergenové imunoterapie se mohou objevit závažné alergické reakce včetně závažné laryngofaryngeální poruchy (např. dysfonie, orofaryngeální diskomfort a otok faryngu) a systémových alergických reakcí (např. náhlé vzplanutí onemocnění postihujícího pokožku, sliznice nebo obojí, útlum dýchání, přetrvávající trávicí potíže jako bolest břicha nebo zvracení nebo snížený krevní tlak a/nebo související příznaky jako hypotonie nebo synkopa). Informujte pacienta o možných souvisejících známkách a příznacích a poučte jej o nutnosti okamžitě vyhledat lékařskou pomoc a přerušit léčbu při jejich výskytu. Léčbu lze znovu zahájit pouze na radu lékaře.
Snášenlivost požité dávky se může u pacienta lišit v závislosti na jeho stavu a prostředí.
Předchozí léčba antialergiky (např. antihistaminiky) může snížit výskyt a závažnost nežádoucích účinků.
Při výskytu nežádoucích účinků je třeba přehodnotit léčebný režim.
Nežádoucí účinky se klasifikují na základě konvence MedDRA podle tříd orgánových systémů a frekvence výskytu následujícím způsobem:
Časté (>1/100 až < 1/10)
Méně časté (>1/1 000 až <1/100)
Vzácné (> 1/10 000 až <1/1 000)
Následující nežádoucí účinky pocházejí z klinických studií a spontánních hlášení.
|
Třída orgánových systémů |
Frekvence |
Nežádoucí účinek |
|
Poruchy krve a lymfatického systému |
vzácné |
lymfadenopatie |
|
Poruchy imunitního systému |
méně časté |
hypersenzitivita |
|
vzácné |
reakce podobná sérové nemoci | |
|
není známo |
angioedém*, anafylaktický šok* | |
|
Poruchy nervového systému |
méně časté |
parestezie |
|
vzácné | ||
|
není známo |
dysgeuzie*, závrať* | |
|
Poruchy oka |
časté |
svědění oka |
|
méně časté |
konjunktivitida | |
|
Poruchy ucha a labyrintu |
méně časté |
svědění ucha |
|
Respirační, hrudní a |
časté |
podráždění hrdla, otok faryngu, puchýřky v |
|
mediastinální poruchy | ||
|
méně časté | ||
|
Gastrointestinální |
časté |
otok rtů, svědění úst, otok úst, otok jazyka, |
|
poruchy |
orální parestezie, orofaryngeální diskomfort, |
|
není známo |
stomatitida, porucha slinné žlázy, nauzea, bolest břicha, zvracení, průjem bolest v ústech, gastritida, ezofageální spasmus, sucho v ústech*, orofaryngeální otok*, otok hltanu*, eozinofilní ezofagitida*, | |
|
Poruchy kůže a podkožní tkáně |
časté |
pruritus, erytém |
|
méně časté |
kopřivka | |
|
vzácné |
ekzém | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
vzácné |
artralgie, myalgie |
|
Celkové poruchy a reakce v místě aplikace |
vzácné |
astenie, pyrexie |
*Bylo hlášeno spontánně postmarketingově.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9. Předávkování
Jestliže jsou užívány vyšší než doporučené denní dávky, zvyšuje se riziko nežádoucích účinků a jejich závažnost.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1. Farmakodynamické vlastnosti
Farmakoterapeutická skupina: extrakt alergenů ATC klasifikace: skupina V01AA.
Přesný mechanismus účinku alergenů během alergenové imunoterapie není dosud zcela objasněn.
Léčba alergenovou imunoterapií indukuje změny reakce T lymfocytů, následované zvýšením alergenově specifických IgG4 a/nebo IgG1, někdy IgA, a snížením specifických IgE. Další, a pravděpodobně opožděná, imunitní odpověď je deviace imunity se změnou reakce alergenově specifických T buněk.
5.2 Farmakokinetické vlastnosti
Většina alergenů v přípravku Staloral 300 je směsí proteinů a glykoproteinů. Intaktní alergeny nejsou v krvi po sublingválním podání přímo biologicky dostupné.
Proto nebyly prováděny žádné farmakokinetické studie u zvířat ani u člověka pro zjišťování farmakokinetického profilu a metabolismu extraktů alergenů.
5.3. Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje s extrakty alergenů obsažených v přípravku Staloral 300 získané na základě konvenčních studií toxicity po jednorázové dávce, toxicity po opakovaném podávání, genotoxicity, reprodukční toxicity a toxicity pro embryofetální vývoj neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1. Seznam pomocných látek
Chlorid sodný, glycerol, mannitol, voda na injekce.
6.2. Inkompatibility Neuplatňuje se.
6.3. Doba použitelnosti
1 rok před prvním otevřením, 1 měsíc po otevření
6.4. Zvláštní opatření pro uchovávání
Uchovávejte v chladničce při teplotě 2°- 8°C.
Při přenášení lahvičky musí být lahvička vždy udržována ve svislé poloze.
Při transportu lahvičky Staloral 300 s nasazenou dávkovací pumpičkou je třeba lahvičku uložit zpět do plastové krabičky a zajistit bezpečnostním kroužkem.
Při cestování letadlem neponechávejte lahvičky Staloral 300 s nasazenou dávkovací pumpičkou v zavazadlovém prostoru.
6.5. Druh obalu a obsah balení
Hnědá skleněná lahvička typu I, pryžová zátka, hliníkový uzávěr „Tear-off" s barevně odlišeným plastikovým víčkem:
- modrým pro koncentraci 10 IR/ml,
- fialovým pro koncentraci 300 IR/ml,
Balení obsahuje dávkovací pumpičku (jednu pro každou lahvičku), příbalovou informaci.
Velikost balení:
Iniciální léčba:
1 lahvička s modrým víčkem (10 IR/ml)
2 lahvičky s fialovým víčkem (300 IR/ml)
3x1 dávkovací pumpička
Udržovací léčba:
2 lahvičky s fialovým víčkem (300 IR/ml)
2x1 dávkovací pumpička
Na trhu nemusejí být k dispozici všechny velikosti balení.
6.6. Zvláštní opatření pro likvidaci přípravku Žádné zvláštní požadavky pro likvidaci.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Stallergenes
6, Rue Alexis de Tocqueville
92160 Antony Francie
8. REGISTRAČNÍ ČÍSLO
59/334/03-C
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30.10.2003 / 4.2.2015
10. DATUM REVIZE TEXTU
19.8.2016
9/8