Sayana 104 Mg/0,65 Ml Injekční Suspenze
Sp.zn.sukls239005/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
SAYANA 104 mg/0,65 ml injekční suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SAYANA předplněná injekční stříkačka určená k jednorázovému podání obsahuje 104 mg medroxyprogesteron-acetátu (MPA) v 0,65 ml injekční suspenze.
Pomocné látky se známým účinkem:
Methylparaben - 1,04 mg v 0,65 ml Propylparaben - 0,0975 mg v 0,65 ml Sodík - 2,47 mg v 0,65 ml
Úplný seznam pomocných látek viz bod 6.1
3. LÉKOVÁ FORMA
Injekční suspenze
Bílá až téměř bílá homogenní suspenze
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek SAYANA je indikován jako dlouhodobá antikoncepce pro ženy. Jedna podkožní injekce zabraňuje ovulaci a poskytuje antikoncepční účinek po dobu alespoň 13 týdnů (+/- 1 týden). Je však nutné brát v úvahu, že obnovení fertility (ovulace) může být oddáleno až o 1 rok (viz bod 4.4).
Protože ztráta kostní hmoty (BMD) se může objevit u žen různých věkových skupin, které dlouhodobě užívají přípravek SAYANA (viz bod 4.4 Zvláštní upozornění a opatření pro použití), měl by být zvážen poměr rizika a přínosu a rovněž brán v úvahu úbytek kostní hmoty (BMD) objevující se během těhotenství a/nebo kojení.
Použití u dospívajících (12 - 18 let)
Vzhledem k tomu, že dlouhotrvající účinek ztráty kostní hmoty spojený s podáváním přípravku SAYANA během kritického období pro růst kostní hmoty není znám, je použití přípravku SAYANA u dospívajících indikováno pouze tehdy, když byly ostatní antikoncepční metody shledány jako nevhodné nebo nepřijatelné (viz bod 4.4).
Přípravek SAYANA nebyl zkoumán u žen mladších 18 let, ale jsou dostupné údaje pro tuto populaci pro intramuskulární podání MPA.
4.2 Dávkování a způsob podání
Předplněná injekční stříkačka přípravku SAYANA by měla být těsně před použitím důkladně protřepána, aby bylo zajištěno, že podávaná dávka bude homogenní suspenzí. Léčba by měla být zahájena lékařem nebo zdravotnickým pracovníkem a měla by být podávána jako podkožní injekce do přední části stehna nebo do břicha. Přípravek je nutné podávat pomalu až do vyprázdnění stříkačky, což může trvat 5-7 sekund. Návod k přípravě přípravku SAYANA před podáním viz bod 6.6.
Krok 1: Výběr a příprava místa pro podání injekce.
Vyberte místo pro podání injekce buď v horní části stehna, nebo oblasti břicha, viz vyznačené plochy (Obrázek 1). Vyhněte se oblastem kostí a pupku.
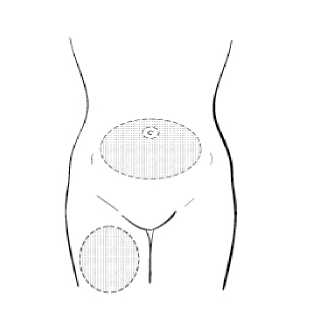
Horní část stehna nebo břicho
Obrázek 1
Otřete zvolené místo vpichu tampónem napuštěným alkoholem. Kůži nechte oschnout.
Stříkačku pevně držte a opatrně z jehly odstraňte ochranný plastový kryt, krytem přitom nekruťte. Ujistěte se, že jehla je stále pevně nasazena na stříkačce (Obrázek 2).
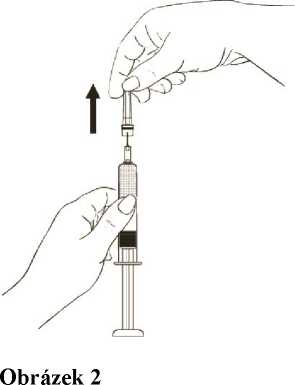
Držte stříkačku jehlou směřující vzhůru a stiskněte jemně píst tak, že se lék dostane až do horní části stříkačky. Ve stříkačce nesmí zbýt žádný vzduch (Obrázek 3)
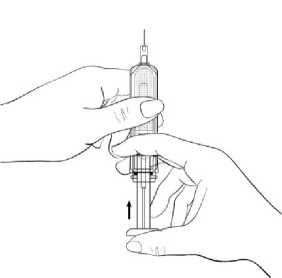
Obrázek 3
Krok 2: Podání dávky
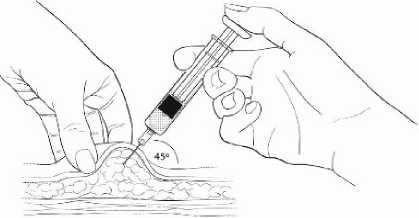
Jemně stiskněte palcem a ukazováčkem plochu kůže ve zvoleném místě vpichu a odtáhněte ji od těla. Zasuňte jehlu pod úhlem 45 stupňů tak, aby většina jehly byla v tukové tkáni. Plastový úchyt jehly by se měl téměř dotýkat kůže (Obrázek 4).
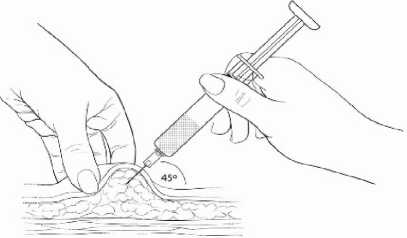
Obrázek 4
Lék aplikujte pomalu, dokud se stříkačka nevyprázdní (Obrázek 5).
• Aplikace trvá cca 5-7 sekund.
• Je důležité, aby byla podána celá dávka přípravku SAYANA.
Podávejte pomalu (5-7 sekund)
Obrázek 5
Po podání celé dávky vytáhněte jehlu jemně z kůže.
Na místo vpichu přitlačte na několik vteřin čistý bavlněný tampón. Místo vpichu nemasírujte.
Dospělí
První injekce: pro zajištění antikoncepce během prvního cyklu použití by měla být podána dávka 104 mg podkožně během prvních pěti dnů normálního menstruačního cyklu. Je-li injekce podána podle těchto instrukcí, není vyžadována žádná další metoda antikoncepce.
Další dávky: Druhá a další injekce by měly být podávány v intervalu 13 týdnů. Pokud je injekce podávána do 7 dnů po intervalu 13 týdnů, nejsou nutná žádná další antikoncepční opatření (např. bariérové metody). Pokud je z jakéhokoli důvodu interval od předchozí injekce delší než 14 týdnů (13 týdnů plus 7 dnů), mělo by být před podáním další injekce vyloučeno těhotenství. Účinnost přípravku SAYANA závisí na dodržení doporučeného dávkovacího schématu.
Po porodu: Pokud žena nekojí, doporučuje se podat injekci během prvních pěti dnů po porodu (pro větší jistotu že pacientka není gravidní). Pokud je nutné podat injekci v jinou dobu, je nutné vyloučit těhotenství.
Kojí-li pacientka, je nutné injekci podat ne dříve než 6 týdnů po porodu, kdy je enzymový systém novorozence již rozvinutější (viz bod 4.6).
Je prokázáno, že ženy, kterým byl aplikován přípravek SAYANA v šestinedělí zaznamenaly dlouhotrvající a silné krvácení. Vzhledem k tomu je třeba zvláštní opatrnosti při podání přípravku v šestinedělí. Pacientky, které chtějí použít přípravek SAYANA bezprostředně po porodu nebo ukončení těhotenství musí být poučeny o zvýšeném riziku silného a dlouhotrvajícího krvácení. Lékař musí mít na paměti, že u pacientek po porodu, které nekojí, se může dostavit ovulace již ve 4. týdnu.
Přechod z jiné metody antikoncepce: Při přechodu z jiné metody antikoncepce by měl být přípravek SAYANA podáván způsobem, který zajistí průběžnou antikoncepční ochranu na základě mechanismu účinku obou metod (např. pacientky, které přecházejí z perorální antikoncepce, by měly dostat první injekci přípravku SAYANA během sedmi dnů poté, co užily poslední antikoncepční tabletku).
Porucha funkce jater: Vliv jaterního onemocnění na farmakokinetiku přípravku SAYANA není znám. Jelikož je přípravek SAYANA téměř výlučně eliminován v játrech, může být nedostatečně metabolizován u pacientů se závažnou jaterní nedostatečností (viz bod 4.3 Kontraindikace).
Porucha funkce ledvin: Vliv onemocnění ledvin na farmakokinetiku přípravku SAYANA není znám. Jelikož je přípravek SAYANA téměř výlučně eliminován v játrech, není úprava dávkování považována u žen s poruchou funkce ledvin za nutnou.
Pediatrická populace
Přípravek SAYANA není indikovaný před menarché (viz bod 4.1 Terapeutické indikace). Jsou dostupné údaje pro i.m. podání MPA u dospívajících (12 - 18 let) (viz bod 4.4 Zvláštní upozornění a zvláštní
4
opatření pro použití a 5.1 Farmakodynamické vlastnosti). Na rozdíl od obav týkajících se ztráty kostní hmoty se očekává, že bezpečnost a účinnost přípravku SAYANA jsou u dospívajících dívek po menarché a u dospělých žen stejné.
4.3 Kontraindikace
• Přípravek SAYANA je kontraindikovaný u pacientek se známou hypersenzitivitou na medroxyprogesteron-acetát nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
• Přípravek SAYANA je kontraindikovaný u těhotných žen nebo při podezření na těhotenství.
• Přípravek SAYANA je kontraindikovaný u žen s prokázanou malignitou prsu nebo pohlavních
orgánů nebo při podezření na ni.
• Přípravek SAYANA je kontraindikovaný u pacientek s vaginálním krvácením z nejasných příčin.
• Přípravek SAYANA je kontraindikovaný u pacientek se závažnou poruchou funkce jater.
• Přípravek SAYANA je kontraindikovaný u pacientek poruchou kostního metabolizmu.
• Přípravek SAYANA je kontraindikovaný u pacientek s aktivní tromboembolickou poruchou a u pacientek s cévní mozkovou příhodou nynější nebo v anamnéze.
4.4 Zvláštní upozornění a opatření pro použití
Ztráta kostní hmoty (BMD)
Používání přípravku SAYANA snižuje sérové hladiny estrogenu a je spojeno s významnou ztrátou hustoty kostních minerálů spolu s tím, jak se kostní metabolizmus adaptuje na nižší hladiny estrogenu. Ztráta kostní hmoty je větší při delším užívání, ale zdá se, že se hustota kostní hmota zvyšuje poté, co se podávání přípravku SAYANA přeruší a ovariální produkce estrogenů vzroste.
Ztráta kostní hmoty je obzvláště závažná během dospívání a časné dospělosti, kritického období pro růst kostní hmoty. Není známo, zda užívání přípravku SAYANA mladšími ženami snižuje maximální dosaženou hustotu kosti a zvyšuje tak riziko zlomenin v pozdějším věku.
Studie zkoumající účinky medroxyprogesteron-acetátu i.m. (přípravek Depo-Provera) na hustotu kostní hmoty u dospívajících žen ukázala, že jeho podání bylo spojeno s významným poklesem hustoty kostních minerálů od výchozích hodnot. U malého počtu žen, které pokračovaly v podávání přípravku SAYANA, se střední hustota kostních minerálů vrátila blízko k výchozím hodnotám po 1 - 3 letech po ukončení podávání. U dospívajících může být přípravek SAYANA použit, ale jen poté, co byly s pacientkou prodiskutovány ostatní antikoncepční metody a tyto shledány nedostačující či nevhodné.
U ženy jakéhokoli věku, pokud vyžaduje dlouhodobější užívání medroxyprogesteron acetátu po dobu delší než 2 roky, by měl být pečlivě přehodnocen poměr přínosu a rizika léčby. Zvláště u žen se zdravotními rizikovými faktory osteoporózy by měly být před použitím přípravku SAYANA zváženy jiné metody antikoncepce.
Významné rizikové faktory osteoporózy jsou:
• Užívání alkoholu a/nebo tabáku
• Chronické užívání léků snižujících kostní hmotu, např. antikonvulziva nebo kortikosteroidy
• Nízký BMI nebo poruchy příjmu potravy, např. anorexie nebo bulimie
• Spontánní zlomenina v anamnéze
• Osteoporóza v rodinné anamnéze
Z výsledků retrospektivní kohortové studie využívající data z General Practice Research Database (GPRD) vyplývá, že ženy používající injekce s MPA (DMPA) jsou vystaveny vyššímu riziku zlomenin v porovnání s uživatelkami kontracepce bez DMPA (incidence 1,41, 95% CI 1,35-1,47 pro 5-leté pokračující období). Není známo, zda je to kvůli DMPA, nebo kvůli jiným faktorům souvisejícím se
životním stylem, které mají vliv na počet zlomenin. Naopak u žen používajících DMPA nebylo riziko zlomenin před používáním DMPA a po jeho používání (relativní riziko 1,08, IS 95% 0,92-1,26) zvýšeno. Důležité je, že tato studie nemůže stanovit, zda má používání DMPA vliv na počet zlomenin v pozdějším věku.
Další informace o změnách denzity kostních minerálů jak u dospělých tak u dospívajících žen, které byly hlášeny v nedávných klinických studiích, jsou uvedeny v bodu 5.1 (Farmakodynamické vlastnosti). Dostatečný přísun vápníku a vitamínu D, ať ve stravě či potravinových doplňcích je důležitý pro zdravé kosti žen v každém věku.
Nepravidelný menstruační cyklus
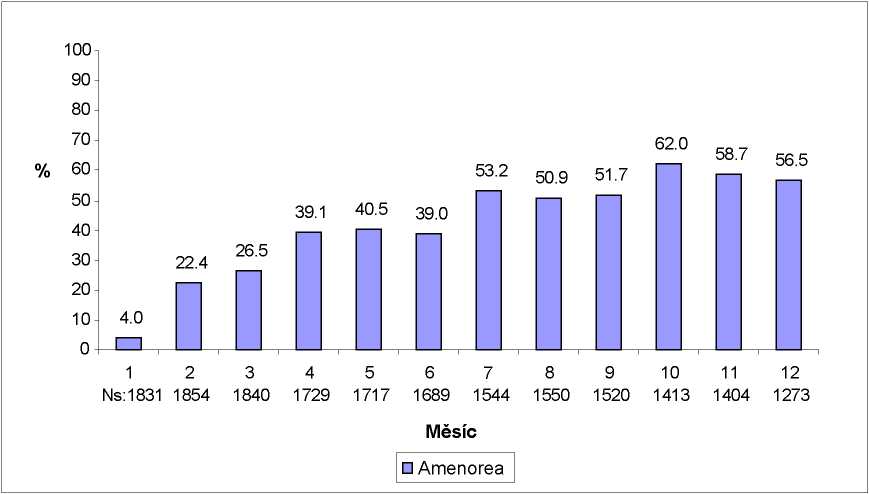
Většina žen užívajících přípravek SAYANA udávala poruchy menstruačního cyklu. Pacientky by měly být vhodně informovány o možnosti výskytu poruch menstruačního cyklu a možného prodloužení anovulace. S rostoucí dobou užívání přípravku SAYANA si stále méně pacientek stěžuje na nepravidelné krvácení a více jich udává amenoreu. Po podání čtvrté dávky udávalo 39% žen amenoreu v průběhu šestého měsíce. Během dvanáctého měsíce udávalo amenoreu 56,5% žen. Změny menstruačního cyklu u tří studií hodnotících antikoncepci jsou zobrazeny na obrázcích 1 a 2. Obrázek 1 ukazuje zvýšení procenta žen, u kterých se vyskytla amenorea v průběhu 12-měsíční studie. Obrázek 2 ukazuje procento žen, u kterých se objevilo pouze špinění, pouze krvácení a krvácení a špinění v průběhu stejného období. Vedle amenorey zahrnovala změna menstruačního cyklu nepravidelné děložní krvácení, menoragii a metroragii. Pokud je abnormální krvácení související s použitím přípravku SAYANA trvalé nebo závažné, mělo by být provedeno příslušné vyšetření a zahájena léčba.
Obrázek 1. Procento žen s amenoreou trvající 30 dnů ve sledovaném měsíci, kterým byl podáván přípravek SAYANA ve studiích hodnotících antikoncepci (ITT populace, n=2 053)
Obrázek 2. Procento žen s amenoreou trvající 30 dnů ve sledovaném měsíci, kterým byl podáván přípravek SAYANA ve studiích hodnotících antikoncepci (ITT populace, n=2 053) 100
90
%
80
70
60
50
40
30
20
10
Riziko vzniku nádoru
Dlouhodobé sledování pacientek užívajících DMPA-IM 150 mg nezjistilo žádné zvýšení celkového rizika ovariálních, jaterních nebo cervikálních nádorů a dále trvající ochranný účinek snižující riziko karcinomu endometria.
Karcinom prsu je vzácný u žen do 40 let věku, ať užívají hormonální antikoncepci či nikoli.
Výsledky některých epidemiologických studií naznačují, že existuje malý rozdíl v riziku diagnózy u žen, které užívají nebo užívaly hormonální antikoncepci, v porovnání s těmi, které ji nikdy neužívaly. Riziko u současných a nedávných uživatelek DMPA je malé, s ohledem na celkové riziko karcinomu prsu, zvláště u mladých žen (viz níže), a po 10 letech od posledního užití není patrné. Délka užívání se nezdá být významná.
Předpokládaný počet dalších případů karcinomu prsu diagnostikovaného až po 10 letech po ukončení léčby injekčními progestogeny+
|
Věk při poslední injekci MPA |
Počet případů na 10,000 žen, které nikdy MPA neužívaly |
Předpokládaný počet dalších případů na 10,000 uživatelek MPA |
|
20 |
Méně než 1 |
Výrazně méně než 1 |
|
30 |
44 |
2-3 |
|
40 |
160 |
10 |
+při užívání po dobu 5 let
Tromboembolické poruchy
Ačkoli medroxyprogesteron-acetát nemá příčinnou souvislost s indukcí trombotické nebo tromboembolické poruchy, neměl by být u žádné pacientky užívající přípravek SAYANA, u které se vyskytne tato příhoda, např. plicní embolie, cévní mozková příhoda, retinální trombóza nebo hluboká žilní trombóza, tento přípravek znovu podáván. Ženy s předchozí anamnézou tromboembolické poruchy nebyly sledovány v klinických hodnoceních a žádné informace, které by dokládaly bezpečnost podání přípravku SAYANA této populaci nejsou dostupné.
Anafylaxe a anafylaktická reakce
Pokud se objeví anafylaktická reakce, měla by být ihned zahájena příslušná léčba. Závažné anafylaktické reakce vyžadují okamžitou léčbu.
Poruchy očí
Jestliže dojde k částečné nebo úplné ztrátě zraku, k náhlému vzniku exoftalmu, diplopie nebo k migréně, je třeba vyčkat s dalším podáváním přípravku až do doby oftalmologického vyšetření. Jestliže vyšetření odhalí edém papily nebo retinální cévní léze, neměl by být přípravek dále podáván.
Změny tělesné hmotnosti
Změny tělesné hmotnosti jsou časté, ale nepředvídatelné. Ve studiích 3. fáze byla sledována tělesná hmotnost po dobu 12 měsíců. Polovina (50%) žen zůstala na své původní hmotnosti v rozsahu 2,2 kg. 12% žen ztratilo více než 2,2 kg a 38% žen přibralo více než 2,3 kg.
Retence tekutin
Existují důkazy, že progestageny mohou vyvolávat určitý stupeň retence tekutin. Přípravek musí být proto podáván opatrně pacientkám, jejichž předchozí onemocnění by mohlo být přírůstkem hmotnosti nebo retencí tekutin nepříznivě ovlivněno.
Ukončení anovulace
Po jednorázové dávce přípravku SAYANA byl kumulativní výskyt ukončení anovulace měřený podle plasmatické hladiny progesteronu 97,4% (38/39 pacientek) do jednoho roku po podávání. Po 14-týdenní terapeutické pauze byl nejčasnější návrat k ovulaci pozorován po jednom týdnu a průměrná doba do ovulace byla 30 týdnů. Ženy by měly být informovány, že existuje možnost zpoždění návratu ovulace po používání metody bez ohledu na dobu používání. Je však známo, že amenorrhoea a/nebo nepravidelná menstruace po ukončení užívání hormonální antikoncepce mohou být zapříčiněny základním onemocněním, s kterým souvisí nepravidelná menstruace, zejména syndromem polycystických ovárií.
Psychiatrické poruchy
Pacientky s anamnézou klinické deprese by měly být v průběhu léčby přípravkem SAYANA pečlivě sledovány.
Ochrana před sexuálně přenosnými chorobami
Pacientky by měly být informovány, že přípravek SAYANA neposkytuje ochranu před infekcí HIV (AIDS) nebo jinými sexuálně přenosnými chorobami.
Uhlohydráty/metabolizmus
U některých pacientek léčených progestiny může dojít ke snížení glukózové tolerance. Během této léčby je třeba pečlivě sledovat pacientky s diabetem.
Funkce jater
Pokud se u pacientky užívající přípravek SAYANA objeví žloutenka, mělo by být zváženo vysazení přípravku (viz bod 4.3).
Hypertenze a porucha metabolizmu lipidů
Pouze omezené údaje naznačují, že u pacientek s hypertenzí nebo poruchou metabolizmu lipidů, kterým byly podávány injekce progesteronu, existuje mírně zvýšené riziko kardiovaskulárních příhod. Je-li v průběhu léčby přípravkem SAYANA zaznamenána hypertenze a/nebo progrese hypertenze nelze dostatečně kontrolovat antihypertenzní léčbou, je nutné léčbu přípravkem SAYANA ukončit. Další rizikové faktory arteriální trombotické poruchy zahrnují: hypertenze, kouření, věk, porucha metabolizmu lipidů, migréna, obezita, pozitivní rodinná anamnéza, onemocnění srdečních chlopní, fibrilace síní.
Přípravek SAYANA je nutné užívat s opatrností u pacientek s 1 nebo více rizikovými faktory.
Jiné stavy
Během těhotenství a při užívání pohlavních steroidů, byly hlášeny následující stavy, souvislost s užíváním gestagenů nebyla stanovena: žloutenka a/nebo pruritus vyvolaný cholestázou, tvorba žlučových kamenů, porfyrie, systémový lupus erythematosus, hemolyticko-uremický syndrom, Sydenhamova chorea, herpes gestationis, ztráta sluchu způsobená otosklerózou.
Laboratorní vyšetření
Při odesílání vzorků na patologické vyšetření by měl být patolog informován o léčbě progestiny. Lékař by měl být informován o tom, že určitá endokrinologická vyšetření a vyšetření jaterních testů a krevních složek mohou být při léčbě progestiny ovlivněny:
a) Snížení hladiny steroidů v plazmě/moči (např. progesteron, estradiol, pregnanediol, testosteron, kortison)
b) Hladiny gonadotropinu v plazmě a moči jsou snížené (např. LH, FSH).
c) Koncentrace pohlavní hormony vázaj ícího globulinu (SHBG) jsou snížené.
Vzhledem k tomu, že přípravek obsahuje methylparaben a propylparaben může vyvolat alergické reakce (i opožděné) a výjimečně bronchospazmus. Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v 104 mg/0,65 ml, tj. je v zásadě bez sodíku.
Pokud se vyskytuje některý ze zmíněných stavů/rizikových faktorů, je nutné zvážit přínosy přípravku SAYANA proti možným rizikům individuálně u každé ženy a prodiskutovat je s ní ještě před rozhodnutím zahájit podávání přípravku. V případě zhoršení nebo prvním objevení kteréhokoliv z těchto stavů nebo rizikových faktorů se musí žena obrátit na svého lékaře. Lékař poté rozhodne, zda by podávání přípravku SAYANA mělo být přerušeno.
4.5. Interakce s jinými léčivými přípravky a jiné formy interakce
Žádné interakční studie s přípravkem SAYANA nebyly prováděny.
Interakce s jinými typy léčby (včetně perorálních antikoagulačních přípravků) byly zaznamenány vzácně, ale příčinná souvislost nebyla stanovena. Možnost interakcí by měla být zvážena u pacientek podstupujících současně léčbu jinými léky.
MPA je in-vitro metabolizován především hydroxylací přes CYP3A4. Specifické studie lékových interakcí vyhodnocující klinický účinek induktorů nebo inhibitorů CYP3A4 na MPA nebyly prováděny a tudíž není klinický účinek induktorů nebo inhibitorů CYP3A4 znám.
4.6 Fertilita, těhotenství a kojení
Fertilita
Přípravek SAYANA je indikován k prevenci otěhotnění.
Návrat plodnosti (koncepce) žen může být po vysazení přípravku SAYANA opožděn (viz bod 4.4).
Přípravek SAYANA je kontraindikovaný u těhotných žen. Některé údaje naznačují souvislost mezi intrauterinní expozicí progestinům v prvním trimestru těhotenství a abnormalitami genitálií u mužských a ženských plodů. Pokud je přípravek SAYANA používán v průběhu těhotenství nebo pokud pacientka otěhotní v průběhu léčby tímto přípravkem, měla by být informována o možném riziku pro plod.
Na základě výsledků 1 studie byli novorozenci z neplánovaných těhotenství, která vznikla v průběhu 1 - 2 měsíců po podání injekce medroxyprogesteron acetátu v dávce 150 mg i.m., vystaveni zvýšenému riziku nízké porodní hmotnosti, což mělo za následek i vyšší riziko novorozenecké úmrtnosti. Celkové riziko je však velmi nízké, neboť otěhotnění při užívání medroxyprogesteron-acetátu v dávce 150 mg i.m., není běžné.
U dětí, které byly vystaveny účinkům medroxyprogesteron-acetátu in utero a byly sledovány až do dospívání, nebyly prokázány žádné nežádoucí účinky na zdraví včetně tělesného, intelektuálního, sexuálního nebo sociálního vývoje.
Kojení
Nízká detekovatelná množství léku byla identifikována v mléce matek užívajících medroxyprogesteron-acetát. U kojících matek léčených medroxyprogesteron-acetátem v dávce 150 mg i.m. nebylo složení mléka a jeho množství nežádoucím způsobem ovlivněno. Novorozenci a děti vystavené působení medroxyprogesteron-acetátu v mateřském mléce byli hodnoceni s ohledem na vývojové a behaviorální účinky během puberty. Nebyly pozorovány žádné nežádoucí účinky. Vzhledem k omezenému počtu údajů o účinku MPA na kojence mladší 6 týdnů nesmí být přípravek SAYANA podán dříve než 6 týdnů po porodu, kdy je enzymový systém novorozence rozvinutější.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek SAYANA nemá žádný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Hlášení z klinických studií:
Níže uvedená tabulka uvádí seznam nežádoucích účinků léčivého přípravku s četností podle údajů o celkové kauzalitě z klinických hodnocení, ve kterých bylo zahrnuto 2053 žen, které dostávaly DMPA subkutánně jako antikoncepci. Nejčastěji hlášené nežádoucí účinky (> 5 %) zahrnovaly bolesti hlavy (8,9 %), metroragii (7,1 %), zvýšení hmotnosti (6,9 %), amenoreu (6,3 %) a reakce v místě injekce (různé typy, 6,1 %).
Nežádoucí účinky jsou uvedeny podle následujících kategorií. Podle výskytu jsou nežádoucí účinky rozděleny následujícím způsobem:
Velmi časté (>1/10)
Časté (>1/100 až <1/10)
Méně časté (>1/1000 až <1/100)
Vzácné (>1/10 000 až <1/1000)
Četnost není známa (nelze z dostupných dat určit)
Hlášení ze sledování po uvedení na trh
Navíc jsou níže uvedeny klinicky významné nežádoucí účinky získané ze sledování po uvedení na trh injekční DMPA (i.m. nebo s.c.):
|
Třídy orgánovýcl systémů |
Velmi časté |
Časté |
Méně časté |
Vzácné |
Četnost není známa |
|
Novotvary benigní, maligní a blíže neurčené (zahrnující cysty a polypy) |
karcinom prsu (viz bod 4.4) | ||||
|
Poruchy imunitního systému |
přecitlivělos t na léčivý přípravek (viz bod 4.4) |
anafylaktické reakce, anafylaktoid ní reakce, angioedém (viz bod 4.4) | |||
|
Poruchy metabolismu a výživy |
retence tekutin (viz bod 4.4), zvýšená chuť |
|
k jídlu, snížená chuť kjídlu | |||||
|
Psychiatrické poruchy |
deprese, insomnie, úzkost, , afektivní porucha, podrážděnost , snížení libida |
poruchy emocí, anorgasmie | |||
|
Poruchy nervového systému |
závratě, bolest hlavy |
migréna, somnolence |
záchvat | ||
|
Poruchy ucha a labyrintu | |||||
|
Srdeční poruchy | |||||
|
Cévní poruchy |
hypertenze (viz bod 4.4), žilní varixy, návaly horka |
plicní embolie, embolie a trombóza (viz bod 4.4), tromboflebiti da | |||
|
Gastrointestinální poruchy |
bolesti břicha, |
břišní distenze | |||
|
Poruchy jater a žlučových cest |
abnormální jaterní funkce (viz bod 4.4) | ||||
|
Poruchy kůže a podkožní tkáně |
akné |
alopecie, hirsutismus, ekchymóza, chloazma, pruritus, kopřivka |
získaná lipodystrofi e |
kožní strie | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
bolesti zad, bolesti v končetině |
artralgie, svalové křeče |
osteoporóza, osteoporotick é zlomeniny | ||
|
Poruchy reprodukčního systému a prsu |
menometrora gie, metroragie, menoragie (viz bod 4.4), dysmenorea, amenorea, vaginitida, bolestivost prsů |
ovariální cysta, děložní krvácení (nepravideln é, zvýšené, snížené), poševní výtok, dispareunie, |
|
galaktorea, pánevní bolest, suchost vulvy a pochvy, premenstruač ní syndrom, citlivost prsů, zvětšení prsů | |||||
|
Celkové poruchy a reakce v místě aplikace |
reakce v místě injekce, přetrvávající atrofie/indent ace/tvorba důlků v místě vpichu, uzlina/bulka v místě vpichu, bolest/citlivo st v místě vpichu |
pyrexie |
astenie | ||
|
Vyšetření |
zvýšení tělesné hmotnosti (viz bod 4.4), abnormální poševní stěr |
snížení hustoty kostní tkáně (viz bod 4.4), snížená tolerance glukózy (viz bod 4.4), abnormální hodnoty jaterních enzymů |
snížení tělesné hmotnosti (viz bod 4.4) |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: http://www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Při předávkování není vyžadováno žádné opatření než přerušení léčby.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
ATC kód: G03AC06
Medroxyprogesteron-acetát je analog 17 a-hydroxyprogesteronu s antiestrogenními, antiandrogenními a antigonadotropními účinky.
Injekční suspenze přípravku SAYANA potlačuje sekreci hypofyzárních gonadotropinů, což zabraňuje zrání folikulů s následnou anovulací. Primární mechanizmus inhibice ovulace vyvolává také ztenčení endometria a tyto účinky jsou zodpovědné za antikoncepční působení.
Změny hustoty kostní hmoty (BMD) u dospělých žen
Ve studii srovnávající změny BMD u žen užívajících přípravek SAYANA s ženami užívajícími medroxyprogesteron-acetát v dávce 150 mg i.m. nebyly prokázány žádné významné rozdíly v úbytku BMD mezi oběma skupinami po dvou letech léčby. Průměrné procentuální změny hustoty kostní hmoty u žen užívajících přípravek SAYANA jsou uvedeny v tabulce 1.
Tabulka 1. Průměrná změna BMD (%) oproti výchozímu stavu u žen užívajících přípravek SAYANA podle lokalizace na skeletu __
|
Doba léčby |
Lumbální páteř |
Celá kyčel |
Krče |
í femuru | ||
|
N |
Průměrná změna (%) (95% CI) |
N |
Průměrná změna (%) (95% CI) |
N |
Průměrná změna (%) (95% CI) | |
|
1 rok |
166 |
-2,7 (-3,1 až -2,3) |
166 |
-1,7 (-2,1 až -1,3) |
166 |
-1,9 (-2,5 až -1,4) |
|
2 roky |
106 |
- 4,1 (-4,6 až 3,5) |
106 |
-3,5 (-4,2 až -2,7) |
106 |
-3,5 (-4,3 až -2,6) |
V další kontrolované klinické studii vykazovaly dospělé ženy užívající injekce medroxyprogesteron-acetátu (150 mg i.m.) po dobu alespoň 5 let pokles průměrné BMD v oblasti páteře a kyčle přibližně o 5 -6% v porovnání s kontrolní skupinou, ve které nedošlo k žádné významné změně. Pokles BMD byl výraznější během prvních dvou let užívání, v dalších letech docházelo pouze k menším poklesům. Průměrné změny v oblasti lumbální páteře byly -2,86%, -4,11%, -4,89%, -4,93% a -5,38% po 1, 2, 3, 4 a 5 letech. Průměrný pokles v oblasti celé kyčle a krčku femuru byl podobný. Viz tabulka 2 pro další podrobnosti.
Po ukončení podávání injekcí medroxyprogesteron-acetátu (150 mg i.m.) došlo k nárůstu BMD směrem k původním hodnotám. Delší trvání léčby bylo spojeno s pomalejší obnovou BMD.
Tabulka 2. Průměrná změna (%) BMD oproti výchozímu stavu u dospělých podle lokalizace na skeletu a kohorty po 5 letech léčby medroxyprogesteron-acetátem (150 mg i.m.) a po 2 letech po ukončení léčby nebo 7 letech pozorování (kontrolní skupina)
|
Doba ve studii |
Páteř |
Celá kyčel |
Krček femuru | |||
|
Medroxyprog esteron acetát |
Kontrola |
Medroxyprog esteron acetát |
Kontrola |
Medroxyprog esteron acetát |
Kontrola | |
|
5 let* |
n=33 |
n=105 |
n=21 |
n=65 |
n=34 |
n=106 |
|
-5,38% |
0,43% |
-5,16% |
0,19% |
-6,12% |
-0,27% | |
|
7 let** |
n=12 -3,13% |
n=60 0,53% |
n=7 -1,34% |
n=39 0,94% |
n=13 -5,38% |
n=63 -0,11% |
*Léčebná skupina se skládala z žen, které užívaly medroxyprogesteron-acetát v injekci (150 mg i.m.) po dobu 5 let a kontrolní skupina se skládala z žen, které po tuto dobu neužívaly hormonální antikoncepci. **Léčebná skupina se skládala z žen, které užívaly medroxyprogesteron-acetát v injekci (150 mg i.m.) po dobu 5 let a které byly pak sledovány po dobu 2 let po užívání a kontrolní skupina se skládala z žen, které neužívaly hormonální antikoncepci po dobu 7 let.
Změny BMD u dospívajících dívek (12 - 18 let)
Výsledky z otevřené nerandomizované klinické studie zkoumající injekce medroxyprogesteron-acetátu (150 mg i.m. každých 12 týdnů až po 240 týdnů (4,6 let), s následným sledováním po ukončení podávání u dospívajících dívek (12 - 18 let) také ukázaly, že medroxyprogesteron-acetát i.m. byl spojen s významným poklesem BMD oproti výchozímu stavu. Mezi subjekty, kterým byly aplikovány > 4 injekce/60 týdnů byl průměrný pokles v BMD lumbální páteře -2,1% po 240 týdnech (4,6 let); průměrný pokles pro celou kyčel byl -6,4% a pro krček femuru -5,4%. Následné sledování po ukončení podávání ukázalo, že (podle průměrných hodnot) BMD lumbální páteře se vrátila k výchozím hodnotám přibližně za 1 rok po ukončení léčby a BMD kyčle se vrátila k výchozím hodnotám přibližně za 3 roky po ukončení léčby. Je ale nutné vzít v úvahu, že hodně subjektů svoji účast ve studii ukončilo a tyto výsledky jsou tedy založeny na malém počtu subjektů (n=71 v 60. týdnu a n=25 v 240. týdnu po ukončení léčby). Naproti tomu s uživateli DMPA neporovnatelná kohorta rozdílných neléčených subjektů s rozdílnými výchozími hodnotami kostních parametrů vykazovala průměrné nárůsty BMD v 240. týdnu o 6,4% u lumbální páteře, 1,7% u celé kyčle a 1,9% u krčku femuru.
5.2 Farmakokinetické vlastnosti
Farmakokinetické parametry medroxyprogesteron-acetátu v jedné subkutánní injekci přípravku SAYANA jsou zobrazeny v tabulce 1.
Tabulka 1. Farmakokinetické parametry medroxyprogesteron-acetátu Po jedné subkutánní jnjekci přípravku SAYANA u zdravých žen (n = 42)
|
C v-/max |
Tmax |
C91 (min) |
AUC0-91 |
AUC^ |
t/ | |
|
(ng/ml) |
(den) |
(ng/ml) |
(ngden/ml) |
(ngden/ml) |
(den) | |
|
Průměr |
1,56 |
8,8 |
0,402 |
66,98 |
92,84 |
43 |
|
Min |
0,53 |
2,0 |
0,133 |
20,63 |
31,36 |
16 |
|
Max |
3,08 |
80,0 |
0,733 |
139,79 |
162,29 |
114 |
Cmax = maximální koncentrace v séru; Tmax = doba, kdy byla pozorována Cmax; AUC0-91 = plocha pod křivkou koncentrace-čas po dobu 91 dnů; t/ = terminální biologický poločas; 1 nanogram = 103 pikogram.
Obecné vlastnosti
Absorpce
Absorpce medroxyprogesteron-acetátu ze subkutánní injekce do dosažení terapeutických hladin je relativně rychlá. Průměrná Tmax je dosažená přibližně týden po podání injekce. Maximální koncentrace medroxyprogesteron-acetátu (Cmax) se obecně pohybuje od 0,5 do 3,0 ng/ml s průměrnou Cmax 1,5 ng/ml po jednorázové podkožní injekci.
Účinek místa aplikace injekce
Přípravek SAYANA byl podáván do přední části stehna nebo do břicha pro hodnocení účinků na profil koncentrace-čas medroxyprogesteron-acetátu. Dolní koncentrace medroxyprogesteron-acetátu (Cmm; den 91) byly podobné u obou míst aplikace injekce, což naznačuje, že místo aplikace injekce neovlivňuje negativně antikoncepční účinek.
Distribuce
Vazba na plazmatické proteiny je přibližně 86%. Medroxyprogesteron-acetát se váže hlavně na albumin v séru; nedochází k žádné vazbě na SHBG.
Biotransformace
Medroxyprogesteron-acetát se rozsáhle metabolizuje v játrech působením enzymů systému P450. Jeho metabolizmus zahrnuje primárně redukci kruhu A a/nebo postranního řetězce, ztrátu acetylové skupiny, hydroxylaci na 2-, 6- a 21- pozici nebo kombinaci těchto pozic, čímž vzniká více než deset metabolitů.
Eliminace
Reziduální koncentrace medroxyprogesteron-acetátu na konci dávkovacího intervalu (3 měsíce) přípravku SAYANA jsou obecně pod 0,5 ng/ml, což odpovídá jeho zjevnému terminálnímu biologickému poločasu přibližně 40 dnů po subkutánním podání. Většina metabolitů medroxyprogesteron-acetátu je vylučována močí jako glukuronidové konjugáty pouze s malým množstvím vylučovaným jako sulfáty.
Linearita/nelinearita
Na základě údajů po jednorázovém podání nebyl zjištěn důkaz non-linearity v rámci dávkovacího rozmezí 50 až 150 mg po subkutánním podání. Vztah mezi AUC nebo Cmin a subkutánní dávkou medroxyprogesteron-acetátu se zdá být lineární. Průměrná Cmax se při zvyšování dávky významně nemění.
Zvláštní skupiny pacientů
Rasa
V klinických studiích nebyly zaznamenány žádné rozdíly ve farmakokinetice a/nebo farmakodynamice medroxyprogesteron-acetátu po subkutánním podání přípravku SAYANA u žen všech etnických původů. Farmakokinetika/farmakodynamika medroxyprogesteron-acetátu byla hodnocena v samostatné studii u asijských žen.
Účinek na tělesnou hmotnost
U přípravku SAYANA není nutná úprava dávkování v závislosti na tělesné hmotnosti. Vliv tělesné hmotnosti na farmakokinetiku medroxyprogesteron-acetátu byl hodnocen u podskupiny pacientek (n = 42, index tělesné hmotnosti [BMI] se pohyboval od 18,2 do 46,0 kg/m2). Hodnoty AUC0-91 u medroxyprogesteron-acetátu byly 68,5 ng-den/ml u žen s BMI < 25 kg/m2, 74,8 ng-den/ml u žen s BMI >25 až <30 kg/m2 a 61,8 ng -den/ml u žen s BMI >30 kg/m2. Průměrná Cmax medroxyprogesteron-acetátu byla 1,65 ng/ml u žen s BMI < 25 kg/m2, 1,76 ng/ml u žen s BMI >25 až <30 kg/m2 a 1,40 ng/ml u žen s BMI > 30 kg/m2. Rozmezí dolních koncentrací (Cmin) medroxyprogesteron-acetátu a biologické poločasy byly srovnatelné u všech tří skupin žen rozdělených podle BMI.
Farmakokinetické/farmakodynamické vztahy
Z farmakodynamického hlediska závisí délka potlačení ovulace na udržení terapeutických koncentrací medroxyprogesteron acetátu v průběhu 13-týdenního dávkovacího intervalu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a hodnocení kancerogenního potenciálu neodhalily žádné zvláštní riziko pro člověka. Ukázalo se, že medroxyprogesteron-acetát má nežádoucí účinky na reprodukci u zvířat a je kontraindikován pro podání během těhotenství.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Makrogol 3350 Methylparaben (E 218)
Propylparaben (E 216)
Chlorid sodný Polysorbát 80
Monohydrát dihydrogenfosforečnanu sodného Dodekahydrát hydrogenfosforečnanu sodného Methionin Povidon
Kyselina chlorovodíková a/nebo hydroxid sodný pro úpravu pH Voda na injekci
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
Neotevřené balení: 3 roky
Po otevření: ihned spotřebujte. Veškerý nespotřebovaný přípravek je nutné zlikvidovat.
6.4 Zvláštní opatření pro uchovávání Chraňte před chladem nebo mrazem
6.5 Druh obalu a obsah balení
Injekční suspenze přípravku SAYANA 104 mg/0,65 ml je dodávána jako předplněná injekční stříkačka (sklo Ph.Eur. typ 1) o obsahu 0,65 ml na jedno použití s pryžovou zátkou a s krytem (bromobutylová pryž).
Balení obsahuje 1 předplněnou stříkačku a 1 jehlu 26G, 3/8" nebo 6 předplněných stříkaček a 6 jehel 26G, 3/8".
Na trhu nemusí být k dispozici všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Pouze na jedno použití.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod k přípravě přípravku
Příprava
Nenechejte zmrznout. Zajistěte, aby lék měl před aplikací pokojovou teplotu (k zajištění správné viskozity suspenze). Ujistěte se, že máte k dispozici všechny následující komponenty (Obrázek 6 a 7).
Prefilled
syringe

plastic
needle
cover

needle
Obrázek 6 Obrázek 7
(předplněná stříkačka) (plastový kryt j ehly/j ehla)
Přípravek SAYANA je nutné, stejně jako ostatní parenterální léčivé přípravky, před podáním vizuálně zkontrolovat, zda neobsahuje částice nebo nemá jinou barvu.
Příprava stříkačky
Jemně otočte konec ochranného krytu jehly tak, že se přeruší ochranný spoj (Obrázek 8). Jehlu i s krytem odložte.
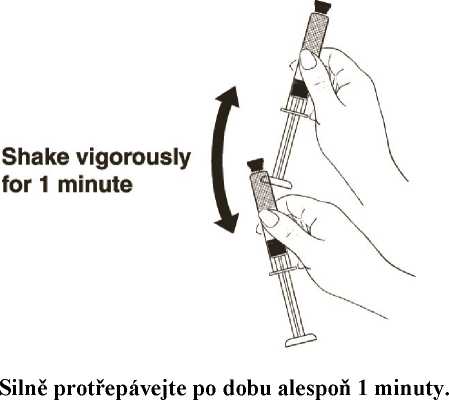
Obrázek 8
Stříkačku držte pevně náplní směrem vzhůru a silně ji protřepávejte po dobu alespoň 1 minuty, aby se lék řádně promíchal. (Obrázek 9).
Poté sejměte ochranný kryt horní části stříkačky.
Obrázek 9
Držte stříkačku pevně a na horní část stříkačky nasaďte jehlu tak, že jemným krouživým pohybem stlačíte plastový kryt jehly směrem dolů (Obrázek 10).
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pfizer spol. s r.o., Stroupežnického 17, 150 00 Praha 5, Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
17/553/07-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
12.9.2007/7.1.2011
10. DATUM REVIZE TEXTU
13.3.2016
19