Preflucel
sp.zn.sukls232031/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU PREFLUCEL
Injekční suspenze v předplněné injekční stříkačce
Vakcína proti chřipce (štěpený virion, inaktivovaná, připravovaná na buněčných kulturách)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Viry chřipky (inaktivované, štěpené) následujících kmenů*
|
A/Califomia/07/2009 (H1N1) |
15 mikrogramů HA** |
|
A/Victoria/361/2011 (A/H3N2) |
15 mikrogramů HA** |
|
B/Hubei-Wujiagang/158/2009 (B) |
15 mikrogramů HA** |
|
na 0,5 ml dávky |
*pomnožené na Vero buňkách (kontinuální buněčná linie savčího původu)
**hemaglutinin
Toto složení vakcíny odpovídá doporučení WHO (severní polokoule) a rozhodnutí EU pro sezónu 2012/2013.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze v předplněné injekční stříkačce. Přípravek PREFLUCEL je čirá až opalescentní suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Profylaxe chřipky u dospělých a starších osob.
Přípravek PREFLUCEL se má používat podle oficiálních doporučení.
4.2 Dávkování a způsob podání
Dávkování
Dospělí (ve věku 18 let a starší) a starší osoby (nad 60 let věku): 0,5 ml Pediatrická populace
Bezpečnost a účinnost u osob mladších 18 let nebyla hodnocena (viz bod 5.1). Způsob podání
Imunizace má být provedena intramuskulární injekcí (do musculus deltoideus). Návod pro přípravu vakcíny před jejím podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku(y) nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo rezidua (např. formaldehyd, benzonázu nebo sacharózu).
U pacientů se středně závažným nebo závažným akutním onemocněním s nebo bez horečky se doporučuje odložit imunizaci.
4.4 Zvláštní upozornění a opatření pro použití
Stejně jako u všech injekčních vakcín má být vždy připravena k okamžitému použití odpovídající medikace a lékařský dohled pro případ anafylaktické reakce po podání vakcíny.
U přípravku PREFLUCEL byla hlášena anafylaxe.
Přípravek PREFLUCEL nesmí být v žádném případě aplikován intravaskulárně.
Protilátková odpověď u pacientů s endogenní nebo iatrogenní imunosupresí může být nedostatečná. Podobně jako u jiných intramuskulárních injekcí má být přípravek PREFLUCEL podáván s opatrností u osob s krvácivými onemocněními jako je hemofilie nebo kteří podstupují antikoagulační léčbu, aby se předešlo riziku hematomu po podání injekce.
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v 0,5 ml, tj. v podstatě neobsahuje sodík.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Přípravek PREFLUCEL může být podán současně s jinými vakcínami. Nemíchejte s jinou vakcínou ve stejné injekční stříkačce nebo injekční lahvičce. Imunizace má být provedena do různých končetin. Je třeba zmínit, že nežádoucí účinky mohou být intenzivnější. Imunitní odpověď může být snížena, jestliže pacient podstupuje imunosupresivní léčbu.
Ačkoli to nebylo pozorováno u přípravku PREFLUCEL, po vakcinaci proti chřipce byly zaznamenány falešně pozitivní výsledky sérologických testů při použití metody ELISA k detekci protilátek proti HIV1, hepatitidě C a především HTLV1. Tyto falešně pozitivní výsledky je možno vyloučit metodou Western Blot. Přechodně falešně pozitivní reakce mohou být způsobeny IgM odpovědí na vakcínu.
4.6 Fertilita, těhotenství a kojení
Bezpečnost přípravku PREFLUCEL během těhotenství a kojení nebyla hodnocena v klinických studiích. Obecně údaje z očkování těhotných žen nenaznačují, že by očkování mohlo mít negativní dopad na plod či matku. Použití této vakcíny lze zvážit od druhého trimestru těhotenství. Před předepsáním přípravku PREFLUCEL se lékařům doporučuje pečlivě zvážit možná rizika a přínosy u každé jednotlivé osoby. U těhotných žen, jejichž zdravotní stav zvyšuje riziko chřipkových komplikací, může být vakcína podána podle národních doporučení.
Kojení
Přípravek PREFLUCEL lze použít v období kojení.
Fertilita
Účinky vakcíny PREFLUCEL na fertilitu u mužů nebyly hodnoceny.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek PREFLUCEL nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Údaje o bezpečnosti při používání přípravku PREFLUCEL vycházejí z údajů klinických studií zahrnujících více než 10 000 dospělých a starších pacientů (8 600 dospělých ve věku 18-59 let; 2 225 starších ve věku nad 60 let). Nejčastější nežádoucí účinky pozorované v klinických studiích byly bolest hlavy, myalgie, bolest v místě vpichu, únava a malátnost. Přípravek PREFLUCEL nebyl studován u pediatrické populace.
Seznam nežádoucích účinků
Frekvence nežádoucích účinků jsou hlášeny jako:
velmi časté (>1/10)
časté (>1/100, <1/10)
méně časté (>1/1 000, <1/100)
vzácné (>1/10 000, <1/1 000)
|
Třída orgánového systému |
Velmi časté >1/10 |
Časté >1/100, <1/10 |
Méně časté >1/1 000, <1/100 |
Vzácné >1/10 000, <1/1 000 |
|
Poruchy imunitního systému |
Hypersenzitivita Anafylaktická reakce | |||
|
Poruchy nervového systému |
Senzitivní poškození1 (hypoestezie, hyperestezie, parestezie) |
Dysgeuzie | ||
|
Poruchy oka |
Oční hyperemie Iritace oka Sekrece z oka1 | |||
|
Respirační, hrudní a mediastinální poruchy |
Orofaryngeální bolest Rhinorrhoea |
Podráždění hrdla Faryngeální edém Dušnost | ||
|
Gastrointestinální poruchy |
Abdominální bolest |
Dysfagie1 | ||
|
Poruchy kůže a podkožní tkáně |
Hyperhidróza |
Pruritus Erytém |
Kopřivka | |
|
Vyšetření |
Zvýšený krevní tlak | |||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Myalgie |
Arthralgie1 |
Muskuloskeletální ztuhlost | |
|
Celkové poruchy a reakce v místě aplikace |
Reakce v místě vpichu: bolest1 |
Reakce v místě vpichu: otok, erytém, indurace1 |
Reakce v místě vpichu: Pruritus, Hemoragie Pocit tepla1 | |
|
Systémové reakce: |
Systémové reakce: |
Systémové reakce: hrudní dyskomfort |
Periferní edém |
|
pyrexie | ||||
|
Cévní poruchy |
Synkopa | |||
|
* Tyto reakce obvyk |
e odezní bez léčby během 1 - 2 dnů. | |||
Byl hlášen případ roztroušené sklerózy u jednoho muže. První příznaky se objevily 6 týdnů po vakcinaci. Příčinnou souvislost s vakcinací nelze vyloučit.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu: Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10. Webové stránky: http://www.sukl.cz/nahlasit-nezadouci-ucinek.
4.9 Předávkování
Není pravděpodobné, že by předávkování mohlo mít nějaký nežádoucí účinek.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcína proti chřipce, čištěný antigen, ATC kód: J07BB02
Séroprotekce je obvykle dosažena během 2 až 3 týdnů. Trvání post-vakcinační imunity k homologním kmenům nebo ke kmenům blízce příbuzným kmenům ve vakcíně se liší, ale obvykle je to 6 až 12 měsíců.
Klinická, účinnost
Klinická účinnost vakcíny proti chřipkové infekci byla sledována během chřipkové sezóny 2008/2009 v pivotní randomizované, placebem kontrolované, dvojitě zaslepené klinické studii fáze III u zdravých dobrovolníků ve věku 18 až 49 let, kteří dostávali přípravek PREFLUCEL (N=3626) nebo placebo (N=3620). Účinnost přípravku PREFLUCEL byla definována jako prevence chřipkové infekce potvrzená kultivací (CCII) shodných a neshodných kmenů.
|
Bě |
Odhadovaná účinnost vakcíny iem chřipkové sezóny 2008/2009 |
* |
|
Kmeny chřipky |
Shodné a neshodné kmeny společně*** | |
|
Dospělí ve věku 18 - 49 let |
Dospělí ve věku 18 - 49 let | |
|
N = 3 626 |
N = 3 626 | |
|
A/H1N1 |
79,0% |
75,2% |
|
(95% IS) |
(59,7 až 89,0) |
(55,4 až 86,2) |
|
A/H3N2 |
50,0%' |
50,0% |
|
(95% IS) |
(-173,0 až 90,8) |
(-173,0 až 90,8) |
|
A kmeny společně |
77,0% |
73,5% |
|
(95% IS) |
(57,9 až 87,4) |
(54,0 až 84,7) |
|
B kmen |
100%2 |
60,1%3 |
|
(95% IS) |
(4,1 až 100,0) |
(9,5 až 82,4) |
|
VŠECHNY kmeny |
78,5% |
71,5% |
|
(95% IS) |
(60,8 až 88,2) |
(54,7 až 82,1) |
kulturou virů)
*** Účinnost proti kmenům chřipky bez ohledu na shodu antigenů (potvrzeno kulturou virů a / nebo RT-PCR)
1 2 dokumentované CCII ve vakcinované skupině a 4 dokumentované případy v placebové skupině
2 4 dokumentované CCII, všechny v placebové skupině
3 Bylo izolováno 28 chřipkových kmenů B, ze kterých 4 představovaly hladinu linie odpovídající vakcinačnímu kmeni (Yamagata linie)
Účinnost vakcíny kalkulovaná pro všechny kmeny, bez ohledu na jejich antigenní shodu, byla v průběhu studie konzistentní, s průměrnou kumulativní účinností 68% - 83% za týden během celé chřipkové sezóny.
Imunogenita
Imunitní odpovědi na jednotlivé antigeny v pivotní klinické studii fáze III u dospělých ve věku 18-49 let (2008/2009) jsou shrnuty v tabulce níže.
|
PREFLUCEL | |||
|
Kmenově specifické anti-HA protilátky |
A/H1N1 |
A/H3N2 |
B |
|
Dospělí ve věku 18 - 49 let N=3473 |
Dospělí ve věku 18 -49 let N=3473 |
Dospělí ve věku 18 - 49 let N=3473 | |
|
Poměr séroprotekce* (95% IS) |
88,0% (86,8 až 89,0) |
93,3% (92,4 až 94,1) |
97,1% (96,5 až 97,7) |
|
Poměr sérokonverze** (95% IS) |
70,4% (68,9 až 71,9) |
79,1% (77,7 až 80,4) |
65,7% (64,1 až 67,3) |
|
Geometrický průměr vzestupu*** (95% IS) |
11,1 (10,52 až 11,74) |
13,5 (12,85 až 14,20) |
7,6 (7,22 až 7,97) |
* Séroprotekce = HI titr > 40
** Sérokonverze = negativní titr HI před vakcinací a post-vakcinační titr HI > 40: Významný vzestup = pozitivní titr HI před vakcinací a minimálně 4-násobný vzestup titru HI po vakcinaci *** Geometrický průměr vzestupu je vzestup protilátkové odpovědi (titr inhibice hemaglutinace) po vakcinaci ve srovnání se situací před vakcinací. Vzestup protilátkové odpovědi je udáván jako geometrický průměr vzestupu titru protilátek každého jednotlivého subjektu 21 dní po vakcinaci ve srovnání s titrem před vakcinací.
V předchozí randomizované, placebem kontrolované, dvojitě zaslepené klinické studii fáze III u zdravých dobrovolníků ve věku 18 až 49 let během sezóny 2007/2008 byl přípravek PREFLUCEL podán 1744 subjektům. Poměry séroprotekce u všech tří kmenů chřipky se pohybovaly od 75,9% do 97,1%, poměry sérokonverze od 57,0% do 71,7% a geometrické průměry vzestupu 21 dní po vakcinaci od 6,5 do 10,8 nad bazálními titry HI.
V randomizované, dvojitě zaslepené, aktivně kontrolované studii fáze III byla během sezóny 2008/2009 hodnocena imunogenita a bezpečnost přípravku PREFLUCEL u dospělých a starších osob (od 50 let věku). Byl podáván přípravek PREFLUCEL (N = 2842) nebo srovnávací trivalentní vakcína proti chřipce pomnožená na vejcích (N = 366). Poměry séroprotekce, sérokonverze a geometrický průměr vzestupu j sou shrnuty v tabulce níže:
|
PREFLUCEL | ||||||
|
Kmenově specifické anti-HA protilátky |
A/H1N1 |
A/H3N2 |
B | |||
|
Věk 50-59 let N=1248 |
Věk 60+ let N=1548 |
Věk 50-59 let N=1248 |
Věk 60+ let N=1548 |
Věk 50-59 let N=1248 |
Věk 60+ let N=1548 | |
|
Poměr séroprotekce* (95% IS) |
76,9% (74,5;79,2) |
71,1% (68,7;73,3) |
90,1% (88,3;91,7) |
90,8% (89,3;92,2) |
87,5% (85,5;89,3) |
82,8% (80,8;84,6) |
|
Poměr sérokonverze** (95% IS) |
50,6% (47,7;53,4) |
37,2 % (34,8;39,7) |
70,1% (67,5; 72,6) |
59,8% (57,3;62,3) |
49,1% (46,3;51,9) |
37,5% (35,0;39,9) |
|
Geometrický průměr vzestupu*** (95% IS) |
5,18 (4,78;5,63) |
3,35 (3,14;3,57) |
9,67 (8,86; 10,55) |
6,14 (5,71;6,59) |
4,59 (4,25;4,97) |
3,20 (3,00;3,40) |
* Séroprotekce = Titr HI (> 40, kritérium CHMP > 70% u subjektů ve věku 18 - 59 let a > 60% u subjektů starších 60 let
** Sérokonverze = negativní titr HI před vakcinací a post-vakcinační titr HI > 40: Významný vzestup = pozitivní titr HI před vakcinací a minimálně 4-násobný vzestup titru HI po vakcinaci, kritérium CHMP > 40% u subjektů ve věku 18 - 59 let a > 30% u subjektů starších 60 let *** Geometrický průměr vzestupu je vzestup protilátkové odpovědi (titr inhibice hemaglutinace) po vakcinaci srovnávaný se situací před vakcinací. Vzestup protilátkové odpovědi je udáván jako geometrický průměr vzestupu titru protilátek každého jednotlivého subjektu 21 dní po vakcinaci ve srovnání s titrem před vakcinací, kritérium CHMP > 2,5 u subjektů ve věku 18 - 59 let a > 2,0 u subjektů starších 60 let
Aktivní komparátory pomnožené na vejcích dosáhly poměry séroprotekce v průřezu všech tří kmenů chřipky v rozmezí od 86,7% do 95,8% a 79,7% až 96,2% u subjektů ve věku 50 - 59 let (N=143), resp. u subjektů starších 60 let (N=212). 21 dní po vakcinaci byly poměry sérokonverze 61,5% až 87,4% (u subjektů ve věku 50-59 let) a 47,6% až 72,6% (subjekty ve věku 60 let a starší). Geometrický průměr vzestupu 21 dní po vakcinaci se pohyboval v rozmezí 5,8 až 13,9, resp. 4,0 až 10,7 v uvedených věkových skupinách.
Přípravek PREFLUCEL nebyl zkoumán u pediatrické populace, proto nejsou údaje o imunitní odpovědi pro tuto věkovou skupinu k dispozici (viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Neuplatňuje se
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních studií toxicity neodhalily žádné zvláštní riziko pro člověka. Přípravek PREFLUCEL byl dobře tolerován a imunogenní u myší, potkanů a morčat. Ve studiích toxicity po jednorázovém a opakovaném podávání u potkanů nebyly prokázány žádné známky systémové toxicity a vakcína byla místně dobře snášena. Genotoxicita a kancerogenní potenciál nebyly hodnoceny, protože tyto studie nejsou u vakcín vhodné. Ve vývojových a reprodukčních studií u potkanů nebyly po vakcinaci matek zaznamenány žádné nežádoucí účinky.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
trometamol chlorid sodný polysorbát 80 voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, proto nesmí být přípravek PREFLUCEL mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
1 rok
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2°C - 8°C). Chraňte před mrazem.
Uchovávejte v krabičce, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
1 nebo 10 předplněných injekčních stříkaček (sklo typu I) s pístovou zátkou neobsahující latex (brombutylová pryž), s připojenou jehlou;
1 nebo 10 předplněných injekčních stříkaček (sklo typu I) s pístovou zátkou neobsahující latex (brombutylová pryž), bez připojené jehly;
Každá injekční stříkačka obsahuje 0,5 ml suspenze. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Před aplikací by měla vakcína mít pokojovou teplotu. Před podáním předplněnou injekční stříkačku důkladně protřepejte, aby se suspenze vakcíny řádně promíchala. Po protřepání je přípravek PREFLUCEL čirá až opalescentní suspenze. Vakcína má být před podáním vizuálně zkontrolována s ohledem na výskyt jakýchkoliv částic a/nebo změnu fyzikálního vzhledu. Pokud jsou přítomny jakékoli změny vzhledu, vakcínu zlikvidujte.
Sejměte ochranný kryt jehly následovně:
1. Předplněnou stříkačku přidržte v dolní části ochranného krytu jehly fixované ke skleněnému tělu stříkačky (Obr. 1).
2. Horní část krytu jehly uchopte druhou rukou mezi palec a ukazovák a pootočte, abyste rozlomili svár (evidentní přerušení) (Obr. 2).
3. Oddělenou část ochranného krytu jehly sejměte z jehly vertikálním pohybem (Obr. 3).
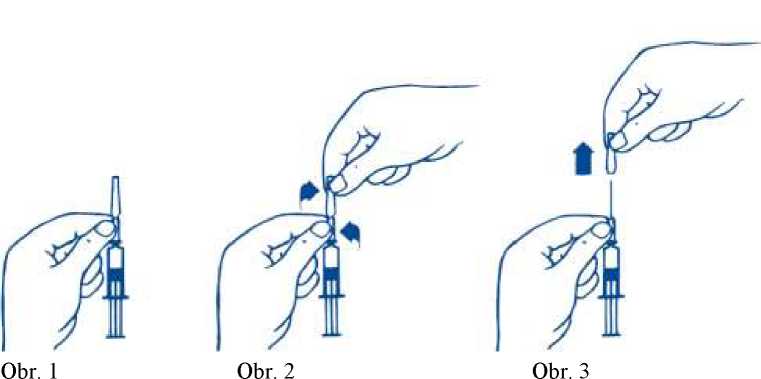
Po odstranění ochranného krytu jehly má být přípravek PREFLUCEL ihned použit.
Aby nedošlo k porušení sterility a/nebo ucpání jehly, nesmí být jehla ponechána delší dobu bez ochrany. Proto má být kryt jehly sejmut až po protřepání a bezprostředně před aplikací.
Doplňující informace pro přípravek PREFLUCEL v injekční stříkačce bez připojené jehly:
Po odstranění ochranného krytu injekční stříkačky, připojte ihned jehlu a před aplikací odstraňte ochranný kryt jehly. Jakmile je jehla připojena, vakcína musí být ihned aplikována.
K minimalizaci rizika lokálních nežádoucích reakcí je třeba vyvarovat se kapek na špičce vnějšího povrchu jehly před aplikací. Pokud je používán alkohol v místě aplikace injekce, měl by před vakcinací zcela vyschnout a neměl by přijít do styku s vakcínou.
Veškerý nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Nanotherapeutics Bohumil s.r.o.
Bohumil 138 281 63 Jevany Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
59/772/10-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 29.9.2010
Datum posledního prodloužení registrace: 22.3.2015
10. DATUM REVIZE TEXTU
13.4.2016
8
Klinické hodnocení fáze III prováděné v USA během chřipkové sezóny 2008/2009
Účinnost proti kmenům chřipky antigenně podobným kmenům vakcíny (potvrzeno