Ovestin
sp.zn.sukls217327/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Ovestin vaginální krém
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden gram krému obsahuje estriolum 1 mg Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Vaginální krém.
Bílý nebo téměř bílý, jemný, homogenní krém.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
• Hormonální substituční terapie (HRT) k léčbě atrofie dolní části urogenitálního traktu související s nedostatkem estrogenu.
• Předoperační a pooperační léčba žen po menopauze podstupujících chirurgický zákrok v oblasti vagíny.
• Diagnostický prostředek při nejednoznačném atrofickém cervikálním stěru.
4.2 Dávkování a způsob podání
Ovestin je přípravek, který obsahuje pouze estrogen a může být podáván ženám s i bez dělohy. Dávkování
• Při atrofii dolní části urogenitálního traktu:
1 aplikace denně po dobu prvních několika týdnů, poté postupné snižování v závislosti na ústupu příznaků, až do dosažení udržovací dávky (např. 1 aplikace dvakrát týdně).
• Při předoperační a pooperační léčbě žen po menopauze podstupujících chirurgický zákrok v oblasti vagíny:
1 aplikace denně po dobu dvou týdnů před zákrokem; 1 aplikace dvakrát týdně po dobu dvou týdnů po zákroku
• Jako diagnostický prostředek při nejednoznačném atrofickém cervikálním stěru:
1 aplikace každý druhý den v týdnu před odběrem dalšího stěru.
Vynechaná dávka má být aplikována ihned, jakmile si pacientka vzpomene, vzpomene-li si však na vynechanou dávku až v den, kdy má být aplikována další dávka, vynechaná dávka má být přeskočena a dále se pokračuje v obvyklém dávkovacím schématu. Nikdy nesmí být aplikovány dvě dávky ve stejný den.
Způsob podání
Ovestin vaginální krém se aplikuje intravaginálně pomocí kalibrovaného aplikátoru večer před ulehnutím.
1 aplikace (naplnění aplikátoru po vyznačený kroužek) představuje 0,5 g vaginálního krému přípravku Ovestin, což odpovídá 0,5 mg estriolu.
Návod k použití pro pacientku:
1. Sejměte z tuby uzávěr, obraťte ho a ostrý hrot použijte na otevření tuby.
2. Na tubu našroubujte konec aplikátoru. Ujistěte se, že je píst úplně nasazen na válec.
3.
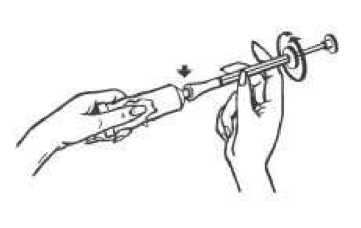
Pomalu zmáčkněte tubu tak, aby se aplikátor naplnil krémem, dokud se píst nezastaví (na červené značce, viz šipky na obrázku níže).
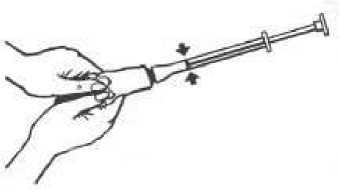
4. Odšroubujte aplikátor z tuby a nasaďte na ni opět uzávěr.
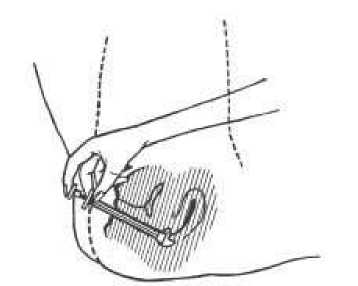
5. Při aplikaci krému si lehněte, konec aplikátoru zasuňte hluboko do pochvy.
6. Pomalu stlačte píst až na doraz, dokud nedojde k vyprázdnění aplikátoru.
7. Po použití vyjměte píst z válce za hranici odporu a obě části aplikátoru omyjte v teplé mýdlové vodě. Nepoužívejte detergenty. Po omytí důkladně opláchněte. NEDÁVEJTE APLIKÁTOR DO HORKÉ NEBO VAŘÍCÍ VODY.
8. Aplikátor je možné znovu složit zasunutím pístu do válce až za hranici, při které je cítit odpor. Jakmile je tuba prázdná, aplikátor zlikvidujte.
Pro počáteční a pokračující léčbu postmenopauzálních příznaků by se měla používat nejnižší účinná dávka a co nejkratší dobu (viz bod 4.4)
U žen, které neužívají HRT nebo u žen, které přecházejí z kontinuální kombinované HRT, může začít
léčba přípravkem Ovestin kterýkoli den. Ženy, které přecházejí z cyklického režimu HRT, by měly
léčbu přípravkem Ovestin začít jeden týden po ukončení cyklu.
4.3 Kontraindikace
• Známý, uváděný v anamnéze nebo suspektní karcinom prsu
• Známé nebo suspektní estrogenně podmíněné maligní tumory (např. karcinom endometria)
• Nediagnostikované krvácení z genitálií
• Neléčená hyperplazie endometria
• Dřívější či současný žilní tromboembolismus (trombóza hlubokých žil, plicní embolie)
• Známá trombofilní porucha (např. deficience proteinu C, proteinu S nebo antitrombinu, viz bod 4.4)
• Aktivní nebo nedávno prodělané arteriální tromboembolické onemocnění (např. angina pectoris, infarkt myokardu)
• Akutní onemocnění jater nebo v anamnéze uváděné onemocnění jater, pokud se jaterní testy nevrátily do normálu
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
• Porfyrie
4.4 Zvláštní upozornění a opatření pro použití
• Léčba postmenoupauzálních symptomů hormonální substitucí by měla být zahájena pouze tehdy, pokud symptomy nepříznivě ovlivňují kvalitu života. Ve všech případech je třeba podrobně zvážit rizika a přínosy léčby, a to alespoň jednou ročně, a pokračovat v HRT pouze tehdy, pokud přínosy převažují nad riziky.
• Údaje týkající se rizik souvisejících s HRT v léčbě předčasné menopauzy jsou omezené. Vzhledem k nízké úrovni absolutního rizika u mladších žen však může být poměr přínosů a rizik u těchto žen příznivější než u starších žen.
Lékařské vyšetření/kontroly
• Před zahájením nebo obnovením HRT je nutno zjistit kompletní osobní a rodinnou zdravotní anamnézu. Lékařské vyšetření (včetně vyšetření pánve a prsou) by se mělo řídit informacemi vycházejícími z anamnézy, kontraindikacemi a upozorněními pro použití HRT. V průběhu léčby se doporučuje provádět pravidelná kontrolní vyšetření, jejichž frekvence a charakter jsou individuální s ohledem na stav každé pacientky. Ženy je třeba upozornit na to, jaké změny
v prsou by měly hlásit svému lékaři nebo zdravotní sestře (viz níže „Karcinom prsu“).
Vyšetření, včetně vhodných zobrazovacích metod, např. mamografie, je třeba provádět v souladu s aktuálně přijímanou screeningovou praxí, upravenou s ohledem na klinické potřeby individuálních pacientek.
Stavy vyžadující sledování
• Pokud je přítomen jakýkoliv z následujících stavů, nebo se vyskytl v minulosti a/nebo se zhoršil v průběhu těhotenství či předchozí hormonální léčby, je třeba pacientku bedlivě sledovat. Je nutno vzít v úvahu, že tyto stavy se mohou vyskytnout opakovaně nebo se mohou během léčby přípravkem Ovestin zhoršit. Jedná se především o následující:
- Leiomyom (děložní fibroidy) nebo endometrióza
- Rizikové faktory tromboembolických poruch (viz níže)
- Rizikové faktory estrogenně podmíněných tumorů, např. dědičná zátěž ke karcinomu prsu z první linie
- Hypertenze
- Poruchy činnosti j ater (např. adenom j ater)
- Diabetes mellitus s vaskulárním postižením nebo bez něj
- Cholelitiáza
- Migréna nebo (těžké) bolesti hlavy
- Systémový lupus erythematodes
- Hyperplazie endometria v anamnéze (viz níže)
- Epilepsie
- Astma
- Otoskleróza
Důvody okamžitého ukončení léčby:
Léčbu je třeba ukončit v případě zjištění kontraindikací a v následujících situacích:
• Žloutenka nebo zhoršení funkce j ater
• Významné zvýšení krevního tlaku
• Nový výskyt migrenózních bolestí hlavy
• Těhotenství
Hyperplazie a karcinom endometria
Aby se zabránilo endometriální stimulaci, neměla by denní dávka překročit l aplikaci denně (0,5 mg estriolu) a tato maximální dávka by neměla být podávána déle než několik týdnů. Jedna epidemiologická studie ukázala, že dlouhodobá léčba nízkými dávkami perorálně podávaného estriolu, ale ne vaginálně podávaného estriolu, může zvýšit riziko karcinomu endometria. Toto riziko se zvyšuje s dobou užívání a zaniká do jednoho roku po ukončení léčby. Zvýšené riziko se týká hlavně méně invazivních a vysoce diferencovaných tumorů. Vaginální krvácení během léčby se musí vždy vyšetřit. Pacientka musí být informována, že má kontaktovat lékaře, jestliže se u ní objeví vaginální krvácení.
Karcinom prsu
Celkové údaje ukazují na zvýšené riziko karcinomu prsu u žen užívajících kombinaci estrogen-gestagen a možná i HRT obsahující pouze samotný estrogen, a to v závislosti na délce užívání HRT.
Kombinovaná léčba estrogenem a gestagenem
Randomizované, placebem kontrolované hodnocení (studie Women’s Health Initiative, WHI) a epidemiologické studie shodně uvádějí zvýšené riziko karcinomu prsu u žen užívajících kombinovanou estrogen-gestagenní HRT. Zvýšení rizika vzniku karcinomu prsu se projeví po přibližně 3 letech léčby (viz bod 4.8).
Léčba samotným estrogenem
Ve studii WHI nebylo zjištěno žádné zvýšení rizika rakoviny prsu u žen, které absolvovaly hysterektomii a užívaly HRT obsahující samotný estrogen. Z observačních studií bylo převážně zjištěno malé zvýšení rizika diagnózy karcinomu prsu, které je významně nižší, než riziko zjištěné u pacientek užívajících kombinace estrogen-gestagen (viz bod 4.8).
Zvýšení rizika se projeví po několika málo letech užívání, ale vrátí se zpět na vstupní úroveň do několika mála (maximálně pěti) let po ukončení léčby.
HRT, především kombinovaná léčba estrogenem a gestagenem, zvyšuje denzitu mamografických nálezů, což může negativně ovlivnit radiologickou detekci karcinomu prsu. Klinické studie ukazují, že pravděpodobnost vzniku zvýšené denzity mamografických nálezů byla nižší u subjektů léčených estriolem než u subjektů léčených jinými estrogeny.
Není známo, zda Ovestin přináší stejné riziko. V populační studii případů a kontrol zahrnující 3 345 žen s invazivním karcinomem prsu a 3 454 kontrolních žen nebyla nalezena souvislost mezi estriolem a nárůstem rizika karcinomu prsu oproti jiným estrogenům. Avšak klinické důsledky těchto nálezů nejsou dosud známy. Proto je důležité, aby bylo riziko diagnostikovaného karcinomu prsu diskutováno s pacientkou a byl zvažován známý prospěch léčby HRT.
Karcinom ovarií
Karcinom ovaria je mnohem vzácnější než karcinom prsu. Dlouhodobé (minimálně 5-10leté) užívání přípravků HRT obsahujících samotný estrogen je spojováno s mírně zvýšeným rizikem vzniku karcinomu ovarií (viz bod 4.8). Některé studie, včetně hodnocení WHI, naznačují, že dlouhodobé užívání kombinované HRT s sebou může nést podobné nebo o něco nižší riziko (viz bod 4.8). Není jasné, zda dlouhodobé užívání slabých estrogenů (jako je Ovestin) vede k rozdílnému riziku než je tomu u jiných přípravků obsahujících pouze estrogen.
Žilní tromboembolismus
HRT je spojována s 1,3-3násobným rizikem vzniku žilního tromboembolismu (VTE), tj. trombózy hlubokých žil nebo plicní embolie. Výskyt takové příhody je mnohem pravděpodobnější v prvním roce užívání HRT než později (viz bod 4.8). Tyto studie nezahrnovaly přípravek Ovestin, a vzhledem k nedostatku údajů, není známo, zda přípravek Ovestin přináší stejné riziko.
U pacientek se známými trombofilními stavy je zvýšené riziko vzniku VTE. Hormonální substituční terapie může toto riziko dále zvyšovat. U těchto pacientek je proto HRT kontraindikována (viz bod 4.3).
Obecně uznávané rizikové faktory vzniku VTE zahrnují užívání estrogenů, vyšší věk, velké operace, delší nehybnost, obezitu (BMI > 30 kg/m2), těhotenství/poporodní období, systémový lupus erythematodes (SLE) a onkologická onemocnění. V otázce, jakou roli mohou mít ve VTE křečové žíly, neexistuje shoda.
Jako u všech pacientů po operaci je třeba zvážit preventivní opatření, aby se zabránilo vzniku pooperační VTE. Pokud po plánované operaci bude nutná delší nehybnost, doporučuje se dočasně HRT vysadit 4 až 6 týdnů před touto operací. Léčba by se neměla obnovit dříve, než bude žena opět plně pohyblivá.
Pokud se Ovestin používá v indikaci „Předoperační a pooperační léčba ...“, je třeba zvážit profylaktickou léčbu proti trombóze.
U žen, které nemají VTE v osobní anamnéze, ale mají příbuzného první linie, který trpěl trombózou v mladém věku, lze nabídnout screening po pečlivém vysvětlení jeho omezení (screening zachytí pouze část trombofilních poruch). Pokud je zjištěn trombofilní defekt, který je spojován s trombózou členů rodiny, nebo pokud se jedná o „závažný“ defekt (např. deficience antitrombinu, proteinu S nebo proteinu C nebo kombinace defektů), je HRT kontraindikována.
U žen, které jsou již léčeny antikoagulačními přípravky, je nutno pečlivě zvážit poměr přínosů a rizik léčby HRT.
Pokud po zahájení léčby dojde ke vzniku VTE, je třeba přípravek vysadit. Pacientky je třeba upozornit, aby se na svého lékaře obrátily, jakmile si budou vědomy nástupu některého potencionálního symptomu tromboembolismu (např. bolestivé otoky dolních končetin, náhlá bolest na hrudi, dyspnoe).
Ischemická choroba srdeční (ICHS)
Randomizovaná, kontrolovaná hodnocení neposkytla žádný důkaz ochrany proti infarktu myokardu u žen se stávající ICHS nebo bez ní, které užívaly kombinovanou léčbu estrogenem a gestagenem nebo HRT obsahující samotný estrogen.
Kombinovaná léčba estrogenem a gestagenem
Relativní riziko vzniku ICHS je po dobu užívání kombinované estrogen-gestagenní HRT mírně zvýšené. Vzhledem k tomu, že základní absolutní riziko ICHS do značné míry závisí na věku, je počet dalších případů ICHS vyvolaných užíváním kombinace estrogen-gestagen u zdravých žen před menopauzou velmi nízký, ale s pokročilým věkem se zvyšuje.
Samotný estrogen
Z randomizovaných, kontrolovaných hodnocení nebylo zjištěno žádné zvýšení rizika ICHS u žen, které absolvovaly hysterektomii a které se léčí samotným estrogenem.
Ischemická cévní mozková příhoda
Léčba kombinací estrogen-gestagen a samotným estrogenem je spojována až s 1,5násobným zvýšením rizika vzniku ischemické mozkové příhody. Relativní riziko se nemění s věkem ani s dobou uplynuvší od menopauzy. Ale vzhledem k tomu, že základní riziko mozkové příhody je značně závislé na věku, celkové riziko vzniku mozkové příhody u žen užívajících HRT se bude s věkem zvyšovat (viz bod 4.8).
Další stavy
• Estrogeny mohou vyvolávat retenci tekutin, a proto je třeba bedlivě sledovat pacientky trpící srdeční či renální dysfunkcí.
• Estriol je slabý gonadotropní inhibitor bez jiných významných účinků na endokrinní systém.
• Užíváním HRT nedochází ke zlepšení kognitivních funkcí. Existují určité údaje týkající se zvýšeného rizika pravděpodobné demence u žen, které začínají užívat kontinuální kombinovanou HRT nebo HRT obsahující samotný estrogen ve věku vyšším než 65 let.
• Ovestin není určen pro použití jako kontraceptivum.
• Ovestin krém obsahuje cetylalkohol a stearylalkohol. Tyto látky mohou vyvolat reakce lokálního podráždění (např. kontaktní dermatitidu).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Z klinické praxe nejsou známy žádné případy interakcí mezi přípravkem Ovestin a jinými léčivými přípravky. Ačkoli údaje jsou omezené, interakce mezi přípravkem Ovestin a jinými léčivými přípravky se mohou objevit. Následující interakce byly popsány při používání kombinovaných perorálních kontraceptiv, které mohou být také relevantní pro přípravek Ovestin.
Metabolismus estrogenů se může zvýšit, pokud jsou souběžně podávány látky, o nichž je známo, že indukují aktivitu enzymů metabolizujících léky, konkrétně enzymů patřících do skupiny cytochromu P450, jako jsou např. antikonvulziva (např. fenobarbital, fenytoin, karbamazepin) a přípravky proti infekcím (např. rifampicin, rifabutin, nevirapin, efavirenz).
Ačkoliv je známo, že ritonavir a nelfinavir působí jako silné inhibitory, vykazují naopak silné indukující vlastnosti, pokud jsou používány souběžně se steroidními hormony.
Bylinné přípravky obsahující třezalku tečkovanou (Hypericumperforatum) mohou indukovat metabolismus estrogenů.
Klinicky může zvýšený metabolismus estrogenů vést ke sníženému účinku a ke změnám profilu děložního krvácení.
4.6 Fertilita, těhotenství a kojení
Fertilita
Přípravek Ovestin je určen pouze k léčbě žen po menopauze (přirozené nebo vyvolané chirurgicky). Těhotenství
Přípravek Ovestin není indikován během těhotenství. Pokud žena otěhotní během léčby přípravkem Ovestin, je třeba léčbu neprodleně ukončit. Výsledky většiny doposud provedených epidemiologických studií relevantních pro neúmyslné vystavení plodu účinkům estrogenů neprokázaly žádné teratogenní ani fetotoxické účinky.
Kojení
Přípravek Ovestin není indikován během kojení. Estriol je vylučován do mateřského mléka a může snížit jeho tvorbu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nejsou k dispozici žádné údaje, které by naznačovaly, že má přípravek Ovestin vliv na schopnost pacientky řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Z literatury a sledování bezpečnosti byly hlášeny následující nežádoucí účinky:
|
Třídy orgánových systémů |
Nežádoucí účinky |
|
Poruchy metabolismu a výživy |
Retence tekutin |
|
Gastrointestinální poruchy | |
|
Poruchy reprodukčního systému a prsu |
Diskomfort a bolest prsu Postmenopauzální špinění Cervikální výtok |
|
Celkové poruchy a reakce v místě aplikace |
Podráždění a svědění v místě aplikace Příznaky podobné chřipce |
Tyto nežádoucí účinky j sou zpravidla přechodné, ale mohou být také ukazatelem příliš vysokých
dávek.
Ostatní nežádoucí účinky byly hlášeny v souvislosti s estrogen-gestagenní léčbou.
• Benigní a maligní estrogenně podmíněné novotvary, např. karcinom endometria. Další informace viz body „4.3 Kontraindikace“ a „4.4 Zvláštní upozornění a opatření pro použití“.
• Onemocnění žlučníku
• Kožní a subkutánní onemocnění: chloasma, erythema multiforme, erythema nodosum, vaskulární purpura
• Možná demence u osob starších 65 let (viz bod 4.4)
Riziko karcinomu prsu
- U žen užívajících kombinovanou léčbu estrogenem a gestagenem po dobu přesahující 5 let bylo hlášeno až dvojnásobně zvýšené riziko diagnózy karcinomu prsu.
- Jakékoliv zvýšení rizika u žen léčených samotným estrogenem je výrazně nižší než riziko pozorované u pacientek užívajících kombinace estrogen-gestagen.
- Míra rizika závisí na délce užívání (viz bod 4.4).
- Dále jsou uvedeny výsledky největší epidemiologické studie (MWS) a největšího randomizovaného, placebem kontrolovaného hodnocení (studie WHI)
Studie MWS (Million Women Study) - Odhad dodatečného rizika vzniku karcinomu prsu po pětiletém užívání____
|
Věkové rozmezí (roky) |
Případy na 1000 žen, které HRT nikdy neužívaly víc než 5 let* |
Poměr rizika# |
Další případy na 1000 žen, které užívaly HRT víc než 5 let (95% CI) |
|
HRT obsahující samotný estrogen | |||
|
50-65 |
9-12 |
1,2 |
1-2 (0-3) |
|
Kombinace estrogen-gestagen | |||
|
50-65 |
9-12 |
1,7 |
6 (5-7) |
# Celkový poměr rizika. Poměr rizika není konstantní, ale bude se zvyšovat s prodlužující se dobou užívání.
* Odvozeno ze základní incidence karcinomu prsu v rozvinutých zemích.
|
Věkové rozmezí (roky) |
Incidence na 1000 žen ve skupině užívající placebo víc než 5 let |
Poměr rizika a 95% CI |
Další případy na 1000 žen, které užívaly HRT víc než 5 let (95% CI) |
|
Samotné estrogeny (CEE) | |||
|
50-79 |
21 |
0,8 (0,7-1,0) |
-4 (-6 - 0)* |
|
Estrogen + gestagen (CEE+MPA) J | |||
|
50-79 |
17 |
1,2 (1,0—1,5) |
+4 (0-9) |
{ Když se analýza omezila na ženy, které před vstupem do studie neužívaly HRT, nebylo patrné žádné zvýšení rizika v průběhu prvních 5 let léčby, po 5 letech bylo riziko vyšší než u žen, které HRT neužívaly.
*WHI u žen bez dělohy, která neprokázala zvýšení rizika karcinomu prsu
Karcinom ovarií
Dlouhodobé užívání HRT obsahující samotný estrogen a kombinaci estrogen-gestagen je spojováno s mírně zvýšeným rizikem karcinomu ovarií. Pětiletá léčba HRT ve studii Million Women měla za následek 1 dodatečný případ na 2500 uživatelek.
Riziko žilního tromboembolismu
HRT je spojována s 1,3-3násobně zvýšeným relativním rizikem vzniku žilního tromboembolismu (VTE), tj. trombózy hlubokých žil nebo plicní embolie. Výskyt takové příhody je pravděpodobnější v prvním roce užívání HRT (viz bod 4.4). Výsledky studií WHI jsou uvedeny v následující tabulce:
Studie WHI - Dodatečné riziko VTE po pětiletém^užívání
|
Věkové rozmezí (roky) |
Incidence na 1000 žen ve skupině užívající placebo víc než 5 let |
Poměr rizika a 95% CI |
Další případy na 1000 žen, které užívaly HRT |
|
Samotný perorální estrogen* | |||
|
50-59 |
7 |
1,2 (0,6-2,4) |
1 (-3 - 10) |
|
Perorální kombinace estrogen-gestagen | |||
|
50-59 |
4 |
2,3 (1,2-4,3) |
5 (1 - 13) |
* Studie u žen bez dělohy
Riziko ischemické choroby srdeční
Riziko vzniku ischemické choroby srdeční u žen ve věku nad 60 let užívajících HRT obsahující kombinaci estrogen-gestagen se mírně zvyšuje (viz bod 4.4).
Riziko ischemické cévní mozkové příhody
Léčba samotným estrogenem a kombinací estrogen-gestagen je spojována až s 1,5násobným zvýšením relativního rizika vzniku ischemické mozkové příhody. Riziko hemoragické mozkové příhody se během léčby HRT nezvyšuje.
Toto relativní riziko nezávisí na věku ani na délce užívání, ale protože vstupní riziko do značné míry na věku závisí, bude se celkové riziko vzniku mozkové příhody u žen užívajících HRT s přibývajícím věkem zvyšovat, viz bod 4.4.
Studie WHI - Dodatečné riziko vzniku ischemické cévní mozkové příhody* ^ při pětiletém užívání
|
Věkové rozmezí (roky) |
Incidence na 1000 žen ve skupině užívající placebo víc než 5 let |
Poměr rizika a 95% CI |
Další případy na 1000 žen, které užívaly HRT víc než 5 let |
|
50-59 |
8 |
1,3 (1,1-1,6) |
3 (1-5) |
■ Bez rozlišení mezi ischemickou a hemoragickou mozkovou příhodou.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48
100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Akutní toxicita estriolu u zvířat je velmi nízká. Předávkování přípravkem Ovestin po vaginální aplikaci je nepravděpodobné. Avšak v případech, kdy je požito velké množství, se může u žen vyskytnout nauzea, zvracení a krvácení z vysazení. Není známo žádné specifické antidotum. V případě potřeby je možno zahájit symptomatickou léčbu.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: přírozené a semisyntetické estrogeny ATC skupina: G03CA04
Mechanismus účinku
Ovestin obsahuje přirozený ženský hormon estriol. Na rozdíl od jiných estrogenů působí estriol krátkodobě, což je způsobeno krátkým retenčním časem v jádrech endometriálních buněk. Nahrazuje sníženou produkci estrogenu u žen v menopauze a zmírňuje menopauzální příznaky. Estriol je účinný zvláště při léčbě urogenitálních příznaků. Při atrofii dolní části urogenitálního traktu navozuje estriol normalizaci urogenitálního epitelu a usnadňuje obnovu normální mikroflóry a fyziologického pH ve vagíně. V důsledku toho zvyšuje odolnost buněk urogenitálního epitelu vůči infekci a zánětu a tím zmírňuje potíže, jako je dyspareunie, suchost, svědění, vaginální a močové infekce, potíže s močením a mírná inkontinence moči.
Informace z klinických hodnocení
• Zmírnění klimakterických příznaků bylo dosaženo během několika prvních týdnů léčby.
• Vaginální krvácení po léčbě přípravkem Ovestin bylo hlášeno vzácně.
5.2 Farmakokinetické vlastnosti
Absorpce
Intravaginální aplikace estriolu zajišťuje optimální dostupnost v místě působení. Estriol je rovněž absorbován do krevního oběhu, jak ukazuje náhlý vzestup plazmatické hladiny nekonjugovaného estriolu.
Distribuce
Maximální plazmatické hladiny je dosaženo za 1-2 hodiny po podání. Po vaginálním podání 0,5 mg estriolu je Cmax přibližně 100 pg/ml, Cmin přibližně 25 pg/ml a Caverage přibližně 70 pg/ml. Po 3 týdnech denního podávání 0,5 mg vaginálního estriolu, Caverage se sníží na 40 pg/ml..
Biotransformace
Téměř všechen estriol (90 %) je vázán na albumin v plazmě a na rozdíl od jiných estrogenů se téměř neváže na globulin vázající pohlavní hormony. Metabolismus estriolu spočívá především v konjugaci a dekonjugaci během enterohepatálního oběhu.
Eliminace
Estriol jako výsledný produkt metabolismu je vylučován především močí v konjugované formě. Pouze jeho malá část (± 2 %) je vylučována stolicí, zejména ve formě nekonjugovaného estriolu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Žádné zvláštní údaje.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Oktyldodekanol, umělá vorvaňovina, glycerol 85%, cetylalkohol, stearylalkohol, polysorbát 60, sorbitan-stearát, kyselina mléčná, chlorhexidin-dihydrochlorid, hydroxid sodný, čištěná voda
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě 2-25°C, v původním obalu, aby byl přípravek chráněn před vlhkostí. Chraňte před mrazem.
6.5 Druh obalu a obsah balení
Hliníková tuba s plastickým uzávěrem, plastický aplikátor, krabička.
Velikost balení:
15 g + aplikátor 50 g + aplikátor
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek, aplikátor nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Aspen Pharma Trading Limited 3016 Lake Drive Citywest Business Campus Dublin 24 Irsko
8. REGISTRAČNÍ ČÍSLO
54/280/91-C
9. DATUM PRVNÍ REGISTRACE /PRODLOUŽENÍ REGISTRACE
Datum první registrace: 28. srpna 1991
Datum posledního prodloužení registrace: 20. června 2007
10. DATUM REVIZE TEXTU
27.7.2016
10