Octanine F 500
sp. zn. sukls199219/2015
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
OCTANINE F 500 OCTANINE F 1000
Prášek a rozpouštědlo pro injekční roztok Lidský koagulační faktor IX
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře.Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. (Viz bod 4.)
Co naleznete v této příbalové informaci:
1. Co je přípravek OCTANINE F a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek OCTANINE F používat
3. Jak se přípravek OCTANINE F používá
4. Možné nežádoucí účinky
5 Jak přípravek OCTANINE F uchovávat
6. Obsah balení a další informace
1. CO JE PŘÍPRAVEK OCTANINE F A K ČEMU SE POUŽÍVÁ
OCTANINE F patří do skupiny léků zvaných koagulční faktory a obsahuje lidský koagulační faktor IX. To je speciální protein odpovědný za srážlivost krve.
OCTANINE F se používá k léčbě a prevenci krvácení u pacientů s poruchou krvácení (hemofilie B). To je zdravotní stav, kdy krvácení trvá déle, než se předpokládá. Porucha je způsobena vrozeným nedostatkem koagulačního faktoru IX v krvi.
OCTANINE F je dodáván jako prášek s rozpouštědlem pro přípravu injekčního roztoku. Po rozpuštění se podává intravenózně (injekcí do žíly).
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE PŘÍPRAVEK OCTANINE F POUŽÍVAT
Nepoužívejte přípravek OCTANINE F:
• jestliže jste alergický na lidský koagulační faktor IX nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
• jestliže trpíte heparinem vyvolanou trombocytopenií typu II, což je snížení počtu krevních destiček po podání heparinu. Krevní destičky jsou buňky v krvi, které pomáhají zastavit krvácení. Heparin je lék, který se používá jako prevence vzniku krevních sraženin
Upozornění a opatření:
Před užitím přípravku OCTANINE F se poraďte se svým lékařem nebo lékárníkem.
• Jako u každého léčivého přípravku, který obsahuje proteiny a je podáván intravenózně, mohou se i zde vyskytnout reakce z přecitlivělosti alergického typu. OCTANINE F obsahuje velmi malé množství lidských proteinů jiných než faktor IX a heparin.
Časné příznaky reakce přecitlivělosti zahrnují:
- vyrážku
- kopřivku
- pocit tíhy na prsou
- sípot
- nízký krevní tlak
- akutní, závážnou alergickou reakci (anafylaxi, pokud se jakýkoliv nebo všechny výše uvedené
příznaky objeví rychle a prudce).
Pokud se takovéto příznaky objeví, zastavte ihned injekci a kontaktujte svého lékaře.
V případě anafylaktického šoku musí lékař zahájit doporučenou léčbu okamžitě.
• Pokud pravidelně nebo opakovaně používáte přípravky s faktorem IX vyrobeným z lidské plazmy, může vám váš lékař doporučit očkování proti hepatitidě A a B.
• Je známé, že u jedinců trpících hemofilií B se mohou vytvořit inhibitory (neutralizující protilátky) proti faktoru IX., které jsou produkovány imunitním systémem. Inhibitory mohou zvyšovat riziko anafylaktického šoku (vážná alergická reakce). Z tohoto důvodu, pokud trpíte alergickými reakcemi, měli byste být vyšetřeni na přítomnost inhibitorů. Pacienti s inhibitorem na faktor IX jsou vystaveni většímu riziku anafylaxe, pokud jsou léčeni faktorem IX. Proto může váš lékař rozhodnout o podání první injekce faktoru IX pod lékařským dohledem, aby v případě alergické reakce mohla být poskytnuta potřebná péče.
• Koncentráty obsahující faktor IX mohou způsobit ucpávání vašich cév krevní sraženinou. Vzhledem k tomuto riziku, které je větší u méně čištěných přípravků, byste měli být sledováni na příznaky tvorby krevních sraženin po podání přípravku s faktorem IX, jestliže:
- máte příznaky fibrinolýzy (rozpad krevní sraženiny)
- trpíte diseminovanou intravaskulární koagulací (tvorba krevních sraženin rozšířená do cév)
- máte diagnostikované onemocnění jater
- je ve vašem případě doložena existence rizikových faktorů pro vznik kardiovaskulárních onemocnění
- prodělali jste nedávno operaci
- je u vás vyšší riziko tvorby krevních sraženin nebo diseminované intravaskulární koagulace
• Pokud jsou ve vašem případě splněny jakékoliv z výše uvedených podmínek, váš lékař vám podá OCTANINE F pouze v tom případě, když přínos jeho podání převáží rizika s tím spojená.
• Při opakované léčbě přípravky lidského koagulačního faktoru IX by pacienti měli být sledováni na přítomnost neutralizujících protilátek (inhibitorů), které jsou kvantifikovány v Bethesda jednotkách (BU) za použití příslušného biologického vyšetření.
Virová bezpečnost krevních derivátů
Při výrobě léčivých přípravků z lidské krve nebo plazmy jsou dodržována opatření zabraňující přenosu infekce na pacienty. Patří sem pečlivý výběr dárců krve a plazmy, který vylučuje možný přenos infekčních onemocnění, a testování každého odběru a poolu plazmy na přítomnost virů. Výrobci těchto přípravků rovněž zařazují do zpracování krve nebo plazmy určité kroky, při nichž jsou viry inaktivovány nebo odstraněny. Přes všechna tato opatření při podání léků vyráběných z lidské krve nebo plazmy nelze možnost přenosu infekce zcela vyloučit. To platí i pro jakékoli neznámé nebo vznikající viry či jiné typy infekcí.
Přijatá opatření jsou považována za účinná u obalených virů, jako je virus lidské imunodeficience (HIV), virus hepatitidy typu B a virus hepatitidy typu C a neobaleného viru hepatitidy typu A. Omezený účinek mají tato opatření u neobalených virů, jako je parvovirus B19. Infekce parvovirem B19 může být závažná zejména pro těhotné ženy (fetální infekce) a pro jedince se sníženou funkcí imunitního systému nebo s anémií určitého typu (například srpkovitá nebo hemolytická anémie).
Při aplikaci každé dávky přípravku OCTANINE F se důrazně doporučuje zaznamenat název a číslo šarže přípravku, aby bylo možné zpětně zjistit údaje o použité šarži.
Děti
Při podívíní přípravku OCTANINE F novorozencům musí být děti pozorně sledovány, zda u nich nedochází k diseminované intravaskulární koagulaci.
Další léčivé přípravky a přípravek OCTANINE F
• Dosud nejsou známy interakce přípravků obsahujících lidský koagulační faktor IX s jinými léčivými přípravky.
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a), a to i o lécích, které jsou dostupné bez lékařského předpisu.
Těhotenství a kojení
Nejsou žádné zkušenosti s podáváním faktoru IX během těhotenství a kojení. Proto by měl být faktor IX během těhotenství a kojení podáván pouze tehdy, je-li to nezbytné.
Poraďte se se svým lékařem nebo lékárníkem dříve, než začnete užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
Nebyly pozorovány účinky na schopnost řídit nebo obsluhovat stroje.
3. JAK SE PŘÍPRAVEK OCTANINE F POUŽÍVÁ
Používejte tento přípravek vždy přesně tak, jak vám váš lékař řekne. Pokud si něčím nejste jisti, měli byste se vždy zeptat svého lékaře nebo lékárníka.
OCTANINE F by měl být podáván intravenózně (injekcí do žíly) poté, co byl rekonstituován pomocí přiloženého rozpouštědla.
Používejte pouze přiloženou injekční soupravu. Použití jiného injekčního/infuzního vybavení může způsobit dodatečné riziko nebo selhání léčby.
Léčba by měla být zahájena pod dohledem lékaře se zkušenostmi s léčbou hemofilie. Jaké množství OCTANINE F byste měli použít a jak dlouho by substituční terapie měla trvat závisí na závažnosti vašeho nedostatku faktoru IX. Také to závisí na místě a míře krvácení a na vaší klinické situaci.
Výpočet dávkování:
Váš lékař vám sdělí, jak často a jaké množství OCTANINE F potřebujete.
Dávkování faktoru IX je vyjádřeno v mezinárodních jednotkách (IU). Aktivita faktoru IX v plazmě odkazuje na množství faktoru IX přítomného v plazmě. Je vyjádřena buď v procentech (vzhledem k normální lidské plazmě) nebo v mezinárodních jednotkách (vzhledem k mezinárodnímu standardu faktoru IX v plazmě).
Jedna mezinárodní jednotka (IU) aktivity faktoru IX je ekvivalent množství faktoru IX v l ml normální lidské plazmy. Výpočet požadované dávky faktoru IX je založen na zkušenosti, že aplikace l IU faktoru IX na kg tělesné hmotnosti zvýší aktivitu faktoru IX v plazmě o l%
normální hodnoty. Pro výpočet dávky, kterou potřebujete, je nutné změřit hladinu aktivity faktoru IX ve vaší plazmě. Toto měření ukáže, jak je potřeba aktivitu zvýšit.
Pro výpočet požadované dávky lze použít následující vzorec:
Požadovaná dávka = tělesná hmotnost (kg) x požadovaný vzestup faktoru IX (%)(IU/dl) x _0,8_
Dávka a četnost podávání budou záviset na odpovědi vašeho organismu na léčbu a rozhoduje o nich váš lékař. Přípravky obsahující faktor IX zřídka vyžadují podávání vícekrát než jednou denně.
Vaše reakce na přípravky obsahující faktor IX může být různá. Z tohoto důvodu by měla být hladina vašeho faktoru IX během léčby měřena, aby mohlo být vypočteno správné dávkování a frekvence infuzí. Zvláště v případě operace provede váš lékař vyšetření (na aktivitu faktoru IX), aby mohla být substituční terapie přesně monitorována.
Prevence krvácení:
Pokud trpíte těžkou hemofilií B, měli byste užívat 20 - 40 IU faktoru IX na kg tělesné hmotnosti. Pro dlouhodobou prevenci byste měli tuto dávku podávat dvakrát týdně. Vaše dávkování by mělo být přizpůsobeno reakci vašeho organismu. V některých případech, zvláště u mladších pacientů, mohou být nutné kratší intervaly mezi podáváním nebo větší dávky.
Použití u dětí:
Ve studii prováděné u dětí ve věku do 6 let byla střední dávka podávaná v jednom expozičním dnu 40 IU/kg tělesné hmotnosti.
Co dělat, pokud se vaše krvácení z důvodů výskytu inhibitorů nezastaví:
Pokud se po injekci nedosáhne očekávané aktivity faktoru IX nebo pokud se krvácení nezastaví po podání předepsané dávky, měli byste informovat svého lékaře. Ten provede vyšetření vaší krevní plazmy a zjistí, zda se u vás nevytvořily inhibitory (protilátky) proti faktoru IX. Tyto inhibitory mohou snižovat aktivitu faktoru IX. V takovém případě by měly být zváženy jiné možnosti léčby. Váš lékař s vámi tuto situaci prodiskutuje a v případě potřeby doporučí jinou léčbu.
Pokud použijete více OCTANINE F než byste měli
Žádné příznaky předávkování lidským koagulačním faktorem IX nebyly hlášeny. Přesto by nemělo být překročeno doporučené dávkování.
„Návod na domácí léčbu“ je uveden na krabičce s příslušenstvím.
4. MOŽNÉ NEŽÁDOUCÍ ÚČINKY
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se však nemusí vyskytnout u každého.
• Přecitlivělost nebo alergické reakce se objevily zřídka u pacientů léčených přípravky obsahujícími faktor IX. Zahrnovaly:
- bezděčné stahy krevních cév (spasma) s otokem obličeje, úst a hrdla
- pálení a bodání v místě infuze
- mrazení
- návaly krve
- kopřivka
- bolest hlavy
- vyrážka
- nízký krevní tlak
- únava
- pocit nemoci
- neklid
- rychlé bušení srdce
- pocit tíhy na prsou
- pocit bodání
- zvracení
- sípot
V některých případech mohou tyto alergické reakce vyústit do závážné reakce zvané anafylaxe, jejíž součástí může být šok. Tyto reakce jsou většinou spojené s tvorbou inhibitorů proti faktoru IX. Pokud trpíte některým z výše uvedených příznaků, informujte prosím svého lékaře.
• Pokud trpíte hemofilií B, můžou se u vás vytvořit neutralizující protilátky (inhibitory) proti faktoru IX. Tyto protilátky mohou způsobit, že váš lék nebude účinkovat správně.
Váš lékař s vámi tuto situaci prodiskutuje a v případě potřeby doporučí jinou léčbu.
Ve studii prováděné s 25 dětmi s hemofilií B, kde 6 pacientů bylo dříve neléčených, se během studie nevyskytl žádný inhibitor. Tolerabilita všech injekcí byla hodnocena jako „velmi dobrá“ nebo „dobrá“.
• U některých pacientů s hemofilií B s inhibitorem faktoru IX, kteří jsou léčeni imunotoleranční terapií a mají již historii alergických reakcí, se může rozvinout nefrotický syndrom (závažná porucha ledvin).
• Ve vzácných případech se může objevit horečka.
• Přípravky obsahující málo čištěný faktor IX mohou ve vzácných případech vyvolat tvorbu krevní sraženiny rozšířenou do cév. To může vést k některé z následujících komplikací:
- srdeční záchvat
- tvorba krevních sraženin rozšířená do cév (diseminovaná intravaskulární koagulace)
- krevní sraženiny v cévách (cévní trombóza)
- krevní sraženiny v plicích (plicní embolie)
Tyto nežádoucí účinky jsou častější, pokud používáte přípravky s méně čištěným faktorem IX a pouze velmi vzácně při použití přípravků s obsahem vysoce čištěného faktoru IX jako je OCTANINE F.
• Heparin obsažený v přípravku může způsobit náhlé snížení počtu kreních destiček na hodnoty pod 100.000 na mikrolitr nebo na méně než 50% výchozí hodnoty. Tato alergická reakce se nazývá „heparinem indukovaná trombocytopenie typu II“. Ve vzácných případech dochází u pacientů, kteří původně nebyli alergičtí na heparin, ke snížení počtu trombocytů za 6 až l4 dnů od počátku léčby. U pacientů na heparin již alergických může dojít ke snížení počtu trombocytů během několika hodin od počátku léčby.. Toto závažné snížení trombocytů může být doprovázeno nebo může vyvolat:
- krevní sraženiny v tepnách nebo žilách
- ucpávání cév sraženinou původem z jiné oblasti
- vážnou poruchu srážlivosti zvanou konsumptivní koagulopatie
- kožní gangrénu v oblasti aplikace injekce
- krvácení „jako po pokousání blechou“
- purpuru
- dehtovitou stolici
i> N
Pokud se u vás objeví tyto alergické reakce, okamžitě zastavte injekci OCTANINE F a budoucnu nepoužívejte přípravky obsahující heparin.
důvodu tohoto vzácného účinku na krevní destičky by měl váš lékař zejména na počátku léčby pozorně sledovat počet krevních destiček.
Bezpečnost v souvislosti s přenosnými agens, viz bod 2 (věnujte zvláštní pozornost s přípravkem OCTANINE F).
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete nahlásit také přímo na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. JAK OCTANINE F UCHOVÁVAT
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Uchovávejte při teplotě nepřesahující 25°C.
Nezmrazujte.
Uchovávejte lahvičku v krabičce, aby byl přípravek chráněn před světlem.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti, která je vyznačena na obalu (měsíc/rok). Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Chemická a fyzikální stabilita po rekonstituci byla vykazována po dobu 72 hodin při 25°C.
Z mikrobiologického pohledu by přípravek měl být spotřebován okamžitě. Pokud není okamžitě spotřebován, skladovací doba a podmínky skladování před použitím jsou v zodpovědnosti uživatele, doba by běžně neměla být delší než 24 hodin při 2-8°C, pokud není rekonstituce/rozředění prováděna v kontrolovaném a validovaném aseptickém prostředí.
Použijte OCTANINE F během jednoho podání. Nepoužívejte zakalené nebo neúplně rozpuštěné roztoky.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí
6. OBSAH BALENÍ A DALŠÍ INFORMACE
Co přípravek OCTANINE F obsahuje Léčivou látkou je factor IX coagulationis humanus.
Dalšími látkami jsou heparin, chlorid sodný, dihydrát natrium-citrátu, arginin-hydrochlorid a lysin-hydrochlorid.
Tento léčivý přípravek obsahuje až 69 mg sodíku v jedné lahvičce OCTANINE F 500 a až 138 mg sodíku v jedné lahvičce OCTANINE F 1000. To je třeba vzít v úvahu u pacientů na kontrolované sodíkové dietě.
Jak OCTANINE F vypadá a co obsahuje toto balení
OCTANINE F je dodáváno ve dvou následujících sílách:
• OCTANINE F 500 je dodáván jako prášek pro přípravu injekčního roztoku s rozpouštědlem obsahující nominálně 500 IU lidského koagulačního faktoru IX v jedné lahvičce.
Přípravek po rekonstituci s 5 ml vody na injekci obsahuje přibližně 100 IU/ml faktoru IX
• OCTANINE F 1000 je dodáván jako prášek pro přípravu injekčního roztoku s rozpouštědlem obsahující nominálně 1000 IU lidského koagulačního faktoru IX v jedné lahvičce.
Přípravek po rekonstituci s 10 ml vody na injekci obsahuje přibližně l00 IU/ml faktoru IX
OCTANINE F je vyroben z plazmy lidských dárců.
Síla (IU) je určena jednostupňovým koagulačním testem dle Evropského lékopisu v porovnání s mezinárodním standardem Světové zdravotnické organizace (WHO). Specifická aktivita OCTANINE F je přibližně 100 IU/mg proteinu.
Popis balení:
OCTANINE F je dodáván jako kombinované balení sestávající ze dvou krabiček spojených plastikovým páskem.
Jedna krabička obsahuje 1 lahvičku s práškem pro přípravu injekčního roztoku a příbalovou informaci.
Druhá krabička obsahuje lahvičku s rozpouštědlem (voda na injekci), 5 ml pro OCTANINE F 500 a 10 ml pro OCTANINE F 1000.
Tato krabička také obsahuje následující příslušenství: jednorázová injekční stříkačka přepouštěcí set Mix2VialTM
1 infuzní set (motýlek)
2 desinfekční alkoholové tampony
Držitel rozhodnutí o registraci
Octapharma (IP) Limited The Zenith Building 26 Spring Gardens Manchester M2 1AB Velká Británie
Pro jakékoliv informace o tomto léku kontaktujte prosím místní obchodní zastoupení Držitele rozhodnutí o registraci:
Výrobce: Octapharma Pharmazeutika Produktionges. m. b. H.
Oberlaaer Strasse 235 A-1100 Vídeň Rakousko
nebo:
Octapharma S.A.S.
70-72 Rue du Maréchal Foch F-67380 Lingolsheim Francie
Tato příbalová informace byla naposledy revidována: 02/2016
_Návod k domácí léčbě_
• Čtěte prosím pozorně všechny pokyny a postupujte podle nich!
• Nepoužívejte Octanine F po uplynutí exspirační doby vyznačené na obalu.
• Během níže uvedeného postupu musí být zachována sterilita!
• Roztok ve stříkačce by měl být čirý nebo slabě perleťově lesklý. Nepoužívejte zakalené roztoky nebo roztoky s usazeninami.
• Použijte připravený roztok okamžitě, aby se předešlo mikrobiální kontaminaci.
• Používejte pouze přiložený injekční set. Použití jiného injekčního/infuzního zařízení
může způsobit dodatečné riziko a selhání léčby._
Návod na přípravu roztoku:
1. Nepoužívejte přípravek ihned po vyjmutí z chladničky. Nechejte rozpouštědlo i prášek v uzavřených lahvičkách dosáhnout pokojové teploty.
2. Odstraňte víčko z obou lahviček a očistěte pryžové zátky jedním z přiložených alkoholových tamponů.
3. Zařízení Mix2VialTM je popsáno na obr. 1. Položte lahvičku s rozpouštědlem na rovný povrch a pevně ji držte. Vezměte Mix2VialTM , otočte jej horní stranou dolů. Nasaďte Mix2VialTM jeho modrým koncem na horní část lahvičky s rozpouštědlem a
silně jej zatlačte dolů, dokud lahvičku nepropíchnete (obr. 2 + 3).
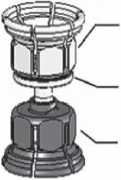
powder
adapter
(transparent)
integrated
fiíter
solvent
adapter
(blue)
Fig. i
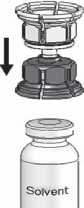


Fig. 3
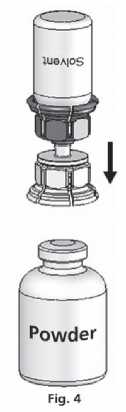
4. Položte lahvičku s práškem na pevný povrch a pevně jí držte. Vezměte lahvičku s rozpouštědlem s připojeným Mix2VialTM a otočte ji dnem vzhůru. Nasaďte ji průhledným koncem na horní část lahvičky s práškem a silně zatlačte dolů dokud lahvičku nepropíchnete (obr. 4). Rozpouštědlo přeteče samo do lahvičky s práškem.
5. Zlehka otáčejte se spojenými lahvičkami, dokud se přípravek nerozpustí.

Rozpouštění je dokončeno při pokojové teplotě během méně než 10 minut. Během přípravy se může objevit jemné napěnění. Rozšroubujte Mix2Vial™ na dvě části (obr. 5). Napěnění zmizí.
Odstraňte prázdnou lahvičku od rozpouštědla spolu s modrou částí Mix2Vial™.
Návod na injekci:
Z důvodu opatrnosti by vám měl být měřen puls před a během injekce. Pokud se vyskytne výrazné zvýšení vašeho pulsu, zpomalte rychlost injekce nebo podávání na krátký čas přerušte.
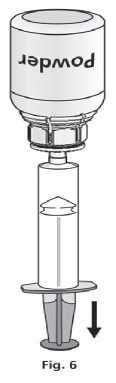
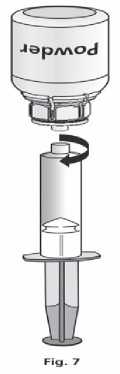
1. Nasaďte injekční stříkačku na průhlednou část Mix2Vial™. Otočte lahvičku dnem vzhůru a nasajte roztok do stříkačky (obr. 6).
Roztok ve stříkačce by měl být čirý nebo slabě perleťově lesklý.
Jakmile je roztok převeden do stříkačky, pevně stříkačku uchopte a oddělte ji od Mix2Vial™ (obr. 7).
Odstraňte Mix2Vial™ spolu s prázdnou lahvičkou.
2. Vydesinfikujte zamýšlené místo aplikace injekce přiloženým alkoholovým tamponem.
3. Nasaďte přiloženou injekční jehlu na stříkačku.
4. Zaveďte injekční jehlu do zvolené žíly. Pokud používáte turniket pro snadnější viditelnost žíly, tento turniket by měl být odstraněn před zahájením injekce Octanine F.
Do stříkačky se nesmí dostat žádná krev, aby nedošlo k riziku tvorby fibrinových sraženin.
5. Vstřikujte roztok pomalu do žíly, rychlost by neměla být větší než 2-3 ml za minutu.
Pokud užíváte více než jednu lahvičku Octanine F pro jednu léčbu, můžete použít znovu stejnou injekční j ehlu a stříkačku. Mix2Vial™ j e však vždy pouze pro jednou použití.
9