Numeta G16%E
sp.zn.sukls42655/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
V Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Numeta G16% E, infuzní emulze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Tento léčivý přípravek se dodává ve formě tříkomorového vaku. Každý vak obsahuje sterilní apyrogenní kombinaci roztoku glukózy, roztoku aminokyselin vhodných pro pediatrické použití s elektrolyty a lipidovou emulzi, jak je popsáno níže:
|
Velikost balení |
50% roztok glukózy |
5,9% roztok aminokyselin a elektrolytů |
12,5% lipidová emulze |
|
500 ml |
155 ml |
221 ml |
124 ml |
Pokud je nežádoucí podávání lipidů, konstrukce vaku umožňuje aktivovat protržením pouze těsnící švy mezi komorami aminokyselin/elektrolytů a glukózy bez protržení těsnících švů mezi komorou aminokyselin a lipidů, které zůstanou intaktní. Obsah vaku lze následně infundovat s /nebo bez lipidů. Složení léčivého přípravku, po smíchání dvou (aminokyseliny a glukóza, aktivovány 2 komory vaku, 376 ml roztoku) nebo tří (aminokyseliny, glukóza a lipidy, aktivovány 3 komory vaku, 500 ml emulze) komor, je uvedeno v následující tabulce.
|
Složení | ||
|
Léčivá látka |
Aktivován 2KV |
Aktivován 3KV |
|
(376 ml) |
(500 ml) | |
|
Komora s aminokyselinami | ||
|
alaninum |
1,03 g |
1,03 g |
|
argininum |
1,08 g |
1,08 g |
|
acidum asparticum |
0,77 g |
0,77 g |
|
cysteinům |
0,24 g |
0,24 g |
|
acidum glutamicum |
1,29 g |
1,29 g |
|
glycinum |
0,51 g |
0,51 g |
|
histidinum |
0,49 g |
0,49 g |
|
isoleucinum |
0,86 g |
0,86 g |
|
leucinum |
1,29 g |
1,29 g |
|
lysinum monohydricum |
1,59 g |
1,59 g |
|
(ekvivalentní lysinum) |
(1,42 g) |
(1,42 g) |
|
methioninum |
0,31 g |
0,31 g |
|
ornithini hydrochloridum |
0,41 g |
0,41 g |
|
(ekvivalentní ornithinum) |
(0,32 g) |
(0,32 g) |
|
phenylalaninum |
0,54 g |
0,54 g |
|
prolinum |
0,39 g |
0,39 g |
|
serinum |
0,51 g |
0,51 g |
|
taurinum |
0,08 g |
0,08 g |
|
threoninum |
0,48 g |
0,48 g |
|
tryptophanum |
0,26 g |
0,26 g |
|
tyrosinum |
0,10 g |
0,10 g |
|
valinum |
0,98 g |
0,98 g |
|
natrii chloridum |
0,30 g |
0,30 g |
|
kalii acetas |
1,12 g |
1,12 g |
|
calcii chloridum dihydricum |
0,46 g |
0,46 g |
|
magnesii acetas tetrahydricus |
0,33 g |
0,33 g |
|
natrii glycerophosphas hydricus |
0,98 g |
0,98 g |
|
Komora s glukózou | ||
|
glucosum monohydricum |
85,25 g |
85,25 g |
|
(ekvivalentní glucosum) |
(77,50 g) |
(77,50 g) |
|
Komora s lipidy | ||
|
olivae oleum raffinatum (cca 80 %) + sojae oleum raffinatum (cca 20 %) |
- |
15,5 g |
2KV= 2komorový vak, 3KV= 3komorový vak Úplný seznam pomocných látek viz bod 6.1. Rekonstituovaný roztok/emulze obsahuje následující složky:
|
Složení | ||||
|
Aktivován 2KV |
Aktivován 3KV | |||
|
V objemových jednotkách (ml) |
376 |
100 |
500 |
100 |
|
Dusík (g) |
2,0 |
0,52 |
2,0 |
0,39 |
|
Aminokyseliny (g) |
13,0 |
3,5 |
13,0 |
2,6 |
|
Glukóza (g) |
77,5 |
20,6 |
77,5 |
15,5 |
|
Lipidy (g) Energie |
0 |
0 |
15,5 |
3,1 |
|
Celkové kalorie (kcal) |
362 |
96 |
517 |
103 |
|
Neproteinové kalorie (kcal) |
310 |
82 |
465 |
93 |
|
Kalorie - glukóza (kcal) |
310 |
82 |
310 |
62 |
|
Kalorie - lipidy (kcal) a |
0 |
0 |
155 |
31 |
|
Neproteinové kalorie / dusík (kcal/g N) |
158 |
158 |
237 |
237 |
|
Lipidové kalorie (% neproteinové kalorie) |
neuplatňuje se |
neuplatňuje se |
33 |
33 |
|
Lipidové kalorie (% celkové kalorie) |
neuplatňuje se |
neuplatňuje se |
30 |
30 |
|
Elektrolyty | ||||
|
Sodík (mmol) |
11,6 |
3,1 |
12,0 |
2,4 |
|
Draslík (mmol) |
11,4 |
3,0 |
11,4 |
2,3 |
|
Hořčík (mmol) |
1,6 |
0,41 |
1,6 |
0,31 |
|
Vápník (mmol) |
3,1 |
0,82 |
3,1 |
0,62 |
|
Fosfátb (mmol) |
3,2 |
0,85 |
4,4 |
0,87 |
|
Acetát (mmol) |
14,5 |
3,9 |
14,5 |
2,9 |
|
Malát (mmol) |
4,3 |
1,1 |
4,3 |
0,86 |
|
Chlorid (mmol) |
13,8 |
3,7 |
13,8 |
2,8 |
|
pH (přibl.) |
5,5 |
5,5 |
5,5 |
5,5 |
|
Osmolarita přibl. (mosmol/l) |
1585 |
1585 |
1230 |
1230 |
a Zahrnuje kalorie z vaječných fosfolipidů.
b Zahrnuje fosfáty z vaječných fosfolipidů, které jsou složkou lipidové emulze.
3. LÉKOVÁ FORMA
Infuzní emulze
Vzhled před rekonstitucí:
• Roztoky v komorách aminokyselin a glukózy jsou čiré, bezbarvé nebo slabě žluté.
• Lipidová emulze je homogenní a mléčně bílá.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Numeta G16% E je indikován pro parenterální výživu novorozenců narozených v termínu a dětí do 2 let věku, pokud perorální nebo enterální výživa je nemožná, nedostatečná nebo kontraindikovaná.
4.2 Dávkování a způsob podání
Dávkování
Dávkování závisí na energetickém výdeji, hmotnosti pacienta, věku, klinickém stavu pacienta a jeho schopnosti metabolizovat složky přípravku Numeta, a také i na další energii nebo proteinech podaných perorálně/enterálně. Celkové složení elektrolytů a makronutriční složení je závislé na počtu aktivovaných komor (viz bod 2).
Maximální denní dávka nemá být překročena. Kvůli předem stanovenému složení vícekomorového vaku nemusí být možné současně splnit všechny výživové potřeby pacienta. Mohou se vyskytovat klinické případy, kdy pacienti budou vyžadovat množství živin odlišné od složení příslušného vaku.
Maximální doporučená hodinová rychlost infuze a denní objem závisí na složkách infuze. První z těchto limitů, který má být dosažen, určuje maximální denní dávku. Pokyny pro maximální doporučenou hodinovou rychlost infuze a denní objem jsou následující:
|
Aktivován 2KV (376 ml) |
Aktivován 3KV (500 ml) | |
|
Maximální rychlost podávání infuze v ml/kg/hod |
5,8 |
5,5 |
|
Odpovídá: | ||
|
Aminokyseliny v g/kg/hod |
0,20 a |
0,14 |
|
Glukóza v g/kg/hod |
0,12 |
0,85 |
|
Lipidy v g/kg/hod |
0 |
0,17 a |
|
Maximální množství v ml/kg/den |
72,3 |
96,2 |
|
Odpovídá: | ||
|
Aminokyseliny v g/kg/den |
2,5 a |
2,5 a |
|
Glukóza v g/kg/den |
14,9 |
14,9 |
|
Lipidy v g/kg/den |
0 |
3,0 |
a Limitující parametr podle pokynů ESPEN-ESPGHAN.
Způsob podání
Pokyny pro přípravu a manipulaci s roztokem/infuzní emulzí viz bod 6.6.
Neředěný přípravek Numeta má vysokou osmolaritu, a proto jej lze podávat pouze do centrální žíly. Nicméně dostatečné naředění přípravku Numeta vodou na injekci sníží osmolaritu a umožní podání do periferní žíly. Tabulka níže ukazuje, jak naředění ovlivní osmolaritu vaků.
Příklady osmolarity u aktivovaných 2KV a aktivovaných 3KV směsí po přidání stopových prvků, vitamínů a vody na injekci:
|
Aminokyseliny a glukóza (aktivován 2KV) |
Aminokyseliny, glukóza a lipidy (aktivován 3KV) | |
|
Původní objem ve vaku (ml) |
376 |
500 |
|
Původní osmolarita (přibližná, mosmol/l) |
1585 |
1230 |
|
Objem přidané vody (ml) |
450 |
350 |
|
Přidané stopové prvky a |
5 ml TE2 |
5 ml TE2 |
|
Přidané vitamíny a |
V lahvičky V1 |
V lahvičky V1 + V lahvičky V2 |
|
Konečný objem po přidání (ml) |
836 |
860 |
|
Osmolarita po přidání (přibližná, mosmol/l) |
715 |
715 |
a Složení přípravků s vitamíny a stopovými prvky je popsáno níže.
Složení běžně používaných přípravků se stopovými prvky
|
Složení v jedné lahvičce |
TE2 (10 ml) |
|
Železo |
8,9 gmol nebo 0,5 mg |
|
Zinek |
15,3 gmol nebo 1 mg |
|
Selen |
0,6 gmol nebo 0,05 mg |
|
Měď |
4,7 gmol nebo 0,3 mg |
|
Jód |
0,4 gmol nebo 0,05 mg |
|
Fluor |
26,3 gmol nebo 0,5 mg |
|
Molybden |
0,5 gmol nebo 0,05 mg |
|
Mangan |
1,8 gmol nebo 0,1 mg |
|
Kobalt |
2,5 gmol nebo 0,15 mg |
|
Chrom |
0,4 gmol nebo 0,02 mg |
Složení běžně používaných vitamínových přípravků
|
Složení v jedné lahvičce |
V1 |
V2 |
|
Vitamín B1 |
2,5 mg |
- |
|
Vitamín B2 |
3,6 mg |
- |
|
Nikotinamid |
40 mg |
- |
|
Vitamín B6 |
4,0 mg |
- |
|
Kys. pantothenová |
15,0 mg |
- |
|
Biotin |
60 gg |
- |
|
Kyselina listová |
400 gg |
- |
|
Vitamín B12 |
5,0 gg |
- |
|
Vitamin C |
100 mg |
- |
|
Vitamin A |
- |
2300IU |
|
Vitamin D |
- |
400 IU |
|
Vitamin E |
- |
7 IU |
|
Vitamin K |
- |
200 pg |
V průběhu první hodiny je nutné postupně zvyšovat rychlost podávání. Před ukončením podávání přípravku Numeta se v průběhu poslední hodiny rychlost podávání postupně snižuje. Rychlost podávání je nutné upravit podle požadované podávané dávky, denního objemového příjmu infuzí a jejího trvání, viz bod 4.9.
Jeden vak nesmí být aktivován, zavěšen a podáván déle než 24 hodin. Infuze lze podávat opakovaně v souladu s pacientovou metabolickou tolerancí.
Léčba pomocí parenterální výživy může pokračovat tak dlouho, jak vyžaduje klinický stav pacienta.
Tento přípravek obsahuje elektrolyty a lze jej dále obohatit komerčními elektrolytovými přípravky v souladu s posouzením lékaře a klinickými potřebami pacienta, viz bod 6.6.
Vitamíny a stopové prvky mohou být přidány podle zvážení lékaře a klinických potřeb pacienta, viz bod 6.6.
4.3 Kontraindikace
Obecné kontraindikace pro podávání přípravku Numeta ve formě aktivovaného 2komorového vaku v podobě intravenózní infuze jsou následující:
• hypersenzitivita na vaječné, sójové nebo arašídové proteiny nebo kteroukoli léčivou nebo pomocnou látku uvedenou v bodě 6.1 nebo komponenty obalu;
• vrozená abnormalita metabolismu aminokyselin;
• patologicky zvýšené koncentrace sodíku, draslíku, hořčíku, vápníku a/nebo fosforu v plazmě;
• jako u ostatních infuzních roztoků obsahujících vápník souběžná léčba ceftriaxonem u novorozenců (ve věku< 28 dní), i pokud se podají oddělenými infuzními sety (riziko fatální precipitace vápenaté soli ceftriaxonu v krevním řečišti novorozence), viz bod 4.4, 4.5 a 6.2;
• závažná hyperglykémie.
Přidání lipidů (podání přípravku Numeta ve formě aktivovaného 3komorového vaku pro intravenózní emulzi) je kontraindikováno v následujících dalších klinických stavech:
• závažná hyperlipidémie nebo závažné poruchy metabolizmu lipidů charakterizované hypertriglyceridémií.
4.4 Zvláštní upozornění a opatření pro použití
Infuzi je nutné okamžitě zastavit, pokud se objeví jakékoli známky nebo příznaky alergické reakce (např. horečka, pocení, třes, bolest hlavy, kožní vyrážka nebo dyspnoe).
U donošených novorozenců ve věku mladších 1 měsíce byly popsány případy fatálních reakcí vápenato-ceftriaxonových pecipitátů v plicích a ledvinách.
U pacientů všech věkových kategorií nesmí být ceftriaxon smíchán nebo podáván současně s intravenózními roztoky obsahujícími vápník, včetně přípravku Numeta, i pokud se podají oddělenými infuzními sety nebo do různých míst vpichu infuze z důvodu rizika precipitace vápenaté soli ceftriaxonu.
Nicméně u pacientů ve věku starších 28 dnů mohou být ceftriaxon a vápník obsahující roztoky podávány postupně jeden po druhém, pokud se aplikují infuzními sety na různých místech nebo pokud budou infuzní sety vyměněny nebo budou důkladně propláchnuty mezi infuzemi fyziologickým roztokem, který zabraňuje precipitaci.
U pacientů užívajících parenterální výživu byly hlášeny pulmonální vaskulární precipitáty způsobující cévní plicní embolii a dýchací obtíže. V některých případech došlo k úmrtí. Nadměrné přidání vápníku a fosfátu zvyšuje riziko tvorby vápenato-fosfátových precipitátů (viz bod 6.2). Bylo také hlášeno podezření na tvorbu precipitátů v krevním řečišti.
Kromě kontroly roztoku se mají pravidelně kontrolovat precipitáty také v infuzním setu a katétru.
Pokud se objeví dýchací potíže, musí se infuze okamžitě zastavit a stav klinicky posoudit.
Nepřidávejte do vaku žádná aditiva bez předchozí kontroly kompatibility, protože případné utvoření precipitátu nebo destabilizace lipidové emulze může vést k cévní okluzi, viz body 6.2 a 6.6.
Jako důsledek použití intravenózních katétrů pro podávání parenterálních přípravků nebo nesprávné péče o katétry se mohou vyskytnout infekce a sepse. Imunosupresivní účinky choroby nebo léků mohou posílit infekci a sepsi. Odhalit časnou infekci napomohou důsledné symptomatické a laboratorní sledování horečky/zimnice, leukocytózy, technických komplikací s přístupovým zařízením a hyperglykémie. Pacienti, u kterých je nutná parenterální výživa, mají často dispozice k infekčním komplikacím kvůli malnutrici a/nebo základnímu chorobnému stavu. Výskyt septických komplikací lze snížit zvýšenou pozorností při dodržování aseptických technik při umístění katétru, jeho údržbě, stejně jako dodržení aseptické techniky při přípravě nutričních přípravků.
U jiných přípravků pro parenterální výživu byl hlášen syndrom přetížení tuky. Snížená nebo omezená schopnost metabolizovat tuky obsažené v přípravku Numeta může vést k „syndromu přetížení tuky“.
Realimentace vážně podvyživených pacientů může vést k rozvoji tzv. reperfúzního syndromu (refeeding syndrome), který je charakterizován posunem v intracelulárních hodnotách draslíku, fosforu a hořčíku, protože u pacientů začne převládat anabolická složka metabolismu. Může dojít i k rozvoji deficitu thiaminu a zadržování tekutin. Doporučuje se opatrné a pomalé zahájení parenterální výživy s důkladným sledováním tekutin, elektrolytů, stopových prvků a vitamínů.
Přípravek Numeta se musí podávat pouze přes centrální žílu s výjimkou, pokud se provede příslušné naředění (viz bod 4.2). Při přidávání látek do přípravku je před podáním do periferní žíly nutné stanovit konečnou osmolaritu směsi, čímž se zabrání podráždění žíly.
Nepřipojujte vaky do série, aby nedošlo ke vzduchové embolii reziduálním plynem obsaženým v primárním vaku.
Lipidy, vitamíny, další elektrolyty a stopové prvky mohou být podávány podle potřeby.
OPATŘENÍ
K žádné z komor 3 komorového vaku ani rekonstituovanému roztoku/emulzi nepřidávejte žádný jiný léčivý přípravek nebo látky bez předchozího ověření jejich kompatibility a stability výsledného přípravku (především stability lipidové emulze). (viz body 6.2 a 6.6)
V průběhu léčby pravidelně sledujte rovnováhu vody a elektrolytů, sérovou osmolaritu, sérové triglyceridy, acidobazickou rovnováhu, krevní glukózu, činnost jater a ledvin, krevní obraz včetně krevních destiček a koagulačních parametrů.
V případě nestabilních stavů (např. následkem vážných posttraumatických stavů, nekompenzované cukrovky, akutní fáze oběhového šoku, akutního infarktu myokardu, závažné metabolické acidózy, závažné sepse a hyperosmolárního kómatu) je třeba podávání přípravku Numeta sledovat a upravovat tak, aby vyhovovalo klinickým potřebám pacienta.
Kardiovaskulární
Používejte opatrně u pacientů s plicním edémem nebo srdečním selháním. Je třeba důkladně sledovat stav tekutin.
Renální
Používejte opatrně u pacientů s renální insuficiencí. U těchto pacientů je třeba důkladně sledovat stav tekutin a elektrolytů, včetně hořčíku (viz hypermagnezémie).
Závažné poruchy rovnováhy vody a elektrolytů, závažné stavy přetížení tekutinami a závažné metabolické poruchy je nutné korigovat před zahájením infuze (viz bod 4.3).
Hepatální/gastrointestinální
Opatrně používejte u pacientů se závažnou jaterní insuficiencí, která zahrnuje cholestázu nebo zvýšené hodnoty jaterních enzymů. Je třeba důkladně sledovat funkční jaterní parametry.
Endokrinní a metabolické
Může dojít k metabolickým komplikacím v případě, že není nutriční příjem upraven požadavkům pacienta, nebo pokud není metabolická kapacita kterékoli dietní součásti správně vyhodnocena. Nežádoucí účinky na metabolismus mohou nastat podáním neodpovídající nebo nadbytečné výživy nebo v důsledku nevhodného složení směsi vzhledem k potřebám pacienta.
Pravidelně je nutné sledovat koncentrace sérových triglyceridů a schopnost organismu metabolizovat lipidy. Pokud je podezření na abnormality lipidového metabolismu, je doporučeno sledování sérových triglyceridů jako klinicky nezbytné.
V případě hyperglykémie musí být upravena infuzní rychlost podávání přípravku Numeta a/nebo podán inzulín, viz bod 4.9.
Hematologické
Používejte opatrně u pacientů se závažnými poruchami krevní srážlivosti. Je třeba důkladně sledovat krevní obraz a koagulační parametry.
Hypermagnezémie
Přípravek Numeta G16 % E dodává 0,3 mmol/kg/d hořčíku, pokud je podáván v maximální dávce (viz bod 4.2), což může vést ke vzniku hypermagnezémie.
Známky hypermagnezémie zahrnují celkovou slabost, hyporeflexii, nauzeu, zvracení, hypokalcémii, respirační selhání, hypotenzi a arytmie. Známky hypermagnezémie nemusí být patrné, proto se doporučuje sledovat hladiny hořčíku v souladu s běžnou klinickou praxí a individuálními potřebami pacienta na začátku léčby a poté v patřičných intervalech. Tento postup je obzvláště důležitý u pacientů se zvýšeným rizikem rozvoje hypermagnezémie, včetně pacientů s poruchou funkce ledvin, pacientů léčených jinými léčivými přípravky, které zvyšují riziko rozvoje hypermagnezémie nebo pacientů užívajících hořčík z jiných zdrojů, včetně novorozenců, jejichž matky v období těsně před porodem užívaly hořčík.
Pokud jsou sérové hladiny hořčíku zvýšeny (nad referenční rozmezí běžných hodnot), je třeba infuzi přípravku Numeta zastavit nebo snížit její rychlost, a to jak se posoudí za klinicky vhodné a bezpečné.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
S přípravkem Numeta nebyly provedeny žádné studie farmakodynamické interakce.
Přípravek Numeta nesmí být podáván současně s krví stejným infuzním setem, neboť hrozí riziko pseudoaglutinace.
Stejně jako u jiných vápník obsahujících roztoků je současná léčba ceftriaxonem s přípravkem Numeta G16%E kontraindikovaná u novorozenců narozených v termínu (ve věku< 28 dní), i pokud se používají oddělené infuzní sety (riziko fatálního vzniku precipitátu vápenaté soli ceftriaxonu v krevním řečišti novorozence).
U pacientů všech věkových kategorií (včetně dospělých) nesmí být ceftriaxon smíchán nebo podáván současně s intravenózními roztoky obsahujícími vápník, včetně přípravku Numeta, ani různými infuzními sety nebo do jiných míst vpichu infuze z důvodu rizika precipitace vápenaté soli ceftriaxonu (viz bod 4.4).
Nicméně u pacientů ve věku starších 28 dnů mohou být ceftriaxon a vápník obsahující roztoky podávány postupně jeden po druhém, pokud se aplikují infuzními sety na různých místech nebo pokud jsou infuzní sety nahrazeny nebo jsou důkladně propláchnuty mezi infuzemi fyziologickým roztokem, který zabraňuje precipitaci.
Olivový a sójový olej jsou přirozené zdroje vitamínu K1, který může působit proti antikoagulační aktivitě kumarinu (nebo jeho derivátu včetně warfarinu).
Vzhledem k tomu, že přípravek Numeta obsahuje draslík, je třeba věnovat pozornost pacientům, kteří jsou současně léčeni kalium šetřícími diuretiky (amilorid, spironolakton, triamteren) nebo inhibitory ACE, antagonisty receptoru angiotensinu II nebo imunosupresivy takrolimem nebo cyklosporinem z důvodu rizika vzniku hyperkalémie.
Lipidy obsažené v této emulzi mohou interferovat s výsledky některých laboratorních testů (např. bilirubin, laktátdehydrogenáza, saturace kyslíkem, krevní hemoglobin), pokud je vzorek krve odebrán dříve, než se lipidy vyloučí. Lipidy jsou obecně odbourány po asi 5 až 6 hodinách, pokud nejsou podány žádné další lipidy.
Viz také bod 6.2 „Inkompatibility“.
4.6 Fertilita, těhotenství a kojení
Neuplatňuje se.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Neuplatňuje se.
4.8 Nežádoucí účinky
Bezpečnost a podání přípravku Numeta byla zjišťována v jednorázové studii fáze III. Ve studii bylo zahrnuto sto padesát devět (159) pediatrických pacientů, kterým byl podán přípravek Numeta.
Následující tabulka shrnuje nežádoucí účinky, které se během této studie vyskytly.
|
Nežádoucí účinky v klinické studii | ||
|
Třída orgánových systémů (TOS) |
Preferovaný termín dle MedDRA |
Frekvenceb |
|
PORUCHY METABOLISMU A VÝŽIVY |
Hypofosfatémiea Hyperglykémiea Hyperkalcémiea Hypertriglyceridémiea Hyperlipidémie Hyponatrémiea |
Časté Časté Časté Časté Méně časté Časté |
|
PORUCHY JATER A ŽLUČOVÝCH CEST |
Cholestáza |
Méně časté |
a Vzorky krve odebrané během infuze (ne nalačno).
b Frekvence je založena na následujících kategoriích: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10000 až <1/1000), velmi vzácné (<1/10000).
Následující nežádoucí účinky byly hlášeny u dalších parenterálních výživových směsí:
Syndrom přetížení tuky: může být způsoben nevhodným podáním (např. předávkování a/nebo vyšší než doporučená rychlost infuze, viz bod 4.9); avšak ke známkám a příznakům tohoto syndromu může dojít i v případě podávání přípravku podle návodu. Snížená nebo omezená schopnost metabolizovat lipidy obsažené v přípravku Numeta doprovázená prodlouženou plazmatickou clearance může mít za následek „syndrom přetížení tuky“ („fat overload syndrome“). Tento syndrom je spojen s náhlým zhoršením klinického stavu pacienta a je charakterizován stavy jako je hyperlipidémie, horečka, jaterní steatóza (hepatomegalie), zhoršení jaterních funkcí, anémie, leukopenie, trombocytopenie, porucha koagulace a manifestace centrálního nervového systému (např. kóma). Tento syndrom je obvykle reverzibilních, pokud je infuze lipidové emulze zastavena.
Pulmonální vaskulární precipitáty (pulmonální vaskulámí embolie a dechová nedostatečnost) (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu: Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10, webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
V případě nevhodného podání (předávkování a/nebo rychlost podávání infuze vyšší, než je doporučeno) se mohou objevit nauzea, zvracení, třes, poruchy elektrolytů
a známky hypervolemie a acidózy, které mohou mít fatální důsledky. V takových situacích musí být infuze ihned zastavena. Pokud je třeba, může být v těchto případech indikována další intervence.
Pokud rychlost infuze glukózy převyšuje clearance, může se vyvinout hyperglykémie, glykosurie a hyperosmolární syndrom.
Snížená nebo omezená schopnost metabolizovat lipidy může mít za následek „syndrom přetížení tuky“, jehož následky jsou obvykle reverzibilní po zastavení infuze lipidové emulze, viz také bod 4.8.
V případě předávkování neexistuje specifické antidotum. Léčba předávkování zahrnuje obecná podpůrná opatření, se zvláštní pozorností k respiračnímu
a kardiovaskulárnímu systému. V některých závažných případech může být nutná hemodialýza, hemofiltrace nebo hemodiafiltrace.
Je nutné pečlivé biochemické sledování a specifické abnormality mají být náležitě léčeny.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: roztoky pro parenterální výživu/kombinace ATC kód: B05 BA10
Obsah dusíku (20 L-aminokyselin, zahrnující 8 esenciálních aminokyselin) a energie (glukóza a triglyceridy) v přípravku Numeta umožňuje udržování dostatečné rovnováhy dusíku/energie. Dusík a energie jsou potřebné k zajištění normálního fungování všech buněk v organismu a jsou důležité pro syntézu proteinů, růst, hojení ran, funkci imunitního systému, funkci svalů a mnoho dalších buněčných aktivit.
Tento přípravek obsahuje také elektrolyty.
Profil aminokyselin je následující:
• esenciální aminokyseliny/celkové aminokyseliny: 47,5 %;
• aminokyseliny s rozvětveným řetězcem/celkové aminokyseliny: 24,0 %.
Lipidová emulze v přípravku Numeta je směs čištěného olivového oleje a čištěného sójového oleje (v poměru cca 80/20), s následující relativní distribucí mastných kyselin:
• 15 % nasycených mastných kyselin (NMK),
• 65 % mononenasycených mastných kyselin (MNMK),
• 20 % polynenasycených mastných kyselin ( PNMK).
Poměr fosfolipidů/triglyceridů je 0,06. Střední obsah esenciálních mastných kyselin (EMK) vylepšuje stav jejich vyšších derivátů při korekci deficitu EMK.
Olivový olej obsahuje významné množství alfa-tokoferolu, který v kombinaci se středním příjmem PNMK přispívá ke zlepšení hladiny vitamínu E a je důležitý pro limitní peroxidaci lipidů.
Glukóza je zdroj sacharidů a je primárním zdrojem energie v organismu.
5.2 Farmakokinetické vlastnosti
Složky infuzní emulze (aminokyseliny, elektrolyty, glukóza, lipidy) jsou distribuovány, metabolizovány a vylučovány stejným způsobem, jako kdyby byly podány jednotlivě. Přípravek se podává intravenózně, a tak je 100% biologicky dostupný a složky jsou distribuovány a metabolizovány všemi buňkami organismu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické studie provedené na jednotlivých složkách 3komorového vaku neodhalily další rizika, než která byla již uvedena v jiných bodech SPC.
Studie na zvířatech nebyly s přípravkem Numeta provedeny (2 nebo 3komorová kombinace).
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
|
Pomocné látky: |
Komora s aminokyselinami |
Komora s glukózou |
Komora s lipidy |
|
kyselina jablečná L-formaa |
X |
- |
- |
|
kyselina chlorovodíkováa |
- |
X |
- |
|
vaječné fosfolipidy přečištěné frakcionací |
- |
- |
X |
|
glycerol |
- |
- |
X |
|
natrium-oleát |
- |
- |
X |
|
hydroxid sodnýa |
- |
- |
X |
|
voda na injekci a k úpravě pH |
X |
X |
X |
6.2 Inkompatibility
Nepřidávejte jiné léčivé přípravky nebo léčivé látky do žádné ze tří komor vaku nebo k rekonstituovanému roztoku/emulzi bez předchozího ověření jejich kompatibility a stability výsledného přípravku (konkrétně stability lipidové emulze nebo vzniku precipitátů), viz bod 6.6.
Stejně jako při použití jakékoli parenterální nutriční směsi musí být sledovány hodnoty vápníku a fosfátu. Nadbytečné podávání vápníku a fosfátu, zejména ve formě minerálních solí, může vést k formaci vápenato-fosfátových precipitátů.
Stejně jako u jiných vápník obsahujících infuzních roztoků je současná léčba ceftriaxonem s přípravkem Numeta kontraindikovaná u novorozenců narozených v termínu (ve věku< 28 dní), i pokud se používají oddělené infuzní sety (riziko fatálního vzniku precipitátu vápenatých solí ceftriaxonu v krevním řečišti novorozence, viz bod 4.5).
U pacientů všech věkových kategorií nesmí být ceftriaxon smíchán nebo podáván současně s intravenózními roztoky obsahujícími vápník, včetně přípravku Numeta, ani různými infuzními sety nebo do jiných míst vpichu infuze z důvodu rizika precipitace vápenaté soli ceftriaxonu.
Přípravek Numeta nesmí být podáván současně s krví prostřednictvím stejného infuzního setu, viz bod 4.5.
Přípravek Numeta obsahuje ionty vápníku, které představují další riziko koagulace a tvorby precipitátů v citrátem antikoagulačně ošetřené krvi nebo jejích složkách.
6.3 Doba použitelnosti
18 měsíců
Doba použitelnosti po rekonstituci
Je doporučeno použít přípravek ihned po protržení těsnicích švů mezi dvěma nebo třemi komorami. Stabilita rekonstituovaných směsí je 7 dnů při teplotách mezi 2°C a 8°C a následně 48 hodin při 30°C.
Doba použitelnosti po suplementaci (elektrolyty, stopové prvky, vitamíny, voda):
Pro specifické směsi byla stabilita přípravku Numeta prokázána po dobu 7 dnů v rozmezí mezi 2-8°C a následně po dobu 48 hodin při 30°C.
Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li použit okamžitě, zodpovídá za dobu použitelnosti a podmínky uchovávání před použitím uživatel. Tato doba by za běžných podmínek neměla být delší než 24 hodin při teplotě +2°C až +8°C, pokud rekonstituce/naředění/suplementace nebyly provedeny za kontrolovaných a validovaných aseptických podmínek.
Prosím také odkaz v bodu 4.2 „Dávkování a způsob podání“ a bodu 6.6 „Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním“.
6.4 Zvláštní opatření pro uchovávání
Chraňte před mrazem.
Uchovávejte v ochranném obalu.
6.5 Druh obalu a obsah balení
3komorový vak, který neobsahuje PVC, se skládá z následujících součástí:
• vícevrstevného plastového obalu;
• portu v oddělení obsahujícím lipidovou emulzi, ten je po naplnění zataven k zamezení možnosti přidávání aditiv do této komory;
• dvou portů u komor s roztoky aminokyselin a glukózy;
• injekční port u komory s glukózou
• port pro aplikaci v komoře s aminokyselinami
Všechny součásti jsou bez obsahu přírodní latexové pryže.
K zabránění kontaktu se vzduchem je vak vybaven ochranným obalem s kyslíkovou bariérou, který obsahuje sáček s absorbentem kyslíku a může také obsahovat indikátor kyslíku.
Dostupné velikosti balení:
Vaky 500 ml: 6 kusů v kartonu 1 kus
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Pouze k jednorázovému použití.
Doporučujeme použít přípravek ihned poté, co dojde k protržení těsnících švů mezi komorami, a neskladovat jej pro následné infuze.
Nepřipojujte vaky do série, abyste zabránili vzduchové embolii vznikající vlivem možného obsahu zbytkového plynu obsaženého v prvním vaku.
Zkontrolujte, že vak a těsnící švy mezi komorami nejsou poškozené. Používejte pouze nepoškozený vak s neporušenými těsnícími švy (tzn. žádný obsah vaků není smísen), pokud je roztok vaku s aminokyselinami a vaku s glukózou čirý, bezbarvý nebo slabě žlutý bez viditelných částic a lipidová emulze je homogenní s mléčně bílým zabarvením.
Před otevřením ochranného obalu zkontrolujte barvu kyslíkového indikátoru (absorbentu). Porovnejte ji s referenční barvou vytištěnou vedle symbolu OK a vyobrazenou v potištěné části štítku indikátoru. Přípravek nepoužívejte, pokud barva kyslíkového indikátoru (absorbentu) neodpovídá referenční barvě vytištěné vedle symbolu OK.
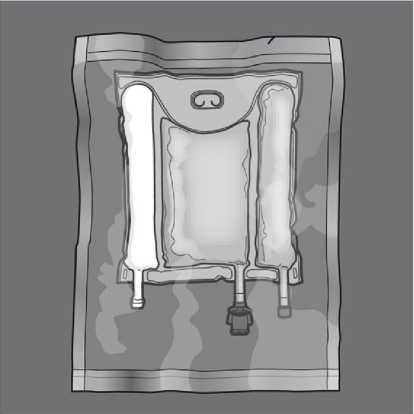
Otevření: Odstraňte ochranný obal. Zlikvidujte ochranný obal a absorbcnt/ sáček
s kyslíkovým indikátorem.
Smíchání: Při protržení těsnících švů by měl mít přípravek pokojovou teplotu. Vak umístěte na rovný a čistý povrch. Nepoužívejte vak, pokud je jeho obsah smíchán kvůli náhodnému protržení švů během transportu.
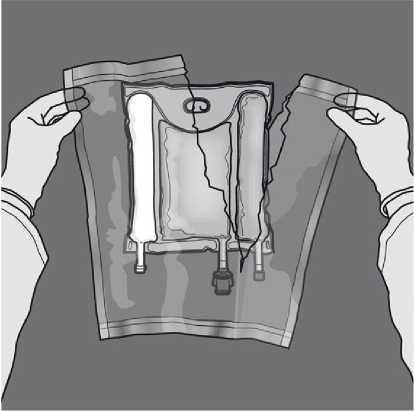
Aktivace 3komorového vaku (protržení dvou dočasných těsnících švů)
Začněte rolovat vak z horní strany se závěsem.
Tlakem otevřete švy.
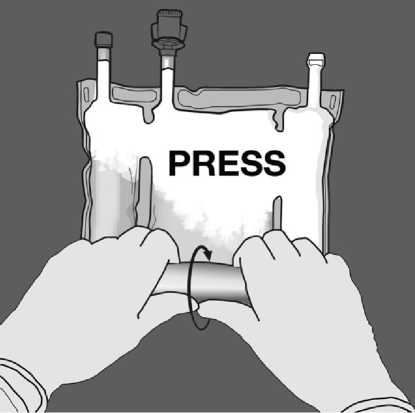
Poté změňte směr rolování vaku směrem k horní straně se závěsem, dokud se šev úplně neotevře.
Stejným způsobem pokračujte až do úplného otevření druhého švu.
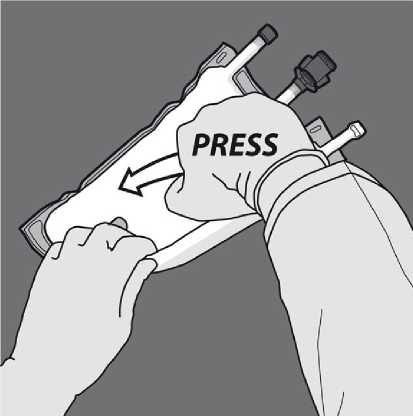
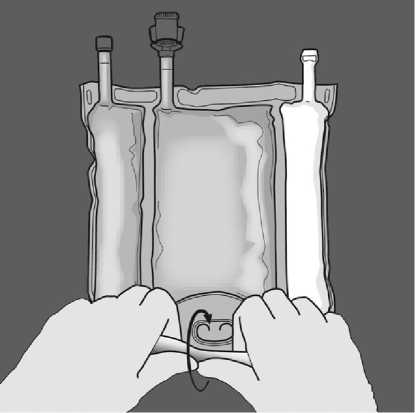
Obraťte vak nejméně třikrát, abyste důkladně promíchali obsah. Vzhled smíchaného roztoku musí být mléčně bílá emulze.
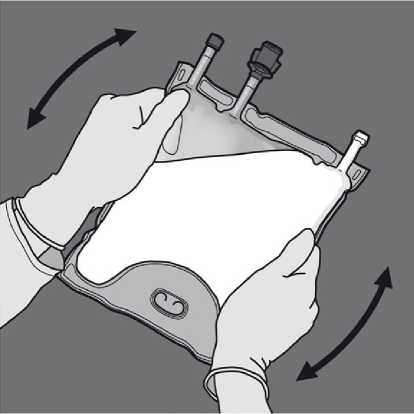
Odstraňte ochranný kryt v místě pro aplikaci a připojte infuzní soupravu.
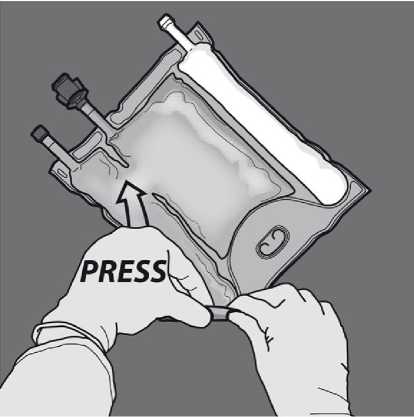
Aktivace 2komorového vaku (protržení dočasného těsnícího švu mezi vakem aminokyselin a glukózy)
Chcete-li smíchat pouze dva roztoky, rolujte vak z horního (závěsného) rohu švu oddělujícího roztoky aminokyselin a glukózy. Použijte tlak pro otevření švu oddělujícího oddělení s glukózou a aminokyselinami.
Nasměrujte vak tak, aby oddíl lipidové emulze byl nejblíže k Vám. Rolujte vak a oddíl s lipidovou emulzí zatím chraňte v dlaních rukou.
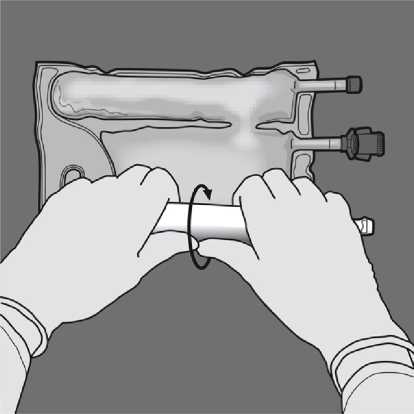
Jednou rukou použitím tlaku rolujte vak směrem k portům.
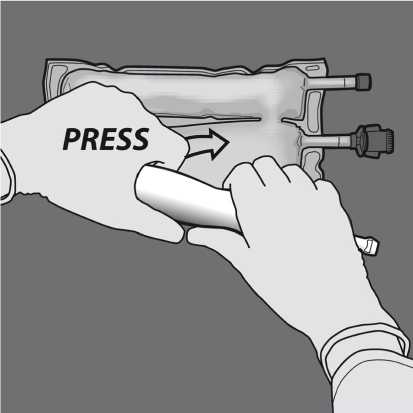
Změňte směr rolováním vaku směrem k vrcholu (závěsnému konci). Stlačte druhou rukou, pokračujte do doby, než se zcela otevře šev oddělující roztoky aminokyselin a glukózy.
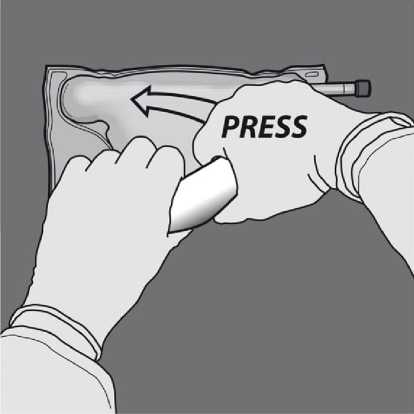
Obraťte vak nejméně třikrát, abyste důkladně promíchali obsah. Vzhled smíchaného roztoku musí být čirý, bezbarvý nebo slabě žlutý.
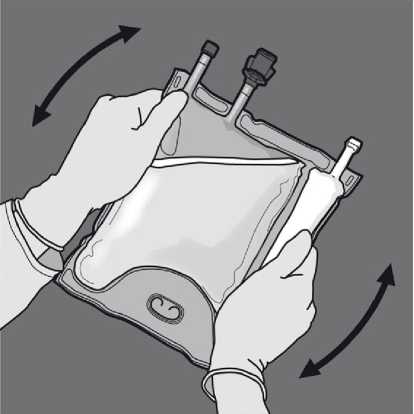
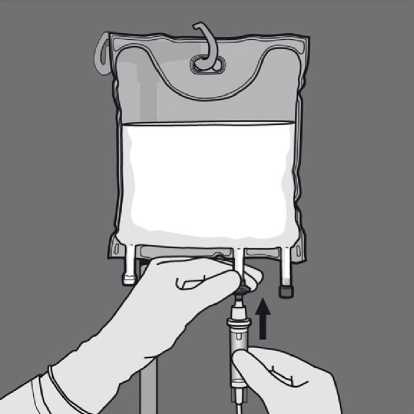
Odstraňte ochranný kryt v místě pro aplikaci a připojte infuzní soupravu.
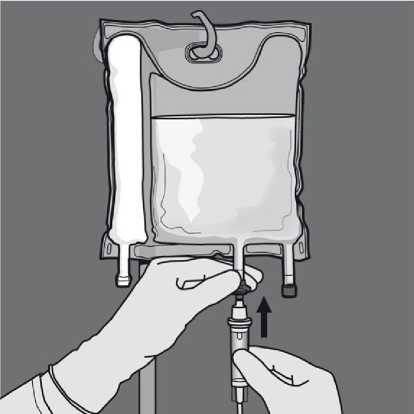
Aditiva: Objem vaku je dostačující pro aditiva, jako jsou např. elektrolyty, stopové prvky, vitamíny a voda na injekci. Jakékoli přidání aditiva (včetně vitamínů) je možné provést do rekonstituované směsi (po protržení těsnicích švů a po smíchání obsahu dvou nebo tří komor). Před rekonstitucí směsi (před protržením těsnicích švů a smícháním roztoků a emulze) je rovněž možné přidat vitamíny do komory s glukózou.
Při přidávání látek je třeba zvážit množství již přítomných elektrolytů ve vaku, aby bylo dosaženo klinických potřeb pacienta. Maximální hladiny elektrolytů a komerčně dostupných vitamínů a stopových prvků, které mohou být přidány k přípravku Numeta s aktivovanými 2KV a aktivovaným 3KV, jsou popsány níže.
|
Aditiva |
Maximální další dávka na vak | |
|
Aminokyseliny a glukóza (aktivován 2KV) |
Aminokyseliny, glukóza a lipidy (aktivován 3KV) | |
|
Sodík |
26,0 mmol |
4,0 mmol |
|
Draslík |
26,2 mmol |
6,2 mmol |
|
Hořčík |
3,6 mmol |
0,0 mmol |
|
Vápník |
8,2 mmol |
2,1mmol |
|
Fosfáta |
8,1 mmol |
2,0 mmol |
|
Stopové prvkyb |
5 ml TE1 |
5 ml TE1 |
|
nebo 5 ml TE2 |
nebo 5 ml TE2 | |
|
Vitamínyb |
A lahvičky V1 |
A lahvičky V1 + A lahvičky V2 |
a: Organické fosfáty nezahrnující fosfáty z vaječných fosfolipidů.
b: Složení stopových prvků (tj. TE2) a přípravků s vitamíny (tj. V1 & V2) jsou znázorněny v bodě 4.2 Složení stopových prvků (tj. TE1) je popsáno níže.
Složení stopových prvků používaného komerčního přípravku
|
Složení v jedné lahvičce |
TE1 (10 ml) |
|
Zinek |
38,2 amol nebo 2,5 mg |
|
Selen |
0,253 amol nebo 0,02 mg |
|
Měď |
3,15 amol nebo 0,2 mg |
|
Jód |
0,0788 amol nebo 0,01 mg |
|
Fluor |
30 amol nebo 0,57 mg |
|
Mangan |
0,182 amol nebo 0,01 mg |
Přidání aditiv:
• Je nutné dodržovat aseptické podmínky.
• Připravte injekční port na vaku.
• Propíchněte injekční port a aplikujte aditiva pomocí injekční jehly nebo zařízení pro rekonstituci.
• Promíchejte obsah vaku a aditiva.
Příprava infuze:
• Je nutné dodržovat aseptické podmínky.
• Zavěste vak.
• Odstraňte plastový kryt z výstupu pro aplikaci.
• Pevně zaveďte infuzní set do výstupu pro aplikaci.
Podávání infuze:
• Pouze k jednorázovému použití.
• Přípravek podávejte pouze po protržení těsnicích švů mezi dvěma nebo třemi komorami a smíchání obsahu dvou nebo tří vaků.
• Ujistěte se, že konečná, aktivovaná 3KV infuzní emulze nevykazuje stopy fázové separace nebo že konečný, aktivovaný 2KV infuzní roztok nevykazuje stopy přítomnosti částeček.
• Po otevření vaku je nutné obsah ihned použít. Obsah nikdy neskladujte pro následné podání v infuzi.
• Částečně spotřebované vaky znovu nenapojujte.
• Nepřipojujte vaky do série, abyste zabránili vzduchové embolii vznikající vlivem možného obsahu zbytkového plynu obsaženého v prvním vaku.
• Veškerý nepoužitý přípravek nebo odpad a veškeré nezbytné vybavení pro jednorázové použití je nutné patřičně zlikvidovat a opakovaně nepoužívat.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
BAXTER CZECH spol. s r.o.
Karla Engliše 3201/6
150 00 Praha 5, Česká republika
8. REGISTRAČNÍ ČÍSLO
76/329/11-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 18.5.2011
Datum posledního prodloužení registrace: 8.4.2016
10. DATUM REVIZE TEXTU
29.6.2016
27