Nexplanon 68 Mg
zastaralé informace, vyhledat novějšíSp. zn. sukls66403/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Nexplanon 68 mg Subkutánní implantát
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Nexplanon je rentgenkontrastní ohebný implantát nepodléhající biologickému rozpadu obsahující pouze gestagen, dodávaný ve sterilním předplněném aplikátoru na jedno použití.
Jeden rentgenkontrastní implantát obsahuje 68 mg etonogestrelum (etonogestrel); rychlost uvolňování je přibližně 60 - 70 pg/den v 5. - 6. týdnu, na konci prvního roku se snižuje přibližně na 35 - 45 pg/den, na konci druhého roku přibližně na 30 - 40 pg/den a na konci třetího roku přibližně na 25 - 30 pg/den. Aplikátor je navržen tak, aby jej bylo možné používat jednou rukou a aby usnadňoval správné podkožní zavedení implantátu.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Implantát k podkožnímu podání.
Rentgenkontrastní bílá až téměř bílá, měkká, biologicky nerozložitelná, ohebná tyčinka o délce 4 cm a 2 mm v průměru.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Antikoncepce.
Bezpečnost a účinnost byla stanovena pro ženy ve věku mezi 18 a 40 lety.
4.2 Dávkování a způsob podání
Dávkování
1 implantát, který může být zavedený po dobu tří let.
Pediatrická populace
Bezpečnost a účinnost přípravku Nexplanon u dospívajících do 18 let nebyly dosud stanoveny. Způsob podání
Před zavedením přípravku Nexplanon má být vyloučeno těhotenství.
Důrazně doporučujeme, aby se zdravotničtí pracovníci zúčastnili školení, kde se seznámí s použitím aplikátoru přípravku Nexplanon a s technikou zavedení a odstranění implantátu Nexplanon, a v případě potřeby požádali o asistenci před zaváděním či odstraňováním implantátu.
Další informace a podrobnější pokyny týkající se zavedení a odstranění implantátu budou na požádání zdarma zaslány (Merck Sharp & Dohme s.r.o., telefon +420 233 010 111).
Před zavedením implantátu si pečlivě přečtěte pokyny pro zavedení a odstranění implantátu v bodě 4.2 Jak zavést přípravek Nexplanon a Jak odstranit přípravek Nexplanon a těmito pokyny se řiďte.
Jak používat přípravek Nexplanon
Nexplanon je dlouhodobě působící hormonální kontraceptivum. Subdermálně se zavádí jeden implantát, který může být ponechán na místě po dobu tří let. Implantát musí být odstraněn do tří let po datu zavedení. Uživatelce implantátu je třeba sdělit, že implantát lze kdykoliv na požádání odstranit. Zdravotnický pracovník může rozhodnout o dřívější výměně implantátu u silnějších žen (viz bod 4.4). Po odstranění implantátu je nepřetržitá ochrana před početím zajištěna okamžitou implantací dalšího implantátu. Pokud si žena nepřeje pokračovat v používání přípravku Nexplanon, ale přeje si předejít otěhotnění, měla by jí být doporučena jiná antikoncepční metoda.
Základem úspěšného používání a následného odstranění implantátu Nexplanon je správné a pečlivé podkožní zavedení implantátu v souladu s pokyny. Pokud není implantát zaveden v souladu s pokyny (viz bod 4.2 Kdy zavést přípravek Nexplanon a Jak zavést přípravek Nexplanon) a ve správný den, může to mít za následek nechtěné těhotenství.
Implantát Nexplanon má být zaveden podkožně těsně pod pokožku na vnitřní straně horní části paže, aby se předešlo možnému poškození velkých cév a nervů, které jsou uloženy hlouběji v pojivu mezi bicepsem a tricepsem.
Pozice implantátu má být okamžitě po implantaci ověřena palpací. V případě, že není možné implantát nahmatat nebo je jeho pozice nejistá, musí být k potvrzení jeho přítomnosti použity jiné metody (viz bod 4.2 Jak zavést přípravek Nexplanon). Žena má být poučena, aby používala nehormonální metodu antikoncepce do doby, dokud není přítomnost implantátu potvrzena.
Balení přípravku Nexplanon obsahuje Kartičku uživatelky, která je určena ženě a která obsahuje číslo šarže implantátu. Zdravotnický pracovník je do kartičky povinen zaznamenat datum zavedení, paži, do které je implantát zaveden, a plánované datum odstranění. Balení obsahuje také samolepky určené do zdravotnické dokumentace, na kterých je uvedeno číslo šarže přípravku.
Kdy zavést přípravek Nexplanon
DŮLEŽITÉ: Před zavedením implantátu vylučte těhotenství.
Doba zavedení závisí na anamnéze předchozí antikoncepce pacientky, dle následujícího schématu: Žádná hormonální antikoncepce v předchozím měsíci
Implantát má být zaveden mezi 1. dnem (první den menstruačního krvácení) a 5. dnem menstruačního cyklu, i když je u ženy stále přítomno krvácení.
Pokud byl implantát zaveden tak, jak je doporučeno, žádná další antikoncepce není nutná. V případě, že byl implantát zaveden v jiný čas, než je doporučeno, má být žena poučena, aby použila bariérovou metodu antikoncepce během 7 dnů následujících po zavedení. Pokud již došlo k pohlavnímu styku, má být vyloučeno těhotenství.
Přechod z hormonální antikoncepční metody na přípravek Nexplanon
Přechod z kombinované hormonální antikoncepce (kombinovaná perorální antikoncepce (COC), vaginální kroužek nebo transdermální náplast)
Implantát má být zaveden pokud možno v den po užití poslední aktivní tablety (poslední tableta obsahující léčivou látku) předcházející kombinované perorální antikoncepce, nebo v den odstranění vaginálního kroužku nebo transdermální náplasti. Nejpozději má být implantát zaveden v den následující po obvyklém období bez tablet, bez vaginálního kroužku, bez transdermální náplasti nebo období s placebo tabletami předchozí kombinované perorální antikoncepce, kdy měla být na řadě další aplikace. Ne všechny antikoncepční metody (transdermální náplast, vaginální kroužek) jsou k dispozici ve všech státech.
Pokud byl implantát zaveden tak, jak je doporučeno, žádná další antikoncepce není nutná. V případě, že byl implantát zaveden v jiný čas, než je doporučeno, má být žena poučena, aby použila bariérovou metodu antikoncepce během 7 dnů následujících po zavedení. Pokud již došlo k pohlavnímu styku, má být vyloučeno těhotenství.
Přechod z čistě gestagenní metody (čistě gestagenní pilulka, injekční metoda, implantát, nebo nitroděložní tělísko [IUD])
Protože existuje několik typů čistě gestagenních metod, zavedení implantátu musí být provedeno následovně:
• Injekční antikoncepce: zaveďte implantát v den, kdy by měla být aplikována další injekce.
• Čistě gestagenní pilulka: žena může přejít z čistě gestagenní pilulky na Nexplanon v kterýkoli den měsíce. Implantát má být zaveden během 24 hodin po užití poslední pilulky.
• Implantát/nitroděložní tělísko (IUD): zaveďte implantát ve stejný den, kdy byl odstraněn předchozí implantát nebo IUD.
Pokud byl implantát zaveden tak, jak je doporučeno, žádná další antikoncepce není nutná. V případě, že byl implantát zaveden v jiný čas, než je doporučeno, má být žena poučena, aby použila bariérovou metodu antikoncepce během 7 dnů následujících po zavedení. Pokud již došlo k pohlavnímu styku, má být vyloučeno těhotenství.
Po potratu nebo umělém přerušení těhotenství
• První trimestr: Implantát musí být zaveden do pěti dnů po potratu nebo ukončení těhotenství v prvním trimestru.
• Druhý trimestr: Zaveďte implantát mezi 21. a 28. dnem následujícím po potratu nebo ukončení těhotenství ve druhém trimestru.
Pokud byl implantát zaveden tak, jak je doporučeno, žádná další antikoncepce není nutná. V případě, že byl implantát zaveden v jiný čas, než je doporučeno, má být žena poučena, aby použila bariérovou metodu antikoncepce během 7 dnů následujících po zavedení. Pokud již došlo k pohlavnímu styku, musí být vyloučeno těhotenství.
Po porodu
• Nekojící: Implantát má být zaveden mezi 21. a 28. dnem po porodu. Pokud byl implantát zaveden tak, jak je doporučeno, žádná další antikoncepce není nutná. V případě, že byl implantát zaveden později než 28 dní po porodu, má být žena poučena, aby použila bariérovou metodu antikoncepce během 7 dnů následujících po zavedení. Pokud již došlo k pohlavnímu styku, musí být vyloučeno těhotenství.
• Kojící: Implantát má být zaveden po čtvrtém týdnu po porodu (viz bod 4.6). Žena má být poučena, aby použila bariérovou metodu antikoncepce během 7 dnů následujících po zavedení. Pokud již došlo k pohlavnímu styku, musí být vyloučeno těhotenství.
Jak zavést přípravek Nexplanon
Základem úspěšného používání a následného odstranění implantátu Nexplanon je správné a pečlivé podkožní zavedení do nedominantní paže v souladu s pokyny. Jak zdravotnický pracovník, tak žena mají být schopni implantát po zavedení pod kůží nahmatat.
Implantát musí být zaveden subdermálně těsně pod kůži. Pokud je implantát zaveden příliš hluboko, může dojít k poškození cév nebo nervů. Příliš hluboká nebo nesprávná implantace může být spojena s paresteziemi (způsobenými poškozením nervů) a s migrací implantátu (v důsledku zavedení do fascie nebo svalu) a ve vzácných případech s intravaskulárním zavedením. Navíc, pokud je implantát zaveden příliš hluboko, nemusí být možné jej nahmatat a jeho nalezení a/nebo odstranění může být obtížné.
Zavedení přípravku Nexplanon má být provedeno za aseptických podmínek a pouze kvalifikovaným zdravotnickým pracovníkem, který je s tímto postupem seznámen. Zavedení má být provedeno pouze za použití předplněného aplikátoru.
Doporučuje se, aby zdravotnický pracovník během celé procedury zavádění seděl tak, aby na místo zavedení a pohyb jehly těsně pod kůži snadno viděl ze strany.
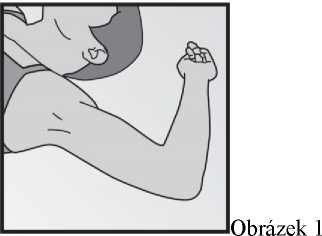
Žena leží na zádech na vyšetřovacím stole a její nedominantní paže je ohnuta v lokti a zevně otočena tak, aby její zápěstí bylo rovnoběžně s jejím uchem nebo aby její ruka byla vedle její hlavy (obrázek 1).
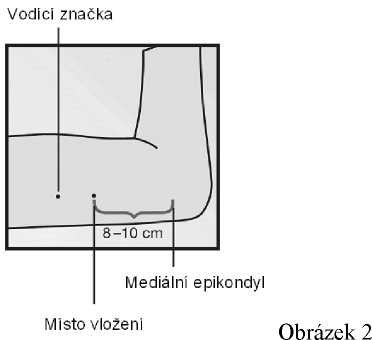
Identifikujte místo zavedení, které se nachází na vnitřní straně nedominantní paže, asi 8-10 cm nad mediálním epikondylem humeru.
Nakreslete si dvě značky sterilním fixem: první označuje místo, kde bude implantát vložen, druhá je umístěna několik centimetrů proximálně od první značky (obrázek 2). Druhá značka bude později sloužit jako vodítko během zavádění.
• Očistěte místo zavedení antiseptickým roztokem.
• Proveďte lokální anestezii místa zavedení (například anestetickým sprejem nebo injekcí 2 ml 1% roztoku lidokainu těsně pod kůži podél plánovaného zaváděcího kanálu).
• Vyjměte sterilní předplněný aplikátor na jedno použití obsahující přípravek Nexplanon z jeho blistru.
• Držte aplikátor těsně nad jehlou v místě vzorkované plochy. Odstraňte průhledný ochranný kryt z jehly posunutím horizontálně ve směru šipky (obrázek 3). Pokud kryt nejde snadno sejmout, nesmí se aplikátor použít. Při pohledu do špičky jehly můžete vidět bílý implantát. Nedotýkejte se fialového posuvníku, dokud jste jehlu úplně podkožně nezavedl(a), protože tím se zatáhne jehla a uvolní implantát z aplikátoru.
Obrázek 3
Volnou rukou napněte palcem a ukazovákem kůži okolo místa zavedení (obrázek 4).
Propíchněte kůži špičkou jehly skloněné pod úhlem přibližně 30° (obrázek 5).
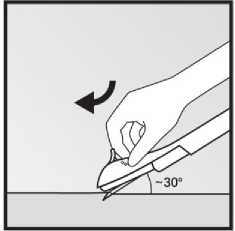
Obrázek 5
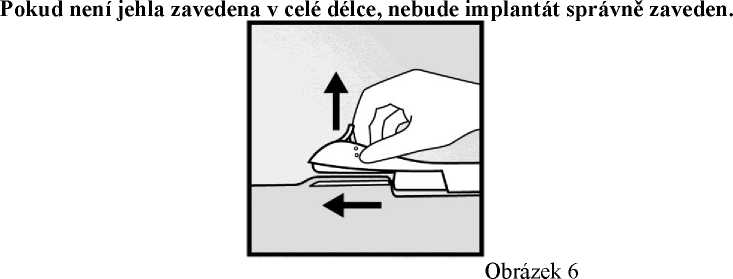
• Sklopte aplikátor do horizontální polohy. Za současného zvedání kůže špičkou jehly zasuňte jehlu v celé její délce. Můžete cítit mírný odpor, ale nepoužívejte nadměrnou sílu (obrázek 6).
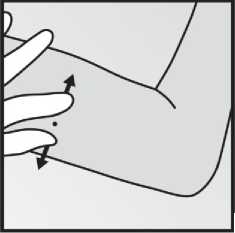
Obrázek 4
• Držte aplikátor stále ve stejné pozici s jehlou zavedenou v celé její délce. Pokud je potřeba, můžete použít Vaši volnou ruku k držení aplikátoru ve stejné pozici během celé následující procedury. Mírným stiskem odjistěte fialový posuvník. Posuňte jej zcela zpět až do okamžiku, kdy cvakne (obrázek 7). Tímto zanecháte implantát v jeho konečné podkožní lokalizaci, zatímco jehla se zafixuje uvnitř aplikátoru. Nyní je možné aplikátor odstranit. Pokud není aplikátor držen ve stejné pozici během celé procedury nebo pokud není fialový posuvník kompletně vytažen zpět, implantát nemusí být správně zaveden.
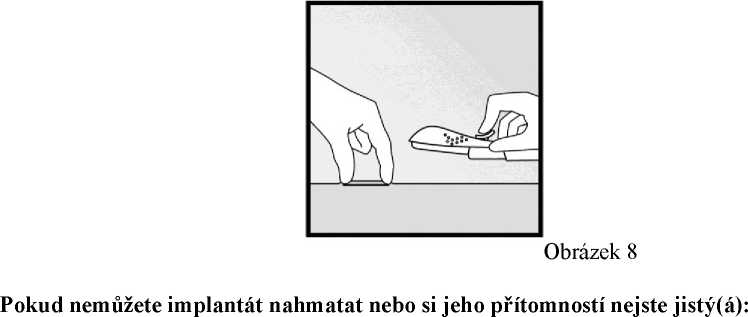
• Vždy si ihned po zavedení ověřte palpací správnou pozici implantátu v paži ženy. Palpací obou konců implantátu byste měl(a) být schopen(schopna) potvrdit přítomnost 4cm tyčinky (obrázek 8).
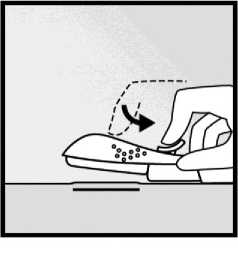
Obrázek 7
• Zkontrolujte aplikátor. Jehla by měla být plně zatažena a vidět by měl být pouze fialový konec obturátoru.
• Použijte jiné metody k potvrzení jeho přítomnosti. Vhodné metody jsou: dvourozměrný rentgenový snímek, výpočetní tomografie (CT), ultrazvukové vyšetření (UZ) s lineární sondou s vysokou frekvencí (10 MHz nebo více) nebo magnetická rezonance (MRI). Před použitím RTG, CT, UZ nebo MRI lokalizace implantátu se doporučuje kontaktovat místního zástupce přípravku Nexplanon pro instrukce. Pokud tyto zobrazovací metody selžou, doporučuje se ověřit přítomnost implantátu změřením hladin etonogestrelu v krevním vzorku pacientky.
V tomto případě místní zástupce poskytne odpovídající metodu. Dokud není ověřena přítomnost implantátu, je nutno používat nehormonální metodu antikoncepce.
• Přiložte malou náplast na místo vpichu injekce. Požádejte ženu, aby si implantát nahmatala.
• Přiložte sterilní gázu s tlakovým obvazem, aby se minimalizovala tvorba modřin. Žena může tlakový obvaz odstranit za 24 hodin a malou náplast na místě vpichu po 3 - 5 dnech.
• Vyplňte Kartičku uživatelky a předejte ji ženě k uschování. Vyplňte také samolepku a nalepte ji do dokumentace ženy.
• Aplikátor je určen na jedno použití a musí být vhodným způsobem zneškodněn v souladu s místními předpisy pro zacházení s biologicky nebezpečným odpadem.
Jak odstranit přípravek Nexplanon
Před zahájením odstranění si má zdravotnický pracovník v Kartičce uživatelky ověřit umístění implantátu Nexplanon. Přesnou polohu implantátu v paži si ověřte palpací.
Pokud není implantát hmatný, může být k ověření jeho polohy použit dvourozměrný rentgenový snímek. Nehmatný implantát má být před odstraňováním vždy nejdříve lokalizován. Vhodné metody pro lokalizaci zahrnují výpočetní tomografii (CT), ultrazvuk (UZ) s lineární sondou s vysokou frekvencí (10 MHz nebo více) a magnetickou rezonanci (MRI). Pokud se nepodaří lokalizovat implantát pomocí těchto metod, může být jeho přítomnost potvrzena stanovením hladiny etonogestrelu. Prosíme, kontaktujte místního zástupce s žádostí o další radu.
Po lokalizaci nehmatného implantátu zvažte provedení odstranění s naváděním ultrazvukem. Vzácně byly hlášeny případy migrace implantátu, které obvykle zahrnují drobný pohyb vzhledem k původní pozici, pokud není implantát zaveden příliš hluboko (viz také bod 4.4). To může komplikovat nalezení implantátu palpací, UZ a/nebo MRI a odstranění může vyžadovat větší incizi a více času.
Odstranění implantátu má být prováděno pouze za aseptických podmínek a zdravotnickým pracovníkem, který je s technikou odstranění seznámen.
Důrazně odrazujeme od operačního chirurgického průzkumu bez znalosti přesné lokalizace implantátu.
Odstranění hluboko zavedeného implantátu se má provádět opatrně vzhledem k prevenci poškození hlubší nervové nebo vaskulární struktury v paži a má ho provádět zdravotnický pracovník obeznámený s anatomií paže.
Pokud nemůže být implantát odstraněn, obraťte se na místního zástupce s žádostí o další radu.
Místo, kde bude proveden řez, očistěte a použijte dezinfekční prostředek. Lokalizujte implantát
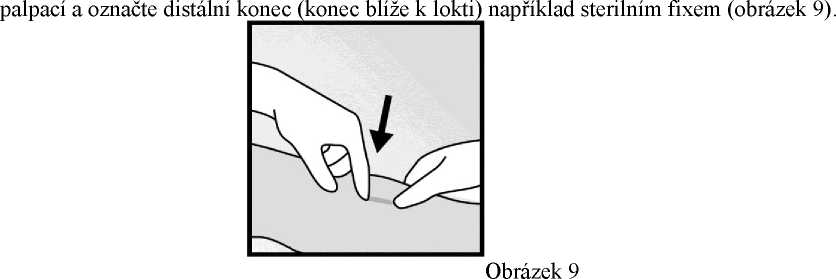
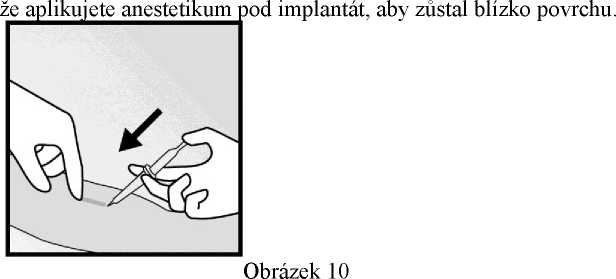
Proveďte lokální anestezii, například 0,5-1 ml 1% roztoku lidokainu v označeném místě incize (obrázek 10). Ujistěte se,
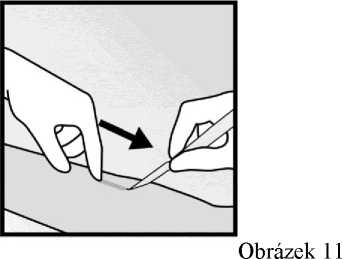
• Stlačte proximální konec implantátu pro jeho fixaci (obrázek 11); může se objevit hrbolek, který označuje distální konec implantátu. Začněte na distálním hrotu implantátu a proveďte podélnou 2mm incizi směrem k lokti.
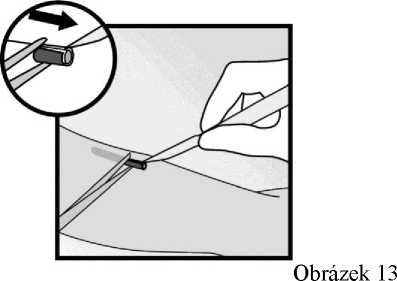
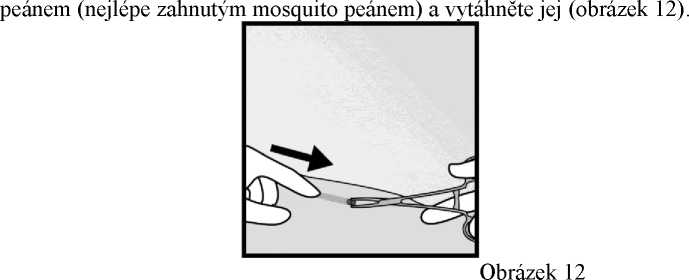
• Pokud je implantát enkapsulován, proveďte incizi do fibrotické tkáně a poté implantát peánem
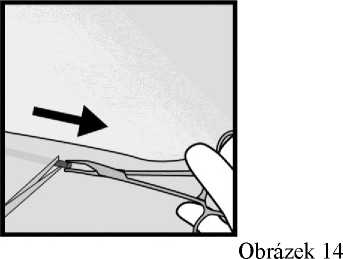
vytáhněte (obrázky 13 a 14).
• Jemně tlačte implantát směrem k incizi, až bude jeho konec viditelný. Uchopte implantát
• Pokud není hrot implantátu v incizi viditelný, jemně zaveďte peán do incize (obrázek 15). Přehoďte si peán do druhé ruky (obrázek 16) a druhým peánem oddělte šetrně tkáň okolo implantátu a implantát uchopte (obrázek 17). Pak lze implantát odstranit.
Obrázek 15
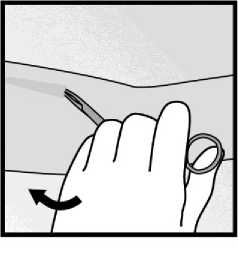
Obrázek 16
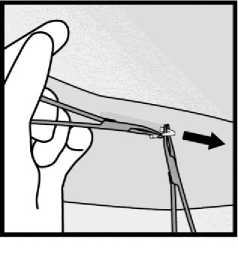
Obrázek 17
• Změřením délky implantátu se ujistěte, že byla vyjmuta celá tyčinka, která měří 4 cm. Byly hlášeny případy zlomení implantátu v paži pacientky. V některých případech bylo hlášeno
obtížné vyjímání zlomeného implantátu. Pokud je implantát vyjmut pouze částečně (méně než 4 cm), musí být zbývající část vyjmuta podle instrukcí uvedených v tomto bodě.
• Pokud si žena přeje pokračovat v používání přípravku Nexplanon, může být nový implantát vložen okamžitě po vyjmutí předchozího implantátu za použití stejné incize (viz bod 4.2 Jak vyměnit přípravek Nexplanon).
• Po vyjmutí implantátu incizi uzavřete náplasťovým stehem a přelepte.
• Přiložte sterilní gázu s tlakovým obvazem, aby nedošlo ke vzniku modřiny. Žena může tlakový obvaz odstranit za 24 hodin a náplast za 3-5 dní.
Jak vyměnit přípravek Nexplanon
Po odstranění předchozího implantátu může být okamžitě provedeno zavedení nového, stejným postupem, který je popsán v bodě 4.2 Jak zavést přípravek Nexplanon.
Nový implantát může být zaveden do téže paže stejnou incizí, kterou byl předchozí implantát odstraněn. Pokud je k zavedení nového implantátu použita stejná incize, proveďte lokální anestezii místa injekční aplikací anestetika těsně pod kůži (např. 2 ml 1% roztoku lidokainu), začněte kolem incize a pokračujte podél zaváděcího kanálu. Postupujte podle dalších kroků v pokynech pro zavedení.
4.3 Kontraindikace
• Aktivní žilní tromboembolická porucha.
• Známá nebo suspektní malignita senzitivní na pohlavní hormony.
• Nádory jater (benigní nebo maligní) současné nebo uvedené v anamnéze.
• Závažné onemocnění jater, probíhající nebo uvedené v anamnéze, dokud nedošlo k normalizaci jaterních funkcí.
• Vaginální krvácení neobjasněné etiologie.
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Při přítomnosti níže uvedených stavů/rizikových faktorů je třeba zvážit prospěch z použití gestagenu oproti případným rizikům pro každou jednotlivou ženu a tato rizika s ní prodiskutovat dříve, než se rozhodne začít používat přípravek Nexplanon. V případě zhoršení, exacerbace anebo prvního výskytu některého z níže uvedených stavů, se má žena obrátit na svého zdravotnického pracovníka. Ten poté rozhodne, zda má být používání přípravku Nexplanon ukončeno.
Karcinom prsu
Riziko karcinomu prsu se obecně zvyšuje s narůstajícím věkem. Při užívání (kombinovaných) perorálních kontraceptiv je riziko výskytu karcinomu prsu mírně zvýšeno. Toto zvýšené riziko postupně mizí během 10 let po ukončení jejich užívání a není závislé na délce užívání, ale na věku ženy, která je užívá. Očekávané počty diagnostikovaných případů na 10 000 žen užívajících kombinovanou perorální antikoncepci (do 10ti let po ukončení užívání) oproti ženám, které ji ve stejném období života nikdy neužívaly, byly vypočteny pro následující věkové skupiny takto: 4,5/4 (16 - 19 let), 17,5/16 (20 - 24 let), 48,7/44 (25 - 29 let), 110/100 (30 - 34 let), 180/160 (35 - 39 let) a 260/230 (40 - 44 let). Riziko u uživatelek kontracepčních metod obsahujících pouze gestageny je patrně podobného rozsahu jako riziko spojené s kombinovanou perorální antikoncepcí. U těchto metod jsou však doklady méně průkazné. V porovnání s absolutním rizikem vzniku karcinomu prsu během života je zvýšené riziko spojené s užíváním perorální antikoncepce nízké. Případy karcinomu prsu diagnostikované u uživatelek perorální antikoncepce bývají v méně pokročilém stádiu než u žen, které perorální antikoncepci neužívaly. Zvýšené riziko pozorované u uživatelek perorální antikoncepce může být způsobeno časnější diagnózou, biologickými účinky perorálních kontraceptiv anebo kombinací obou aspektů.
Onemocnění jater
Pokud dojde k akutní anebo chronické poruše jaterní funkce, je třeba ženu poslat ke specialistovi na vyšetření a konzultaci.
Trombotické a jiné cévní příhody
Epidemiologické výzkumy prokázaly souvislost užívání kombinované perorální antikoncepce (estrogen + gestagen) se zvýšeným výskytem venózní tromboembolie (VTE, hluboká venózní trombóza a plicní embolie) a arteriální tromboembolie (ATE, infarkt myokardu a ischemická mozková příhoda). Klinická relevance těchto zjištění pro etonogestrel (biologicky aktivní metabolit desogestrelu) používaný jako čistě gestagenní kontraceptivum za nepřítomnosti estrogenní složky není známa.
Omezené epidemiologické údaje nenaznačují zvýšené riziko VTE nebo ATE u žen používajících implantát; nicméně po uvedení přípravku na trh byly hlášeny případy VTE a ATE u žen používajících implantát obsahující etonogestrel. Doporučuje se zhodnotit rizikové faktory, o kterých je známo, že zvyšují riziko VTE a ATE. Ženy s tromboembolickými onemocněními v anamnéze je třeba upozornit na možnost znovuobjevení. V případě trombózy má být implantát odstraněn. Odstranění implantátu je třeba také zvážit při dlouhodobé imobilizaci z důvodu chirurgickému zákroku nebo onemocnění.
Zvýšený krevní tlak
Používání přípravku Nexplanon má být ukončeno, rozvine-li se v jeho průběhu trvalá hypertenze anebo nereaguje-li signifikantní zvýšení krevního tlaku adekvátně na antihypertenzní léčbu.
Účinky na metabolismus sacharidů
Používání kontraceptiv obsahujících gestagen může mít vliv na periferní inzulínovou rezistenci a glukózovou toleranci. Proto mají být diabetičky během prvních měsíců používání přípravku Nexplanon pečlivě sledovány.
Chloasma
V některých případech se může vyskytnout chloasma, zvláště u žen s chloasma gravidarum v anamnéze. Ženy, které mají sklon k tvorbě chloasma, by se během používání přípravku Nexplanon měly vyhnout působení slunečního anebo ultrafialového záření.
Tělesná hmotnost
Kontracepční účinek přípravku Nexplanon souvisí s plazmatickými hladinami etonogestrelu, které jsou nepřímo úměrné tělesné hmotnosti a po zavedení postupně během času klesají. Klinické zkušenosti s použitím u žen s vyšší hmotností ve třetím roce po zavedení jsou omezené. Proto nelze vyloučit, že kontracepční účinek může být u těchto žen během třetího roku používání nižší než u žen s normální tělesnou hmotností. Zdravotnický pracovník proto může u žen s vyšší tělesnou hmotností uvážit dřívější výměnu implantátu.
Komplikace zavedení
Vzácně, většinou v souvislosti s příliš hlubokým prvotním zavedením (viz bod 4.2 Jak zavést přípravek Nexplanon) a/nebo s vnější sílou (např. manipulací s implantátem nebo při kontaktních sportech), může implantát migrovat z místa zavedení. V těchto případech může být lokalizace implantátu mnohem obtížnější a odstranění může vyžadovat větší incizi (viz bod 4.2 Jak odstranit přípravek Nexplanon). Pokud není implantát odstraněn, antikoncepční účinek a riziko gestagen dependentních nežádoucích účinků, mohou přetrvávat déle, než si žena původně přála.
Zvláště v případě, kdy není implantát zaveden podle pokynů uvedených v bodě 4.2 Jak zavést přípravek Nexplanon nebo v důsledku lokálního zánětu, může dojít k jeho vypuzení.
Ovariální cysty
U všech hormonálních antikoncepčních přípravků s nízkou dávkou hormonů dochází k vývoji folikulů a občas může folikul pokračovat v růstu i poté, co dorostl velikosti, které by dosáhl v normálním cyklu. Obvykle tyto zvětšené folikuly spontánně zmizí. Často jsou asymptomatické. Někdy jsou spojeny s mírnou bolestí břicha a ve vzácných případech vyžadují chirurgickou intervenci.
Ektopické těhotenství
Ochrana před ektopickým těhotenstvím není u tradičních čistě gestagenních kontraceptiv tak účinná, jako u kombinovaných perorálních kontracepčních prostředků, což bylo spojováno s častým výskytem ovulace při použití těchto metod. Přestože Nexplanon bude ovulaci potlačovat, je třeba při diferenciální diagnostice amenorey anebo bolesti břicha u žen uvážit možnost ektopického těhotenství.
Další stavy
Níže uvedené stavy byly hlášeny jak během těhotenství, tak při užívání pohlavních hormonů, ale jejich souvislost s užíváním gestagenů nebyla prokázána: žloutenka a/nebo pruritus související s cholestázou; tvorba žlučových kamenů; porfyrie; systémový lupus erythematodes; hemolyticko-uremický syndrom; Sydenhamova chorea; herpes gestationis; ztráta sluchu související s otosklerózou a (dědičný) angioedém.
Lékařské vyšetření/konzultace
Před zavedením anebo opětovným zavedením přípravku Nexplanon, musí být zjištěna úplná anamnéza (včetně rodinné anamnézy) a vyloučeno těhotenství. Má být změřen krevní tlak a provedeno somatické vyšetření zaměřené na údaje uvedené v kontraindikacích (viz bod 4.3) a v upozorněních (viz bod 4.4). Je vhodné pozvat ženu na kontrolu za tři měsíce od zavedení přípravku Nexplanon. Při této kontrole má být změřen krevní tlak a je třeba se ženy zeptat, zda má nějaké otázky nebo potíže nebo se u ní vyskytly nežádoucí účinky. Frekvence a povaha dalších pravidelných kontrol by měla být podle posouzení lékaře přizpůsobena individuální potřebě ženy.
Ženy mají být poučeny, že Nexplanon nechrání před HIV (AIDS) a ostatními pohlavně přenosnými chorobami.
Snížená účinnost
Účinnost přípravku Nexplanon může být snížena při současném užívání dalších léčivých přípravků (viz bod 4.5).
Změny charakteru menstruačního krvácení
Během používání přípravku Nexplanon je pravděpodobné, že se u žen objeví změny charakteru menstruačního krvácení, které jsou předem nepředvídatelné. Ty mohou zahrnovat výskyt nepravidelného krvácení (nepřítomnost, méně časté, častější, kontinuální) a změny v intenzitě krvácení (snížená nebo zvýšená) nebo délky jeho trvání. Asi u 1 z 5 žen byla hlášena amenorea, zatímco u další 1 z 5 žen bylo hlášeno časté a/nebo prodloužené krvácení. Charakter krvácení během prvních tří měsíců je u mnoha žen prediktivní pro budoucí charakter krvácení. Akceptovat změny charakteru krvácení mohou ženě pomoci informace, poradenství a používání menstruačního kalendáře. Posouzení vaginálního krvácení má být provedeno ad hoc a může zahrnovat vyšetření k vyloučení gynekologické patologie anebo těhotenství.
Zlomený nebo ohnutý implantát in situ
Byly hlášeny případy zlomeného nebo ohnutého implantátu v paži pacientky. Na základě dat získaných in vitro může být rychlost uvolňování etonogestrelu mírně zvýšená, když je implantát zlomený nebo ohnutý. Nepředpokládá se, že by tato změna měla klinicky významný vliv.
Při odstraňování implantátu je důležité, aby byl vyjmut zcela (viz bod 4.2 Jak odstranit přípravek Nexplanon).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Poznámka: Je třeba vzít v úvahu preskripční informace souběžně podávané medikace, aby bylo možné stanovit potenciální interakce.
Vliv jiných léčivých přípravků na Nexplanon
Interakce mezi hormonálními kontracepčními přípravky a jinými léčivými přípravky mohou vést k menstruačnímu krvácení a/nebo k selhání antikoncepce. V literatuře byly hlášeny informace o následujících interakcích (hlavně s kombinovanými kontracepčními přípravky, ale příležitostně také s čistě gestagenními kontraceptivy).
Jaterní metabolismus
Může dojít k interakci s léčivými přípravky, které indukují jaterní enzymy, zvláště enzymy cytochromu P450, což může mít za následek zvýšenou clearance pohlavních hormonů (např. fenytoin, fenobarbital, primidon, bosentan, karbamazepin, rifampicin), a léčivými přípravky používanými při HIV (např. ritonavir, nelfinavir, nevirapin, efavirenz) a možná také oxkarbazepinem, topiramátem, felbamátem, griseofulvinem a rostlinnými přípravky obsahujícími třezalku tečkovanou (Hypericum perforatum).
Management
U žen léčených některým z výše zmíněných léčivých přípravků je vhodné, aby kromě přípravku Nexplanon navíc používaly nehormonální metodu antikoncepce. Při užívání léčivých přípravků indukujících jaterní enzymy má být nehormonální metoda antikoncepce používána po celou dobu současného podávání přípravku a dalších 28 dní po ukončení jeho podávání.
U žen, které jsou dlouhodobě léčeny přípravky indukujícími jaterní enzymy, se doporučuje implantát odstranit a poradit antikoncepční metodu, která není těmito přípravky ovlivněna.
Zvýšení plazmatických hladin hormonů spojené se současně podávanými léčivými přípravky Léčivé přípravky (např. ketokonazol), které inhibují jaterní enzymy, například CYP3A4, mohou zvýšit plazmatické hladiny hormonů.
Vliv přípravku Nexplanon na jiné léčivé přípravky
Hormonální kontracepční prostředky mohou zasahovat do metabolismu jiných léků. Podle toho mohou být jejich plazmatické a tkáňové koncentrace buď zvýšené (např. cyklosporin) nebo snížené (např. lamotrigin).
Laboratorní parametry
Údaje získané při používání kombinovaných perorálních kontraceptiv prokázaly, že kontracepční steroidní hormony mohou ovlivnit některé laboratorní parametry, včetně biochemických parametrů jaterních funkcí, funkcí štítné žlázy, renálních a adrenálních funkcí, sérových hladin (vazebných) proteinů, např. kortikosteroidy vázajícího globulinu a frakcí lipidů/lipoproteinů, parametrů metabolismu sacharidů a parametrů koagulace a fibrinolýzy. Obecně platí, že změny zůstávají v rozmezí normálních hodnot. Není známo, do jaké míry tato zjištění platí i pro čistě gestagenní kontraceptiva.
4.6 Fertilita, těhotenství a kojení
Používání přípravku Nexplanon v průběhu těhotenství není indikováno. Pokud dojde k otěhotnění při zavedeném přípravku Nexplanon, je třeba implantát odstranit. Studie na zvířatech prokázaly, že velmi vysoké dávky gestagenních látek mohou způsobit maskulinizaci samičích plodů. Rozsáhlé epidemiologické studie nezjistily zvýšené riziko vrozených vad u dětí matek, které před těhotenstvím užívaly perorální antikoncepci ani teratogenní účinky v případech, kdy byla perorální antikoncepce nechtěně užívána během těhotenství. Přestože tyto údaje pravděpodobně platí pro všechna perorální kontraceptiva, není jasné, zda je tomu tak i v případě přípravku Nexplanon.
Farmakovigilanční údaje pro různá perorální kontraceptiva obsahující etonogestrel a desogestrel (etonogestrel je metabolitem desogestrelu) nesvědčí o zvýšeném riziku.
Kojení
Klinická data ukazují, že přípravek Nexplanon neovlivňuje tvorbu a kvalitu (koncentraci bílkovin, laktózy nebo tuku) mateřského mléka. Malé množství etonogestrelu je však do mateřského mléka vylučováno. Za předpokladu, že dítě vypije denně 150 ml/kg mateřského mléka, je průměrná denní dávka etonogestrelu, kterou dítě přijme, a která je vypočítaná po měsíci jeho uvolňování z implantátu, asi 27 ng/kg/den. To odpovídá přibližně 2,2 % váze přizpůsobené mateřské denní dávky a přibližně 0,2 % odhadované absolutní mateřské denní dávky. Později se koncentrace etonogestrelu v mléce během laktace postupně snižuje.
K dispozici jsou limitované údaje dlouhodobého sledování 38 dětí, jejichž matkám byl implantát zaveden v období mezi 4. a 8. týdnem po porodu. Děti byly kojeny v průměru po dobu 14 měsíců a sledovány do 36. měsíce života. Vyhodnocení růstu a fyzického i psychomotorického vývoje nevykazovalo při srovnání se skupinou kojených dětí, jejichž matky měly zavedené nitroděložní tělísko (n=33), žádné rozdíly. Vývoj a růst dětí by měl nicméně být pečlivě sledován. Na základě dostupných údajů je možné přípravek Nexplanon v průběhu kojení používat a má být zaveden až po 4. týdnu po porodu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Na základě farmakodynamického profilu se předpokládá, že Nexplanon nemá žádný nebo jen zanedbatelný vliv na schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Během používání přípravku Nexplanon je pravděpodobné, že se u žen objeví změny charakteru menstruačního krvácení, které jsou předem nepředvídatelné. Ty mohou zahrnovat výskyt nepravidelného krvácení (nepřítomnost, méně časté, častější nebo kontinuální) a změny v intenzitě krvácení (snížená nebo zvýšená) nebo délky jeho trvání. Asi u 1 z 5 žen byla hlášena amenorea, zatímco u další 1 z 5 žen bylo hlášeno časté a/nebo prodloužené krvácení. Sporadicky bylo hlášeno silné krvácení. V klinických studiích byly změny menstruačního krvácení nejčastějším důvodem ukončení léčby (asi u 11 %). Charakter krvácení během prvních tří měsíců je u mnoha žen prediktivní pro budoucí charakter krvácení.
Možné nežádoucí účinky ohlášené v klinických studiích jsou uvedeny v následující tabulce.
|
Třídy orgánových systémů |
Nežádoucí účinky v terminologii MedDRA1 | ||
|
Velmi časté (> 1/10) |
Časté (> 1/100 až < 1/10) |
Méně časté (> 1/1000 až < 1/100) | |
|
Infekce a infestace |
vaginální infekce; |
faryngitida, rinitida; infekce močových cest; | |
|
Poruchy imunitního systému |
hypersenzitivita; | ||
|
Poruchy metabolismu a výživy |
zvýšená chuť k jídlu; | ||
|
Psychiatrické poruchy |
citová labilita; depresivní nálada; nervozita; snížení libida; |
úzkost; nespavost; | |
|
Poruchy nervového systému |
bolest hlavy; |
závrať; |
migréna; somnolence; |
|
Cévní poruchy |
návaly horka; | ||
|
Gastrointestinální poruchy |
bolest břicha; nauzea; flatulence; |
zvracení; zácpa; průjem; | |
|
Poruchy kůže a podkožní tkáně |
akné; |
alopecie; |
hypertrichóza; vyrážka; pruritus; |
|
Třídy orgánových systémů |
Nežádoucí účinky v terminologii MedDRA1 | ||
|
Velmi časté (> 1/10) |
Časté (> 1/100 až < 1/10) |
Méně časté (> 1/1000 až < 1/100) | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
bolest zad; artralgie; myalgie; bolest kosterního svalstva; | ||
|
Poruchy ledvin a močových cest |
dysurie; | ||
|
Poruchy reprodukčního systému a prsu |
citlivost prsou; bolest prsou; nepravidelná menstruace; |
dysmenorea; ovariální cysta; |
vaginální výtok; vulvovaginální diskomfort; galaktorea; zvětšení prsou; pruritus genitálií; |
|
Celkové poruchy a reakce v místě aplikace |
bolest v místě zavedení implantátu; reakce v místě zavedení implantátu; únava; onemocnění podobné chřipce; bolest; |
pyrexie; otoky; | |
|
Vyšetření |
zvýšení tělesné hmotnosti; |
snížení tělesné hmotnosti; | |
1 Jsou uvedeny nejvhodnější MedDRA termíny (verze 10.1) použité k popisu nežádoucích účinků. Synonyma nebo příbuzné stavy nejsou uvedeny, ale měly by být také brány v úvahu.
Po uvedení na trh byl ve vzácných případech pozorován klinicky významný vzestup krevního tlaku. Byly hlášeny i případy seborey. Mohou se objevit anafylaktické reakce, kopřivka, angioedém, zhoršení angioedému a/nebo zhoršení dědičného angioedému. Zavedení anebo odstranění implantátu může způsobit vytvoření modřiny, lehké lokální podráždění, bolest anebo svědění. V místě zavedení může dojít ke vzniku fibrózy, jizvy nebo se může vytvořit absces. Mohou se objevit parestezie nebo pocity podobné parestezii. Je možné vypuzení nebo migrace implantátu (viz bod 4.4). Pokud nejsou dodrženy instrukce (viz bod 4.2), může dojít k nesprávnému zavedení, obtížné lokalizaci a obtížnému vyjmutí implantátu. Chirurgický zákrok může být nezbytný pro odstranění implantátu.
Ve vzácných případech byly hlášeny případy mimoděložního těhotenství (viz bod 4.4).
U žen užívajících (kombinovaná perorální) kontraceptiva byla hlášena řada (závažných) nežádoucích účinků. K nim patří venózní tromboembolické poruchy, arteriální tromboembolické poruchy, nádory závislé na hormonech (např. nádory jater, rakovina prsu) a chloasma, některé z nich jsou detailněji popsány v bodě 4.4 Zvláštní upozornění a opatření pro použití.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu: Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10, webové stránky: http: //www .sukl .cz/nahlasit-nezadouci-ucinek.
4.9 Předávkování
Před zavedením nového implantátu musí být starý implantát vždy odstraněn. Údaje o předávkování etonogestrelem nejsou k dispozici. Obecně nejsou známy žádné závažné škodlivé účinky při předávkování kontraceptivy.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Hormonální antikoncepce pro systémové použití, gestageny, ATC kód: G03AC08
Mechanismus účinku
Nexplanon je rentgenkontrastní implantát nepodléhající biologickému rozkladu obsahující etonogestrel, určený k podkožnímu podání, dodávaný v předplněném sterilním aplikátoru na jedno použití. Etonogestrel je biologicky aktivní metabolit desogestrelu, gestagenu široce používaného v perorálních kontraceptivech. Strukturálně je odvozen od 19-nortestosteronu a váže se s vysokou afinitou na progesteronové receptory cílových orgánů. Kontracepční účinek etonogestrelu je primárně dosažen inhibicí ovulace. V prvních dvou letech používání implantátu nebyla ovulace pozorována a ve třetím roce pouze ojediněle. Kromě inhibice ovulace způsobuje etonogestrel také změny cervikálního hlenu, které znesnadňují průnik spermií.
Klinická účinnost a bezpečnost
Klinické studie byly provedeny u žen ve věku mezi 18 a 40 lety. Ačkoli neexistuje přímé srovnání, kontracepční účinnost se zdála být přinejmenším srovnatelná s tou, která je známa u kombinovaných perorálních kontraceptiv. Během klinických studií nebyla pozorována těhotenství během expozice 35 057 cyklů; sledovaný Pearl index je 0,00 (95 % CI: 0,00-0,14). Je však třeba si uvědomit, že v praxi nemůže být žádná metoda považována za 100% účinnou. Vysoký stupeň ochrany před otěhotněním je dosažen mimo jiné i tím, že kontracepční účinek přípravku Nexplanon není závislý na compliance ženy při užívání přípravku. Kontracepční účinek etonogestrelu je reverzibilní, jak je zřejmé z rychlého návratu normálního menstruačního cyklu po odstranění implantátu. Přestože etonogestrel inhibuje ovulaci, ovariální aktivita není zcela potlačena. Průměrné koncentrace estradiolu zůstávají vyšší, než jsou hodnoty pozorované v časné folikulární fázi. Ve dvouleté studii, při níž byla porovnávána kostní minerální denzita u 44 žen používajících přípravek Nexplanon a 29 žen používajících IUD (nitroděložní tělísko), nebyly pozorovány žádné nežádoucí účinky na kostní hmotu. Nebyly pozorovány žádné klinicky významné účinky na metabolismus lipidů. Používání kontraceptiv obsahujících gestagen může mít vliv na inzulínovou rezistenci a glukózovou toleranci. Klinické studie dále ukazují, že uživatelky přípravku Nexplanon mají často méně bolestivou menstruaci (dysmenorea).
5.2 Farmakokinetické vlastnosti
Absorbce
Po zavedení implantátu je etonogestrel rychle absorbován do krevního oběhu. Koncentrace inhibující ovulaci je dosaženo během 1 dne. Nejvyšší sérové koncentrace (mezi 472 a 1 270 pg/ml) je dosaženo za 1 až 13 dnů. Rychlost uvolňování z implantátu se časem postupně snižuje. V důsledku toho během několika prvních měsíců sérové koncentrace rychle klesají. Koncem prvního roku je průměrná koncentrace přibližně 200 pg/ml (rozmezí 150 - 261 pg/ml), která se pomalu snižuje na 156 pg/ml (rozmezí 111 - 202 pg/ml) na konci třetího roku. Pozorované rozdíly v sérových koncentracích lze do jisté míry přisuzovat rozdílům v tělesné hmotnosti.
Distribuce
Etonogestrel je z 95,5 - 99 % vázán na plazmatické bílkoviny, zejména na albumin a v menší míře na specifický vazebný globulin pro pohlavní hormony. Střední distribuční objem 27 l a celkový distribuční objem 220 l se během používání přípravku Nexplanon téměř nemění.
Biotransformace
Etonogestrel podléhá hydroxylaci a redukci. Metabolity jsou konjugovány na sulfáty a glukuronidy. Studie na zvířatech prokázaly, že se enterohepatální oběh na gestagenním účinku etonogestrelu pravděpodobně nepodílí.
Po intravenózním podání etonogestrelu je průměrný poločas eliminace přibližně 25 hodin a sérová clearance je přibližně 7,5 l/hod. Clearance i eliminační poločas zůstávají po dobu léčby stálé. Etonogestrel a jeho metabolity jsou vylučovány močí a stolicí (v poměru 1,5:1) v podobě volných steroidů anebo jako konjugáty. Po zavedení u kojících žen je etonogestrel vylučován do mateřského mléka s poměrem hladin mléko/sérum 0,44 - 0,50 během prvních čtyř měsíců. U kojících žen představuje průměrný přenos etonogestrelu na dítě asi 0,2 % odhadované absolutní mateřské denní dávky etonogestrelu (2,2 %, pokud jsou hodnoty vyjádřeny na kg tělesné hmotnosti). Koncentrace vykazují v průběhu doby postupný a statisticky významný pokles.
5.3 Předklinické údaje vztahující se k bezpečnosti
Toxikologické studie neodhalily žádné jiné účinky než ty, které jsou vysvětlitelné na základě hormonálních vlastností etonogestrelu, bez ohledu na způsob podání.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Implantát
Jádro: kopolymer ethylenu s vinylacetátem (28 % vinylacetátu, 43 mg)
síran barnatý (15 mg) magnesium-stearát (0,1 mg)
Povrch: kopolymer ethylenu s vinylacetátem (1 5 % vinylacetátu, 15 mg)
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti
5 let
Nexplanon nesmí být zaveden po uplynutí doby použitelnosti uvedené na obalu.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Uchovávejte v původním blistrovém obalu.
6.5 Druh obalu a obsah balení
Balení obsahuje jeden implantát (4 cm dlouhý o průměru 2 mm), který je vložen v nerezové jehle sterilního předplněného aplikátoru na jedno použití. Aplikátor obsahující implantát je zataven v blistru vyrobeném z průhledného polyetylentereftalát-glykolu (PETG) a uzavřeném krytem z polyethylenu s vysokou hustotou (HDPE). Obsah blistru je sterilní, pokud není obal poškozen nebo otevřen.
Velikost balení: Papírová krabička s 1 blistrem, papírová krabička s 5 blistry.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Viz bod 4.2.
Aplikátor je pouze na jedno použití.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
N.V. Organon, PO Box 20, 5340 BH Oss, Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
17/049/01-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
7.2.2001/20.6.2013
10. DATUM REVIZE TEXTU
6.10.2014
17