Nebido
Sp.zn.sukls166408/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Nebido
1000 mg/ 4 ml, injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden ml injekčního roztoku obsahuje testosteroni undecanoas 250 mg, což odpovídá testosteronum 157,9 mg.
Jedna ampulka/lahvička se 4 ml injekčního roztoku obsahuje testosteroni undecanoas 1000 mg, což odpovídá testosteronum 631,5 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok.
Čirý, nažloutlý, olejový roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Substituční léčba testosteronem u mužského hypogonadismu, pokud byl deficit testosteronu potvrzen klinickými příznaky a biochemickými vyšetřeními (viz bod 4.4).
4.2 Dávkování a způsob podání Dávkování
Jedna ampulka/lahvička Nebida (odpovídající 1000 mg testosteron undekanoátu) se aplikuje jednou za 10 až 14 týdnů. Tato frekvence injekcí postačuje k udržení dostatečných hladin testosteronu a nevede k jeho akumulaci.
Zahájení léčby
Před zahájením a v úvodu léčby je třeba stanovit sérové hladiny testosteronu. V závislosti na sérových hladinách testosteronu a klinických příznacích lze interval mezi prvními dvěma injekcemi na rozdíl od doporučeného udržovacího intervalu 10 až 14 týdnů zkrátit na minimálních 6 týdnů. Touto úvodní dávkou lze rychleji docílit dostatečných rovnovážných hladin testosteronu.
Udržovací léčba a individualizace terapie
Intervaly mezi injekcemi by měly být v doporučeném rozmezí 10 až 14 týdnů. Při udržovací terapii je nezbytné pečlivé sledování sérových hladin testosteronu. Doporučovány jsou pravidelné kontroly sérových hladin testosteronu. Odběry je třeba provádět na konci intervalu mezi injekcemi a s ohledem na klinické příznaky. Sérové hladiny testosteronu by měly být v dolní třetině referenčního rozmezí. Sérové hladiny pod dolní hranicí normy naznačují nutnost zkrácení intervalu mezi injekcemi. V případě vysokých sérových hladin je třeba zvážit prodloužení intervalu mezi injekcemi.
Speciální populace
Pediatrická populace
Přípravek Nebido není určen pro děti ani dospívající a nebyl u mužů mladších 18 let klinicky hodnocen (viz bod 4.4).
Starší osoby
Omezené údaje nenaznačují, že by bylo potřeba upravovat dávkování u starších osob (viz bod 4.4).
Pacienti s poruchou funkce jater
Nebyly provedeny žádné formální studie u pacientů s poruchou funkce jater. Užití Nebida je u mužů, kteří měli v minulosti nebo právě mají jaterní nádory, kontraindikováno (viz bod 4.3).
Pacienti s poruchou funkce ledvin
Nebyly provedeny žádné formální studie u pacientů s poruchou funkce ledvin.
Způsob podání
Intramuskulární podání.
Injekce se musí aplikovat velmi pomalu (po více než dvě minuty). Nebido je pouze k intramuskulárnímu podání. Je třeba dbát na to, aby byla injekce Nebida aplikována hluboko do hýžďového svalu, v souladu s obvyklými postupy při aplikaci intramuskulárních injekcí. Zvláštní pozornost je třeba věnovat zamezení intravazální injekce (viz bod 4.4 pod „Podání“). Obsah ampulky/lahvičky se aplikuje intramuskulárně bezprostředně po jejím otevření (pro ampulku viz bod 6.6 s návodem jak bezpečně otevřít ampuli).
4.3 Kontraindikace
Užití Nebida je kontraindikováno u mužů s:
- androgen-dependentním karcinomem prostaty nebo mužské mléčné žlázy
- dříve prodělanými nebo přítomnými nádory jater
- hypersenzitivitou na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Použití Nebida u žen je kontraindikováno.
4.4 Zvláštní upozornění a opatření pro použití
Nedoporučuje se používat Nebido k léčbě dětí a dospívajících.
Přípravek Nebido by měl být používán pouze v případě průkazu hypogonadismu (hyper- a hypogonadotropního), pokud byla před zahájením terapie vyloučena jiná etiologie, která by mohla příznaky způsobovat. Je třeba jednoznačně prokázat insuficienci testosteronu přítomností klinických příznaků (regrese sekundárních pohlavních znaků, změny stavby těla, astenie, pokles libida, erektilní dysfunkce apod.) a potvrdit dvěma samostatnými stanoveními koncentrace testosteronu v krvi.
Starší populace
Zkušenosti s bezpečností a účinností použití přípravku Nebido u pacientů ve věku nad 65 let jsou omezené. V současné době není žádný konsenzus ohledně referenčních hodnot testosteronu specifických pro věk. Je však třeba zvážit, že fyziologické hladiny testosteronu v séru se s věkem snižují.
Lékařské vyšetření a laboratorní testy Lékařská vyšetření
Před zahájením podávání testosteronu musí být všichni pacienti podrobně vyšetřeni, aby bylo vyloučeno riziko preexistujícího karcinomu prostaty. U pacientů léčených testosteronem je nezbytné nejméně jednou ročně provádět pečlivé a pravidelné kontroly prostaty a mléčných žláz v souladu s doporučenými postupy (digitální vyšetření per rectum a stanovení sérového PSA). U pacientů v pokročilém věku a u rizikových nemocných (s přítomností klinických nebo rodinných rizikových faktorů) je nezbytné provádět tato vyšetření dvakrát ročně.
V úvahu je třeba vzít lokální pokyny vztahující se k monitoringu bezpečnosti při substituční léčbě testosteronem.
Laboratorní testy
Hladina testosteronu by měla být monitorována na počátku léčby a v pravidelných intervalech během léčby. Lékaři by měli upravit dávku individuálně tak, aby bylo zajištěno udržení eugonadálních hladin testosteronu.
U pacientů na dlouhodobé androgenní léčbě by měly být také pravidelně sledovány následující laboratorní parametry: hemoglobin a hematokrit, jaterní funkce a lipidový profil (viz bod 4.8).
Z důvodu variability laboratorních hodnot je třeba všechna měření testosteronu provádět ve stejné laboratoři.
Nádory
Androgeny mohou akcelerovat progresi subklinického karcinomu prostaty a benigní hyperplazie prostaty.
Nebido je třeba používat s opatrností u pacientů s nádory, kteří mají riziko hyperkalcémie (a asociované hyperkalciurie) z důvodu kostních metastáz. U těchto nemocných se doporučuje pravidelné sledování sérových koncentrací vápníku.
U uživatelů hormonálních látek jako jsou androgenové látky se vyskytly benigní a maligní tumory jater. Pokud se u mužů, kteří používají Nebido, objeví vážné potíže v horní části břicha, zvětšení jater nebo příznaky intraabdominálního krvácení, je třeba do diferenciálně-diagnostických úvah zahrnout i jaterní nádory.
Srdeční, hepatální nebo renální insuficience
U pacientů se závažnou srdeční, hepatální nebo renální insuficiencí nebo s ischemickou chorobou srdeční může léčba testosteronem způsobit závažné komplikace charakterizované edémem s městnavým srdečním selháním nebo bez něj. V takovém případě musí být léčba ihned ukončena.
Hepatální nebo renální insuficience
Nebyly provedeny studie, hodnotící účinnost a bezpečnost tohoto léčivého přípravku u pacientů s postižením ledvin nebo jater. Proto je při substituční léčbě testosteronem u těchto pacientů potřebná opatrnost.
Srdeční insuficience
Opatrnosti je třeba u pacientů s predispozicí k edémům, např. v případě závažných srdečních, hepatálních nebo renálních insuficiencí nebo ischemické choroby srdeční, jelikož léčba androgeny může zvýšit retenci sodíku a vody. V případě závažných komplikací charakterizovaných edémem s nebo bez městnavého srdečního selhání musí být léčba ihned ukončena (viz bod 4.8).
Testosteron může způsobit zvýšení krevního tlaku a přípravek Nebido by se měl u mužů s hypertenzí používat s opatrností. Dle obecných pravidel je u pacientů se získanými nebo vrozenými poruchami srážlivosti krve vždy třeba uvážit rizika intramuskulární aplikace injekce.
Pacientům s epilepsií a migrénou je třeba podávat Nebido opatrně, protože může dojít ke zhoršení zmíněných stavů.
U nemocných léčených androgeny, kteří v důsledku substituční léčby dosahují normálních plazmatických koncentrací testosteronu, může dojít ke zlepšení inzulínové senzitivity.
Nadměrná expozice androgenům se může klinicky projevovat podrážděností, nervozitou, zvýšením tělesné hmotnosti, protrahovanými nebo častými erekcemi. Při výskytu těchto příznaků je potřebná úprava dávkování.
Může dojít k zesílení preexistující spánkové apnoe.
Sportovce léčené testosteronovou substitucí z důvodu primárního nebo sekundárního mužského hypogonadismu je třeba informovat o tom, že tento léčivý přípravek obsahuje aktivní látku způsobující pozitivní reakci v antidopingových testech.
Androgeny nejsou vhodné k posilování vývinu svalů u zdravých lidí ani ke zvyšování fyzické zdatnosti.
Jestliže příznaky nadměrné expozice androgenům přetrvávají nebo se opakovaně objevují v průběhu terapie při doporučovaných dávkovacích intervalech, je třeba léčbu Nebidem natrvalo ukončit.
Podání
Stejně jako jiné olejové roztoky, musí se Nebido aplikovat přísně intramuskulárně a velmi pomalu (po více než dvě minuty). Tuková mikroembolie plic může ve vzácných případech vést ke známkám a příznakům jako je kašel, dušnost, malátnost, nadměrné pocení, bolest na hrudníku, závrať, parestezie nebo synkopa. Tyto reakce se mohou objevit během injekce nebo bezprostředně po ní a jsou reverzibilní. Aby bylo zavčasu možno rozpoznat známky a příznaky tukové mikroembolie plic, musí být pacient během aplikace injekce a těsně po ní sledován. Léčba je obvykle podpůrná, např. podání kyslíku.
Byly hlášeny anafylaktické reakce, předpokládá se, že mohly mít souvislost s použitím Nebida.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Perorální antikoagulancia
U testosteronu a jeho derivátů byl popsán vliv na zvýšení aktivity perorálních antikoagulancií odvozených od kumarinu. Pacienti užívající perorální antikoagulancia musí být pod pečlivým dohledem, a to především na začátku nebo na konci terapie androgeny. Doporučuje se zvýšené sledování protrombinového času a INR.
Současné podání testosteronu a ACTH nebo kortikosteroidů může vystupňovat vznik otoků; tyto aktivní látky je proto třeba podávat obezřetně, a to především u nemocných s onemocněním srdce nebo jater anebo u pacientů se sklonem k otokům.
Interakce s laboratorními testy: androgeny mohou snížit hladiny globulinu vázajícího tyroxin, následkem čehož dochází k poklesu hladin celkového T4 a ke zvýšenému vychytávání T3 a T4. Hladiny volných hormonů štítné žlázy se však nemění a klinické nálezy nesvědčí pro dysfunkci štítné žlázy.
4.6 Fertilita, těhotenství a kojení
Fertilita
Substituční léčba testosteronem může reverzibilně snížit spermatogenezi (viz bod 4.8 a 5.3). Těhotenství a kojení
Nebido není určen k léčbě žen. Těhotné ani kojící ženy jej nesmějí používat (viz bod 4.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebido nemá žádný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nežádoucí účinky spojené s užíváním androgenů viz také bod 4.4.
Nejčastější hlášené nežádoucí účinky během léčby Nebidem jsou akné a bolest v místě injekce.
Tuková mikroembolie plic může ve vzácných případech vést ke známkám a příznakům jako je kašel, dušnost, malátnost, nadměrné pocení, bolest na hrudníku, závrať, parestezie nebo synkopa. Tyto reakce se mohou objevit během injekce, nebo bezprostředně po ní, a jsou reverzibilní. Případy, které společnost nebo ohlašující považovali za možné projevy tukové mikroembolizace plic, byly vzácně hlášeny v klinických studiích (^1/10 000 až < 1/1000 injekcí) i v postmarketingovém sledování (viz bod 4.4)
Byly hlášeny anafylaktické reakce, předpokládá se, že mohly mít souvislost s použitím Nebida.
Androgeny mohou akcelerovat progresi subklinického karcinomu prostaty a benigní hyperplazie prostaty.
Tabulka 1 níže uvádí nežádoucí reakce (ADR) podle orgánových systémů MedDRA (MedDRA SOCs) hlášené u Nebida. Frekvence jsou založeny na údajích z klinických studií a definované jako časté (> 1/100 až < 1/10), méně časté (> 1/1000 až < 1/100) a vzácné (> 1/10000 až
< 1/1000). Nežádoucí reakce byly hlášeny v 6 klinických studiích (N=422) a souvislost s léčbou Nebidem byla hodnocena přinejmenším jako možná.
Tabulkový seznam nežádoucích účinků
Tabulka 1, rozřazeno s ohledem na četnost u mužů s nežádoucími účinky, dle MedRA SOC -založeno na shromážděných datech ze šesti klinických hodnocení, N=422 (100 %), to je N=302 hypogonadálních mužů léčených i.m. injekcemi 4 ml a N=120 mužů léčených 3 ml TU 250 mg/ml.
|
Třída orgánových systémů |
Časté (>1/100 až < 1/10) |
Méně časté (>1/1000 až < 1/100) |
Vzácné (>1/10000 až < 1/1000) |
|
Poruchy krve a lymfatického systému |
Polycytémie Zvýšený hematokrit* Zvýšený počet červených krvinek* Zvýšený hemoglobin* | ||
|
Poruchy imunitního systému |
Hypersenzitivita | ||
|
Poruchy metabolismu a výživy |
Zvýšení tělesné hmotnosti |
Zvýšená chuť k jídlu Zvýšený glykosylovaný hemoglobin Hypercholesterolémie Zvýšené triglyceridy v krvi Zvýšený cholesterol v krvi | |
|
Psychiatrické poruchy |
Emoční poruchy Neklid | ||
|
Poruchy nervového systému |
Migréna | ||
|
Cévní poruchy |
Kardiovaskulární poruchy Hypertenze Závrať | ||
|
Respirační, hrudní a mediastinální poruchy |
Bronchitis Sinusitis Chrápání Dysfonie | ||
|
Gastrointestinální poruchy | |||
|
Poruchy jater a žlučových cest |
Abnormální jaterní testy Zvýšená aspartát aminotransferáza | ||
|
Poruchy kůže a podkožní tkáně |
Akné |
Alopecie Erytém Vyrážka1 Svědění Suchá kůže | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Bolest kloubů Bolest v končetinách Poruchy svalů2 Muskuloskeletální ztuhlost Zvýšená kreatin fosfokináza v krvi | ||
|
Poruchy ledvin a močových cest |
Snížený proud moče Retence moče Poruchy močového ústrojí |
|
Noční močení Dysurie | |||
|
Poruchy reprodukčního systému a prsu |
Zvýšení specifického prostatického antigenu Abnormální výsledky při vyšetření prostaty Benigní hyperplázie prostaty |
Intraepiteliální neoplasmata prostaty Indurace prostaty Prostatitis Poruchy prostaty Změny libida Testikulární bolest Indurace prsou Bolest prsou Gynekomastie Zvýšený estradiol Zvýšený testosteron | |
|
Celkové a jinde nezařazené reakce a lokální reakce po podání |
Různé typy reakcí v místě injekce3 |
Únava Astenie Hyperhidrosis4 | |
|
Poranění, otravy a procedurální komplikace |
Tuková mikroembolie plic** |
* Příslušná frekvence byla pozorována v souvislosti s použitím přípravků obsahujících testosteron. ** Frekvence je založena na počtu injekcí
K popisu určitých nežádoucích reakcí jsou použity nejvhodnější termíny dle databáze MedDRA. Synonyma nebo příbuzné stavy nejsou vyjmenovány, ale měly by být také brány v úvahu.
1 Vyrážka včetně papulární vyrážky
2 Svalové poruchy: spasmus svalů, napětí svalů a bolest svalů
3 Různé typy reakcí v místě injekce: bolest a nepříjemný pocit v místě injekce, svědění, erytém, hematom, podráždění a reakce obecně v místě podání injekce.
4 Hyperhidrosis: hyperhidrosis a noční pocení
Popis vybraných nežádoucích účinků
Tuková mikroembolie plic může ve vzácných případech vést ke známkám a symptomům jako jsou kašel, dušnost, malátnost, hyperhidróza, bolest na hrudníku, závrať, parestezie nebo mdloby. Tyto reakce se mohou vyskytnout v průběhu podání injekce nebo bezprostředně po ní a jsou reverzibilní. Případy, které společnost nebo ohlašující považovali za možné projevy tukové mikroembole plic, byly vzácně hlášeny v klinických studiích (>1/10 000 až < 1/1000 injekcí) i v postmarketingovém sledování (viz bod 4.4).
Kromě výše uvedených nežádoucích reakcí byly při léčbě přípravky obsahujícími testosteron hlášeny: nervozita, nepřátelství, spánková apnoe, různé kožní reakce včetně seborey, zvýšený růst ochlupení, zvýšená frekvence erekcí a velmi vzácně žloutenka.
Léčba vysokými dávkami testosteronu často reverzibilně přerušuje nebo snižuje spermatogenezi a redukuje velikost testes, substituční léčba hypogonadismu testosteronem může ve vzácných případech způsobit přetrvávající bolestivou erekci (priapismus). Léčba vysokými dávkami nebo dlouhodobé podávání testosteronu může příležitostně zvyšovat retenci tekutin nebo výskyt otoků.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: http://www.sukl .cz/nahlasit-nezadouci -ucinek
4.9 Předávkování
Po předávkování nejsou kromě ukončení léčby daným léčivým přípravkem nebo kromě redukce jeho dávky potřebná žádná zvláštní léčebná opatření.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Androgeny, 3-oxoandrosten (4) deriváty ATC kód: G03B A03
Testosteron undekanoát je ester přirozeně se vyskytujícího androgenu testosteronu. Aktivní forma - testosteron - vzniká odštěpením postranního řetězce.
Testosteron je nejdůležitější mužský androgen. K jeho syntéze dochází především v testes, malé množství vzniká v kůře nadledvin.
Testosteron je v průběhu fetálního období, v raném dětství a dospívání zodpovědný za mužské charakteristické rysy, posléze udržuje mužský fenotyp a androgen-dependentní funkce (např. spermatogenezi, přídavné pohlavní žlázy). Vykonává rovněž funkce např. v kůži, svalech, kostech, ledvinách, játrech, kostní dřeni a CNS.
V závislosti na cílovém orgánu je spektrum účinků testosteronu především androgenní (např. prostata, semenné váčky, nadvarlata) a nebo proteoanabolické (svaly, kosti, krvetvorba, ledviny, játra).
Ke vlivu testosteronu na některé orgány dochází po periferní konverzi testosteronu na estradiol, který se poté váže na estrogenové receptory jader cílových buněk, např. hypofýz a, tuková tkáň, mozek, kosti a testikulární Leydigovy buňky.
5.2 Farmakokinetické vlastnosti
Absorpce
Nebido je depotní přípravek k intramuskulární aplikaci s obsahem testosteron undekanoátu, který nepodléhá “first-pass”efektu. Po intramuskulární injekci olejového roztoku testosteron undekanoátu se směs postupně uvolňuje z depotního místa a je téměř úplně štěpena sérovými esterázami na testosteron a undekanovou kyselinu. Zvýšené sérové hladiny testosteronu nad základní hodnoty lze nalézt jeden den po podání přípravku.
Podmínky ustáleného stavu
Po aplikaci první intramuskulární injekce 1000 mg testosteron undekanoátu mužům s hypogonadismem bylo dosaženo průměrných hodnot Cmax 38 nmol/l (11 ng/ml) po 7 dnech. Druhá dávka byla podána 6 týdnů po první injekci, přičemž bylo dosaženo maximální koncentrace testosteronu přibližně ve výši 50 nmol/l (15 ng/ml). Následující tři injekce byly podány v konstantním dávkovacím intervalu 10 týdnů, ustáleného stavu bylo dosaženo mezi třetí a pátou injekcí. Průměrné hodnoty Cmax a Cmin testosteronu v ustáleném stavu byly přibližně 37 (11 ng/ml) a 16 nmol/l (5 ng/ml). Medián intra- a interindividuální variability (variační koeficient, %) hodnot Cmin byl 22 % (rozmezí: 9 - 28 %) a 34 % (rozmezí: 25 - 48 %).
Distribuce
V séru mužů je asi 98 % cirkulujícího testosteronu vázáno na globulin vázající pohlavní hormony (sex hormone binding globulin, SHBG) a na albumin. Za biologicky aktivní je pokládána pouze volná frakce testosteronu. Po intravenózní infúzi testosteronu mužům v pokročilém věku byl eliminační poločas testosteronu asi jedna hodina a zřejmý distribuční objem asi 1,0 l/kg.
Biotransformace
Testosteron, vznikající esterovým štěpením z testosteron undekanoátu, je metabolizován a vylučován stejně jako endogenní testosteron. Undekanoová kyselina je metabolizována B-oxidací stejně jako jiné alifatické karboxykyseliny. Hlavními aktivními metabolity testosteronu jsou estradiol a dihydrotestosteron.
Eliminace
Testosteron podléhá značnému hepatálnímu a extrahepatálnímu metabolizmu. Po podání radioaktivně značeného testosteronu se asi 90 % radioaktivity objevuje v moči ve formě konjugátů s kyselinou glukuronovou a sírovou a 6 % se po průchodu enterohepatálním oběhem nachází ve stolici. K produktům vylučovaným do moči patří androsteron a etiocholanolon. Po intramuskulárním podání tohoto depotního přípravku je rychlost uvolňování charakterizována poločasem přibližně 90±40 dnů.
5.3 Předklinické údaje vztahující se k bezpečnosti
Toxikologické studie neprokázaly jiné účinky Nebida, než které lze vysvětlit hormonálním profilem léku.
V in vitro testech na reverzním mutačním modelu (v Amesově testu) ani na křeččích ovariálních buňkách nebyl testosteron shledán mutagenním. Ve studiích na laboratorních zvířatech byl nalezen vztah mezi léčbou androgeny a některými nádory. Experimentální údaje ze studií na potkanech prokázaly po léčbě testosteronem zvýšený výskyt karcinomu prostaty.
Je známo, že pohlavní hormony urychlují rozvoj některých nádorů, indukovaných známými karcinogeny. Klinický význam zmíněného pozorování není znám.
Studie fertility na hlodavcích a primátech prokázaly, že léčba testosteronem může zhoršit plodnost z důvodu suprese spermatogeneze, přičemž tento vliv je závislý na výši dávky.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Benzylbenzoát Čištěný ricinový olej
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
5 let
Léčivý přípravek musí být použit ihned po otevření.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Ampulky
Ampulky 5 ml z hnědého skla (třída I), s plnícím objemem 4 ml. Velikost balení: 1 x 4 ml Lahvičky
Lahvičky 6 ml z hnědého skla (třída I), s šedou brombutylovou injekční zátkou (potaženo fólií ETFE) a víčkem s obrubou, s plnícím objemem 4 ml.
Velikost balení: 1 x 4 ml
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Roztok k intramuskulárnímu podání je třeba před podáním zkontrolovat zrakem. Lze použít pouze čiré roztoky bez příměsi.
Tento léčivý přípravek je určen pouze na jedno použití. Nepoužitý roztok je třeba zlikvidovat v souladu s místními požadavky.
Ampulka
Návod k použití OPC ampule (ampule naříznutá v jednom bodě)
Na ampuli pod barevným bodem je rýha, která omezuje potřebu pilovat hrdlo. Před otevřením se ujistěte, že veškerý roztok z horní části ampule přešel do spodní části ampule. K otevření použijte obě ruce, zatímco v jedné ruce držíte spodní část ampule, druhou rukou odlomte horní část ampule ve směru pryč od barevného bodu.
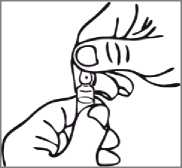
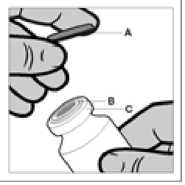
Lahvička
Lahvička je pouze na jedno použití. Obsah lahvičky musí být aplikován intramuskulárně ihned po natáhnutí do stříkačky. Po odstranění plastového víčka (A) neodstraňujte kovový kroužek (B) ani šroubovací uzávěr (C).
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Bayer Pharma AG D-13342 Berlín Německo
8. REGISTRAČNÍ ČÍSLO(A)
56/176/05-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15.6.2005
Datum posledního prodloužení registrace: 22.12.2008
10. DATUM REVIZE TEXTU
23.3.2016
12/12