Muconasal Plus
sp.zn. sukls119559/2009
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
MUCONASAL PLUS
1.18 mg/ml
nosní sprej, roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 ml roztoku obsahuje:
Tramazolini hydrochloridum monohydricum 1,265 mg, což odpovídá Tramazolini hydrochloridum
1.18 mg.
1 dávka obsahuje 70,0 mg roztoku a odpovídá 88 pg léčivé látky Tramazolini hydrochloridum monohydricum.
Pomocná látka se známým účinkem: přípravek obsahuje benzalkonium-chlorid.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Nosní sprej, roztok Čirý, světle žlutý roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Ke snížení otoku nosní sliznice, tj. k dekongesci nosní sliznice doprovázející běžná nachlazení a alergickou rýmu. Na doporučení lékaře k usnadnění odtoku sekretu při zánětech vedlejších nosních dutin a středního ucha (obstrukce Eustachovy trubice).
4.2 Dávkování a způsob podání
Dávkování
Muconasal Plus je určen k léčbě pouze dospělých a dětí od 6 let.
Podle potřeby 1 dávka do každé nosní dírky, maximálně 4x denně.
Dávkování je stejné pro dospělé a děti od 6 let.
Přípravek nesmí být podáván bez doporučení lékaře déle než 5 - 7 dnů u dospělých a déle než 3 dny u dětí.
Způsob podání
Pokyny pro použití dávkovacího rozprašovače
Před každým použitím je třeba dodržovat následující pokyny:
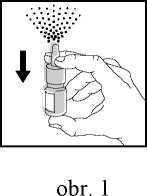
1. Sejměte ochranný kryt dávkovacího rozprašovače.
2. Před prvním použitím je nutno rozprašovač opakovaně stisknout ve směru znázorněném na obr. 1 až do vystříknutí spreje.
Při dalším použití je rozprašovač automaticky připraven k okamžité aplikaci.
Před použitím spreje se vždy vysmrkejte.
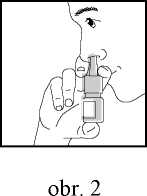
3. Nástavec spreje zasuňte do nosní dírky a rozprašovač jedenkrát stiskněte (viz obr. 2). Stejným způsobem aplikujte přípravek do druhé nosní dírky.
Při aplikaci spreje lehce nosem vdechněte.
4. Nasaďte opět ochranný kryt.
Po použití je doporučeno nástavec spreje opláchnout.
4.3 Kontraindikace
• hypersenzitivita na léčivou látku tramazolin-hydrochlorid nebo benzalkonium-chlorid nebo kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
• glaukom s úzkým úhlem
• po kraniálních chirurgických výkonech prováděných nasální cestou
• chronická suchá rýma (rhinitis sicca)
• Muconasal Plus není vhodný pro děti mladší než 6 let
• první trimestr těhotenství
4.4 Zvláštní upozornění a opatření pro použití
Muconasal Plus má být používán se zvýšenou opatrností a po poradě s lékařem u osob s arteriální hypertenzí, onemocněním srdce, hypertyreózou, hypertrofií prostaty, feochromocytomem a porfyrií vzhledem k možnému riziku systémové absorpce.
Opatrnost je třeba u pacientů užívajících inhibitory monoaminooxidázy (IMAO), tricyklická antidepresiva, vazokonstrikční látky a antihypertenziva (viz bod 4.5).
Nevymizí-li příznaky během 7 dnů léčby (u dětí do 3 dnů), je zapotřebí konzultovat lékaře, zda-li se má v léčbě pokračovat. Dlouhodobé podávání dekongescenčních přípravků (vazokonstrikčních přípravků k nosní aplikaci) může vést k vývoji chronického zánětu (a pocitu ucpaného nosu) a atrofii nosní sliznice.
Po ukončení aplikace se může objevit otok nosní sliznice (rebound fenomén).
Při aplikaci přípravku Muconasal Plus je třeba zabránit vniknutí spreje do očí, aby nedošlo k podráždění.
Muconasal Plus obsahuje konzervační látku benzalkonium-chlorid. Je dráždivý, může způsobit kožní reakce.
4.5 Interakce
Při současném podávání některých antidepresivních přípravků (inhibitorů monoaminooxidázy - IMAO nebo tricyklických antidepresiv) nebo vazokonstrikčních látek může docházet ke zvýšení krevního tlaku.
Současné podání s tricyklickými antidepresivy může vést ke vzniku arytmií.
Interakce s antihypertenzivy, zvláště těmi, které působí na sympatický nervový systém, může být komplexní a mít různé účinky na kardiovaskulární systém.
4.6 Fertilita, těhotenství a kojení
Dlouhodobé zkušenosti s podáváním přípravku neprokázaly nežádoucí účinky v období těhotenství. Bezpečnost podávání v průběhu laktace nebyla doposud stanovena.
Muconasal Plus se nesmí užívat v prvním trimestru těhotenství. V dalším průběhu těhotenství a během kojení má být lék užíván pouze na radu lékaře.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny.
Nicméně pacienti by měli být upozorněni, že se během užívání přípravku Muconasal Plus mohou vyskytnout nežádoucí účinky, jako jsou halucinace, ospalost, sedace, závratě a únava.
Proto je třeba opatrnosti při řízení vozidel nebo obsluze strojů. Jestliže se u pacienta vyskytnou výše zmíněné nežádoucí účinky, je třeba vyhnout se potenciálně rizikovým činnostem, jako je řízení vozidla nebo obsluha strojů.
4.8 Nežádoucí účinky
Následující nežádoucí účinky se mohou vyskytnout při užívání přípravku Muconasal Plus.
Jsou rozděleny podle frekvence výskytu za použití MedDRA konvence:
velmi časté (>1/10)
časté (>1/100 až <1/10)
méně časté (>1/1000 až <1/100)
vzácné (>1/10 000 až <1/1000)
velmi vzácné (<1/10 000)
není známo (z dostupných údajů nelze určit)
Poruchy imunitního systému
není známo: hypersenzitivita
Psychiatrické poruchy
méně časté: neklid
není známo: halucinace, nespavost
Poruchy nervového systému
méně časté: bolest hlavy
vzácné: závrať, dysgeuzie (porucha chuti)
není známo: spavost, sedace
Srdeční poruchy
méně časté: palpitace
není známo: arytmie, tachykardie
Respirační, hrudní a mediastinální poruchy časté: nosní obtíže
méně časté: otok nosní sliznice, suchost nosní sliznice, sekrece z nosu, kýchání
vzácné: epistaxe
Gastrointestinální poruchy méně časté: nauzea
Poruchy kůže a podkožní tkáně
není známo: vyrážka, svědění, otok kůže (jako příznaky hypersenzitivity)
Celkové poruchy a reakce v místě aplikace
není známo: otok sliznice (jako příznak hypersenzitivity), únava
Vyšetření
není známo: zvýšení krevního tlaku
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Příznaky
Zvýšení krevního tlaku a tachykardie mohou být, zvláště u dětí, následovány náhlým poklesem krevního tlaku, šokem, reflexní bradykardií a subnormálními teplotami.
Obdobně jako u jiných alfa-sympatomimetik může být klinický obraz intoxikace přípravkem Muconasal Plus matoucí, protože fáze stimulace a deprese CNS a kardiovaskulárního systému se mohou střídat. Zvláště u dětí vede intoxikace k účinkům na CNS - k epileptickým záchvatům a kómatu, bradykardii, respiračnímu útlumu. Symptomy stimulace CNS jsou úzkost, agitovanost, halucinace a epileptické záchvaty. Symptomy útlumu CNS jsou snížení tělesné teploty, letargie, somnolence a kóma.
Navíc se mohou vyskytnout následující symptomy: mydriáza, mióza, pocení, horečka, bledost, cyanóza rtů, kardiovaskulární dysfunkce včetně srdeční zástavy, respirační dysfunkce včetně selhání plic a zástavy dechu, psychické změny.
Terapie
V případě předávkování ihned vypláchnout nebo vyčistit pečlivě nos. V některých případech je nutná symptomatická léčba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Dekongesční a jiná nosní léčiva k lokální aplikaci, ATC kód: R01AA09
Léčivá látka přípravku Muconasal Plus, tramazolin-hydrochlorid, je alfa-sympatomimetikum s vazokonstrikčním účinkem snižujícím bezprostředně po podání otok nosní sliznice a mající za následek rychlé a dlouhotrvající zprůchodnění nosu.
Po podání Muconasal Plus se lokální vazokonstrikce projeví během 5 minut a přetrvává zpravidla 8 - 10 hodin.
5.2 Farmakokinetické vlastnosti
Farmakokinetické studie u člověka nebyly doposud provedeny.
Absorpce
Farmakokinetické vlastnosti tramazolinu byly sledovány u laboratorních potkanů, králíků a u primátů. Bylo zjištěno, že po perorální nebo intranazální aplikaci je 50 - 80% z podané dávky absorbováno.
4/6
Distribuce
Tramazolin a jeho metabolity jsou distribuovány do všech vnitřních orgánů s nejvyšší zjištěnou koncentrací v játrech.
Metabolismus a eliminace
Po perorálním a místním podání byly tři hlavní metabolity zjištěny v moči.
Eliminace tramazolinu a jeho metabolitů z krevního oběhu s terminálním poločasem 5 - 7 hodin je převážně renální.
5.3 Předklinické údaje vztahující se k bezpečnosti
Akutní toxicita tramazolin-hydrochloridu byla zjišťována u myší a potkanů. U myší byly hodnoty LD50 57 mg/kg po intraperitoneálním podání, 77 mg/kg po subkutánním podání a 195 mg/kg po perorálním podání, u potkanů různého stáří byly hodnoty LD50 po intraperitoneálním podání 37,5 (stáří 12-24 h), > 67 (stáří 30-33 dní), nebo 37 mg/kg (stáří 90-100 dní).
Studie chronické toxicity po perorálním podání byly provedeny u potkanů a opic.
Ve 12 měsíční studii u potkanů dávky až 3 mg/kg/den (jako dietní příměs) nevedly k žádným nežádoucím účinkům způsobeným léčivou látkou přípravku.
V 6 měsíční studii u potkanů při dávce 5 mg/kg/den (podání sondou), s výjimkou lehké proliferace intersticiální pojivové tkáně srdce, nebyl zjištěn žádný negativní nález.
Dávky až do 6 mg/kg/den po dobu 2 let nevyvolaly u opic žádné negativní zjištění.
V 90 denní studii u opic po intranasálních dávkách vyšších než je maximální doporučená denní dávka pro člověka, podávaných v 8 jednotlivých denních dávkách, nebyly zjištěny žádné nežádoucí účinky.
U králíků 7denní aplikace (kapátkem) roztoku tramazolin-hydrochloridu (60 mg/ml) 6krát denně nevyvolala žádné nežádoucí účinky kromě mydriázy.
V testu bakteriální reverzní mutace tramazolin-hydrochlorid nevyvolával genové mutace. Další studie genotoxicity nebyly provedeny. 2letá studie v dávkách do 3 mg/kg/den (jako dietní příměs) u potkanů neodhalila žádný důkaz pro kancerogenní účinek.
Při zjišťování toxického vlivu na reprodukční schopnosti potkanů a králíků nebyly zjištěny žádné teratogenní nebo embryotoxické účinky při perorálních dávkách až 3 mg/kg/den. U potkanů byla při dávkách > 3 mg/kg/den nalezena snížená produkce mateřského mléka. Nebylo však zaznamenáno žádné narušení samčí ani samičí fertility ani žádný vliv na prenatální a postnatální vývoj.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Monohydrát kyseliny citronové, hydroxid sodný, benzalkonium-chlorid, hypromelosa, povidon, glycerol 85%, heptahydrát síranu hořečnatého, hexahydrát chloridu hořečnatého, dihydrát chloridu vápenatého, hydrogenuhličitan sodný, chlorid sodný, cineol, levomenthol, přírodní kafr, čištěná voda
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
Po otevření je možné přípravek používat po dobu 12 měsíců.
6.4 Zvláštní opatření pro uchovávání
Žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Hnědá skleněná lahvička s mechanickou pumpičkou a nosním aplikátorem, krabička. Velikost balení: 10 ml.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim International GmbH Binger Strasse 173 Ingelheim am Rhein, Německo
8. REGISTRAČNÍ ČÍSLO
69/006/00-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 19.1.2000/
Datum posledního prodloužení registrace: 3.9.2014
10. DATUM REVIZE TEXTU
3.9.2014
6/6