Mitomycin Medac 20 Mg Prášek A Rozpouštědlo Pro Intravezikální Roztok
Sp.zn. sukls142415/2016
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Mitomycin medac 20 mg prášek a rozpouštědlo pro intravezikální roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička přípravku Mitomycin medac obsahuje mitomycinum 20 mg. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro intravezikální roztok
Prášek: šedý až šedomodrý prášek nebo koláč. Rozpouštědlo: čirý a bezbarvý roztok
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Mitomycin medac je indikován k intravezikálnímu podání k prevenci relapsu u dospělých pacientů s povrchovým karcinomem močového měchýře po transuretrální resekci.
4.2 Dávkování a způsob podání
Mitomycin medac musí být podáván lékaři se zkušenostmi s touto léčbou, a pouze pokud je to přísně indikováno.
Mitomycin medac je určen k intravezikálnímu podání po rekonstituci.
Dávkování
Existuje mnoho režimů intravezikálního podání mitomycinu, které se liší používanou dávkou mitomycinu, frekvencí instilace a délkou léčby.
Pokud není určeno jinak, dávkuje se 20 - 40 mg mitomycinu instilovaných do močového měchýře jednou týdně. Lze také používat režimy s instilacemi každé 2 týdny, každý měsíc nebo každé 3 měsíce.
O optimálním režimu, frekvenci a délce léčby by měl rozhodnout odborný lékař individuálně u každého pacienta.
Hodnota pH moči má být vyšší než pH 6.
Zvláštní populace
Dávka musí být snížena u pacientů, kteří podstoupili rozsáhlou předchozí cytostatickou léčbu, v případě myelosuprese nebo u starších pacientů.
O použití mitomycinu u pacientů > 65 let nejsou dostupné dostatečné údaje z klinických studií.
Přípravek nemá být používán u pacientů s poruchou funkce ledvin (viz bod 4.3).
Podávání přípravku se nedoporučuje u pacientů s poruchou funkce jater z důvodu nedostatku údajů o účinnosti a bezpečnosti u této skupiny pacientů.
Pediatrická populace
Bezpečnost a účinnost mitomycinu u dětí nebyla stanovena.
Nejsou dostupné žádné údaje.
Způsob podání
Mitomycin medac je určen k intravezikální instilaci po rozpuštění.
Návod k rekonstituci a naředění tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Kojení
Perforace stěny močového měchýře Cystitida
4.4 Zvláštní upozornění a opatření pro použití
Vzhledem k toxickým účinkům mitomycinu na kostní dřeň se musí jiné modality myelotoxické terapie (zejména jiná cytostatika, ozařování) podávat se zvláštní opatrností, aby se minimalizovalo riziko aditivní myelosuprese.
Dlouhodobá terapie může vést ke kumulativní toxicitě na kostní dřeň. Útlum kostní dřeně se může projevit pouze až s odstupem, v nejvyšší míře se projevuje po 4 - 6 týdnech, akumuluje se po prodlouženém používání, a proto často vyžaduje individuální úpravu dávky.
U starších pacientů se často vyskytuje snížení fyziologických funkcí, deprese kostní dřeně, což může být déletrvající, proto je u této populace nutno mitomycin podávat se zvláštní opatrností a za pečlivého sledování pacientova stavu.
Mitomycin je mutagenní a potenciálně kancerogenní látka pro člověka. Je třeba zabránit styku s kůží a sliznicemi.
V případě výskytu plicních příznaků, které nelze připsat základnímu onemocnění, je nutno léčbu okamžitě zastavit. Plicní toxicitu lze dobře léčit steroidy.
Léčba má být také okamžitě zastavena, pokud j sou přítomny příznaky hemolýzy nebo známky renální dysfunkce (nefrotoxicita). Výskyt hemolyticko-uremického syndromu (HUS: ireverzibilní renální selhání, mikroangiopatická hemolytická anémie [syndrom MAHA] a trombocytopenie) je často fatální.
Při dávkách > 30 mg mitomycinu/m2 tělesného povrchu byla pozorována mikroangiopatická hemolytická anémie. Doporučuje se pečlivé sledování renálních funkcí.
Nové nálezy naznačují, že k odstranění imunitních komplexů, které podle všeho hrají významnou roli v nástupu příznaků, může být vhodný terapeutický pokus za použití stafylokokového proteinu A.
U pacientů současně léčených jinými cytostatiky byl hlášen výskyt akutní leukémie (v některých případech po preleukemické fázi) a myelodysplastického syndromu.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Možná interakce při systémové terapii
Jsou možné myelotoxické interakce s jinými léčebnými modalitami toxickými pro kostní dřeň (zejména s jinými cytotoxickými léčivými přípravky, ozařováním).
Kombinace s vinka alkaloidy nebo bleomycinem může zvýšit plicní toxicitu.
U pacientů dostávajících současnou léčbu mitomycinem a fluoruracilem nebo tamoxifenem bylo hlášeno zvýšené riziko hemolyticko-uremického syndromu.
V pokusech na zvířatech vedlo podávání pyridoxin-hydrochloridu (vitamínu B6) ke ztrátě účinku mitomycinu.
Ve spojení s léčbou mitomycinem se nemají podávat žádné injekce živých vakcín, protože to může způsobit zvýšené riziko infekce živou vakcínou.
Mitomycin může zvýšit kardiotoxicitu doxorubicinu.
4.6 Fertilita, těhotenství a kojení
Údaje o podávání mitomycinu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Mitomycin má mutagenní, teratogenní a kancerogenní účinek, a může proto narušit vývoj embrya.
Ženy nesmí během léčby mitomycinem otěhotnět. V případě těhotenství během léčby musí být poskytnuto genetické poradenství.
Kojení
Zdá se, že se mitomycin vylučuje do lidského mateřského mléka. Vzhledem k jeho prokázaným mutagenním, teratogenním a kancerogenním účinkům musí být kojení během léčby mitomycinem přerušeno (viz bod 4.3).
Fertilita
Pohlavně zralí pacienti mají během chemoterapie a 6 měsíců po ní používat antikoncepci nebo sexuálně abstinovat.
Mitomycin je genotoxický. Mužům, kteří jsou léčeni mitomycinem, se proto doporučuje nepočít dítě během léčby a ještě 6 měsíců po ní a poradit se o konzervaci spermií před zahájením terapie vzhledem k možnosti ireverzibilní neplodnosti způsobené terapií mitomycinem.
4.7 Účinky na schopnost řídit a obsluhovat stroje
I při používání podle pokynů může tento léčivý přípravek vyvolat nauzeu a zvracení, a tak snížit reakční dobu do takové míry, že schopnost řídit motorová vozidla nebo obsluhovat stroje je narušena. To platí ještě více ve spojení s alkoholem.
4.8 Nežádoucí účinky
Nežádoucí účinky jsou uvedeny níže podle třídy orgánových systémů a frekvence. Frekvence uvedené níže j sou definovány takto:
Velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1000 až < 1/100), vzácné (> 1/10000 až < 1/1000), velmi vzácné (< 1/10000) nebo není známo (z dostupných údajů nelze určit).
Možné nežádoucí účinky při intravezikální terapii
Nežádoucí účinky mohou být způsobeny buď roztokem pro intravezikální instilaci nebo být následkem hluboké resekce.
Nejčastějšími nežádoucími účinky intravezikálně podaného mitomycinu jsou alergické kožní reakce v podobě lokálního exantému (např. kontaktní dermatitida, také v podobě palmárního a plantárního erytému) a cystitida.
|
Poruchy kůže a podkožní tkáně |
Časté Alergická kožní vyrážka, kontaktní dermatitida, palmoplantární erytém, pruritus Vzácné Generalizovaný exantém |
|
Poruchy ledvin a močových cest |
Časté Cystitida (potenciálně hemoraaická), dysurie, nykturie, polakisurie, hematurie, lokální podráždění stěny močového měchýře Velmi vzácné nebo není známo Nekrotizující cystitida, alergická (eozinofilní) cystitida, stenóza vývodných cest močových, snížená kapacita močového měchýře, kalcifikace stěny močového měchýře, fibróza stěny močového měchýře, perforace močového měchýře. |
Pokud se cystitida vyskytne, má být podána symptomatická léčba lokálními antiflogistiky a analgetiky. Ve většině případů lze v léčbě mitomycinem pokračovat, v případě potřeby ve snížené dávce. Byly hlášeny ojedinělé případy alergické (eozinofilní) cystitidy, které vyžadovaly přerušení terapie.
Po intravezikálním podání se do systémového oběhu dostává jen malé množství mitomycinu. Nicméně ve velmi vzácných případech byly hlášeny následující systémové nežádoucí účinky:
Možné systémové nežádoucí účinky vyskytující se velmi vzácně po intravezikálním podání
|
Poruchy krve a lymfatického systému |
Leukocytopenie, trombocytopenie |
|
Respirační, hrudní a mediastinální poruchy |
Intersticiální plicní onemocnění |
|
Gastrointestinální poruchy | |
|
Poruchy jater a žlučových cest |
Zvýšení hladin transamináz |
|
Poruchy kůže a podkožní tkáně |
Alopecie |
|
Poruchy ledvin a močových cest |
Renální dysfunkce |
|
Celkové poruchy a reakce v místě aplikace |
Možné nežádoucí účinky při systémové terapii
Nejčastějšími nežádoucími účinky systémově podávaného mitomycinu jsou gastrointestinální příznaky, jako je nauzea, zvracení, útlum kostní dřeně s leukopenií a většinou dominující trombocytopenií. Tento útlum kostní dřeně se vyskytuje až u 65 % pacientů.
Až u 10 % pacientů se musí očekávat závažná orgánová toxicita v podobě intersticiální pneumonie nebo nefrotoxicity.
Mitomycin je potenciálně hepatotoxický.
|
Poruchy krve a lymfatického systému |
Velmi časté Útlum kostní dřeně, leukopenie, trombocytopenie Vzácné Život ohrožující infekce, sepse, hemolytická anémie |
|
Poruchy imunitního systému |
Velmi vzácné Těžká alergická reakce |
|
Srdeční poruchy |
Vzácné Srdeční selhání po předchozí terapii antracykliny |
|
Respirační, hrudní a mediastinální poruchy |
Časté Intersticiální pneumonie, dyspnoe, kašel, dušnost Vzácné Plicní hypertenze, plicní venookluzivní nemoc (PVOD) |
|
Gastrointestinální poruchy |
Velmi časté Nauzea, zvracení Méně časté |
|
Poruchy jater a žlučových cest |
Vzácné Jaterní dysfunkce, zvýšení hladin transamináz, žloutenka, venookluzivní choroba (VOD) jater |
|
Poruchy kůže a podkožní tkáně |
Časté Exantém, alergická kožní vyrážka, kontaktní dermatitida, palmoplantární erytém Méně časté Alopecie Vzácné Generalizovaný exantém |
|
Poruchy ledvin a močových cest |
Časté Renální dysfunkce, zvýšení hladiny sérového kreatininu, glomerulopatie, nefrotoxicita Vzácné Hemolyticko-uremický syndrom (HUS) (často fatální), mikroangiopatická hemolytická anémie (syndrom MAHA) |
|
Celkové poruchy a reakce v místě aplikace |
Časté Po extravazaci: Celulitida, nekróza tkáně Méně časté Horečka |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
V případě předávkování se musí očekávat závažná myelotoxicita nebo až myeloftíza, přičemž plně vyvinutý klinický účinek se objevuje přibližně až za 2 týdny.
Doba, za kterou počet leukocytů klesne na nejnižší hodnotu, může činit 4 týdny. Při podezření na předávkování musí být proto také provedeno prodloužené pečlivé hematologické sledování.
Doposud však žádné případy předávkování při intravezikálním podání mitomycinu nebyly hlášeny. Jelikož není k dispozici žádné účinné antidotum, je třeba při každém podání postupovat s nejvyšší opatrností.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: cytostatika, cytotoxická antibiotika a příbuzné látky, jiná cytotoxická antibiotika, ATC kód: L01DC03
Antibiotikum mitomycin je cytostatický léčivý přípravek ze skupiny alkylačních látek.
Mitomycin je antibiotikum s cytostatickým účinkem, které je izolováno ze Streptomyces caespitosus.
Je přítomno v neaktivní podobě. K aktivaci na trifunkční alkylační látku dochází rychle, buď při fyziologickém pH za přítomnosti NADPH v séru nebo intracelulárně prakticky ve všech buňkách těla s výjimkou mozku, jelikož mitomycin nepřestupuje přes hematoencefalickou bariéru. Tyto tři alkylační radikály jsou odvozeny z chinonu, aziridinu a uretanové skupiny. Mechanismus účinku je založen převážně na alkylaci DNA (v menší míře RNA), s odpovídající inhibicí syntézy DNA. Míra poškození DNA koreluje s klinickým účinkem a je nižší v rezistentních buňkách než v buňkách citlivých. Stejně jako u jiných alkylačních látek jsou proliferující buňky poškozeny do větší míry než buňky v klidové fázi (G0) buněčného cyklu. Navíc, zvláště při použití vyšších dávek, jsou uvolňovány volné peroxidové radikály, které způsobují zlomy v DNA. Uvolňování peroxidových radikálů je spojeno s orgánově specifickým výskytem nežádoucích účinků.
5.2 Farmakokinetické vlastnosti
Po intravenózním podání 10 - 20 mg/m2 mitomycinu byly naměřeny maximální plazmatické hladiny 0,4 - 3,2 ^g/ml. Biologický poločas je krátký, mezi 40 a 50 minutami. Sérová hladina klesá biexponenciálně, prudce během prvních 45 minut a posléze pomaleji.
Po přibližně 3 hodinách jsou sérové hladiny obvykle pod hranicí detekce. Hlavním místem metabolismu a eliminace jsou játra. V souladu s tím byly vysoké koncentrace mitomycinu nalezeny ve žlučníku. Renální exkrece hraje v eliminaci jen menší roli.
Při intravezikální terapii je mitomycin absorbován pouze v nevýznamných dávkách. Nicméně systémový účinek nelze zcela vyloučit.
5.3 Předklinické údaje vztahující se k bezpečnosti
Ve studiích na zvířatech má mitomycin toxický účinek na všechny proliferující tkáně, zejména na buňky kostní dřeně a gastrointestinální sliznice, a je inhibována spermatogeneze.
Mitomycin má mutagenní, kancerogenní a teratogenní vlastnosti, které lze prokázat ve vhodných experimentálních modelech.
Při injekci mimo žílu nebo v případě extravazace do okolní tkáně mitomycin vyvolává těžkou nekrózu.
FARMACEUTICKÉ ÚDAJE
6.
6.1 Seznam pomocných látek
Prášek pro roztok k intravezikálnímu podání: močovina Rozpouštědlo pro intravezikální roztok: chlorid sodný a voda na injekci.
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
Mitomycin medac, injekční lahvičky s 20 mg mitomycinu a instilační souprava 9 měsíců
Po rekonstituci má být přípravek použit okamžitě.
6.4 Zvláštní opatření pro uchovávání
Neuchovávejte při teplotě nad 25 °C. Uchovávejte injekční lahvičku v krabičce, aby byl přípravek chráněn před světlem.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Mitomycin medac se dodává v injekčních lahvičkách z čirého skla (třídy I) s bromobutylovou pryžovou zátkou potaženou fluoropolymerem a s odklápěcím hliníkovým uzávěrem.
Balení obsahující 1 injekční lahvičku (20 ml), 1 PVC vak o objemu 20 ml s roztokem chloridu sodného 0,9 %, katetry
Balení obsahující 4 injekční lahvičky (20 ml), 4 PVC vaky o objemu 20 ml s roztokem chloridu sodného 0,9 %, katetry
Balení obsahující 5 injekčních lahviček (20 ml), 5 PVC vaků o objemu 20 ml s roztokem chloridu sodného 0,9 %, katetry
Balení obsahující 6 injekčních lahviček (20 ml), 6 PVC vaků o objemu 20 ml s roztokem chloridu
sodného 0,9 %, katetry
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Rozpusťte obsah jedné injekční lahvičky přípravku Mitomycin medac (odpovídá 20 mg mitomycinu) ve 20 ml sterilního 0,9% roztoku chloridu sodného. Obsah injekční lahvičky musí být rozpuštěn tak, aby během 2 minut vznikl modrofialový čirý roztok.
Smí být použity pouze čiré roztoky.
Obsah injekčních lahviček je určen pouze pro jednorázové použití / jedno podání. Nepoužitý roztok musí být zlikvidován.
Chraňte rekonstituovaný roztok před světlem.
Mitomycin medac nesmí být používán ve smíšených injekcích. Jiné injekční nebo infuzní roztoky musí být podávány samostatně.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod k použití rozpouštědla pro intravezikální roztok (instilační souprava)
Obr. 1 - 7:
(1)
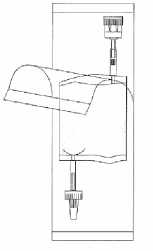
Roztrhněte ochranný kryt, avšak neodstraňujte jej úplně! Bude to chránit konec instilačního systému před kontaminací až do posledního okamžiku.
(2)
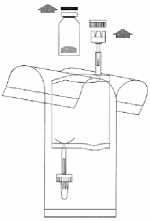
Sejměte víčka z injekční lahvičky a instilačního systému. Připravte si odpadní vak.
(3)
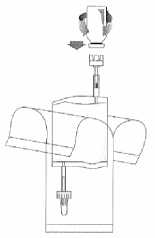
Držte injekční lahvičku ve svislé poloze, pevně ji zatlačte na adaptér instilačního systému a jednou nebo dvakrát ji otočte.
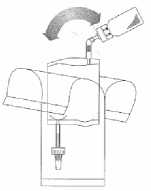
Držte hadičku (nikoliv injekční lahvičku) pevně ve svislé poloze, zlomte horní ventil ohnutím vpřed a vzad.
(5)
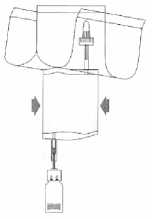
Načerpejte tekutinu do injekční lahvičky, ale neplňte injekční lahvičku úplně.
(6)
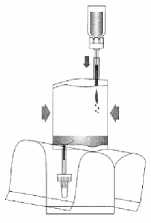
Převraťte celý systém. Držte injekční lahvičku nahoře a načerpejte do ní vzduch. Natáhněte rozpuštěný mitomycin do instilačního systému. Injekční lahvičku nesnímejte.
(7)
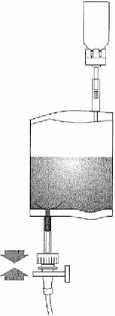
Držte instilační systém ve svislé poloze. Nyní úplně odstraňte ochranný kryt. Připojte katetr k systému. Nyní zlomte těsnící mechanismus v oblasti hadičky ohnutím vpřed a vzad a instilujte roztok. Po ukončení instilace odpojte katetr protlačením vzduchu. Držte vak s rozpouštědlem zmáčknutý a přeneste jej spolu s katetrem do odpadního vaku.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
medac Gesellschaft fur klinische Spezialpraparate mbH Theaterstr. 6 22880 Wedel Německo
Tel.: +49 4103 8006-0 Fax: +49 4103 8006-100
8. REGISTRAČNÍ ČÍSLO(A)
44/085/16-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 2.3.2016 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
11.5.2016