Menyan 0,25 Mg/0,035 Mg Tablety
Sp.zn.sukls106319/2016
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Menyan 0,25 mg/0,035 mg tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tableta obsahuje norgestimatum 250 mikrogramů a ethinylestradiolum 35 mikrogramů.
Pomocné látky se známým účinkem:
Jedna tableta obsahuje 89,357 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tableta
Kulaté, modré, nepotahované, ploché tablety o průměru 6,4 mm se zkosenými hranami, na jedné straně vyraženo „146“, druhá strana bez označení
4 KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Perorální antikoncepce
Rozhodnutí předepsat přípravek Menyan 0,25 mg/0,035 mg tablety by mělo být provedeno po zvážení jednotlivých současných rizikových faktorů ženy, zvláště rizikových faktorů pro žilní tromboembolismus (VTE), a toho, jaké je riziko VTE u přípravku Menyan 0,25 mg/0,035 mg tablety v porovnání s dalšími přípravky CHC (viz body 4.3 a 4.4).
4.2 Dávkování a způsob podání
Perorální podání.
Dávkování
Pediatrická populace
Přípravek Menyan 0,25 mg/0,035 mg tablety je kontraindikován u dívek, které nedosáhly pubertálního věku - před první menstruací (viz bod 4.3).
Dospělí
Jedna tableta denně je užívána 21 po sobě jdoucích dní ve stejnou dobu (nejlépe večer), následovaných 7denní přestávkou v užívání. Každý následný blistr je zahájen po uplynutí 7denní přestávky v užívání.
V takovém případě nejsou nutná žádná další antikoncepční opatření.
V průběhu přestávky v užívání tablet může dojít ke krvácení, obvykle počínaje 2 až 4 dny po podání poslední tablety.
Starší pacienti
Tento přípravek není určen ženám po menopauze.
Způsob podání Zahájení léčby
Užívání tablety se zahájí 1. den přirozeného cyklu ženy (tj. první den jejího menstruačního krvácení).
Přechod z jiného antikoncepčního přípravku
Přechod z jiné kombinované hormonální antikoncepce (kombinovaná perorální antikoncepce, vaginální kroužek, transdermální náplast)
Žena by měla začít užívat přípravek Menyan 0,25 mg/0,035 mg tablety nejlépe v den po poslední účinné tabletě (poslední tableta obsahující účinné látky) její předchozí kombinované hormonální antikoncepce, ale nejpozději v den po obvyklém období bez tablety nebo po tabletě placeba její předcházející kombinované hormonální antikoncepce. V případě použití vaginálního kroužku nebo transdermální náplasti by měla žena zahájit používání přípravku Menyan 0,25 mg/0,035 mg tablety nejlépe v den vyjmutí, ale nejpozději v den, kdy měla být provedena aplikace.
Přechod z metody pouze s progestogenem (progestogenová pilulka, injekce, implantát nebo nitroděložní tělísko uvolňující progestogen)
Žena může přejít kterýkoliv den z progestogenové pilulky (z implantátu nebo nitroděložního systému v den jeho vyjmutí, z injekčních přípravků, když má být podána další injekce), ale měla by ve všech těchto případech být poučena o použití další bariérové metody po dobu prvních 7 dnů užívání tablety.
Užívání po porodu
Po vaginálním porodu, pokud je žena plně mobilní a nejsou přítomny žádné puerperální komplikace, může být podávání perorální antikoncepce u nekojících matek zahájeno 21 dní po porodu. Žádná další antikoncepční opatření nejsou nutná. Pokud je poporodní užívání zahájeno více než 21 dnů po porodu, je třeba po dobu prvních 7 dní od začátku užívání tablet použít některé další antikoncepční opatření.
Pokud po porodu došlo k pohlavnímu styku, je třeba před zahájením užívání perorální antikoncepce vyčkat na první den prvního menstruačního krvácení.
Pro více informací pro kojící matky viz body 4.3, 4.4 a 4.6.
Užívání po interrupci nebo potratu
Po interrupci v prvním trimestru
Žena může začít užívat okamžitě. Pokud tak učiní, není třeba žádné další antikoncepční opatření.
Po porodu nebo interrupci v druhém trimestru
Ženě je třeba doporučit, aby zahájila užívání mezi 21. až 28. dnem po porodu nebo po interrupci ve druhém trimestru. Pokud užívání zahájí později, je třeba doporučit současné používání některé bariérové antikoncepční metody po dobu prvních 7 dní. Pokud však již předtím došlo k pohlavnímu styku, je třeba před skutečným zahájením užívání kombinované perorální antikoncepce vyloučit těhotenství nebo musí žena vyčkat na první menstruační krvácení.
Kojící ženy viz bod 4.6.
Vynechání periody
Pro vynechání periody musí být v den po ukončení užívání současného blistru zahájeno užívání nového blistru přípravku Menyan 0,25 mg/0,035 mg tablety (žena vynechá dny bez užívání tablet). Užívání tablet bude pokračovat obvyklým způsobem.
V průběhu užívání druhého blistru může u ženy docházet k lehkému špinění nebo ke krvácení z průniku, pokud však nedojde k vynechání tablety, nebude antikoncepční ochrana snížena.
Další blistr přípravku Menyan 0,25 mg/0,035 mg tablety je zahájen po obvyklé 7denní přestávce bez tablety, bez ohledu na to, zda došlo k úplnému ukončení menstruace nebo ne.
Snížení spolehlivosti
Pokud je přípravek Menyan 0,25 mg/0,035 mg tablety užíván v souladu s pokyny pro použití, je možnost otěhotnění velmi nepravděpodobná. Za následujících okolností však může být spolehlivost perorální antikoncepce snížena:
Postup v případě vynechání tablet
Pokud se žena opozdí o méně než 12 hodin s užitím jakékoliv tablety, není antikoncepční ochrana snížená. Žena by měla užít tabletu co nejdříve si vzpomene a další tablety by měla užít v obvyklou dobu.
Pokud se opozdí o více než 12 hodin s užitím jakékoliv tablety, antikoncepční ochrana může být snížená. Postup v případě vynechaných tablet může vycházet z následujících dvou základních pravidel:
1. Užívání tablet nesmí být nikdy přerušeno na delší dobu než 7 dny.
2. K dosažení adekvátní suprese osy hypothalamus-hypofýza-ovaria je nutných 7 dnů nepřerušeného užívání tablet.
Dle toho je možné pro denní praxi poskytnout následující doporučení:
• Den 1-7
Žena by měla užít poslední zapomenutou tabletu co nejdříve, jakmile si vzpomene, i když by to znamenalo užívání dvou tablet ve stejnou dobu. Potom pokračuje v užívání dalších tablet v obvyklou dobu. Současně by se po dobu dalších 7 dnů měla používat bariérová metoda, například kondom. Pokud došlo k pohlavnímu styku v předcházejících 7 dnech, je třeba zvážit možnost těhotenství. Čím více tablet vynecháte a čím blíže se tak stane k pravidelným přestávkám v podávání, tím vyšší riziko otěhotnění existuje.
• Den 8-14
Žena by měla užít poslední zapomenutou tabletu co nejdříve, jakmile si vzpomene, i když by to znamenalo užívání dvou tablet ve stejnou dobu. Potom pokračuje v užívání dalších tablet v obvyklou dobu. Za předpokladu, že žena užila své tablety správně během 7 dnů před první vynechanou tabletou, není potřeba používat žádné další antikoncepční prostředky. Nicméně pokud zapomněla užít více než 1 tabletu, je třeba ženě doporučit použití dalších opatření po dobu 7 dnů.
• Den 15-21
Riziko snížené spolehlivosti hrozí z důvodu nadcházejících 7 dnů bez tablety. Nicméně upravením plánu užívání tablet je možné snížení antikoncepční ochrany i nadále zabránit. Za předpokladu, že žena užila své tablety během 7 dnů před první vynechanou tabletou správně, není proto při dodržení kterékoli z následujících dvou možností nutné používat žádná další antikoncepční opatření. Pokud tomu tak není, měla by žena pokračovat první z následujících dvou možností a měla by po dobu následujících 7 dnů používat také další antikoncepční opatření.
1. Žena by měla užít poslední zapomenutou tabletu co nejdříve, jakmile si vzpomene, i když by to znamenalo užívání dvou tablet ve stejnou dobu. Potom pokračuje v užívání dalších tablet v obvyklou dobu. Další blistr je nutné zahájit co nejdříve po dokončení současného blistru, tzn. mezi jednotlivými blistry by neměla být žádná časová mezera. U ženy pravděpodobně nedojde k žádnému krvácení z vysazení do konce druhého blistru, ve dnech užívání tablet se však může vyskytnout špinění nebo krvácení z průniku.
2. Ženě je možné také doporučit, aby ukončila užívání tablet ze současného blistru. Pak by měla mít pauzu 7 dnů bez tablet, včetně dnů, kdy zapomněla tablety užít, a pak pokračovat dalším blistrem.
Pokud žena zapomene užít tablety a nevyskytne se žádné krvácení z vysazení v prvním normálním období bez podávání tablet, je třeba zvážit možnost těhotenství.
V případě těžkých gastrointestinálních poruch (např. zvracení nebo průjem) nemusí být vstřebání kompletní a je třeba použít další antikoncepční opatření. Pokud dojde ke zvracení během 3-4 hodin po užití tablet, je třeba co nejdříve užít novou (náhradní) tabletu. Novou tabletu je třeba dle možností užít během 12 hodin, kdy se tablety obvykle užívají. Pokud uběhne více než 12 hodin, platí doporučení týkající se vynechaných tablet v bodě „Postup v případě vynechání tablet“. Pokud žena nechce měnit svůj normální plán užívání tablet, musí užít další tabletu(y) z dalšího blistru.
4.3 Kontraindikace
Kombinovaná hormonální antikoncepce (CHC) by se neměla používat u následujících stavů.
• Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
• Přítomnost nebo riziko žilního tromboembolismu (VTE)
o žilní tromboembolismus - současný žilní tromboembolismus (léčený pomocí antikoagulancií) nebo anamnéza VTE (např. hluboká žilní trombóza [DVT] nebo plicní embolie [PE])
o známá dědičná nebo získaná predispozice pro žilní tromboembolismus, jako je rezistence na APC (včetně faktoru V Leiden), deficit antitrombinu III, deficit proteinu C, deficit proteinu S
o velký chirurgický zákrok s déletrvající imobilizací (viz bod 4.4)
o vysoké riziko žilního tromboembolismu v důsledku přítomnosti více rizikových faktorů (viz bod 4.4);
• Přítomnost nebo riziko arteriálního tromboembolismu (ATE)
o arteriální tromboembolismus - současný arteriální tromboembolismus, anamnéza arteriálního tromboembolismu (např. infarkt myokardu) nebo prodromální stav (např. angina pectoris);
o cerebrovaskulámí onemocnění - současná cévní mozková příhoda, anamnéza
cévní mozkové příhody nebo prodromálního stavu (např. tranzitorní ischemická ataka, TIA);
o známá hereditární nebo získaná predispozice k arteriálnímu tromboembolismu, jako je hyperhomocysteinémie a antifosfolipidové protilátky (antikardiolipinové protilátky, lupus antikoagulans);
o anamnéza migrény s fekálními neurologickými příznaky;
o vysoké riziko arteriálního tromboembolismu v důsledku vícečetných rizikových faktorů (viz bod 4.4) nebo přítomnosti jednoho závažného rizikového faktoru, j ako j e:
• diabetes mellitus s cévními příznaky;
• závažná hypertenze;
• závažná dyslipoproteinémie.
• Kojící matky méně než 6 týdnů po porodu.
• Karcinom endometria nebo jiné známé estrogen-dependentní neoplasie nebo podezření na ně.
• Nediagnostikované abnormální vaginální krvácení.
• Kouření 15 nebo více cigaret denně u pacientek ve věku 35 let a starších.
• Akutní nebo chronické onemocnění jater včetně hepatitidy (virové nebo nevirové) nebo těžké cirhózy, nebo anamnéza těchto stavů do minimálně 3 měsíců po návratu těchto abnormálních testů funkce jater do normálu; jaterní adenomy nebo karcinomy.
• Přítomnost nebo podezření na přítomnost karcinomu prsu.
• Pankreatitida nebo pankreatitida v anamnéze, pokud souvisí s těžkou hypertriglyceridemií.
• Přípravek Menyan 0,25 mg/0,035 mg tablety je kontraindikován u dívek, které nedosáhly pubertálního věku - před první menstruací.
Pokud při prvním použití přípravku Menyan 0,25 mg/0,035 mg tablety dojde k jakémukoli z těchto stavů, musí být užívání tablet okamžitě přerušeno.
4.4 Zvláštní upozornění a opatření pro použití
Upozornění
Pokud jsou přítomna jakákoli onemocnění nebo rizikové faktory uvedené níže, měla by být vhodnost přípravku Menyan 0,25 mg/0,035 mg tablety s ženou prodiskutována.
V případě zhoršení nebo prvního výskytu jakéhokoli z těchto stavů nebo rizikových faktorů by mělo být ženě doporučeno, aby kontaktovala svého lékaře, který stanoví, zda by měla užívání přípravku Menyan 0,25 mg/0,035 mg tablety ukončit.
Riziko žilního tromboembolismu (VTE)
Užívání jakékoli kombinované hormonální antikoncepce (CHC) zvyšuje riziko žilního tromboembolismu (VTE) ve srovnání s jejím neužíváním. Přípravky, které obsahují levonorgestrel, norgestimát (včetně přípravku Menyan
0,25 mg/0,035 mg tablety) nebo norethisteron jsou spojovány s nejnižším rizikem VTE. Rozhodnutí používat přípravek Menyan 0,25 mg/0,035 mg tablety by mělo být učiněno po diskusi se ženou, aby se zajistilo, že rozumí riziku VTE u přípravku Menyan 0,25 mg/0,035 mg tablety, rozumí, jak její současné rizikové faktory toto riziko ovlivňují a že riziko VTE je nejvyšší v prvním roce užívání léku. Existují také některé důkazy, že riziko je zvýšené, když je CHC opětovně zahájena po pauze v užívání trvající 4 týdny nebo déle.
U žen, které neužívají CHC a nejsou těhotné, se asi u 2 z 10 000 vyvine VTE v průběhu jednoho roku. U každé jednotlivé ženy však může být riziko daleko vyšší v závislosti na jejích základních rizikových faktorech (viz níže).
Odhaduje se, že z 10 000 žen, které používají CHC obsahující levonorgestrel se asi u 61 vyvine VTE během jednoho roku.
Současné důkazy naznačují, že riziko VTE při použití CHC obsahující norgestimát je podobné jako riziko u CHC obsahující levonorgestrel.
Tento počet VTE za rok je menší než počet očekávaný u žen během těhotenství nebo po porodu.
VTE může být fatální v 1-2 % případů.
1 Střední bod rozmezí 5-7 na 10 000 WY (žen-roků) na základě relativního rizika pro CHC obsahující levonorgestrel oproti jejímu nepoužívání přibližně 2,3 až 3,6
Počet příhod VTE na 10 000 žen za rok
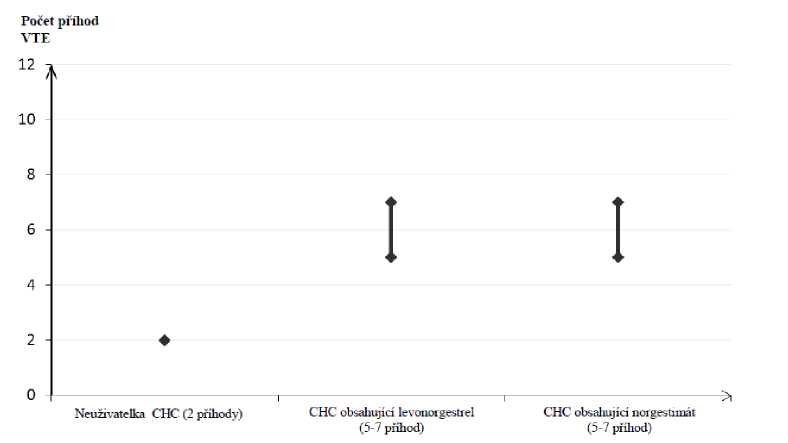
Extrémně vzácně byla hlášena trombóza u uživatelek CHC v dalších cévách, např. jaterních, mezenterických, renálních nebo retinálních žilách a tepnách.
Rizikové faktory VTE
Riziko žilních tromboembolických komplikací u uživatelek CHC se může podstatně zvyšovat u ženy, která má další rizikové faktory, zvláště pokud je přítomno více rizikových faktorů (viz tabulka).
Přípravek Menyan 0,25 mg/0,035 mg tablety je kontraindikován, pokud má žena více rizikových faktorů, které pro ni představují vysoké riziko žilní trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů - v tomto případě by mělo být zváženo její celkové riziko VTE. Pokud je poměr přínosů a rizik považován za negativní, neměla by být CHC předepisována (viz bod 4.3).
Tabulka: Rizikové faktory VTE
|
Rizikový faktor |
Poznámka |
|
Obezita (index tělesné hmotnosti nad 30 kg/m2) |
Při zvýšení BMI se významně zvyšuje riziko. Zvláště důležité je zvážit, zda jsou také přítomny další rizikové faktory. |
|
Prodloužená imobilizace, velký chirurgický zákrok, jakýkoli chirurgický zákrok na nohách a pánvi, neurochirurgický zákrok nebo větší trauma. |
V těchto situacích je doporučeno ukončit používání/užívání náplasti/pilulky/kroužku (v případě plánovaného chirurgického výkonu minimálně 4 týdny předem) a nezahajovat užívání/používání do dvou týdnů po kompletní remobilizaci. Měla by se použít další antikoncepční metoda pro zabránění nechtěnému těhotenství. |
|
Poznámka: dočasná imobilizace, včetně cestování letadlem > 4 hodiny může být také rizikovým faktorem VTE, zvláště u žen s dalšími rizikovými faktory |
Antitrombotická léčba by měla být zvážena, pokud přípravek Menyan0,25 mg/0,035 mg tablety nebyl předem vysazen. |
|
Pozitivní rodinná anamnéza (žilní tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). |
Pokud je suspektní hereditární predispozice, měla by být žena před rozhodnutím o používání jakékoli CHC odeslána k odborníkovi na konzultaci |
|
Další onemocnění související s VTE |
Zhoubné onemocnění, systémový lupus erytematodes, hemolyticko-uremický syndrom, chronické zánětlivé onemocnění střev (Crohnova choroba nebo ulcerózní kolitida) a srpkovitá anémie |
|
Vyšší věk |
Zvláště nad 35 let |
Není žádná shoda o možné roli varixů a povrchové tromboflebitidy v nástupu nebo progresi žilní trombózy.
Zvýšené riziko tromboembolismu v těhotenství a zvláště během šestinedělí musí být zváženo (pro informaci o „Fertilitě, těhotenství a kojení“ viz bod 4.6).
Příznaky VTE (hluboká žilní trombóza a plicní embolie)
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky hluboké žilní trombózy (DVT) mohou zahrnovat:
- jednostranný otok nohy a/nebo chodidla nebo podél žíly v noze;
- bolest nebo citlivost v noze, která může být pociťována pouze vstoje nebo při chůzi;
- zvýšenou teplotu postižené nohy, zarudnutí nebo změnu barvy kůže nohy. Příznaky plicní embolie (PE) mohou zahrnovat:
- náhlý nástup nevysvětlitelné dušnosti nebo rychlého dýchání;
- náhlý kašel, který může být spojený s hemoptýzou;
- ostrou bolest na hrudi;
- těžké točení hlavy nebo závrať způsobené světlem;
- rychlý nebo nepravidelný srdeční tep.
Některé z těchto příznaků (např. „dušnost“, „kašel“) nejsou specifické a mohou být nesprávně interpretovány jako častější nebo méně závažné příhody (např. infekce dýchacího traktu).
Dalšími známkami cévní okluze mohou být: náhlá bolest, otok a světle modré zbarvení končetin.
Pokud nastane okluze v oku, mohou se příznaky pohybovat od nebolestivého rozmazaného vidění, které může přejít do ztráty zraku. Někdy může nastat ztráta zraku téměř okamžitě.
Riziko arteriálního tromboembolismu (ATE)
Epidemiologické studie spojovaly používání CHC se zvýšeným rizikem arteriálního tromboembolismu (infarkt myokardu) nebo cerebrovaskulární příhody (např. tranzitorní ischemická ataka, cévní mozková příhoda). Arteriální tromboembolické příhody mohou být fatální.
Rizikové faktory ATE
Riziko arteriálních tromboembolických komplikací nebo cerebrovaskulární příhody u uživatelek CHC se zvyšuje u žen s rizikovými faktory (viz tabulka). Přípravek Menyan 0,25 mg/0,035 mg tablety je kontraindikován, pokud má žena jeden závažný rizikový faktor nebo více rizikových faktorů ATE, které pro ni představují riziko arteriální trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů - v tomto případě by mělo být zváženo její celkové riziko. Pokud je poměr přínosů a rizik považován za negativní, neměla by být CHC předepisována (viz bod 4.3).
Tabulka: Rizikové faktory ATE
|
Rizikový faktor |
Poznámka |
|
Vyšší věk |
Zvláště nad 35 let |
|
Kouření |
Ženě by mělo být doporučeno, aby nekouřila, pokud chce používat CHC. Ženám ve věku nad 35 let, které dále kouří, by mělo být důrazně doporučeno, aby používaly jinou metodu antikoncepce. |
|
Hypertenze |
|
Obezita (index tělesné hmotnosti nad 30 kg/m2) |
Při zvýšení BMI se významně zvyšuje riziko. Zvláště důležité u žen s dalšími rizikovými faktory |
|
Pozitivní rodinná anamnéza (arteriální tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). |
Pokud je suspektní hereditární predispozice, měla by být žena odeslána k odborníkovi na konzultaci před rozhodnutím o používání jakékoli CHC |
|
Migréna |
Zvýšení frekvence nebo závažnosti migrény během používání CHC (což může být prodromální známka cévní mozkové příhody) může být důvodem okamžitého ukončení léčby |
|
Další onemocnění související s nežádoucími cévními příhodami |
Diabetes mellitus, hyperhomocysteinémie, chlopenní srdeční vada a fibrilace síní, dyslipoproteinémie a systémový lupus erytematodes. |
Příznaky ATE
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky cévní mozkové příhody mohou zahrnovat:
- náhlou necitlivost nebo slabost obličeje, paže nebo nohy, zvláště na jedné straně těla;
- náhlé potíže s chůzí, závratě, ztrátu rovnováhy nebo koordinace;
- náhlou zmatenost, problémy s řečí nebo porozuměním;
- náhlé potíže se zrakem na jednom nebo obou očích;
- náhlou, závažnou nebo prodlouženou bolest hlavy neznámé příčiny;
- ztrátu vědomí nebo omdlení s nebo bez záchvatu.
Dočasné příznaky naznačují, že se jedná o tranzitorní ischemickou ataku (TIA). Příznaky infarktu myokardu (IM) mohou zahrnovat:
- bolest, nepříjemný pocit, tlak, těžkost, pocit stlačení nebo plnosti na hrudi, v paži nebo pod hrudní kostí;
- nepříjemný pocit vyzařující do zad, čelisti, hrdla, paže, žaludku;
- pocit plnosti, poruchu trávení nebo dušení;
- pocení, nauzeu, zvracení nebo závratě;
- extrémní slabost, úzkost nebo dušnost;
- rychlý nebo nepravidelný srdeční tep.
Nádory
Zvýšené riziko rakoviny hrdla děložního u dlouhodobých uživatelek kombinované perorální antikoncepce (> 5 let) bylo hlášeno v některých epidemiologických studiích, ale o rozsahu, v jakém se tento nález dá přisoudit účinkům sexuálního chování a jiným faktorům, jako je lidský papilloma virus (HPV), stále pokračují spory.
Metaanalýza 54 epidemiologických studií ukázala, že existuje lehce zvýšené relativní riziko (RR = 1,24) pro rakovinu prsu diagnostikovanou u žen, které současně užívají kombinovanou perorální antikoncepci. Zvýšené riziko postupně mizí v průběhu 10 let po ukončení použití kombinované perorální antikoncepce. Vzhledem k tomu, že je karcinom prsu u žen mladších 40 let vzácný, je zvýšení počtu diagnóz karcinomu prsu u současných a dřívějších uživatelek kombinované perorální antikoncepce v poměru s celkovým rizikem karcinomu prsu malé. Tyto studie neposkytují důkaz pro kauzalitu. Karcinomy prsu diagnostikované u předchozích uživatelek mají tendenci být méně pokročilé klinicky než karcinom diagnostikovaný u uživatelek, které přípravek nikdy neužívaly. Pozorovaný vzorec zvýšeného rizika může být důsledkem časnější diagnózy karcinomu prsu u uživatelek kombinované perorální antikoncepce, biologických účinků kombinované perorální antikoncepce nebo kombinace obou.
Ve vzácných případech byly u uživatelek kombinované perorální antikoncepce hlášené benigní nádory jater a dokonce ve vzácných případech maligní nádory jater. V izolovaných případech vedly tyto nádory k život ohrožujícím nitrobřišním krvácením. Nádory jater by měly být zvažovány v diferenciální diagnóze, pokud se u žen užívajících kombinovanou perorální antikoncepci vyskytuje závažná bolest v horní části břicha, zvětšení jater nebo známky nitrobřišního krvácení.
Při použití vyšších dávek kombinované perorální antikoncepce (50 pg ethinylestradiolu) je riziko endometriálního a ovariálního karcinomu snížené. Zda toto platí i pro kombinovanou perorální antikoncepci s nižší dávkou musí být ještě potvrzeno.
Další stavy
Antikoncepční účinek může být snížen u žen s hmotností 90 kg nebo vyšší.
Ženy s hypertriglyceridémií nebo s hypertriglyceridémií v rodinné anamnéze mohou mít při užívání kombinované perorální antikoncepce zvýšené riziko pankreatitidy.
I když bylo hlášeno malé zvýšení krevního tlaku u mnoha žen užívajících kombinovanou perorální antikoncepci, klinicky relevantní zvýšení je vzácné. Pouze v těchto vzácných případech je okamžité přerušení podávání kombinované perorální antikoncepce oprávněné. Pokud během použití kombinované hormonální antikoncepce při preexistující hypertenzi nereaguje konstantně zvýšený krevní tlak nebo významně zvýšený krevní tlak adekvátně na antihypertenzní léčbu, musí být kombinovaná hormonální antikoncepce vysazena. Používání kombinované hormonální antikoncepce může být znovu obnoveno, pokud je antihypertenzivní terapií možné dosáhnout normotenzních hodnot.
Následující stavy byly dávány do souvislosti se vznikem nebo zhoršením v těhotenství a při použití kombinované perorální antikoncepce, ale důkazy o souvislosti s kombinovanou perorální antikoncepcí nejsou jednoznačné: žloutenka a/nebo svědění související s cholestázou, žlučové kameny, porfyrie, systémový lupus erythematosus, hemolyticko-uremický syndrom, Sydenhamova chorea, gestační herpes, ztráta sluchu v důsledku otosklerózy.
U žen s hereditárním angioedémem mohou exogenní estrogeny indukovat nebo zhoršovat příznaky angioedému.
Přerušení užívání kombinované hormonální antikoncepce může být nevyhnutelné při akutních a chronických poruchách jaterních funkcí, než se markery jaterních funkcí vrátí k normálním hodnotám. Přerušení užívání kombinované hormonální antikoncepce rovněž vyžaduje recidiva pruritu při cholestáze, která se poprvé objevila v těhotenství nebo během dřívějšího užívání pohlavních steroidů.
Přestože může mít kombinovaná perorální antikoncepce vliv na periferní inzulinovou rezistenci a glukózovou toleranci, neexistují důkazy pro nutnost změny terapeutického režimu u diabetiků užívajících nízkou dávku kombinované perorální antikoncepce (obsahující < 0,05 mg ethinylestradiolu). Ženy s diabetem by však měly být pozorně monitorovány, zejména v časných stádiích použití kombinované perorální antikoncepce.
Během použití kombinované perorální antikoncepce bylo hlášeno zhoršení endogenní deprese, epilepsie, Crohnovy choroby a ulcerózní kolitidy.
Občas se může objevit chloasma, zejména u žen s anamnézou chloasma gravidarum. Ženy s tendencí ke vzniku chloasmatu by se měly při užívání kombinované perorální antikoncepce vyhýbat expozici slunci nebo ultrafialovému záření. Chloasma často není plně reverzibilní.
Lékařské vyšetření/konzultace
Před prvním zahájením nebo znovuzahájením léčby přípravkem Menyan 0,25 mg/0,035 mg tablety by měla být získána kompletní anamnéza (včetně rodinné anamnézy) a musí být vyloučeno těhotenství. Měl by se změřit krevní tlak a mělo by být provedeno tělesné vyšetření při zvážení kontraindikací (viz bod 4.3) a varování (viz bod 4.4). Je důležité, aby byla žena upozorněna na informace o žilní a arteriální trombóze, včetně rizika přípravku Menyan 0,25 mg/0,035 mg tablety v porovnání s dalšími typy CHC, na příznaky VTE a ATE, známé rizikové faktory a co by měla dělat v případě suspektní trombózy.
Žena by také měla být informována, aby si pečlivě přečetla příbalovou informaci pro uživatele a aby dodržovala uvedené instrukce. Frekvence a povaha vyšetření by měly být založeny na stanovených postupech a upraveny podle individuálních potřeb ženy.
Ženy by měly být informovány, že hormonální antikoncepce nechrání před HIV infekcí (AIDS) a dalšími sexuálně přenosnými chorobami.
Snížení účinnosti
Účinnost kombinované perorální antikoncepce může být snížena například při vynechání účinné tablety (viz bod 4.2), v případě gastrointestinálních poruch při užívání účinných tablet (viz bod 4.2) nebo při současném užívání dalších léků (viz bod 4.5).
Snížení kontroly cyklu
U všech kombinovaných hormonálních antikoncepcí může dojít k nepravidelnému krvácení (špinění či krvácení z průniku), obzvláště během prvních měsíců používání. Z tohoto důvodu má hledání příčiny nepravidelného krvácení smysl až po adaptačním intervalu přibližně tří cyklů. Pokud krvácení z průniku přetrvává či se vyskytne po dosud pravidelných cyklech a kombinovaná perorální antikoncepce byla užívána v souladu s doporučeným režimem, je třeba zvážit jiné příčiny, než je kombinovaná perorální antikoncepce. Měly by se zvážit i nehormonální příčiny a pokud je nezbytné, musí se provést adekvátní diagnostické kroky k vyloučení organických chorob nebo těhotenství. To může zahrnovat kyretáž.
U některých žen se v období bez užívání tablety nemusí krvácení z vysazení objevit. Pokud byla kombinovaná perorální antikoncepce užívána dle pokynů popsaných v bodě 4.2, je nepravděpodobné, že by byla žena těhotná. Nicméně pokud nebyla kombinovaná perorální antikoncepce užívána dle těchto pokynů před krvácením z vysazení u první zapomenuté dávky nebo pokud dojde k vynechání dvou krvácení z vysazení, je nutné před pokračováním s užíváním kombinované perorální antikoncepce vyloučit těhotenství.
U některých uživatelek se může objevit amenorea nebo oligomenorea a to zejména, pokud se tyto obtíže vyskytovaly již dříve.
Při užívání přípravku Menyan 0,25 mg/0,035 mg tablety se nesmí užívat bylinné přípravky obsahující třezalku tečkovanou (Hypericum perforatum) (viz bod 4.5).
Pomocné látky
Tablety obsahují laktózu. Ženy se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným deficitem laktázy nebo malabsorpcí glukózy a galaktózy, by neměly tento přípravek užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Účinky jiných léčivých přípravků na přípravek Menyan
Mohou se vyskytnout interakce s léky, které indukují mikrozomální enzymy, což může mít za následek zvýšenou clearance pohlavních hormonů a může vést ke krvácení z průniku a/nebo k selhání antikoncepce.
Postup
Enzymová indukce může být pozorována již po několika dnech léčby. Maximální enzymová indukce je obvykle pozorována v průběhu několika týdnů. Po ukončení léčby může enzymová indukce přetrvávat po dobu přibližně 4 týdnů.
Krátkodobá léčba
Ženy léčené některým z enzymy indukujících přípravků mají dočasně používat bariérovou nebo jinou metodu kontracepce navíc k COC. Bariérová metoda se musí používat po celou dobu současného užívání léčivého přípravku, a dalších 28 dní po jeho vysazení.
Dlouhodobá léčba
Ženám, které dlouhodobě užívají některou z léčivých látek indukující enzymy, je doporučena jiná spolehlivá nehormonální antikoncepční metoda.
Následující interakce byly popsány v literatuře.
Látky zvyšující clearance COC (snižující účinnost COC enzymovou indukcí), např.: barbituráty, bosentan, karbamazepin, fenytoin, primidon, rifampicin a léky na HIV ritonavir, nevirapin a efavirenz a pravděpodobně také felbamát, griseofulvin, oxkarbazepin, topiramát a přípravky obsahující třezalku tečkovanou (Hypericum perforatum)
Látky s variabilními účinky na clearance COC:
Při současném užívání s COC, mnoho kombinací inhibitorů HIV proteázy a nenukleosidových inhibitorů reverzní transkriptázy, včetně kombinací s HCV inhibitory, může zvyšovat či snižovat plazmatické koncentrace estrogenu nebo progestinů. Konečný účinek těchto změn může být klinicky relevantní v některých případech.
Proto by měly být prostudovány informace o přípravku k současné léčbě HIV/HCV s cílem identifikovat potenciální interakce a jakákoli příslušná doporučení. V případě jakékoli pochybnosti, ženy užívající inhibitor proteáz nebo nenukleosidový inhibitor reverzní transkriptázy mají použít navíc i bariérovou antikoncepční metodu.
Léčivé přípravky ovlivňující vstřebávání
Léky, které zvyšují gastrointestinální motilitu, například metoklopramid, mohou snižovat vstřebávání hormonů.
Léčba aktivním uhlím ohrozí vstřebávání steroidních hormonů.
Změny plazmatických hladin souběžně podávaných léčivých přípravků, které mohou být klinicky významné:
Při souběžném užívání může kombinovaná hormonální antikoncepce také ovlivnit farmakokinetiku některých léčivých přípravků.
Léčivé přípravky, u kterých může být plazmatická hladina zvýšena (díky inhibici CYP). Příklady zahrnují:
• cyklosporin,
• prednisolon,
• theofylin.
Léčivé přípravky, u kterých může být plazmatická hladina snížena (díky inhibici glukuronidace). Příklady zahrnují:
• Lamotrigin.
Laboratorní testy
Použití kontracepčních steroidů může ovlivňovat výsledky určitých laboratorních testů, mezi něž patří biochemické parametry jater, štítné žlázy, nadledvinek a funkce ledvin, plazmatické hladiny (transportních) proteinů, např. kortikosteroidy vázající globulin a lipidové/lipoproteinové frakce, parametry metabolismu karbohydrátů a parametry krevní koagulace a fibrinolýzy. Změny obecně zůstávají v rámci normálního laboratorního rozmezí.
4.6 Fertilita, těhotenství a kojení
Není indikováno v průběhu těhotenství. Před přerušením užívání je nutno potvrdit předpokládané těhotenství.
Zvýšené riziko VTE během poporodního období je třeba brát v úvahu při znovuzahájení užívání přípravku Menyan 0,25 mg/0,035 mg tablety (viz bod 4.2 a 4.4).
Kojení
Antikoncepční steroidy a/nebo jejich metabolity mohou být vylučovány do mateřského mléka.
Použití kombinované perorální antikoncepce je u kojících matek do 6 týdnů po porodu kontraindikováno (viz bod 4.3) a jejich použití u kojících matek v době mezi 6 týdnem a 6 měsícem po porodu by mělo být klinicky zváženo.
Kojící matky musí být poučeny o tom, že nesmějí používat kombinované pilulky, protože mohou snížit množství mateřského mléka, mohou však být poučeny o užívání pilulek obsahujících pouze progestogen.
Fertilita
Norgestimát samotný a v kombinaci s ethinylestradiolem je účinnou antiovulační látkou. Po přerušení užívání perorální antikoncepce by žena měla oddálit své těhotenství až do doby, kdy dojde k alespoň jednomu spontánnímu cyklu, aby bylo možno zjistit datum otěhotnění. V tomto období musí být použita alternativní antikoncepční metoda.
Norgestimát v kombinaci s ethinylestradiolem způsoboval v závislosti na velikosti dávky potlačení fertility, snížení schopnosti implantace a velikosti vrhu a zvýšení fetální resorpce u samic laboratorních potkanů při všech velikostech dávky. Je středně potentní ve standardní in vivo progestační analýze měřící proliferaci endometria u králíků a účinně blokuje ovulaci u laboratorních potkanů, křečků a králíků.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit a obsluhovat stroje nebyly provedeny. Žádné účinky na schopnost řídit a obsluhovat stroje nebyly u uživatelek COC pozorovány.
4.8 Nežádoucí účinky
Popis vybraných nežádoucích účinků
U žen užívajících CHC bylo pozorováno zvýšené riziko arteriálních a žilních trombotických a tromboembolických příhod, včetně infarktu myokardu, cévní mozkové příhody, tranzitorních ischemických atak, žilní trombózy a plicní embolie a je podrobněji popsáno v bodě 4.4.
Některé nežádoucí účinky, které byly spojované s užíváním perorální antikoncepce, mohou vyžadovat okamžitou lékařskou pomoc a/nebo ukončení užívání perorální antikoncepce. Mezi tyto nežádoucí účinky patří: infarkt myokardu, hluboká žilní trombóza, plicní embolie, cerebrovaskulární příhoda, trombóza retinální žíly, nový nástup bolesti hlavy podobné migréně, karcinom prsu, jaterní adenomy, vysoký krevní tlak, angioedém a hypersenzitivita.
Při provádění vhodných diagnostických a terapeutických opatření musí být použity alternativní nehormonální metody antikoncepce.
Na základě spojených bezpečnostních údajů z 5 klinických studií byla nejčastěji uváděným (> 10 %) nežádoucím účinkem bolest hlavy (27,9 %). Nejčastěji uváděným (> 10 %) nežádoucím účinkem identifikovaným po uvedení na trh byl průjem (11,8 %).
Nejčastěji uváděnými nežádoucími účinky (> 10 %) v prvním léčebném cyklu klinických hodnocení byly: dysmenorea (40,4 %), nauzea (29,1 %); metroragie (26,3 %); gastrointestinální porucha hlášená jako nauzea nebo zvracení (24,6 %) a abnormální krvácení z vysazení (16,9 %). Incidence těchto nežádoucích účinků byla nejvyšší v cyklu 1 a s výjimkou dysmenorey se postupem času snížila. K nejvyšší incidenci zvracení došlo v cyklu 12 (11,8 %).
Pěti klinických studií (2 randomizované, aktivně kontrolované studie a 3 nekontrolované, nezaslepené studie), které byly použity pro vyhodnocení bezpečnosti přípravku Menyan 0,25 mg/0,035 mg tablety, se zúčastnilo 1891 zdravých žen ve fertilním věku. Ve 3 studiích byly subjekty sledovány po dobu až 24 cyklů a ve zbývajících 2 studiích po dobu až 12 cyklů. Dodatková nekontrolovaná studie (N = 8331) udávala zprávu o nežádoucích účincích podle cyklu léčby až pro 24 cyklů. Vzhledem k tomu, že se nežádoucí účinky lišily v závislosti na cyklu léčby, byl pro zařazení nežádoucího účinku do kategorie četnosti použit nejvyšší cyklus incidence.
Níže uvedená tabulka ukazuje všechny nežádoucí účinky, které byly hlášené při použití přípravku Menyan 0,25 mg/0,035 mg tablety v klinických studiích nebo byly získané ze zkušeností s tabletami norgestimátu a ethinylestradiolu po uvedení na trh. Zobrazené kategorie četnosti používají následující konvenci: velmi časté (> 1/10), časté (> 1/100 až <1/10), méně časté (> 1/1 000 až < 1/100), vzácné (> 1/10 000 až < 1/1000), velmi vzácné (< 1/10 000) a neznámé (z dostupných údajů nelze určit).
|
Infekce a infestace | |
|
Časté |
Infekce močových cest, vaginální infekce |
|
Novotvary benigní, maligní a blíže neurčené (zahrnující cysty a polypy) | |
|
Méně časté |
Cervikální dysplazie |
|
Vzácné |
Cysta v prsu |
|
Četnost není známa |
Jaterní adenom, karcinom prsu, benigní novotvar prsu, fokální nodulární hyperplazie, fibroadenom prsu |
|
Poruchy imunitního systému | |
|
Časté |
Hypersenzitivita |
|
Poruchy metabolismu a výživy | |
|
Časté |
Retence tekutin |
|
Méně časté |
Snížení a zvýšení apetitu, kolísání hmotnosti |
|
Vzácné |
Poruchy apetitu |
|
Četnost není známa |
Dyslipidemie |
|
Psychiatrické poruchy | |
|
Časté | |
|
Méně časté |
Úzkost, poruchy libida |
|
Vzácné |
Ztráta libida |
|
Poruchy nervového systému | |
|
Velmi časté |
Bolesti hlavy |
|
Časté |
Migréna, závratě |
|
Méně časté |
Synkopa, parestezie |
|
Četnost není známa |
Cévní mozková příhoda, křeče |
|
Poruchy oka | |
|
Méně časté |
Poruchy vidění, suché oči |
|
Četnost není známa |
Nesnášenlivost kontaktních čoček, trombóza retinálních cév* |
|
Poruchy ucha a labyrintu | |
|
Vzácné |
Závratě |
|
Srdeční poruchy | |
|
Méně časté |
Palpitace |
|
Vzácné | |
|
Četnost není známa |
Infarkt myokardu |
|
Cévní poruchy | |
|
Méně časté |
Trombóza, hypertenze, návaly horka |
|
Četnost není známa |
Hluboká žilní trombóza* |
|
Vzácné |
Žilní tromboembolické příhody nebo arteriální tromboembolické příhody |
|
Respirační, hrudní a mediastinální poruchy | |
|
Méně časté |
Dyspnea |
|
Četnost není známa |
Plicní embolie* |
|
Gastrointestinální poruchy | |
|
Velmi časté | |
|
Časté |
Gastrointestinální bolesti, bolesti břicha, abdominální distenze, zácpa, flatulence |
|
Vzácné |
Pankreatitida |
|
Poruchy jater a žlučových cest | |
|
Vzácné |
Hepatitida |
|
Poruchy kůže a podkožní tkáně | |
|
Časté |
Akné, vyrážka |
|
Méně časté |
Alopecie, hirsutismus, kopřivka, pruritus, erythema, změna barvy kůže |
|
Vzácné |
Hyperhidróza, fotosenzitivní reakce |
|
Četnost není známa |
Angioedém, erythema nodosum, noční pocení |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |
|
Časté |
Svalové křeče, bolesti končetin, bolest zad |
|
Méně časté |
Myalgie |
|
Poruchy reprodukčního systému a prsu | |
|
Velmi časté |
Dysmenorea, metroragie, abnormální krvácení z vysazení |
|
Časté |
Amenorea, výtok z genitálií, bolest prsou |
|
Méně časté |
Výtok z prsů, zvětšení prsů, ovariální cysty, vulvovaginální suchost |
|
Vzácné |
Vaginální výtok |
|
Četnost není známa |
Potlačená laktace |
|
Celkové poruchy a reakce v místě aplikace | |
|
Časté |
Bolest na hrudi, edém, astenické potíže |
|
Vyšetření | |
|
Časté |
Zvýšení hmotnosti |
|
Méně časté |
Pokles tělesné hmotnosti |
* Nezaznamenáno při klinických studiích, četnost proto nemůže být odhadnuta. Pro četnost založenou na standardních hlášeních u podobných kombinovaných perorálních antikoncepčních přípravků viz bod 4.4.
Interakce
Interakce jiných léčivých přípravků (enzymových induktorů) s perorálními kontraceptivy mohou vést ke krvácení z průniku a/nebo k selhání antikoncepce (viz bod 4.5).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: http: //www .sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Nejsou k dispozici zprávy o závažných nežádoucích účincích předávkování. Mezi příznaky může patřit nauzea, zvracení a děložní krvácení. Neexistují antidota a další léčba by měla být symptomatická.
5 FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Hormonální antikoncepce pro systémové použití; gestageny a estrogeny, fixní kombinace
ATC kód: G03AA11
Přípravek Menyan 0,25 mg/0,035 mg tablety působí mechanismem suprese gonadotropinu estrogenními i gestagenními účinky ethinylestradiolu a norgestimátu. Hlavním mechanismem účinku je inhibice ovulace, avšak změny týkající se cervikálního hlenu, tubární motility a endometria mohou rovněž přispívat k účinnosti přípravku.
5.2 Farmakokinetické vlastnosti
Absorpce: Norgestimát i ethinylestradiol se po perorálním podání rychle absorbují. Po jednorázovém nebo opakovaném podání (tří cyklů) přípravku Menyan 0,25 mg/0,035 mg tablety zůstávají sérové koncentrace norgestimátu pod mezí stanovení (0,1 ng/ml). Metabolity norgestimátu, norelgestromin a norgestrel, se nacházejí v cirkulaci v měřitelných koncentracích a dosahují nejvyšších sérových hladin přibližně za 1,5 hodiny po podání. Zvýšení Cmax a AUC pro norelgestromin odpovídají dávkování norgestimátu v rozmezí 0,180-0,250 mg. Sérové koncentrace ethinylestradiolu jsou měřitelné za 0,5 hodiny po podání a dosahují vrcholových hodnot přibližně za 1,2 hodiny po podání.
Distribuce: Norelgestromin a norgestrel jsou vysoce vázány na sérové proteiny (> 97 %). Norelgestromin je vázán na albumin avšak nikoli na globulin vážící pohlavní hormony (SHBG), zatímco norgestrel je vázán převážně na SHBG a v mnohem menší míře na albumin. Ethinylestradiol je vázán převážně na sérový albumin.
Studie prokázaly, že absence vazby norelgestrominu na SHBG je ve srovnání s jinými gestageny obsaženými v perorální antikoncepci ojedinělá a hraje klíčovou roli ve zvýšení jeho biologické aktivity. Naopak norgestrel metabolizovaný z norgestimátu je převážně vázán na SHBG, což limituje jeho biologickou aktivitu.
Biotransformace: Norgestimát je rychle metabolizován mechanismem efektu prvního průchodu (střevního a/nebo jaterního) na farmakologicky aktivní gestageny norelgestromin (vrcholové sérové koncentrace pozorovány za 2 hodiny) a norgestrel. Ethinylestradiol je metabolizován na různé hydroxylované metabolity a jejich glukuronidové a sulfátové konjugáty.
Eliminace: Norelgestromin, norgestrel a ethinylestradiol jsou následně metabolizovány a jejich metabolity jsou eliminovány ledvinami a stolicí. Hodnoty eliminačního poločasu byly v rovnovážném stavu 10 až 15 hodin pro ethinylestradiol,
24,9 hodiny pro norelgestromin a 45 hodin pro norgestrel. Po podání 14C-norgestimátu se vyloučí 47 % podané radioaktivity močí a 37 % stolicí.
Farmakokinetika v rovnovážném stavu: Po podání 0,250 mg norgestimátu / 0,035 mg ethinylestradiolu činila průměrná hodnota AUC 0-24h v rovnovážném stavu, založená na sérových hladinách nevázaných na SHBG, 18,1 h*ng/ml pro norelgestromin a 3,64 h*ng/ml pro norgestrel. Hodnota AUC pro norgestrel po podání 0,250 mg norgestimátu / 0,035 mg ethinylestradiolu odpovídala expozici po podání dávky přibližně 30 mikrogramů levonorgestrelu v kombinaci
s ethinylestradiolem.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické studie neodhalily žádná jiná zvláštní rizika pro člověka než ta, která již byla uvedena v jiných bodech tohoto souhrnu údajů o přípravku. Tyto studie mimo jiné zahrnovaly konvenční farmakologické studie bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu a reprodukční a vývojové toxicity prováděné s kombinací norgestimátu a ethinylestradiolu.
6 FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Laktosa
Monohydrát laktosy Povidon K-25 Tokoferol-alfa Mikrokrystalická celulosa Sodná sůl kroskarmelosy Předbobtnalý kukuřičný škrob Magnesium-stearát Hlinitý lak indigokarmínu (E132)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
PVC/PVdC/Al blistr obsahující 21 tablet. Každý blistr je balený do třívrstvého sáčku.
Velikost balení:
21 tablet
21 tablet (1 blistr s 21 tabletami)
63 tablet (3 blistry po 21 tabletách)
126 tablet (6 blistrů po 21 tabletách)
273 tablet (13 blistrů po 21 tabletách)
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Neuplatňuje se.
7 DRŽITEL ROZHODNUTÍ O REGISTRACI
AV Medical Consulting s.r.o., Ostrava- Poruba, Česká republika
8 REGISTRAČNÍ ČÍSLO(A)
17/207/13-C
9 DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 24.4.2013
10 DATUM REVIZE TEXTU
5.8.2016
19