Lodotra 1 Mg Tablety S Řízeným Uvolňováním
zastaralé informace, vyhledat novějšísp. zn. sukls98160/2013, sukls98161/2013, sukls98162/2013
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Lodotra 1 mg tablety s řízeným uvolňováním Lodotra 2 mg tablety s řízeným uvolňováním Lodotra 5 mg tablety s řízeným uvolňováním
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Lodotra 1 mg:
Jedna tableta s řízeným uvolňováním obsahuje prednisonum 1 mg. Lodotra 2 mg:
Jedna tableta s řízeným uvolňováním obsahuje prednisonum 2 mg. Lodotra 5 mg:
Jedna tableta s řízeným uvolňováním obsahuje prednisonum 5 mg. Pomocná látka se známým účinkem: laktosa.
Lodotra 1 mg:
Jedna tableta s řízeným uvolňováním obsahuje 42,8 mg laktosy. Lodotra 2 mg:
Jedna tableta s řízeným uvolňováním obsahuje 41,8 mg laktosy. Lodotra 5 mg:
Jedna tableta s řízeným uvolňováním obsahuje 38,8 mg laktosy. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tableta s řízeným uvolňováním Lodotra 1 mg:
Světle nažloutlá válcovitá tableta s řízeným uvolňováním, vysoká 5 mm a o průměru 9 mm, s „NP1“ vyraženým na jedné straně.
Lodotra 2 mg:
Nažloutlá válcovitá tableta s řízeným uvolňováním, vysoká 5 mm a o průměru 9 mm, s „NP2“ vyraženým na jedné straně.
Lodotra 5 mg:
Světle žlutá válcovitá tableta s řízeným uvolňováním, vysoká 5 mm a o průměru 9 mm, s „NP5“ vyraženým na jedné straně.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Lodotra je indikována k léčbě středně těžké až těžké aktivní revmatoidní artritidy, zejména doprovázené ranní ztuhlostí, u dospělých.
4.2 Dávkování a způsob podání
Dávkování
Dávkování závisí na závažnosti stavu a individuální odpovědi pacienta. Obecně je doporučena počáteční dávka 10 mg prednisonu. V určitých případech je možná začít s vyšší dávkou (např. 15 či 20 mg prednisonu). V závislosti na klinických symptomech a pacientově odpovědi lze postupně počáteční dávku snižovat na nižší udržovací dávku.
V případě přechodu ze standardního režimu (glukokortikoidy podávané ráno) na užívání přípravku Lodotra před spaním (okolo 22:00) má dávka (v mg prednisonu) zůstat stejná. Následně pak může být dávka dle klinické situace upravena.
Pokud je dávkování přípravku pomocí této síly nerealizovatelné/nepraktické, je možné využít další síly tohoto přípravku. Při dlouhodobé terapii revmatoidní artritidy má být individuální denní dávka upravena dle závažnosti stavu onemocnění až do 10 mg.
V závislosti na výsledcích terapie je možné postupně snížit dávku o 1 mg každé 2 až 4 týdny k dosažení optimální udržovací dávky.
K ukončení terapie přípravkem Lodotra má být dávka snižována postupně o 1 mg každé 2 až 4 týdny a v případě nutnosti mají být monitorovány parametry osy hypofýza-nadledviny.
Pediatrická populace
Vzhledem k nedostatečným údajům o snášenlivosti a účinnosti není podávání dětem a dospívajícím doporučeno.
Způsob podání
Lodotra má být podávána před spaním (okolo 22. hodiny) s večeří nebo po ní a má být spolknuta celá a zapita dostatečným množstvím tekutiny. V případě, že od večeře uplynulo více než 2 až 3 hodiny, doporučuje se podat přípravek Lodotra s lehkým jídlem či svačinou (např. krajíc chleba se šunkou či sýrem). Přípravek Lodotra nemá být podáván na lačno, protože to může snižovat jeho biologickou dostupnost.
Přípravek Lodotra je navržen, aby uvolňoval léčivou látku se zpožděním přibližně 4 až 6 hodin po podání. Uvolňování léčivé látky a farmakologický účinek začíná tedy v noci.
Lodotra tablety s řízeným uvolňováním jsou složeny z jádra obsahujícího prednison a z inertní potahové vrstvy. Zpožděné uvolňování prednisonu je závislé na neporušené potahové vrstvě. Z toho důvodu se nesmí tablety lámat, dělit ani žvýkat.
U pacientů s hypotyreózou či cirhózou jater mohou být dostačující relativně nižší dávky nebo může být nutné dávku snížit.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Farmakoterapie založená na prednisonu má být podávána pouze, pokud je to absolutně nezbytné, a má být doplněna příslušnou antiinfekční terapií v následujících případech:
- akutní virová infekce (pásový opar, infekce vyvolané virem herpes simplex, plané neštovice, herpetická keratitida),
- HBsAg-pozitivní chronická aktivní hepatitida,
- přibližně 8 týdnů před a 2 týdny po imunizaci živými vakcínami,
- systémové mykózy a parazitózy (např. hlístice),
- dětská obrna,
- lymfadenitida po BCG inokulaci,
- akutní a chronická bakteriální infekce,
- tuberkulóza v anamnéze (varování: reaktivace!). Vzhledem k imunosupresivním vlastnostem mohou glukokortikoidy vyvolat či zhoršit infekci. Tito pacienti mají být pečlivě monitorováni, např. pomocí tuberkulinového testu. Významně ohroženým pacientům má být podávána tuberkulostatická léčba.
Navíc farmakoterapie založená na prednisonu má být podána pouze, pokud je to absolutně nezbytné, a má být doplněna příslušnou terapií v následujících případech:
- gastrointestinální vředy,
- těžká osteoporóza a osteomalacie,
- hypertenze, která se těžko kontroluje,
- těžký diabetes mellitus,
- psychiatrické poruchy (i v anamnéze),
- glaukom s úzkým či širokým úhlem,
- vředy rohovky či zranění rohovky.
Z důvodu rizika perforace střev smí být podán prednison pouze, pokud je to absolutně nezbytné, a za patřičného sledování v následujících případech:
- těžká ulcerózní kolitida s hrozící perforací,
- divertikulitida,
- enteroanastomóza (okamžitě po operaci).
Požadované koncentrace prednisonu v krvi nemůže být dosaženo, pokud je Lodotra podána na lačno. Proto má být Lodotra vždy podávána s večerním jídlem či po něm, aby byla zajištěna dostatečná účinnost. Z výsledků všech farmakokinetických studií je patrné, že se mohou nízké koncentrace prednisonu v krvi vyskytnout v 6 % až 7 % a z výsledků jedné studie i v 11 %, i když je dodrženo doporučené dávkování. Je nutné toto uvážit, pokud není Lodotra dostatečně účinná. V těchto situacích má být zvážen přechod na konvenční lékové formy s okamžitým uvolňováním.
Lodotra nesmí být nahrazena tabletami s okamžitým uvolňováním prednisonu ve stejném režimu dávkování vzhledem ke zpožděnému mechanismu uvolňování přípravku Lodotra.
V případě substituce, ukončení či přerušení dlouhodobé léčby, je nutné vzít v úvahu následující rizika: rekurence revmatoidní artritidy, akutní selhání nadledvinek (zejména v zátěžových situacích, např. při infekci, po úraze, při zvýšené fyzické zátěži), kortizonový abstinenční syndrom.
Lodotra nemá být podávána při akutních indikacích místo tablet s okamžitým uvolňováním prednisonu kvůli svým farmakologickým vlastnostem.
Během užívání přípravku Lodotra je nutné vzít v úvahu možnou zvýšenou potřebu insulinu nebo perorálních antidiabetik. Pacienti s diabetes mellitus mají být během terapie pečlivě monitorováni.
U pacientů s vysokým tlakem, který je těžko kontrolovatelný, je nutné provádět pravidelné kontroly krevního tlaku během terapie.
Pacienti s těžkou srdeční nedostatečností musí být pečlivě monitorováni kvůli riziku zhoršení jejich stavu.
Opatrnosti je třeba při podávání kortikosteroidů, včetně prednisonu, pacientům s nedávným infarktem myokardu z důvodu rizika ruptury myokardu.
Opatrnosti je třeba při podávání kortikosteroidů, včetně prednisonu, pacientům s renální insuficiencí.
Dle dostupných dat se porucha spánku vyskytuje častěji při terapii přípravkem Lodotra než při terapii konvenčními lékovými formami s okamžitým uvolňováním, které jsou užívány ráno. Pokud se objeví insomnie a nezlepšuje se, může být vhodné nahradit tuto terapii za konvenční lékovou formu s okamžitým uvolňováním.
Léčba přípravkem Lodotra může také maskovat známky a příznaky existujících či rozvíjejících se infekcí, a tak ztížit diagnózu.
I v nízkých dávkách může mít dlouhodobé užívání přípravku Lodotra za následek zvýšené riziko infekce. Tyto možné infekce mohou být způsobeny mikroorganismy, které zřídka za běžných podmínek způsobují infekce (tzv. oportunní infekce).
U pacientů léčených glukokortikoidy mohou mít určitá virová onemocnění (neštovice, spalničky) těžký průběh. Nejvyšší riziko je u jedinců se sníženou imunitou bez předchozího prodělání neštovic či spalniček. U takových jedinců je nutné, pokud během léčby přípravkem Lodotra přišli do styku s osobami nakaženými neštovicemi či spalničkami, začít s preventivní léčbou.
U pacientů se známým nebo suspektním zamořením Strongyloides (hádě) mohou glukokortikoidy vést k hyperinfekci a šíření Strongyloides s rozšířenou migrací larev.
Vakcinace inaktivovanými vakcínami je obecně možná. Ale je nutné vzít v úvahu, že imunitní odpověď a následně i úspěšnost vakcinace může být snížena zvýšenými dávkami glukokortikoidů.
V případě dlouhodobé terapie přípravkem Lodotra je doporučeno, aby pacienti docházeli na pravidelné lékařské prohlídky (včetně oftalmologických vyšetření každé tři měsíce), a pokud jsou jim podávány relativně vysoké dávky, je nutné zajistit podávání dostatečného množství suplementů draslíku a omezení množství přijatého sodíku a kontrolovat koncentraci draslíku v séru.
Pokud se během léčby přípravkem Lodotra vyskytnou vysoce zátěžové situace (úrazy, chirurgické zákroky atd.), může být nutné zvýšit dočasně dávku.
V závislosti na délce terapie a podávaných dávkách je možné očekávat negativní vliv na metabolismus vápníku. Je proto doporučena profylaxe osteoporózy, a to zejména pokud se vyskytují i další rizikové faktory (včetně rodinných predispozic, pokročilého věku, postmenopauzy, nedostatečného příjmu vápníku a proteinů, nadměrného kouření, nadměrného pití alkoholu, stejně jako snížení fyzické aktivity). Profylaxe je založena na dostatečném příjmu vápníku a vitamínu D, stejně tak i na fyzické aktivitě. V případě pre-existující osteoporózy má být zvážena další terapie.
Tento přípravek obsahuje monohydrát laktosy. Pacienti se vzácnými dědičnými problémy s intolerancí galaktosy, vrozeným deficitem laktázy nebo malabsorpcí glukosy a galaktosy by tento přípravek neměli užívat.
V případech užívání vysokých dávek prednisonu po delší dobu (30 mg/den alespoň 4 týdny) byla pozorována reverzibilní porucha spermatogeneze, která přetrvává několik měsíců po přerušení léčby.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Srdeční glykosidy: Účinek glykosidů může být posílen nedostatkem draslíku.
Saluretika/laxativa: Zvýšené vylučování draslíku.
Antidiabetika: Redukce vlivu na snižování hladiny cukru v krvi.
Deriváty kumarinu: Účinnost kumarinových antikoagulancií může být snížena či zvýšena.
Nesteroidní antiflogistika/antirevmatika, salicyláty a indometacin: Zvýšené riziko gastrointestinálního krvácení.
Nedepolarizující svalová relaxancia: Relaxace svalů může být prodloužena.
Atropin a jiná anticholinergistika: Souběžné užívání přípravku Lodotra může mít za následek další zvýšení nitroočního tlaku.
Prazikvantel: Glukokortikoidy mohou snižovat koncentrace prazikvantelu v krvi.
Chlorochin, hydroxychlorochin, meflochin: Zvýšeno riziko výskytu myopatie a kardiomyopatie. Somatropin: Účinnost somatropinu může být redukována.
Estrogeny (např. perorální antikoncepce): Mohou zvyšovat účinnost glukokortikoidů.
Lékořice: Možná inhibice metabolismu glukokortikoidů.
Rifampicin, fenytoin, barbituráty, bupropion a primidon: Snížená účinnost glukokortikoidů. Cyklosporin: Zvýšená koncentrace cyklosporinu v krvi, zvýšené riziko záchvatů.
Amfotericin B: Riziko hypokalemie může být zvýšené.
Cyklofosfamid: Účinek cyklofosfamidů může být zvýšen.
ACE inhibitory: Zvýšené riziko výskytu změn krevního obrazu.
Antacida obsahující sloučeniny hliníku a hořčíku: Snížená absorpce glukokortikoidů. Vzhledem ke zpožděnému uvolňování přípravku Lodotra je však interakce mezi prednisonem a antacidy obsahujícími sloučeniny hliníku a hořčíku nepravděpodobná.
Vliv na diagnostické metody: Kožní reakce při testování alergií mohou být potlačeny. Zvýšení hladiny TSH po podání protirelinu může být redukována.
4.6 Fertilita, těhotenství a kojení
Během těhotenství má být Lodotra podávána pouze v případě, že přínosy převáží nad potenciálními riziky. Má být užívána nejnižší účinná dávka potřebná k udržení dostatečné kontroly onemocnění.
Studie na zvířatech ukázaly, že podávání farmakologických dávek glukokortikoidů během těhotenství může zvyšovat riziko intrauterinní růstové retardace plodu, kardiovaskulárních a/nebo metabolických chorob v dospělosti, a může mít vliv na denzitu glukokortikoidových receptorů a obrat neurotransmiterů nebo vývoj chování.
Ve studiích se zvířaty podání prednisonu způsobilo rozštěpy patra (viz bod 5.3). V současnosti probíhá diskuze o možnosti zvýšeného rizika vývoje orálních rozštěpů u lidského plodu v důsledku podání glukokortikoidů během prvního trimestru.
Pokud jsou glukokortikoidy podávány ke konci těhotenství, je plod ohrožen vznikem adrenokortikoidní atrofie, která může vyžadovat pozvolně se snižující substituční terapii novorozenců.
Kojení
Glukokortikoidy se vylučují v malém množství do mateřského mléka (až 0,23 % individuální dávky). V případě denních dávek do 10 mg je množství v mateřském mléku pod hranicí detekce. Doposud nebyl hlášen škodlivý vliv na novorozence. Nicméně glukokortikoidy mají být předepsány, pouze pokud přínosy pro matku a dítě převáží rizika.
Vzhledem k tomu, že se poměr koncentrace v mateřském mléku/plazmě zvyšuje s dávkami nad 10 mg denně (např. 25 % sérové koncentrace je nalezeno v mateřském mléce při dávce 80 mg prednisonu denně), je v těchto případech doporučeno přerušit kojení.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie zjišťující vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Frekvence a závažnost nežádoucích účinků vyjmenovaných níže závisí na dávce a délce léčby. Při dodržení doporučeného dávkování přípravku Lodotra (nízko-dávková terapie kortikoidy s denní dávkou v rozsahu 1 až 10 mg) se vyjmenované nežádoucí účinky vyskytují méně často s nižší závažností ve srovnání s dávkami vyššími než 10 mg.
Následující nežádoucí účinky se mohou vyskytnout v závislosti na délce terapie a dávce:
velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1000 až <1/100); vzácné (> 1/10000
až < 1/1000); velmi vzácné (<1/10000), není známo (z dostupných údajů nelze určit)
Poruchy krve a lymfatického systému
Časté: mírná leukocytóza, lymfopenie, eozinopenie, polycytemie
Srdeční poruchy Není známo: tachykardie
Poruchy imunitního systému
Časté: potlačení imunitní reakce, maskování infekcí, zhoršení latentních infekcí Vzácné: alergické reakce
Infekce a infestace
Časté: zvýšená náchylnost a závažnost infekcí Endokrinní poruchy
Časté: útlum nadledvinek a vyvolání Cushingova syndromu (typické symptomy: měsícovitý obličej, obezita horní části trupu a pletora)
Vzácné: porucha sekrece pohlavních hormonů (amenorea, impotence), porucha funkce štítné žlázy Poruchy metabolismu a výživy
Časté: retence sodíku se vznikem otoků, zvýšená exkrece draslíku (varování: arytmie), zvýšení chuti k jídlu a nárůst tělesné hmotnosti, porucha glukózové tolerance, diabetes mellitus, hypercholesterolemie a hypertriglyceridemie
Není známo: Reversibilní epidurální, epikardiální nebo mediastinální lipomatóza, hypokalemická alkalóza
Psychiatrické poruchy Časté: Insomnie
Vzácné: Deprese, podrážděnost, euforie, impulsivní chování, psychóza
Poruchy nervového systému Časté: bolest hlavy
Vzácné: pseudotumor cerebri, manifestace latentní epilepsie a zvýšené predispozice k záchvatům u manifestní epilepsie
Poruchy oka
Časté: katarakta, zejména se zadní subkapsulární opacitou, glaukom
Vzácné: zhoršení symptomů spojených s korneální ulcerací, progrese virových, plísňových a
bakteriálních zánětů oka
Není známo: centrální serózní chorioretinopatie
Cévní poruchy
Méně časté: hypertenze, zvýšené riziko arteriosklerózy a trombózy, vaskulitida (také jako abstinenční syndrom po dlouhodobé terapii)
Gastrointestinální poruchy
Méně časté (bez souběžné léčby nesteroidními antirevmatiky): gastrointestinální ulcerace,
gastrointestinální krvácení
Vzácné: pankreatitida
Není známo: nauzea, průjem, zvracení
Poruchy kůže a podkožní tkáně
Časté: strie, atrofie, teleangiektázie, zvýšená fragilita kapilár, petechie, ekchymóza
Méně časté: hypertrichóza, steroidní akné, zpomalení hojení ran, růžovce podobná (periorální)
dermatitida, změny v pigmentaci pokožky
Vzácné: hypersenzitivní reakce, např. lékový exantém
Není známo: hirsutismus
Poruchy svalové a kosterní soustavy a pojivové tkáně
Časté: svalová atrofie a slabost, osteoporóza (závislá na dávce, může se vyskytnout i při krátkodobém užívání)
Vzácné: aseptická osteonekróza (hlavice kosti pažní a stehenní)
Není známo: steroidní myopatie, ruptura šlachy, fraktury obratlů a dlouhých kostí
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: http: //www .sukl .cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Akutní intoxikace přípravkem Lodotra nejsou známy. V případě předávkování lze očekávat zesílené nežádoucí účinky, zejména na endokrinní, metabolický a elektrolytový systém (viz bod 4.8).
Antidotum proti prednisonu není známo.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Glukokortikoidy, ATC kód: H02AB07 Prednison je nefluorovaný glukokortikoid k systémové léčbě.
Prednison má na dávce závislý účinek na metabolismus téměř všech tkání. Za fyziologických podmínek je nezbytný pro udržení homeostázy organismu v klidovém stavu i při zátěži a pro regulaci aktivity imunitního systému.
V běžně předepsaných dávkách přípravku Lodotra má prednison rychlý protizánětlivý účinek (antiexudativní a antiproliferativní) a opožděný imunosupresivní efekt. Inhibuje chemotaxi a aktivitu buněk imunitního systému, uvolňování a účinek mediátorů zánětlivých a imunitních reakcí, např. lysozomálních enzymů, prostaglandinů a leukotrienů.
Dlouhodobá léčba vysokými dávkami vede ke zhoršené funkci imunitního systému a kůry nadledvin. Mineralotropický efekt, významný pro hydrokortison, který je detekovatelný i pro prednison, může vyžadovat sledování sérových elektrolytů.
U pacientů s revmatoidní artritidou prozánětlivé cytokiny, jako jsou například interleukiny IL-1 a IL-6 a tumor nekrotizující faktor alfa (TNF-a), dosahují maximální plazmatické hladiny v časných ranních hodinách (např. IL-6 mezi 7-8 hod. ranní). Bylo zjištěno, že koncentrace cytokinů se snižují po podání přípravku Lodotra a po následném nočním uvolnění prednisonu (s nástupem absorpce mezi 2-4 hod. ranní a Cmax mezi 4 až 6 hod. ranní).
Účinnost a bezpečnost přípravku Lodotra byla hodnocena ve dvou randomizovaných, dvojitě zaslepených kontrolovaných studiích u pacientů s aktivní revmatoidní artritidou.
V první studii, multicentrické randomizované, dvojitě zaslepené studii fáze III trvající 12 týdnů u celkem 288 pacientů předléčených prednisonem nebo prednisolonem, ve skupině, která přešla na užívání přípravku Lodotra ve stejné dávce, došlo k průměrnému snížení trvání ranní ztuhlosti o 23 %, vzhledem k referenční skupině, kde se doba trvání nezměnila. Podrobnosti jsou uvedeny v následující tabulce.
Relativní změna v trvání ranní ztuhlosti po 12 týdnech léčby:
|
Relativní změna [%] |
Lodotra (n = 125) |
Prednison IR (n = 129) |
|
Průměr |
-23 |
0 |
|
(SD) |
(89) |
(89) |
|
Medián |
-34 |
-13 |
|
(min, max) |
(-100, 500) |
(-100, 610) |
V následné otevřené prodloužené fázi (9 měsíců léčby) průměrná relativní změna v trvání ranní ztuhlosti byla asi -50 % ve srovnání s výchozím stavem.
Změna v trvání ranní ztuhlosti po 12 měsících léčby přípravkem Lodotra:
|
Doba trvání ranní ztuhlosti [min] |
Lodotra | |
|
Průměr (SD) |
N | |
|
0 měsíců |
156 |
107 |
|
Začátek studie |
(97) | |
12 měsíců
Konec otevřené fáze
74
(92)
Ve stejné studii po 12 týdnech léčby byla průměrná hodnota poklesu prozánětlivých cytokinů IL-6 o 29 % pozorována u skupiny léčené přípravkem Lodotra, zatímco žádná změna nebyla pozorována ve srovnávací skupině, která dostávala standardní prednison. Po 12 měsících léčby přípravkem Lodotra zůstala úroveň IL-6 stabilní.
Změna v úrovni IL-6 po 12 měsících:
|
IL-6 [IU/L] |
Lodotra | |
|
medián (min, max) |
N | |
|
0 měsíců |
860 |
142 |
|
Začátek studie |
(200,23000) | |
|
12 měsíců |
470 |
103 |
|
Konec otevřené fáze |
(200,18300) | |
Hodnota < 200 IU/L byla pro statistickou analýzu nastavena na 200
U/L
Účinnost přípravku Lodotra společně s DMARD byla potvrzena v druhé randomizované, placebem kontrolované studii u pacientů nedostatečně reagujících na samotnou léčbu DMARD. Po 12 týdnech měli pacienti užívající přípravek Lodotra významně vyšší četnost ACR20 a ACR50 odpovědí (46,8 % a 22,1 % v uvedeném pořadí) ve srovnání s pacienty s placebem (29,4 % a 10,1 % v uvedeném pořadí). Průměrná změna skóre DAS 28 od výchozího stavu byla také větší (5,2 pro skupinu Lodotra a
5,1 u skupiny s placebem) až do 12. týdne ve skupině užívající přípravek Lodotra (-1,2 bodu) ve srovnání s placebo skupinou (změna -0,7 bodu).
Navíc po 12 týdnech léčby průměrné trvání ranní ztuhlosti bylo 86,0 minuty (změna -66 minut) ve skupině užívající přípravek Lodotra a 114,1 minut v placebo skupině (změna -42,6 minut). Lodotra může být bezpečně použita v kombinaci s jinými DMARD.
5.2 Farmakokinetické vlastnosti
Absorpce
Lodotra jsou tablety s řízeným uvolňováním, které obsahují prednison. Prednison se uvolňuje 4-6 hodin po užití přípravku Lodotra. Poté je prednison rychle a téměř úplně absorbován.
Distribuce
Přibližně 6 až 9 hodin po podání je dosaženo maximální sérové hladiny.
Biotransformace
Při prvním průchodu jaterním metabolismem se více než 80 % prednisonu přemění na prednisolon. Poměr prednisonu k prednisolonu je přibližně 1:6 až 1:10. Samotný prednison má jen zanedbatelný farmakologický účinek. Prednisolon je aktivní metabolit. Tyto sloučeniny se reverzibilně vážou na plazmatické bílkoviny s vysokou afinitou k transkortinu (kortikosteroidy vázající globulin, CBG) a s nízkou afinitou k plazmatickému albuminu.
U nízkých dávek (do 5 mg) je přítomno přibližně 6 % volného prednisolonu. Vylučování metabolitů je u této dávky lineární. U dávky nad 10 mg se vazebné kapacity transkortinu postupně vyčerpávají a je přítomno více volného prednisolonu, což může vést k rychlejšímu vylučování metabolitů.
Eliminace
Prednisolon je vylučován především játry, přibližně 70 % glukuronidací a přibližně 30 % sulfatací. Dochází také ke konverzi na 11B,17B-dihydroxyandrosta-1,4-dien-3-on a 1,4-pregnadien-20-ol.
Metabolity nevykazují žádnou hormonální aktivitu a vylučují se především ledvinami. Zanedbatelné množství prednisonu a prednisolonu se nachází v nezměněné podobě v moči. Plazmatický poločas eliminace predniso(lo)nu je přibližně 3 hodiny. U pacientů s těžkou jaterní dysfunkcí se může poločas prodloužit, a proto se má zvážit snížení dávky. Trvání biologických účinků predniso(lo)nu přesahuje dobu přítomnosti v séru.
Biologická dostupnost
Studie biologické dostupnosti provedená v roce 2003 na 27 zdravých jedincích ukázala následující výsledky ve srovnání s prednisonovými tabletami s okamžitým uvolňováním:
|
Parametr |
Lodotra 5 mg: 2,5 hod po lehkém jídle |
Lodotra 5 mg: Okamžitě po jídle |
Referenční přípravek 5 mg nalačno |
|
Maximální plazmatická koncentrace (Cmax): ng/ml |
20,2 (18,5; 21,9) |
21,8 (20,0; 23,7) |
20,7 (19,0; 22,5) |
|
Doba dosažení maximální plazmatické koncentrace (tmax): h |
6,0 (4,5; 10,0) |
6,5 (4,5; 9,0) |
2,0 (1,0; 4,0) |
|
Trvání zpoždění uvolňování léčiva (tlag): h |
4,0 (3,5; 5,0) |
3,5 (2,0; 5,5) |
0,0 (0,0; 0,5) |
|
Plocha pod křivkou koncentrace-čas (AUC 0-»): ng x h/ml |
110 (101; 119) |
123 (114; 133) |
109 (101; 118) |
Hodnoty jsou průměrem dle metody nejmenších čtverců a rozsah.
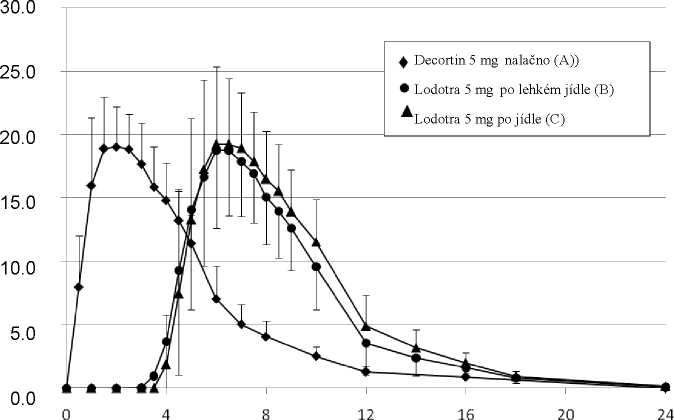
Čas od podání (h)
Graf: Průměrné plazmatické hladiny prednisonu po podání 5 mg prednisonu v jedné dávce ve formě přípravku Lodotra 5 mg nebo tablet s okamžitým uvolňováním. 5mg tablety s okamžitým uvolňováním (A: nalačno, podání ve 2 hod. ráno), Lodotra 5 mg (B: 2,5 hodiny po lehké večeři), Lodotra 5 mg (C: okamžitě po večeři).
Profily plazmatické koncentrace přípravku Lodotra jsou velmi podobné s profily tablet s okamžitým uvolňováním, s významným rozdílem, že profil přípravku Lodotra se opozdí o 4 - 6 hodin po požití léku. Nižší plazmatické koncentrace byly pozorovány u 6-7 % dávek.
Proporcionalita dávky byla prokázána pro přípravky Lodotra 1 mg, 2 mg a 5 mg na základě hodnot AUC a Cmax.
5.3 Předklinické údaje vztahující se k bezpečnosti
Subchronická/chronická toxicita
Změny prokazatelné světelným a elektronovým mikroskopem byly nalezeny na buňkách Langerhansových ostrůvků u potkanů po denním podávání i.p. dávky 33 mg/kg po dobu 7-14 dnů.
U králíků experimentální poškození jater mohlo být způsobeno podáváním denní dávky 2-3 mg/ kg po dobu 2-4 týdnů. Histotoxické účinky (myonekróza) byly popsány u morčat po několikatýdenním podávání dávky 0,5-5 mg/kg a u psů při dávce 4 mg/kg.
Mutagenita a potenciál k tvorbě nádorů
Toxicita prednisonu ve studiích prováděných na zvířatech byla spojena s přehnanou farmakologickou aktivitou. V běžných testech genotoxicity nebyly pozorovány žádné genotoxické účinky prednisonu.
Reprodukční toxicita
V reprodukčních studiích na zvířatech bylo prokázáno, že glukokortikoidy, jako je prednison, vyvolávají malformace (rozštěp patra, malformace skeletu). Při parenterálním podání u potkanů byly zjištěny menší anomálie lebky, čelisti a jazyka. Byla zaznamenána i intrauterinní růstová retardace (viz také bod 4.6).
U pacientů užívajících terapeutické dávky je nepravděpodobné, že by mohlo dojít k podobným účinkům.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety:
Koloidní bezvodý oxid křemičitý
Sodná sůl kroskarmelosy
Monohydrát laktosy
Magnesium-stearát
Povidon K 29/32
Červený oxid železitý E 172
Obal tablety:
Koloidní bezvodý oxid křemičitý
Dihydrát hydrogenfosforečnanu vápenatého
Glycerol-dibehenát
Magnesium-stearát
Povidon K 29/32
Žlutý oxid železitý E 172
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti 2 roky
Doba použitelnosti po prvním otevření lahvičky: 14 týdnů.
6.4 Zvláštní opatření pro uchovávání Neuchovávejte při teplotě nad 25 °C.
6.5 Druh obalu a obsah balení
Nádoba se 30 a 100 tabletami s řízeným uvolňováním
Bílá HDPE lahvička. Šroubovací uzávěr vyrobený z HDPE (s vysoušecí kapslí) se třemi vyvýšenými místy kolem okraje umožňujícími snadné otevření.
Nádoba s 500 tabletami s řízeným uvolňováním
Bílá HDPE lahvička (s malým množstvím LDPE). Šroubovací uzávěr (bez tří vyvýšených míst) z polypropylenu.
Velikost balení: Lahvičky se 30 a 100 tabletami s řízeným uvolňováním
Nemocniční balení: Lahvičky s 30, 100 a 500 tabletami s řízeným uvolňováním
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Mundipharma Gesellschaft m.b.H., Apollogasse 16-18, 1070 Vídeň, Rakousko
8. REGISTRAČNÍ ČÍSLO(A)
Lodotra 1 mg tablety s řízeným uvolňováním: 56/282/13-C Lodotra 2 mg tablety s řízeným uvolňováním: 56/283/13-C Lodotra 5 mg tablety s řízeným uvolňováním: 56/284/13-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
3.7.2013
10. DATUM REVIZE TEXTU
8.10.2014
12/12