Lidocain 2%
sp.zn. sukls57676/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Lidocain 2%
injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Lidocaini hydrochloridum monohydricum 43 mg, což odpovídá lidocaini hydrochloridum 40 mg, ve 2 ml.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok
Popis přípravku: čirý bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Lokální anestezie: navození krátkodobé anestezie v chirurgii, gynekologii a stomatologii a rovněž navození blokády nervů a navození kaudálního nebo jiného typu epidurálního bloku.
Kardiologie: léčba recidivující trvalé ventrikulární tachykardie nebo ventrikulární fibrilace, která nereaguje na beta-blokátory nebo amiodaron nebo v případě kontraindikace amiodaronu.
4.2 Dávkování a způsob podání
Dávkování
Lokální anestezie: doporučená dávka pro navození blokády nervů je 5-10 ml přípravku Lidocain 2%; k anestezii prstů na ruce a noze se podávají 2-3 ml.
Maximální dávka přípravku Lidocain 2% je 15 ml; tato dávka nemá být v průběhu 24 hodin opakována.
Pediatrická populace:
Dětem se podávají nižší a více zředěné celkové dávky v závislosti na jejich tělesné hmotnosti (0,5 %, 1 %). Maximální jednorázová dávka lidokainu je 4,5 mg/kg tělesné hmotnosti. Maximální dávka se nesmí během 24 hodin opakovat.
Kardiologie:
Bolus: u dospělých lze jako první dávku podat pomalou intravenózní injekcí 1 až 2 mg/kg tělesné hmotnosti (maximálně 100 mg). V 5- až 10minutových intervalech lze opakovaně podat dávku 0,5 až 0,75 mg/kg tělesné hmotnosti, a to do maximální celkové dávky 300 mg.
Intravenózní infuze: doporučuje se dát jednu ampulku přípravku Lidocain 2% na 500 ml Ringerova roztoku a podávat dávku lidokainu 20 až 55 pg/kg tělesné hmotnosti za minutu (rychlostí nejvýše 4 mg/min), přičemž k aplikaci se použije infuzní pumpa. K udržovací léčbě může být podávána infuze 1 mg/min tak dlouho, dokud to pacientův stav vyžaduje. Doporučuje se, aby infuzi vždy předcházela bolusová i.v. injekce.
Maximální dávka: u dospělých nemá dávka lidokainu podaná během 1 hodiny přesáhnout dávku 4,5 mg/kg tělesné hmotnosti nebo maximální dávku 300 mg.
Pediatrická populace:
Účinnost a bezpečnost použití lidokainu v pediatrické kardiologii není dostatečně prozkoumaná. Podle doporučení Americké kardiologické společnosti (American Heart Association) může být podána počáteční dávka 1 mg/kg tělesné hmotnosti a potom infuze 20 až 50 pg/kg tělesné hmotnosti za minutu. Při nedostatečném účinku může být podána druhá injekce s dávkou 1 mg/kg tělesné hmotnosti.
Při selhání srdce a hepatální nedostatečnosti: doporučuje se snížit dávku o 40 %.
U starších pacientů se selháním srdce se snižuje plazmatická clearance, a proto se doporučují nižší dávky.
Při používání tohoto přípravku u kardiologických pacientů je nevyhnutelné kontinuální lékařské sledování a monitorování EKG.
Způsob podání
Infiltrace, nervový blok, epidurální, intravenózní a subarachnoidální lokální anestezii; intravenózní aplikace při arytmii.
Toxicita může být snížena zředěním injekčního roztoku, a proto je třeba použít zředěný roztok, pokud jsou zapotřebí vyšší dávky. Injekční roztok může být zředěn 0,9% roztokem chloridu sodného.
4.3 Kontraindikace
• Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
• výskyt křečí po podání lidokainu v anamnéze;
• atrioventrikulární (AV) blokáda II.-III. stupně a porušená intraventrikulární vodivost;
• Adams-Stokesův syndrom, těžká bradykardie nebo syndrom chorého sinu (sick sinus syndrom);
• kardiogenní šok;
• signifikantní snížení funkce levé komory;
• těžká porucha funkce j ater.
U pacientů s glaukomem je kontraindikováno retrobulbární podání.
4.4 Zvláštní upozornění a zvláštní opatření pro použití
Při lokální anestezii tkání s bohatou vaskularizací (např. krk v případě operace strumy) podání vyžaduje zvláštní opatrnost, aby se zabránilo intravaskulárnímu podání. Aby se předešlo intravaskulárnímu podání, je třeba před vlastním podáním aspirovat, i když nepřítomnost krve ve stříkačce úplně nevylučuje možnost intravaskulárního podání.
Při podávání v oblasti hlavy a krku včetně dentálního použití stejně jako při blokádě ganglium stellatum, se musí použít nižší dávky, protože se mohou vyskytnout systémové toxické symptomy v důsledku retrográdního toku směrem k cerebrální cirkulaci.
Bezpečnost anestetik amidového typu je sporná u pacientů s predispozicí k maligní hypertermii, a proto je potřeba se jim v těchto případech vyhnout.
Epidurální anestezie má začít podáním testovací dávky, aby se zabránilo náhodnému subdurálnímu nebo intravazálnímu podání. U pacienta je potřeba pečlivě sledovat toxické účinky na kardiovaskulární a centrální nervový systém (protože epidurální dávky jsou vždy vyšší než dávky subdurální).
Anestezie v blízkosti páteře vyžaduje mimořádnou opatrnost u pacientů s neurologickým onemocněním, deformací páteře, septikémií a těžkou hypertenzí. Během spinální anestezie má být nepřetržitě sledován krevní tlak.
Paracervikální blokáda může někdy způsobit bradykardii/tachykardii plodu a je potřeba pečlivě monitorovat srdeční frekvenci plodu.
Účinek lokálních anestetik se může snížit, pokud je injekce podána do oblasti zánětu nebo infekce.
Vkardiologii má být před použitím lidokainu normalizovaná hladina draslíku (hypokalémie snižuje účinek lidokainu). Před léčbou lidokainem mají být upraveny hyperkalémie, hypoxie a poruchy acidobazické rovnováhy.
Zvláštní opatrnost je nutná v případech poruch jaterních funkcí, oběhové nedostatečnosti, hypovolémie, hypotenze, poruch vedení vzruchu, respirační nedostatečnosti, nedostatečné funkce ledvin, myastenie gravis a epilepsie, kdy je potřeba snížit dávky. Zvláštní péče je také doporučena při léčbě dětí a starších pacientů.
Během léčby je nutné monitorovat EKG. Pokud se vyskytne dysfunkce sinu, prodloužení PQ intervalu, rozšíření QRS komplexu nebo nová arytmie, má být dávka snížena nebo se má podávání ukončit, je-li to nezbytné. Při výrazné bradykardii může být intravenózně podáno 0,5 až 1 mg atropinu a pokud je to potřebné, mohou se při hypotenzi intravenózně podat sympatomimetika a/nebo antagonisté beta-receptorů.
Pacienti užívající antiarytmika třídy III (např. amiodaron) mají být pečlivě sledováni a má být kontrolováno EKG, neboť účinky na srdce mohou být aditivní.
Pro pacienty s akutní porfyrií je lidokain pravděpodobně porfyrinogenní a má se předpisovat pouze při závažných stavech nebo akutních indikacích.
Při léčbě lidokainem mají být dostupné léčivé přípravky a vybavení potřebné k resuscitaci!
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Chlorpromazin, cimetidin, propranolol, pethidin, bupivakain, chinidin, disopyramid, amitriptylin, imipramin a nortriptylin zvyšují plazmatickou hladinu lidokainu snížením hepatálního metabolismu.
Kombinace s antiarytmiky třídy Ia (např. chinidin, prokainamid, disopyramid) může vést k prodloužení QT intervalu a pouze vzácně může dojít k atrioventrikulární blokádě nebo fibrilaci komor.
Fenytoin zesiluje kardiodepresivní účinky lidokainu.
Kombinace lidokainu s prokainamidem může vyvolat neurologické nežádoucí účinky (delirium, halucinace).
Lidokain může zesilovat účinky neuromuskulárních blokátorů, protože omezuje přenos na neuromuskulární ploténce.
Nadměrné požití alkoholu zesiluje účinek lidokainu ve smyslu respiračního útlumu.
Při podávání v kombinaci se sedativy je třeba postupovat opatrně - zesilují se sedativní účinky.
4.6 Fertilita, těhotenství a kojení
V preklinických testech reprodukční toxicity u potkanů nezpůsobovaly dávky 6,6krát vyšší než humánní dávky fetotoxicitu, avšak tato zjištění nejsou vždy pro klinické stavy prediktivní.
Kontrolované klinické studie u těhotných žen zatím nebyly uskutečněny. Lidokain může prostupovat placentou. Lidocain lze v prvním trimestru těhotenství použít pouze tehdy, když klinický stav ženy vyžaduje léčbu lidokainem.
Kojení
Lidokain se do lidského mateřského mléka vylučuje, ale při podávání terapeutických dávek se žádné účinky na kojené novorozence/děti neočekávají.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek může působit na centrální nervový systém (viz bod 4.8), což může ovlivnit schopnosti řídit vozidla a obsluhovat stroje. Z tohoto důvodu musí lékař s ohledem na typ zákroku stanovit individuální rozsah omezení.
4.8 Nežádoucí účinky
Většina nežádoucích účinků závisí na dávce.
Frekvence nežádoucích účinků jsou definované podle následuj ící konvence:
Velmi časté (>1/10)
Časté (>1/100 až <1/10)
Méně časté (>1/1000 až <1/100)
Vzácné (>1/10000 to <1/1000)
Velmi vzácné (<1/10000)
Není známo (z dostupných údajů nelze určit)
Poruchy krve a lymfatického systému:
Velmi vzácné: methemoglobinémie
Poruchy imunitního systému:
Velmi vzácné: hypersenzitivita, anafylaktoidní reakce Psychiatrické poruchy:
Není známo: po podání vyšších dávek neklid, euforie, dezorientace.
Poruchy nervového systému:
Není známo: ospalost, závrať, po podání vyšších dávek třes, křeče, ztráta vědomí.
Poruchy oka:
Není známo: diplopie může být příznakem toxicity lidokainu.
Poruchy ucha a labyrintu:
Není známo: tinitus
Srdeční poruchy:
Vzácné: bradykardie, poruchy vedení vzruchu, zástava srdce
Cévní poruchy:
Vzácné: hypotenze
Respirační, hrudní a mediastinální poruchy:
Není známo: respirační tíseň a zástava dechu po podání vyšších dávek.
Gastrointestinální poruchy:
Časté: nauzea, zvracení, necitlivost jazyka a rtů
Poruchy kůže a podkožní tkáně:
Velmi vzácné: kožní reakce
Celkové poruchy a reakce v místě aplikace:
Velmi vzácné: edém
Při spinální nebo epidurální anestezii se může vyskytnout částečná nebo celková spinální blokáda s hypotenzí, ztrátou funkce rekta, močového měchýře a sexuálních funkcí, necitlivost v perineální oblasti. Pravděpodobnost těchto nežádoucích účinků se zvyšuje při podávání vyšší dávky nebo když se lidokain omylem podá do spinálního prostoru (t.j. když se dávka určená do epidurálního prostoru dostane do spinálního prostoru). Ve vzácných případech se ztracené motorické, senzorické a/nebo vegetativní funkce po takových zásazích vracejí pomalu (po několika měsících) nebo neúplně.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: http://www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Při předávkování lidokainem byly zaznamenány účinky na centrální nervovou soustavu a na kardiovaskulární systém. Necitlivost jazyka a rtů, neklid, úzkost, tinitus, závratě, rozmazané vidění, třes, deprese a ospalost mohou být prvními příznaky toxicity centrálního nervového systému. V tomto případě se má podávání lidokainu okamžitě zastavit.
V lokální anestezii je zvláště důležité monitorování kardiovaskulárních a respiračních funkcí pacienta, stejně jako jeho vědomí. Změna těchto parametrů může znamenat předávkování a je nutné podat ihned pacientovi kyslík. Je potřeba zajistit volné dýchací cesty a v případě potřeby má být zajištěno asistované nebo umělé dýchání.
CNS symptomy mohou být léčeny benzodiazepiny (např. diazepam) nebo barbituráty s krátkodobým působením (např. fenobarbital), během léčby nutno vzít v úvahu, že po i.v. podání mohou tyto léky způsobit respirační depresi. V případě předávkování během anestezie je doporučeno podání krátkodobého myorelaxancia (např. sukcinylcholin).
V akutní fázi předávkování lidokainem je dialýza neúčinná.
Pro zvládnutí kardiovaskulárních příznaků lze použít atropin, který může v dávce 0,5-1 mg podané i. v. pomoci upravit bradykardii a poruchu vodivosti, zatímco pro léčbu hypotenze jsou podávána sympatomimetika spolu s agonisty beta receptorů. Může být nezbytné intravenózní doplnění tekutin a elektrolytů.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: lokální anestetika, amidy ATC kód: N01BB02 Mechanismus účinku
Lidokain je lokální anestetikum amidového typu, látka stabilizující membránu a antiarytmikum třídy Ib podle klasifikace Vaughana Williama. Vyvolává anestezii dvěma způsoby: brání vzniku a vedení nervového vzruchu. Lokální anestetika včetně lidokainu působí prostřednictvím snížení permeability membrány neuronu pro ionty sodíku. Práh elektrické dráždivosti postupně stoupá a tak dochází k blokádě vedení. Nástup anestetického účinku je rychlý a blokáda může trvat 1 až 1,5 hodiny. Lidokain je široce používán k infiltraci, k blokádě nervů, k epidurální, intravenózní regionální a subarachnoidální anestezii.
Při použití jako antiarytmika působí lidokain potlačením diastolické depolarizace a spontánní tvorby potenciálu v komorách. Látka neovlivňuje AV vedení a nemá žádný vliv na síň. V terapeutických dávkách neovlivňuje srdeční frekvenci a nemá negativně inotropní účinky (kardiodepresivní účinky).
Nástup a trvání účinku
Po i. v. bolusovém podání bývá zaznamenán nástup účinku za 45-90 sekund. Nástup účinku 2% roztoku lidokainu je přibližně 15 minut.
5.2 Farmakokinetické vlastnosti
Absorpce
Po parenterálním podání je lidokain kompletně absorbován. Rozsah absorpce závisí na více faktorech, jako je místo podání a přítomnost nebo nepřítomnost vazokonstrikční látky. Kromě intravaskulárního podání jsou nejvyšší plazmatické hladiny spojeny s mezižeberní blokádou a nejnižší při subkutánním podání.
Distribuce
Distribuční prostor zahrnuje:
Mozkomíšní mok: lidokain prostupuje hematoencefalickou bariérou pasivní difúzí. Údaje shromážděné z literatury prokázaly, že u 10 pacientů bylo maximální plazmatické hladiny dosaženo 25 minut po podání a hodnoty v mozkomíšním moku dosáhly maxima za 70 minut po podání subkutánní injekce v dávce 2 mg/kg.
Tkáně: lék je distribuován do vysoce prokrvených tkání, např. do ledvin, plic, jater a srdce a také do tukové tkáně. Vzhledem k distribuci látky při absenci jaterního onemocnění nebo chronického selhání jater vymizí antiarytmický účinek jednotlivé intravenózní dávky během 10 až 20 minut.
Placenta: lidokain prostupuje placentou pasivní difúzí. Prostup lidokainu placentou může být dostatečný k dosažení toxických hladin v krvi plodu. Po subarachnoidální injekci lze lék detekovat v krvi matky i plodu; koncentrace jsou však nízké ve srovnání s koncentracemi po epidurálním podání. Lidokain rychle prostupuje placentou, objevuje se v krevním oběhu plodu během několika minut po podání matce. Poměr hladiny v pupečníkové krvi ke hladině v krvi matky po intravenózní a spinální anestezii se pohybuje mezi 0,5 a 0,7, ale byly zaznamenány i hodnoty až 1,32. Lék lze detekovat v moči novorozence po dobu 48 hodin po porodu.
Vazba na bílkoviny krevní plazmy: vazba lidokainu na bílkoviny plazmy závisí ve velké míře jak na plazmatické hladině léku, tak i na plazmatické koncentraci alfa-1-kyselých glykoproteinů (AAG). Vazba lidokainu na bílkoviny krevní plazmy se pohybuje v rozmezí od 33 % do 80 %. Bylo pozorováno, že vazba byla zvýšena u uremických pacientů a u nemocných s transplantovanou ledvinou a že k jejímu zvýšení dojde po akutním infarktu myokardu. Posledně uvedená skutečnost je také charakterizována vzestupem hladin AAG. Zvýšená vazba na bílkoviny může snížit dostupnost volného lidokainu nebo může dokonce způsobit zvýšení celkových plazmatických hladin léku.
Biotransformace
Lidokain je rychle metabolizován v játrech mikrosomálními enzymy a oxidativní N-dealkylace probíhá během několika minut. Rychlost metabolismu se zdá být omezena průtokem krve játry a v důsledku toho může poškodit pacienty po infarktu myokardu a/nebo srdečním selhání. Lidokain se metabolizuje na monoethylglycinexylidid (MEGX) a glycinexylidid. Oba metabolity jsou mnohem méně účinné antiarytmické sloučeniny než původní látka. Vzhledem k rychlému metabolismu jsou pro udržení potřebné terapeutické hladiny v krvi (1,5-5 pg/ml) nutné opakované i. v. bolusové injekce nebo kontinuální infuze (perfuze).
Eliminace
Přibližně 90 % léku je vyloučeno ve formě metabolitů a 10 % v nezměněné podobě ledvinami. Vyloučení nezměněného léku močí částečně závisí na pH moči. Uvádí se, že vyšší acidita moči má za následek vyloučení vyšší frakce lidokainu.
Biologický poločas lidokainu po i. v. podání je 1,5 až 2 hodiny. Může být prodloužen na 24 hodin při podávání léku infuzí. Biologický poločas je delší u pacientů s onemocněním jater. U pacientů se selháním jater a/nebo srdečním selháním se doporučuje 40% snížení dávky.
Linearita/nelinearita
Existuje lineární vztah mezi množstvím podaného lidokainu a výslednou maximální hladinou anestetik v krvi.
5.3 Předklinické údaje vztahující se k bezpečnosti
V preklinických studiích nebylo prokázáno, že by měl lidokain mutagenní účinky. Vzhledem k oblasti a trvání terapeutického použití tohoto léku nebyly provedeny studie kancerogenity lidokainu. Na základě konvenčních studií farmakologické bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu a reprodukční toxicity neodhalily neklinické údaje žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Chlorid sodný, voda na injekci.
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodu 6.6.
Po smísení lidokainu s amfotericinem, methohexitalem nebo sulfadiazinem dochází k precipitaci. V závislosti na pH roztoku může být lidokain inkompatibilní s ampicilinem.
6.3 Doba použitelnosti
5 let
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
6.5 Druh obalu a obsah balení
Ampulky z bezbarvého skla, jmenovitého objemu 2 ml s jedním bodem zlomu, v plastovém blistru a papírové krabičce. Ampule je označena jedním kroužkem. Značka One-point-cut/odlomení v jednom bodě je bílá. Barva kroužku je zelená.
Velikost balení: 10x2 ml, 100x2 ml.
Na trhu nemusí být všechny velikosti balení.
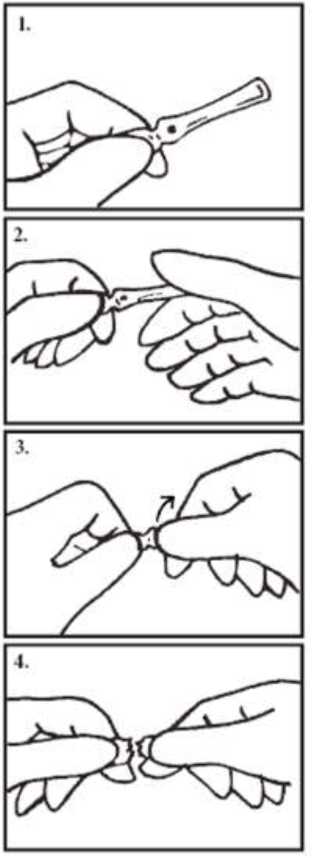
Postup otevírání (pro praváky):
Držte ampulku v levé ruce mezi palcem a ohnutým ukazováčkem. Ampuli držte barevnou značkou směrem nahoru (obr. 1)! Uchopte vrchní část ampulky mezi palcem a ohnutým ukazováčkem pravé ruky. Palec musí pokrývat bod ampulky (obrázek 2). Zatlačte pravým palcem proti levému ukazováčku a středně silným stálým tlakem odlomte ohnutím bez pohybu rukou od sebe nebo k sobě (obr. 3). Hrdlo ampulky může prasknout kdykoliv po počátečním tlaku a nemusíte cítit, kdy je ampule odlomená (obr. 4).
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Injekce lze ředit fyziologickým roztokem (0,9% NaCl).
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
EGIS Pharmaceuticals PLC 1106 Budapešť, Keresztúri út 30-38.
Maďarsko
8. REGISTRAČNÍ ČÍSLO (A)
01/758/92-S/C
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 18.12.1992
Datum posledního prodloužení registrace: 21.3.2012
10. DATUM REVIZE TEXTU
10.3.2016
Strana 9 (celkem 9)