Ketof
sp.zn. sukls55209/2009 a sukls18965/2011, sukls265122/2011
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
KETOF
Sirup
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Léčivá látka: Ketotifeni hydrogenfumaras 1,38 mg (odpovídá ketotifenum 1,0 mg) v 5 ml sirupu (1 odměrná lžička).
Pomocné látky se známým účinkem: propylparaben, methylparaben, sorbitol, ethanol 96% .
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Sirup
Popis přípravku: čirý, bezbarvý až slabě nažloutlý roztok s jahodovou vůní a sladkou chutí.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
- Symptomatické léčba alergické rinitidy a alergických kožních reakcí.
- Profylaxe astmatických potíží při senné rýmě a při alergické bronchitidě.
- Dlouhodobější podávání přípravku k profylaxi astmatických potíží a astmatických záchvatů. Při zahájené této léčby je třeba zpočátku pokračovat v dosavadní terapii bronchodilatátory, theofylinem nebo kortikoidy.
Poznámka
Ketotifen není vhodný k léčbě akutního astmatického záchvatu.
4.2 Dávkování a způsob podání
Malým dětem ve věku od 6 měsíců do 3 let se podává polovina odměrné lžičky s 2,5 ml sirupu (odpovídá 0,5 mg ketotifenu) vždy ráno a večer.
Dospělí, mladiství a děti starší než 3 roky užívají 1 odměrnou lžičku s 5 ml sirupu (odpovídá 1 mg ketotifenu) večer po první 3 až 4 dny terapie, a v dalších dnech 1 odměrnou lžičku s 5 ml sirupu (odpovídá 1 mg ketotifenu) vždy ráno a večer.
V případě nutnosti se jednotlivá dávka dospělým a pacientům starším než 10 let může zvýšit nejvýše na 10 ml sirupu (což odpovídá 2 mg ketotifenu) dvakrát denně, vždy ráno a večer.
Způsob a doba podávání
Sirup se může užívat neředěný anebo společně s libovolným množstvím tekutiny (např. vody, čaje nebo ovocné šťávy).
Protože se plný účinek dá očekávat teprve po 8 až 12 týdnech terapie, je třeba v léčbě po přiměřenou dobu pokračovat. O snížení dávek jiných současně používaných léčiv je možné uvážit až po uplynutí této doby.
Pro dobu trvání léčby nejsou stanovena zvláštní omezení.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 Epilepsie anebo křečové stavy v anamnéze (viz oddíl 4.4, Zvláštní upozornění a opatření pro použití).
4.4 Zvláštní upozornění a opatření pro použití
Během léčby ketotifenem byly hlášeny záchvaty. Jelikož ketotifen může snížit záchvatový práh, je kontraindikován u pacientů s epilepsií v anamnéze (viz bod 4.3 Kontraindikace).
Antiastmatika, která pacient již užívá preventivně anebo ke zvládnutí příznaků, se při zahájení dlouhodobé terapie ketotifenem nesmějí náhle vysadit. Platí to zejména pro systémově podávané kortikosteroidy, protože u pacientů závislých na kortikosteroidech může být přítomna insuficience nadledvin; v těchto případech si může návrat k normálním vztahům hypofýza-nadledviny vyžádat až 1 rok.
U pacientů, léčených současně ketotifenem a perorálními antidiabetiky (biguanidy), se vzácně objevil reverzibilní pokles počtu trombocytů. Proto je třeba u pacientů, užívajících souběžně biguanidy, pravidelně počty trombocytů kontrolovat.
Upozornění pro diabetiky
5 ml (1 odměrná lžička) sirupu KETOF obsahuje 3 g sorbitolu, což odpovídá 0,25 sacharidové jednotky.
Methylparaben a propylparaben mohou vyvolat reakce přecitlivělosti, včetně opožděných reakcí. Pacienti se vzácnou hereditární intolerancí fruktosy sirup KETOF užívat nemají.
Přípravek obsahuje 2,4 objemová procenta alkoholu.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Pozorované interakce, u nichž se nedoporučuje souběžné použití Perorální antidiabetika
U pacientů užívajících ketotifen souběžně s perorálními antidiabetiky (biguanidy) byl vzácně zaznamenán reverzibilní pokles počtu trombocytů. U pacientů užívajících ketotifen souběžně s perorálními antidiabetiky (biguanidy) je proto třeba provádět měření počtu trombocytů (viz bod 4.4 Zvláštní upozornění a opatření pro použití)
Předpokládané interakce, které je třeba vzít v úvahu Léčivé přípravky tlumící CNS
Ketotifen může potencovat centrální účinky centrálně tlumících látek, antihistasminik a alkoholu.
4.6 Fertilita, těhotenství a kojení
Ženy v plodném věku
Nejsou k dispozici údaje, které by podpořily speciální doporučení pro ženy v plodném věku. Těhotenství
Ketotifen neměl nepříznivé účinky na těhotenství ani na perinatální a postnatální vývoj v dávkách, tolerovaných březími samicemi pokusných zvířat, jeho bezpečnost u gravidních žen však nebyla
stanovena. Ketotifen by se proto neměl během těhotenství podávat, kromě případů, kdy je to zcela nezbytné a přínos převáží potenciální rizika.
Kojení
U potkanů se ketotifen vylučuje do mateřského mléka. Ačkoli nejsou k dispozici humánní údaje, je pravděpodobné,, že by se do mateřského mléka mohl vylučovat i u člověka. Žena léčená ketotifenem proto nesmí kojit.
Fertilita
Nejsou k dispozici údaje o vlivu ketotifenu/ketotifenu SRO na fertilitu u člověka (údaje získané u zvířat viz bod 5.3 Předklinické údaje vztahující se k bezpečnosti).
4.7 Účinky na schopnost řídit a obsluhovat stroje
V prvních dnech léčby ketotifenem může být pacietova reaktivita snížena, a proto je při řízení motorových vozidel a při obsluze strojů nutná zvýšená opatrnost. To platí zejména při kombinaci s požitím alkoholu nebo léčiv, která sama o sobě mohou reaktivitu nepříznivě ovlivnit.
Ketof sirup může mít výrazný vliv na schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Nežádoucí účinky z klinických studií jsou uvedeny dle tříd orgánových systémů MedDRA. V každé třídě orgánových systémů jsou nežádoucí účinky řazeny dle četnosti, s tím, že nejčastější je uveden jako první. V každé skupině četností jsou nežádoucí účinky řazeny dle klesající závažnosti. Kromě toho je odpovídající kategorie četnosti u každého nežádoucího účinku založena na následující klasifikaci (CIOMS III):
Velmi časté ( >1/10)
Časté (>1/100 až <1/10)
Méně časté (>1/1 000 až <1/100)
Vzácné (>1/10 000 až <1/1 000)
Velmi vzácné (<10 000), není známo (z dostupných údajů nelze určit)
Infekce a infestace
Méně časté: Cystitida
Poruchy imunitního systému
Velmi vzácné: Erythema multiforme, Stevensův-Johnsonův syndrom, závažné kožní reakce
Poruchy metabolismu a výživy
Vzácné: Zvýšení tělesné hmotnosti
Psychiatrické poruchy
Časté: Neklid, podrážděnost, nespavost, nervozita
Poruchy nervového systému
Méně časté: Závratě *
Vzácné: Útlum *, zmatenost
Gastrointestinální poruchy
Méně časté: Sucho v ústech*
*Sedace, sucho v ústech a závratě se mohou objevit na začátku léčby, obvykle však v průběhu medikace spontánně mizí.
**Příznaky stimulace CNS, např. excitace, podrážděnost, nespavost a nervozita, byly pozorovány především u dětí.
Nežádoucí účinky ze spontánních hlášení a případy z literatury (četnost není známa)
Následující nežádoucí účinky byly odvozeny ze zkušenosti s ketotifenem po uvedení na trh na základě spontánních hlášení a případů z literatury. Jelikož tyto účinky jsou hlášeny dobrovolně, u populace neurčeného rozsahu, není možné stanovit jejich frekvenci, která je tudíž kategorizována jako není známo. Nežádoucí účinky jsou uvedeny dle tříd orgánových systémů MeDRA. V každé třídě orgánových systémů jsou NU uvedeny dle klesající závažnosti:
Poruchy nervového systému: Křeče, spavost, bolesti hlavy Gastrointestinálníporuchy: Zvracení, nauzea, průjem Poruchy kůže a podkožní tkáně: Rash, urtikarie
Při terapii přípravkem KETOF sirup se může vyvinout únava.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo na adresu:
Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41, Praha 10, webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek.
4.9 Předávkování
Projevy a příznaky
Dosud jsou známy případy užití jednorázové dávky až 120 mg ketotifenu. Otravy neměly letální vyústění.
Po požití extrémně vysokých dávek se mohou objevit tyto příznaky: Unava, spavost až silná sedace, zmatenost a desorientace; bradykardie nebo tachykardie a hypotenze, tachypnoe, cyanóza; zejména u dětí zvýšená dráždivost a křeče; přechodné kóma.
Léčba
Léčba by měla být symptomatická. Pokud se vyskytne excitace či křeče, je možno podat krátkodobě působící barbituráty nebo benzodiazepiny. Doporučuje se monitorování kardiovaskulárního systému. Pokud byl přípravek podán před velmi krátkou dobou, je možné uvažovat o vyprázdnění žaludku. Prospěšné může být podání aktivního uhlí či solných projímadel.
Při případné nutné terapii - symptomatické nebo specifické - se použije tato opatření:
- monitorování kardiovaskulárních a respiračních funkcí
- fysostigmin při anticholinergních projevech
Ketotifen nelze odstranit dialýzou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Přípravek KETOF sirup je antiastmatikum, antihistaminikum, ATC kód R06 AX17 Ketotifen je perorálně účinný benzocykloheptathiofenový derivát s řadou farmakologických účinků. Působí jako antihistaminikum s výraznou specifitou pro Hi-receptory a jako slabé anticholinergikum. Dále byly prokázány ještě tyto účinky, které mohou být důležité pro preventivní působení při bronchiálním astmatu:
- inhibice degranulace žírných buněk se snížením uvolnění mediátorů, např. histaminu a leukotrienů
- inhibice bronchokostrikce vyvolané SRS-A
- zvýšení intracelulární koncentrace cAMP, vyvolané inhibicí fosfodiesterázy
- prevence snížení senzitivity beta2-receptorů anebo opětovná úprava jejich senzitivity.
Oproti účinnosti, kterou má ketotifen jako profylaktikum, však nemá terapeutický účinek při akutním astmatickém záchvatu ani nepůsobí bronchodilatačně. Zahájení účinku vyžaduje 8 - 12 týdnů terapie, účinnost jedné dávky přetrvává až 12 hodin.
Ketotifen může zpočátku působit sedativně. Po prvním týdnu léčby tento účinek většinou ustoupí.
5.2 Farmakokinetické vlastnosti
Po perorálním podání se ketotifen absorbuje z více než 80 %.
Maximální koncentrace v plazmě je dosaženo po 3-4 hodinách, eliminační poločas je 20 hodin. Terapeutická koncentrace v plazmě je 1-4 mikrog/ml, vazba na plazmatické proteiny je přibližně 70 %.
Hlavní podíl ketotifenu se v játrech metabolizuje glukuronidací a demetylací. Inaktivní N-glukuronid představuje hlavní metabolit ketotifenu; další, demetylovaný metabolit, je farmakologicky účinný. U dětí je zvýšen podíl N-demetylovaného metabolitu jako následek urychleného metabolismu látky. Močí se vylučuje více než 60 % podaného množství, méně než 1 % v nezměněné formě jako mateřská látka, zbytek ve formě metabolitů. Malý podíl se vyloučí stolicí. Eliminace ketotifenu při poruchách renálních nebo jaterních funkcí dosud studována nebyla.
Biologická dostupnost
R. 1990 byla provedena otevřená, zkřížená, randomizovaná studie biologické dostupnosti, v níž 20 dospělých mužů věku 21 - 34 let dostalo jednorázově per os 10 ml sirupu (což odpovídá 2 mg ketotifenu) ; výsledky ve srovnání s podáním referenčního přípravku uvádí tato tabulka:
_Zkoušený přípravek_Referenční přípravek_
Cmax (ng/ml) 421 ± 206 355 ± 147
Maximální koncentrace v plazmě
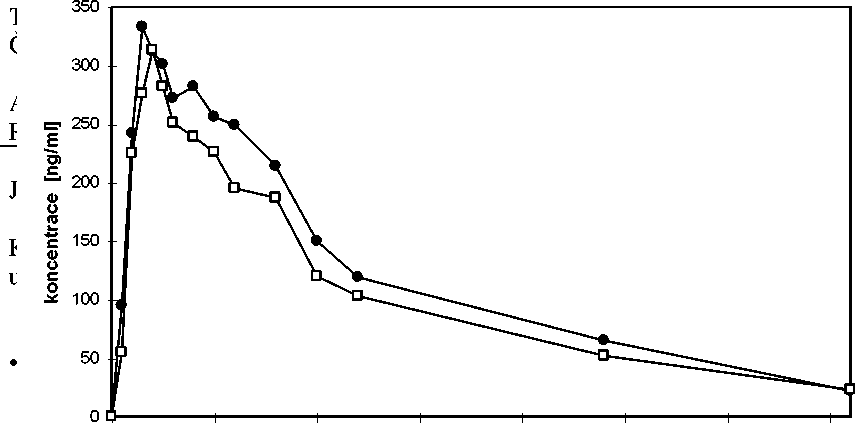
řípravkem
0 5 10 15 20 25 30 35
Čas [h]
5.3 Předklinické údaje vztahující se k bezpečnosti
Akutní toxicita
Akutní toxicita (LD50) po perorálním podání byla u myší 365 mg/kg, u potkanů 360 mg/kg, u králíků 790 mg/kg.
Chronická toxicita
Ve studiích chronické toxicity dávka 10 mg/kg denně, podávaná p.o. potkanům po dobu 13 týdnů, i dávka 5 mg/kg denně, podávaná p.o. psům po dobu až jednoho roku se prokázaly jako netoxické.
Mutagenní a tumorigennípotenciál
V četných testech mutagenity provedených in vitro a in vivo, nebyly nalezeny náznaky mutagenního účinku ketotifenu ani v koncentracích značně vyšších, než jaké odpovídají koncentracím, dosahovaným při terapii u člověka.
Dlouhodobá sledování u potkanů a myší nenalezla náznaky tumorigenního účinku ketotifenu. Reprodukční toxicita
Ve studiích, provedených na různých druzích pokusných zvířat, nebyly nalezeny náznaky teratogenního účinku. Ani po perorálně podávaných dávkách, dosahujících až toxických hodnot, ketotifen nepříznivě neovlivnil ani fertilitu, ani perinatální anebo postnatální vývoj.
Ketotifen přestupuje do mateřského mléka. Neexistují však žádné náznaky rizika pro kojence.
Předklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity, hodnocení kancerogenního potenciálu a reprodukční toxicity neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Kyselina citronová, dihydrát hydrogenfosforečnanu sodného, ethanol 96% (V/V), methylparaben, propylparaben, sorbitol, tekuté jahodové aroma, aroma, čištěná voda.
Sirup KETOF obsahuje 2,4 % (V/V) ethanolu.
Upozornění pro diabetiky:
5 ml sirupu KETOF (1 odměrná lžička) obsahuje 0,25 sacharidové jednotky
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
4 roky.
Po prvním otevření je přípravek použitelný 2 roky.
Přípravek se nesmí použít po uplynutí doby použitelnosti, uvedené na obalu. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25° C.
6.5 Druh obalu a velikost balení
Lahev z hnědého skla s bílým šroubovacím uzávěrem a těsnící vložkou (PE), PP odměrná lžička o obsahu 5 ml s ryskami na 1,25/2,5/5 ml, krabička.
Velikost balení:
100 ml nebo 200 ml.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Hexal AG, Industriestrasse 25, D-83607 Holzkirchen, Německo, e-mail: medwiss@hexal.de
8. REGISTRAČNÍ ČÍSLO
14/616/99-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
22.9.1999 / 13.8.2014
10. DATUM REVIZE TEXTU
13.8.2014