Immunine 600 Iu
sp.zn. sukls109557/2016 sukls81031/2016
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE IMMUNINE 600 IU
Prášek a rozpouštědlo pro injekční nebo infuzní roztok Factor IX coagulationis humanus
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek IMMUNINE a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek IMMUNINE používat
3. Jak se přípravek IMMUNINE používá
4. Možné nežádoucí účinky
5 Jak přípravek IMMUNINE uchovávat
6. Obsah balení a další informace
1. Co je přípravek IMMUNINE a k čemu se používá
Přípravek IMMUNINE je koncentrát koagulačního faktoru IX. Nahrazuje faktor IX, který u hemofilie B chybí nebo nefunguje správně. Hemofilie B je pohlavně vázaná, dědičná porucha krevní srážlivosti způsobená sníženými hladinami faktoru IX. Následkem toho dochází k závažnému krvácení do kloubů, svalů a vnitřních orgánů, buď bez příčiny nebo v důsledku úrazu či chirurgického poranění. Podání přípravku IMMUNINE dočasně upravuje nedostatek faktoru IX a snižuje sklon ke krvácení.
IMMUNINE se používá k léčbě a prevenci krvácení u pacientů s vrozenou hemofilií B.
IMMUNINE je určen k léčbě dětí od 6 let věku a dospělých. Není k dispozici dostatek údajů k tomu, aby bylo možné doporučit přípravek IMMUNINE k léčbě dětí do 6 let.
2. Čemu musíte věnovat pozornost, než začnete přípravek IMMUNINE používat Nepoužívejte přípravek IMMUNINE
• jestliže jste alergický(á) na lidský koagulační faktor IX nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
• pokud trpíte stavem zvaným spotřební koagulopatie (také známá jako DIC, diseminovaná intravaskulární koagulace). Je to život ohrožující stav, při kterém dochází k nadměrnému srážení krve s výraznou tvorbou krevních sraženin v krevních cévách.
• pokud trpíte stavem zvaným hyperfibrinolýza. K hyperfibrinolýze dochází při snížení krevní srážlivosti v důsledku rozpadu fibrinu, látky důležité pro srážlivost.
• pokud jste alergický(á) na heparin nebo máte v anamnéze abnormální pokles počtu krevních buněk důležitých pro tvorbu krevní sraženiny, který je způsoben podáním heparinu (heparinem indukovaná trombocytopenie).
Po odpovídající léčbě těchto stavů má být přípravek IMMUNINE podáván pouze v případě život ohrožujícího krvácení.
Upozornění a opatření
Před použitím přípravku IMMUNINE se poraďte se svým lékařem nebo lékárníkem.
Pokud se vyskytnou alergické reakce:
Existuje málo pravděpodobná možnost, že se u Vás vyskytne závažná, náhlá alergická reakce (anafylaktická reakce) na přípravek IMMUNINE.
Jestliže jste zaznamenal(a) kterýkoli z následujících příznaků, ihned zastavte infuzi a okamžitě zavolejte svého lékaře. Tyto příznaky mohou být časnými projevy anafylaktického šoku a vyžadují neodkladnou pohotovostní léčbu.
• zčervenání kůže
• vyrážka
• tvorba pupínků na kůži (kopřivka)
• svědění celého těla
• otok rtů a jazyka
• dýchací obtíže / dušnost
• porucha dýchání při a/nebo z důvodu zúžení dýchacích cest (sípání)
• tlak na hrudi
• celková nevolnost
• závrať
• pokles krevního tlaku
• ztráta vědomí
Kdy je nutné sledování:
• Lékař bude pravidelně kontrolovat Vaši krev, aby se ujistil, že je nynější dávkování dostatečné a Vaše krev dostává potřebné množství faktoru IX.
• Aby byly rozpoznány možné komplikace Váš lékař Vás bude zvláště pečlivě sledovat
o jestliže dostáváte vysoké dávky přípravku IMMUNINE
o jestliže máte sklon k trombózám. V tomto případě budete také dostávat nižší dávky faktoru IX, léčivé látky přípravku IMMUNINE.
Pokud krvácení přetrvává:
• Pokud Vaše krvácení po podání přípravku IMMUNINE neustane, informujte prosím ihned svého lékaře. Mohly se u Vás vytvořit inhibitory faktoru IX. Inhibitory faktoru IX jsou protilátky ve Vaší krvi, které působí proti účinkům faktoru IX. Tím se snižuje účinnost přípravku IMMUNINE při léčbě krvácení. Lékař provede nezbytná vyšetření, aby to potvrdil.
• Existuje možná souvislost mezi výskytem inhibitorů faktoru IX a alergickými reakcemi.
Pacienti s inhibitory faktoru IX mohou mít zvýšené riziko náhlých a závažných alergických reakcí (anafylaxe). Proto by pacienti, u nichž dojde k alergické reakci, měli být vyšetřeni na přítomnost inhibitoru faktoru IX.
Informace o bezpečnosti z hlediska přenosných agens
U léčivých přípravků vyráběných z lidské krve nebo plazmy se používají určitá opatření k prevenci přenosu infekce na pacienta. Mezi tato opatření patří:
• pečlivý výběr dárců krve a plazmy, aby se zajistilo vyloučení osob nesoucích riziko přenosu infekce
• testování jednotlivých odběrů krve a poolů plazmy na přítomnost virů/infekce
• zařazení výrobních kroků, které mohou inaktivovat nebo odstraňovat viry, do procesu zpracování krve nebo plazmy.
Přesto nemůže být při podávání léčiv vyráběných z lidské krve nebo plazmy zcela vyloučena možnost přenosu infekce. To platí i pro jakékoli neznámé nebo vznikající viry nebo jiné typy infekcí.
Přijatá opatření jsou považována za účinná u obalených virů, například viru lidské imunodeficience (HIV, virus vyvolávající AIDS), viru hepatitidy B a viru hepatitidy C a u neobaleného viru hepatitidy A.
Omezený účinek mohou mít tato opatření u neobalených virů jako je parvovirus B19 [virus vyvolávající zarudnutí kůže (infekční erytém)].
Infekce parvovirem B19 může být závažná u těhotných žen (infekce plodu) a u jedinců s poruchou funkce imunitního systému nebo u jedinců s určitými typy anémie (např. srpkovitá anémie či hemolytická anemie).
Pokud Vám jsou pravidelně/opakovaně podávány přípravky vyráběné z lidské plazmy, Váš lékař Vám může doporučit, abyste zvážil(a) očkování proti hepatitidě A a B.
Důrazně doporučujeme, abyste při každém podání přípravku IMMUNINE zaznamenal(a) název a číslo šarže přípravku, aby byl k dispozici přehled použitých šarží.
Děti
Není k dispozici dostatek údajů k tomu, aby mohlo být doporučeno podání přípravku IMMUNINE dětem mladším 6 let.
Další léčivé přípravky a přípravek IMMUNINE
Informujte svého lékaře nebo lékárníka o všech lécích, které používáte, které jste v nedávné době používal(a) nebo které možná budete používat.
Nejsou známy interakce přípravku IMMUNINE s jinými léčivými přípravky.
Těhotenství, kojení a plodnost
Hemofilie B je u žen velmi vzácná. Proto zatím nejsou zkušenosti s použitím přípravku IMMUNINE během těhotenství a kojení. Rovněž nejsou žádné zkušenosti ohledně dopadu přípravku IMMUNINE na plodnost.
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek používat. Lékař rozhodne, zda můžete přípravek IMMUNINE během těhotenství a kojení používat.
Řízení dopravních prostředků a obsluha strojů
Nebyly pozorovány žádné účinky na schopnost řídit či obsluhovat stroje.
Přípravek IMMUNINE obsahuje chlorid sodný a dihydrát natrium-citrátu.
Přípravek IMMUNINE 600 IU obsahuje 20 mg sodíku v jedné lahvičce (stanoveno výpočtem). To je třeba vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku.
3. Jak se přípravek IMMUNINE používá
Vaše léčba by měla být zahájena a vedena lékaři, kteří mají zkušenosti s léčbou hemofilie B.
Váš lékař určí dávku, která je pro Vás vhodná. Vypočítá ji na základě Vašich speciálních potřeb. Máte-li pocit, že je účinek přípravku IMMUNINE příliš silný nebo příliš slabý, prosím, promluvte si se svým lékařem.
Použití u dětí
Není k dispozici dostatek údajů k tomu, aby mohlo být doporučeno podání přípravku IMMUNINE dětem mladším 6 let.
Sledování prováděné Vaším lékařem
Lékař Vám bude pravidelně provádět určité laboratorní testy, aby se ujistil, že máte v krvi dostatečné množství faktoru IX. To je zvláště důležité v případě velkého chirurgického výkonu nebo život ohrožujících krvácení.
Pacienti s inhibitory
Pokud není ani po odpovídající dávce dosaženo očekávaných hladin faktoru IX v krvi nebo pokud krvácení neustává, mohou být přítomny inhibitory. Lékař ověří přítomnost inhibitorů pomocí vhodných testů. V případě vývoje inhibitoru má být kontaktováno specializované centrum pro léčbu hemofilie.
Pokud se u Vás vytvořily inhibitory faktoru IX, můžete potřebovat větší množství přípravku IMMUNINE k zastavení krvácení. Pokud krvácení ani pak neustane, Váš lékař zváží jiný přípravek. Bez porady s lékařem nezvyšujte dávku přípravku IMMUNINE k zastavení krvácení.
Četnost podávání
Váš lékař Vám vysvětlí, jak často a v jakých intervalech si máte přípravek IMMUNINE aplikovat. Četnost podávání určí přímo pro Vás, podle Vaší odpovědi na přípravek IMMUNINE.
Cesta a/nebo způsob podání
Přípravek IMMUNINE se podává pomalu do žíly (intravenózně) po přípravě roztoku pomocí přiloženého rozpouštědla.
Přípravek IMMUNINE nesmí být před podáním mísen s jinými léčivy. Mohlo by to narušit účinnost a bezpečnost přípravku.
Prosím, pečlivě dodržujte pokyny svého lékaře.
Rychlost podání závisí na tom, jak Vám to je příjemné, a neměla by překročit 2 ml za minutu.
• Používejte pouze přiložený set k podání přípravku. Při použití jiných injekčních setů může přípravek IMMUNINE přilnout k vnitřním stěnám infuzního setu, což může vést k nesprávnému dávkování.
• Pokud stejným žilním přístupem dostáváte i jiné léčivé přípravky, musí být tento žilní vstup propláchnut vhodným roztokem, např. fyziologickým roztokem, před a po podání přípravku IMMUNINE.
• Přípravek IMMUNINE rozpouštějte těsně před podáním a roztok poté ihned použijte. (Roztok neobsahuje konzervační látky.)
• Injekční roztok je čirý nebo mírně zakalený. Nepoužívejte roztoky, které jsou hodně zakalené nebo obsahují viditelné částice.
• Nespotřebovaný rozpuštěný přípravek vhodným způsobem zlikvidujte.
Rozpouštění prášku k přípravě injekčního roztoku:
Dbejte na to, abyste roztok připravoval/a v co nejčistších a nejsterilnějších podmínkách!
1. Zahřejte neotevřenou inj. lahvičku obsahující rozpouštědlo (vodu na injekci) na pokojovou teplotu (maximálně +37°C).
2. Odstraňte ochranná víčka z lahvičky s práškem a z lahvičky s rozpouštědlem (obr. A) a dezinfikujte pryžové zátky obou lahviček.
3. Odstraňte ochranný kryt z jednoho konce přiložené převodní j ehly krouživým pohybem a povytažením. Odkrytou jehlu vpíchněte přes pryžovou zátku do lahvičky s rozpouštědlem (obr. B a C).
4. Odstraňte ochranný kryt z druhého konce převodní jehly; nedotýkejte se odkrytého konce.
5. Převraťte lahvičku s rozpouštědlem nad lahvičku s práškem a propíchněte volným koncem převodní jehly pryžovou zátku lahvičky s práškem (obr. D). Rozpouštědlo se pomocí vakua samo natáhne do lahvičky s práškem.
6. Poté, co je všechen roztok natažen do lahvičky s práškem, oddělte obě lahvičky od sebe vyjmutím jehly z lahvičky s práškem (obr. E). Lahvičkou s práškem jemně zatřepejte nebo zakroužete, aby se urychlilo rozpouštění.
7. Po úplném rozpuštění prášku zapíchněte přiloženou zavzdušňovací jehlu (Obr. F), čímž všechna pěna opadne. Zavzdušňovací jehlu vyjměte.
Injekce/infuze:
Dbejte na to, abyste roztok připravoval/a v co nejčistších a nejsterilnějších podmínkách!
1. Sejměte ochranný kryt z přiložené filtrační jehly pootočením a povytažením a nasaďte jehlu na sterilní jednorázovou inj. stříkačku. Natáhněte roztok do inj. stříkačky (obr. G).
2. Odpojte filtrační jehlu od injekční stříkačky a pomalu roztok intravenózně aplikujte (nejvýše rychlostí 2 ml/min) pomocí přiloženého infuzního setu (nebo přiložené jednorázové jehly).
Při infuzním podání je nutno použít jednorázovou infuzní soupravu s vhodným filtrem.
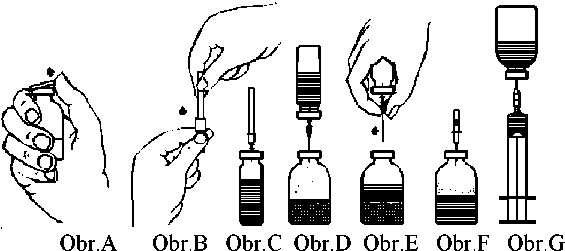
Délka trvání léčby
Obvykle je nutná dlouhodobá léčba přípravkem IMMUNINE.
Jestliže jste použil(a) více přípravku IMMUNINE, než jste měl(a)
Informujte prosím svého lékaře. Příznaky předávkování faktorem IX nebyly hlášeny.
Jestliže jste zapomněl(a) použít přípravek IMMUNINE
• Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku.
• Okamžitě pokračujte další dávkou, a poté pokračujte v pravidelných intervalech, jak Vám doporučil lékař.
Jestliže jste přestal(a) používat přípravek IMMUNINE
Bez porady s lékařem nepřestávejte přípravek IMMUNINE používat.
Máte-li jakékoli další otázky, týkající se používání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud se u Vás vyskytne některý z následujících závažných nežádoucích účinků, měl(a) by jste vyhledat neprodleně lékařskou radu.
• nebezpečná alergická reakce (anafylaktická reakce). Jestliže jste zaznamenal (a) kterýkoli z následujících příznaků, ihned zastavte infuzi a okamžitě zavolejte svého lékaře. Buďte zvláště pozorný(á), pokud Váš doktor zjistí inhibitory ve Vaší krvi.
• zčervenání kůže
• vyrážka
• tvorba pupínků na kůži (kopřivka)
• svědění celého těla
• otok rtů a jazyka
• dýchací obtíže / dušnost
• porucha dýchání při a/nebo z důvodu zúžení dýchacích cest (sípání)
• tlak na hrudi
• celková nevolnost
• závrať
• pokles krevního tlaku
• ztráta vědomí
• náhle vznikající otok kůže a slizničních membrán s nebo bez poruch polykání nebo dechu (angioedém),
• vznik krevních sraženin v malých žílách celého těla (diseminovaná intravaskulární koagulace (DIC)),
• srdeční příhoda (infarkt myokardu),
• rychlé bušení srdce (tachykardie),
• pokles krevního tlaku (hypotenze),
• krevní sraženiny (tromboembolické příhody),
• uzávěr cévy krevní sraženinou (např. plicní embolie, žilní trombóza, tepenná trombóza, trombóza mozkové tepny),
• zrudnutí
• zhoršení vdechu a/nebo výdechu v důsledku zúžení dýchacích cest (sípání),
• dýchací obtíže (dyspnoe)
• porucha ledvin s příznaky jako otok víček, tváře a spodní části dolních končetin se zvýšením hmotnosti a ztrátou bílkovin močí (nefrotický syndrom)
Pokud Váš doktor zj istí inhibitory ve Vaší krvi, může být u Vás specifické riziko stavu zvaného sérová nemoc. Jestliže jste zaznamenal(a) kterýkoli z následujících příznaků, ihned zastavte infuzi a okamžitě zavolejte svého lékaře.
• vyrážka
• svědění
• bolesti kloubů (artralgie), a to zejména v prstech na rukou a nohou
• horečka
• otoky lymfatických uzlin (lymfadenopatie)
• pokles krevního tlaku (hypotenze)
• zvětšená slezina (splenomegalie)
Další nežádoucí účinky
Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 pacientů):
• dráždění v krku a bolest v krku, kašel (suchý)
• vyrážka a svědění (pruritus)
• horečka (pyrexie)
Nežádoucí účinky, jejichž četnost nelze z dostupných údajů stanovit:
• bolest hlavy
• neklid
• brnění
• pocit nevolnosti (nauzea)
• zvracení
• vyrážka po celém těle (kopřivka)
• zimnice
• reakce z přecitlivělosti
• pálení a štípání v místě injekce
• otupělost
• zrudnutí
• dechové obtíže (tlak na hrudi)
Následující nežádoucí účinky byly zaznamenány u přípravků ze stejné skupiny:
Abnormální nebo snížené vnímání (parestezie)
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www .sukl.cz/nahlasit-nezadouci-ucinek.
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek IMMUNINE uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku a krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v chladničce (2°C až 8°C). Chraňte před mrazem.
Lahvičky uchovávejte v krabičce, aby byl přípravek chráněn před světlem.
Během uvedené doby použitelnosti může být přípravek IMMUNINE uchováván při pokojové teplotě do 25°C, nejvýše však po omezenou dobu 3 měsíců. Začátek a konec uchovávání při teplotě do 25°C vyznačte na krabičku přípravku. Přípravek IMMUNINE musíte během těchto tří měsíců spotřebovat. Pokud přípravek nespotřebujete, musíte jej po uplynutí tří měsíců zlikvidovat. Přípravek nesmí být ukládán zpět do chladničky.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
Obsah balení a další informace
6.
Co přípravek IMMUNINE obsahuje
Prášek
- Léčivou látkou je lidský krevní koagulační faktor IX. 1 inj. lahvička s práškem pro přípravu injekčního roztoku obsahuje 600 IU factor IX coagulationis humanus.
Po rozpuštění v 5 ml vody na injekci obsahuje 1 ml roztoku 120 IU lidského koagulačního faktoru IX.
- Pomocnými látkami jsou chlorid sodný a dihydrát natrium-citrátu.
Rozpouštědlo
- voda na injekci
Jak přípravek IMMUNINE vypadá a co obsahuje toto balení
Přípravek IMMUNINE je bílý nebo nažloutlý prášek pro přípravu injekčního roztoku. Po rekonstituci v přiloženém rozpouštědle (voda na injekci) je roztok čirý nebo mírně zakalený (opalescentní). Pokud zpozorujete změnu barvy nebo přítomnost částic v roztoku nebo zakalení roztoku, přípravek prosím nepoužívejte a kontaktujte zákaznický servis společnosti.
Velikost balení: 1x 600 IU
Jedno balení obsahuje:
1 lahvičku přípravku IMMUNINE 600 IU 1 lahvičku s vodou na injekci (5 ml)
1 převodní jehlu 1 zavzdušňovací jehlu 1 filtrační jehlu
1 jehlu k jednorázovému použití 1 injekční stříkačku (5 ml) k jednorázovému použití 1 infuzní set
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci Do 31.10.2016:
BAXTER CZECH spol. s r.o., Praha, Česká republika
Od 1.11.2016:
Baxalta Innovations GmbH Industriestrasse 67 A-1221 Vídeň Rakousko
Výrobce
Baxter AG, Industriestrasse 67, Vídeň, Rakousko Registrační číslo: 75/008/08-C
Tento léčivý přípravek je v členských státech EHP registrován pod těmito názvy:
Rakousko: Immunine 600 I.E. - Pulver und Losungsmittel zur Herstellung einer Injektionslosung Bulharsko: Immunine 600 IU Česká republika: Immunine 600 IU
Estonsko: Immunine Německo: Immunine 600 I.E.
Itálie: Fixnove
Lotyšsko: Immunine 600 SV pulveris un škidinátájs injekciju vai infuziju škiduma pagatavošanai
Litva: Immunine 600 TV milteliai ir tirpiklis injeciniam tirpalui
Nizozemsko: Immunine
Norsko: Immunine 600 IE
Polsko: Immunine 600 IU
Portugalsko: Immunine 600 IU
Rumunsko: Immunine 600 IU
Slovensko: Immunine 600 IU
Slovinsko: Immunine 600 IU
Španělsko: Immunine 600 IU
Švédsko: Immunine 600 IE
Tato příbalová informace byla naposledy revidována: 1.6.2016
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Dávkování a způsob podání
Léčba by měla být zahájena pod dozorem lékaře, který má zkušenosti s léčbou hemofilie.
Dávkování
Dávka a délka substituční léčby závisí na závažnosti deficitu faktoru IX, na místě a rozsahu krvácení a na klinickém stavu pacienta.
Podávaná dávka faktoru IX se vyjadřuje v mezinárodních jednotkách (IU), které se vztahují k aktuálnímu standardu WHO pro přípravky obsahující faktor IX. Aktivita faktoru IX v plazmě se vyjadřuje buď v procentech (vzhledem k normální lidské plazmě) nebo v mezinárodních jednotkách-IU (vzhledem k mezinárodnímu standardu pro koncentráty faktoru IX v plazmě).
Jedna mezinárodní jednotka (IU) aktivity faktoru IX odpovídá množství faktoru IX v 1 ml normální lidské plazmy.
Léčba podle potřeby
Výpočet požadované dávky faktoru IX je založen na empirickém zjištění, že 1 mezinárodní jednotka (IU) faktoru IX na kg tělesné hmotnosti u pacientů ve věku 12 a starších zvyšuje aktivitu faktoru IX v plazmě přibližně o 1,1 % normální aktivity.
Potřebná dávka se určuje podle následujícího vzorce:
Potřebné jednotky = tělesná hmotnost (kg) x požadovaný vzestup faktoru IX (%) (IU/dl) x 0,9
Dávka a četnost podávání by měly být vždy vztaženy ke klinické účinnosti v individuálním případě. Přípravky obsahující faktor IX jen zřídka vyžadují častější podávání než jednou denně.
V případě následujících krvácivých příhod by v daném období neměla poklesnout aktivita faktoru IX pod danou plazmatickou aktivitu (v % normálu nebo v IU/dl).
Následující tabulka může být vodítkem pro určení dávkování při krvácivých příhodách a chirurgických výkonech:
|
Stupeň krvácení / Typ chirurgického výkonu |
Požadovaná hladina faktoru IX (% normálu)(IU/dl) |
Frekvence dávkování (hodiny) / Délka trvání léčby (dny) |
|
Krvácení | ||
|
Časná hemartróza, krvácení do svalů nebo ústní dutiny |
20-40 |
Opakujte každých 24 hodin. Nejméně 1 den, dokud se krvácení, které se vyznačuje bolestí, nezastaví nebo se nedosáhne vyléčení. |
|
Rozsáhlejší hemartróza, krvácení do svalů nebo hematom |
30-60 |
Opakujte infuze každých 24 hodin po 3-4 dny či více, dokud bolest a akutní nemohoucnost nepřejdou. |
|
Život ohrožující krvácení |
60-100 |
Opakujte infuze každých 8 až 24 hodin, dokud není nebezpečí zažehnáno. |
|
Operace | ||
|
Menší Včetně extrakce zubu |
30-60 |
Každých 24 hodin, nejméně 1 den, dokud se nedosáhne vyléčení. |
|
Větší operace |
80-100 (před operací a po operaci) |
Opakujte infuze každých 8-24 hodin až do adekvátního zahojení rány, pak pokračujte v terapii nejméně dalších 7 dní, abyste udrželi aktivitu na 30% až 60%. |
Profylaxe
Pro dlouhodobou profylaxi krvácení u pacientů s těžkou hemofilií B jsou obvyklé dávky 20 až 40 IU faktoru IX na kg tělesné hmotnosti v intervalu 3 až 4 dnů.
V některých případech, zejména u mladších pacientů, mohou být nezbytné kratší intervaly mezi dávkami nebo vyšší dávky.
Jako vodítko k určení potřebné dávky a frekvence opakovaných infuzí se doporučuje sledování hladin faktoru IX v průběhu léčby. Zejména v případě větších chirurgických výkonů je přesné sledování substituční terapie pomocí koagulačních vyšetření (aktivity faktoru IX v plazmě) nezbytné. Jednotliví pacienti se mohou lišit v odpovědi na faktor IX dosahováním různých hodnot in vivo recovery a vykazováním různých poločasů.
Pediatrická populace
Na základě dostupných klinických údajů může být pro dětské pacienty doporučeno dávkování u pacientů starších než 12 let. U věkové skupiny od 6 let do 12 let nejsou dostupné klinické údaje dostatečné pro poskytnutí doporučení dávkování.
Nežádoucí účinky
Zvláštní populace
Používání přípravku IMMUNINE bylo sledováno u pediatrických pacientů s hemofilií B. Bezpečnost byla podobná jako u dospělých používajících přípravek IMMUNINE.
Používání přípravku IMMUNINE bylo sledováno ve dvou observačních studiích u dětí ve věku do 6 let a u pacientů ve věku 0-64 let s hemofilií B, resp. Bezpečnost u dětí ve věku do 6 let byla podobná jako u dětí starších než 6 let a u dospělých používajících přípravek IMMUNINE.
10