Immunate Stim Plus 250 Iu Fviii/190 Iu Vwf
sp.zn. sukls132809/2016
Příbalová informace: Informace pro uživatele
Immunate Stim Plus 250 IU FVIII/190 IU VWF
Prášek a rozpouštědlo pro injekční roztok Léčivé látky: Factor VIII coagulationis humanus / Factor von Willebrand humanus
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci:
1. Co je přípravek Immunate a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Immunate používat
3. Jak se přípravek Immunate používá
4. Možné nežádoucí účinky
5 Jak přípravek Immunate uchovávat
6. Obsah balení a další informace
1. Co je přípravek Immunate a k čemu se používá Co je přípravek Immunate
Přípravek Immunate je komplex koagulačního faktoru VIII a von Willebrandova faktoru vyrobený z lidské plazmy. Koagulační faktor VIII v přípravku Immunate nahrazuje faktor VIII, který při hemofilii A chybí nebo nefunguje správně. Hemofilie A je na pohlaví závislá dědičná porucha srážení krve způsobená sníženými hladinami faktoru VIII. Má za následek silné krvácení do kloubů, svalů a vnitřních orgánů, ať už spontánní nebo jako důsledek úrazu nebo chirurgického traumatu. Podání přípravku Immunate dočasně upravuje nedostatek faktoru VIII a snižuje sklon ke krvácení.
Kromě toho, že von Willebrandův faktor (VWF) funguje jako ochranný protein faktoru VIII, zprostředkovává rovněž přilnutí destiček k místům cévních poranění a je důležitým prvkem při shlukování destiček.
K čemu se přípravek Immunate používá
Přípravek Immunate se používá k léčbě a prevenci krvácení u pacientů s vrozeným (hemofilie A) nebo získaným nedostatkem faktoru VIII.
Přípravek Immunate se rovněž používá k léčbě krvácení u pacientů s von Willebrandovou chorobou s nedostatkem faktoru VIII, pokud není dostupný jiný přípravek účinný proti von Willebrandově chorobě a pokud léčba samotným desmopresinem (DDAVP) je neúčinná nebo kontraindikovaná.
2. Čemu musíte věnovat pozornost, než začnete přípravek Immunate používat Nepoužívejte přípravek Immunate
- Jestliže jste alergický(á) na lidský koagulační faktor VIII nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Jestliže si tím nejste jistý(á), zeptejte se svého lékaře.
Upozornění a opatření
Nastanou-li alergické reakce:
• Existuje vzácná možnost, že se u Vás vyvine anafylaktická reakce (těžká, náhlá alergická reakce) na přípravek Immunate. Mějte na paměti časné příznaky alergické reakce jako je nával horka, vyrážka, kopřivka, pupeny, celkové svědění, otoky rtů, očních víček a jazyka, obtížné dýchání, sípání, bolest na hrudi, tlak na hrudi, celkově nezdravý pocit a závratě, zrychlený tlukot srdce a nízký krevní tlak. Tyto příznaky mohou představovat časný příznak anafylaktického šoku, jehož projevy mohou dále zahrnovat extrémní závratě, ztrátu vědomí a extrémní dýchací potíže.
• Pokud se některý z těchto příznaků objeví, ihned zastavte injekci/infuzi a kontaktujte svého lékaře. Těžké příznaky, včetně dýchacích potíží a (téměř) mdlob, vyžadují okamžitou léčbu.
Jestliže je potřebné sledování:
• Váš lékař může chtít provést vyšetření, aby se ujistil, že je Vaše současná dávka přípravku Immunate dostatečná pro dosažení a udržení adekvátních hodnot faktoru VIII nebo von Willebrandova faktoru.
Jestliže se stále objevuje krvácení:
• Jestliže se krvácení po léčbě s přípravkem Immunate nezastaví, poraďte se ihned se svým lékařem. Mohly se u Vás vytvořit neutralizující protilátky (inhibitory) proti faktoru VIII. Váš lékař může chtít provést testy pro jejich potvrzení. Inhibitory faktoru VIII jsou protilátky v krvi, které blokují faktor VIII, který používáte. To snižuje účinnost faktoru VIII při kontrole krvácení.
Pokud trpíte von Willebrandovou chorobou, zvláště typem 3, mohou se u Vás vyvinout neutralizující protilátky (inhibitory) na von Willebrandův faktor. Váš lékař může chtít provést test k jejich potvrzení. Inhibitory von Willebrandova faktoru jsou protilátky v krvi, které blokují von Willebradův faktor, který užíváte. Proto je pak von Willebrandův faktor při kontrole krvácení méně účinný.
Při výrobě léčivých přípravků z lidské krve nebo plazmy jsou dodržována opatření zabraňující přenosu infekce na pacienty. Patří sem pečlivý výběr dárců krve a plazmy, který vylučuje možné přenašeče infekčních onemocnění, testování každého vzorku plazmy na přítomnost virů a infekcí a při zpracování krve nebo plazmy jsou zahrnuty určité kroky, při nichž jsou viry inaktivovány nebo odstraněny. Přes všechna tato opatření při přípravě léků vyráběných z lidské krve nebo plazmy nelze možnost přenosu infekce zcela vyloučit. To platí i pro jakékoli neznámé nebo vznikající viry či jiné typy infekcí.
Přijatá opatření jsou považována za účinná u obalených virů, jako je virus lidské imunodeficience (HIV), virus hepatitidy typu B a virus hepatitidy typu C, a neobaleného viru hepatitidy typu A. Omezený účinek mají tato opatření u neobalených virů, jako je parvovirus B19. Infekce parvovirem B19 může být závažná zejména pro těhotné ženy (fetální infekce) a pro jedince se sníženou funkcí imunitního systému nebo s anémií určitého typu (například srpkovitá nebo hemolytická anémie).
Pokud pravidelně nebo opakovaně užíváte produkty s faktorem VIII izolovaným z lidské plazmy, lékař Vám může doporučit, abyste zvážili očkování proti hepatitidě typu A a B.
Při aplikaci každé dávky přípravku Immunate se důrazně doporučuje zaznamenat název a číslo šarže přípravku, aby bylo možné zpětně zjistit údaje o použité šarži.
Přípravek Immunate obsahuje iso-agglutininy krevních skupin (anti-A a anti-B). U pacientů s krevní skupinou A, B nebo AB se může objevit hemolýza po opakovaném podání v krátkých časových intervalech nebo po podání velmi vysokých dávek.
Děti
U dětí mladších 6 let, které byly pouze výjimečně léčeny přípravky s obsahem FVIII, používejte přípravek obezřetně, jelikož pro tuto skupinu pacientů jsou k dispozici jen omezené klinické údaje.
Další léčivé přípravky a přípravek Immunate
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Nebyly hlášeny žádné interakce přípravku Immunate s jinými léčivými přípravky.
Přípravek Immunate nesmí být před podáním mísen s žádnými dalšími léčivými přípravky nebo rozpouštědly, s výjimkou přiložené sterilizované vody na injekci, protože by tím mohla být narušena účinnost a bezpečnost přípravku. Před infuzí přípravku Immunate a po ní je vhodné propláchnout zavedený žilní přístup například fyziologickým roztokem.
Přípravek Immunate s jídlem a pitím
Neexistují specifická doporučení vzhledem k podávání přípravku Immunate spolu s potravou. Těhotenství, kojení a plodnost
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat.
Nejsou zkušenosti s podáváním přípravku Immunate během těhotenství, kojení a s plodností, protože hemofilie A je u žen vzácná. Přípravek Immunate by měl být používán během těhotenství a kojení pouze v jednoznačných indikacích. Informujte proto svého lékaře, jste-li těhotná nebo kojíte. Váš lékař rozhodne, zda během těhotenství a kojení budete moci přípravek Immunate používat.
Řízení dopravních prostředků a obsluha strojů
Neexistují žádné informace o účincích přípravku Immunate na schopnost řídit nebo obsluhovat stroje. Přípravek Immunate obsahuje sodík
Máte-li předepsanou dietu s nízkým obsahem sodíku, bude Vás Váš lékař pečlivě sledovat, protože množství sodíku v maximální denní dávce může přesáhnout 200 mg.
3. Jak se přípravek Immunate používá
Vaše léčba by měla být pod dohledem lékaře se zkušenostmi s léčbou poruch krevní srážlivosti.
Vždy užívejte přípravek Immunate přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem.
Dávkování pro profylaxi krvácení
Pokud užíváte přípravek Immunate k předcházení krvácení (profylaxi), Váš lékař Vám vypočítá dávku podle Vaší individuální potřeby. Obvyklá dávka bude mezi 20 a 40 IU faktoru VIII na 1 kg tělesné hmotnosti, podávaná v intervalech 2 až 3 dnů. V některých případech, zejména u mladších pacientů, mohou být nezbytné kratší intervaly mezi dávkami nebo vyšší dávky.
Jestliže máte pocit, že účinek přípravku Immunate je nedostatečný, sdělte to svému lékaři.
Dávkování pro léčbu krvácení
Jestliže dostáváte přípravek Immunate pro léčbu krvácení, Váš lékař Vám vypočítá dávku podle Vaší
individuální potřeby s použitím následujícího vzorce._
Potřebné IU = tělesná hmotnost (kg) x žádaný vzestup faktoru VIII (% normálu) x 0,5_
Následující tabulka je určena pouze pro Vašeho lékaře a poskytuje mu vodítko pro dávkování při krvácivých příhodách a chirurgických výkonech. V případě níže vyjmenovaných krvácivých příhod by během odpovídajícího období neměla aktivita faktoru VIII poklesnout pod danou hodnotu (v % normálu).
Za určitých okolností, zejména v případě nízkého titru inhibitoru, mohou být zapotřebí vyšší než vypočítaná množství.
|
Stupeň krvácení / Typ chirurgického výkonu |
Požadovaná hodnota F VIII (% normálu) (IU/dl) |
Frekvence dávkování (hodiny) / Délka trvání léčby (dny) |
|
Krvácení | ||
|
Časné krvácení do kloubů, krvácení do svalů nebo z ústní dutiny |
20 - 40 |
Opakujte infuze každých 12 až 24 hodin nejméně jeden den, dokud se krvácení (indikováno bolestí) nezastaví nebo se nedosáhne vyléčení. |
|
Intenzivnější krvácení do kloubů, krvácení do svalů nebo hematom |
30 - 60 |
Opakujte infuze každých 12 až 24 hodin po 3-4 dny či více, dokud bolest a akutní nemohoucnost nepřejdou. |
|
Život ohrožující krvácení |
60 - 100 |
Opakujte infuze každých 8 až 24 hodin, dokud není nebezpečí zažehnáno. |
|
Operace | ||
|
Menší Včetně extrakce zubu |
30 - 60 |
Infuze každých 24 hodin, nejméně 1 den, dokud se nedosáhne vyléčení. |
|
Větší |
80 - 100 (před operací a po operaci) |
Opakujte infuze každých 8 až 24 hodin až do adekvátního zahojení rány, pak pokračujte v terapii nejméně dalších 7 dní, abyste udrželi aktivitu faktoru VIII na 30 % až 60 % (IU/dl). |
Sledování Vaším lékařem
Váš lékař provede potřebné laboratorní testy, aby se ujistil, že máte dostatečné hladiny faktoru VIII. To je obzvlášť důležité, pokud jste prodělal(a) větší operaci.
Dávkování při von Willebrandově nemoci
Substituční léčba s použitím přípravku Immunate pro kontrolu krvácení se řídí doporučeními platnými pro hemofilii A.
Způsob a cesta podání
Přípravek Immunate se podává do žíly (intravenózně) po přípravě roztoku s přiloženým rozpouštědlem. Postupujte přesně podle pokynů svého lékaře.
Rychlost podávání by měla být určena podle toho, jak to pacientovi nejlépe vyhovuje, a neměla by překročit hodnotu 2 ml za minutu.
Před podáním zahřejte produkt na pokojovou nebo tělesnou teplotu. K rekonstituci použijte pouze infuzní soupravu, která je součástí balení, protože po přilnutí lidského koagulačního faktoru VIII k vnitřním povrchům některých infuzních souprav může dojít k selhání léčby.
Přípravek Immunate je určen k rekonstituci bezprostředně před podáním. Roztok je pak nutno ihned použít, jelikož neobsahuje konzervační přísady. Léčivý přípravek po rekonstituci by měl být před podáním vizuálně zkontrolován na výskyt částic a změny zabarvení. Roztok by měl být čirý nebo lehce zakalený. Roztoky, které jsou zakalené nebo obsahují usazeniny, je nutno zlikvidovat. Roztok připravený k použití se nesmí ukládat zpět do chladničky.
Rekonstituce prášku pro přípravu injekčního roztoku:
Použijte aseptický postup!
1. Zahřejte neotevřenou lahvičku obsahující rozpouštědlo (sterilizovanou vodu na injekci) na pokojovou teplotu (maximálně 37°C).
2. Odstraňte ochranná víčka z lahvičky s práškem a z lahvičky s rozpouštědlem (obr. A) a očistěte pryžové zátky obou lahviček.
3. Umístěte zvlněný okraj převodní soupravy na lahvičku s rozpouštědlem a přitlačte (obr. B).
4. Odstraňte ochranný kryt z druhého konce převodní soupravy; nedotýkejte se obnaženého konce.
5. Převraťte převodní soupravu s připojenou lahvičkou s rozpouštědlem nad lahvičku s práškem a propíchněte volnou jehlou pryžovou zátku lahvičky s práškem (obr. C). Rozpouštědlo se pod tlakem samo natáhne do lahvičky s práškem.
6. Asi po jedné minutě oddělte obě lahvičky od sebe odpojením převodní soupravy s připojenou lahvičkou s rozpouštědlem od lahvičky s práškem (obr. D). Jelikož se přípravek snadno rozpouští, pohybujte lahvičkou s koncentrátem pouze jemně - pokud je to vůbec nutné. OBSAH LAHVIČKY NEPROTŘEPÁVEJTE. NEPŘEVRACEJTE LAHVIČKU S PRÁŠKEM, DOKUD NEBUDETE PŘIPRAVENI NATÁHNOUT OBSAH.
7. Po rekonstituci je nutno pohledem zkontrolovat, zda připravený roztok neobsahuje pevné částice nebo zda roztok neztratil svou barvu. I přes přísné dodržování postupu rekonstituce se může občas objevit několik drobných částic. Přiložená filtrační souprava částice odstraní a účinnost vyznačená na obalu nebude snížena.
Podávání:
Použijte aseptický postup!
Aby nedošlo k podání částí pryže ze zátky spolu s léčivým přípravkem (riziko mikroembolie), použijte přiloženou filtrační soupravu. Chcete-li natáhnout rozpuštěný přípravek, nasaďte filtrační soupravu na přiloženou jednorázovou injekční stříkačku a propíchněte jí pryžovou zátku (obr. E).
Na okamžik odpojte injekční stříkačku od filtrační soupravy. Do lahvičky s práškem se dostane
vzduch a případná pěna opadne. Poté přes filtrační soupravu natáhněte roztok do injekční stříkačky (obr. F).
Odpojte injekční stříkačku od filtrační soupravy a pomalu roztok intravenózně vstříkněte (maximální rychlost vstřikování: 2 ml za minutu) pomocí přiložené infuzní soupravy (motýlek), případně přiložené jednorázové j ehly.
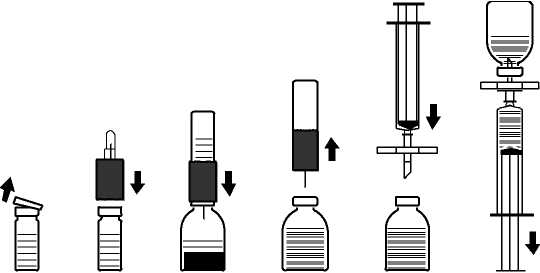
Obr. A Obr. B Obr. C Obr. D Obr. E Obr. F
Všechen nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Podávání přípravku Immunate je třeba zdokumentovat; rovněž je třeba zaznamenat číslo šarže. Ke každé lahvičce je připevněn odnímatelný záznamový štítek.
Frekvence podávání
Váš lékař Vám řekne, jak často a v jakých intervalech je třeba přípravek Immunate podávat. Určí to podle účinnosti přípravku ve Vašem individuálním případě.
Délka trvání léčby
Substituční terapie přípravkem Immunate je obvykle doživotní.
Jestliže jste použil(a) více přípravku Immunate, než jste měl(a)
• Nebyly zaznamenány žádné příznaky předávkování koagulačním faktorem VIII. Máte-li jakékoli pochyby, poraďte se prosím se svým lékařem.
• Mohou se vyskytnout tromboembolické příhody.
• U pacientů s krevní skupinou A, B nebo AB se může vyskytnout hemolýza.
Jestliže jste zapomněl(a) použít přípravek Immunate
• Nezdvojnásobujte následující dávku, abyste nahradil(a) vynechanou dávku
• Pokračujte ihned s dalším pravidelným podáním a dále pokračujte v pravidelných intervalech podle doporučení lékaře.
Jestliže jste přestal(a) užívat přípravek Immunate
Nepřerušujte užívání přípravku Immunate bez konzultace s lékařem.
Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Možné nežádoucí účinky přípravků obsahujících lidský plazmatický faktor VIII:
Vzácně byly pozorovány alergické reakce, které mohou v některých případech vyústit v těžké až život ohrožující reakce (anafylaxe). Proto mějte na paměti časné příznaky alergických reakcí, jako jsou zrudnutí kůže, vyrážka, kopřivka, pupeny, celkové svědění, natékání rtů a jazyka, obtížné dýchání, sípání, tlak na hrudi, nízký krevní tlak, pokles krevního tlaku, celkově nezdravý pocit a závratě. Tyto symptomy mohou být časnými příznaky anafylaktického šoku. Dojde-li k alergické nebo anafylaktické reakci, ihned zastavte injekci/infuzi a okamžitě informujte svého lékaře. Závažné příznaky vyžadují okamžitou léčbu.
Tvorba neutralizujících protilátek (inhibitorů) proti faktoru VIII nebo von Willebrandovu faktoru je známou komplikací při léčbě jedinců s hemofilií A nebo von Willebrandovou chrobou. Pokud se u Vás neutralizující protilátky (inhibitory) vyvinou, může se to projevit jako nedostatečná klinická odezva (při odpovídající dávce není krvácení pod kontrolou) nebo jako alergická reakce. V takových případech doporučujeme kontaktovat specializované hemofilické středisko.
Pokud máte krevní skupinu A, B nebo AB může po podání velkých dávek dojít k hemolýze.
Nežádoucí účinky hlášené v souvislosti s podáním přípravku Immunate:
K hodnocení nežádoucích účinků byly použity následující frekvence:_
|
Velmi časté |
Mohou postihovat více než 1 z 10 lidí |
|
Časté |
Mohou postihovat až 1 z 10 lidí |
|
Méně časté |
Mohou postihovat až 1 ze 100 lidí |
|
Vzácné |
Mohou postihovat až 1 z 1 000 lidí |
|
Velmi vzácné |
Mohou postihovat až 1 z 10 000 lidí |
|
Není známo |
Z dostupných údajů nelze určit |
Z nežádoucích účinků uvedených níže v tabulce, byla hypersenzitivita hlášena z klinické studie a všechny ostatní nežádoucí účinky byly hlášeny z post-marketingové zkušenosti.
|
MedDRA standardní třída orgánového systému |
Nežádoucí účinek |
Frekvence |
|
Poruchy imunitního systému |
Hypersenzitivita |
Méně časté * |
|
Poruchy krve a lymfatického systému |
Inhibice faktoru VIII |
Není známo |
|
Koagulopatie |
Není známo | |
|
Psychiatrické poruchy |
Neklid |
Není známo |
|
Poruchy nervového systému |
Brnění nebo ztuhlost |
Není známo |
|
Závrať |
Není známo | |
|
Není známo | ||
|
Poruchy oka |
Zánět spojivek |
Není známo |
|
Srdeční poruchy |
Zrychlený tlukot srdce |
Není známo |
|
Citelný tlukot srdce |
Není známo | |
|
Cévní poruchy |
Nízký krevní tlak |
Není známo |
|
Zrudnutí |
Není známo | |
|
Bledost |
Není známo | |
|
Respirační, hrudní a mediastinální poruchy |
Není známo | |
|
Není známo | ||
|
Gastrointestinální poruchy |
Není známo | |
|
Není známo | ||
|
Poruchy kůže a podkožní tkáně |
Kopřivka |
Není známo |
|
Není známo | ||
|
Není známo | ||
|
Návaly |
Není známo | |
|
Zvýšené pocení |
Není známo | |
|
Neurodermatitida |
Není známo | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Bolest svalů |
Není známo |
|
Celkové poruchy a reakce v místě aplikace |
Není známo | |
|
Není známo | ||
|
Edém (včetně periferního otoku , otoku očních víček a tváře) |
Není známo | |
|
Není známo | ||
|
Není známo | ||
|
Podráždění v místě vpichu (včetně pálení) |
Není známo | |
|
Bolest |
Není známo | |
|
*jedna hypersenzitivní reakce u 5 pacientů z 329 infuzí v jec |
né klinické studii | |
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo na adresu:
Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10, webové stránky: www .sukl .cz/nahlasit-nezadouci-ucinek.
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Immunate uchovávat
Uchovávejte mimo dohled a dosah dětí.
Uchovávejte a převážejte chlazené (2 C - 8 C). Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti vyznačené na štítcích a na krabičce. Datum použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Během doby použitelnosti může být produkt uchováván při pokojové teplotě (do 25 C) maximálně po jedno období nepřesahující 6 měsíců. Dobu uchovávání při pokojové teplotě zaznamenejte na obal produktu. Po uchovávání při pokojové teplotě neukládejte přípravek Immunate zpět do chladničky; ihned jej použijte nebo zlikvidujte.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek Immunate obsahuje
Prášek
• Léčivými látkami jsou lidský koagulační faktor VIII a lidský von Willebrandův faktor. Jedna lahvička obsahuje 250 IU (mezinárodních jednotek) lidského koagulačního faktoru VIII a 190 IU lidského plazmatického von Willebrandova faktoru.
Po rekonstituci přiloženým rozpouštědlem bude přípravek obsahovat přibližně 50 IU/ml lidského plazmatického koagulačního faktoru VIII a 38 IU/ml lidského plazmatického von Willebrandova faktoru.
• Pomocné látky jsou lidský albumin, glycin, chlorid sodný, citronan sodný, lysin-hydrochlorid a chlorid vápenatý.
Rozpouštědlo
• Voda na injekci
Jak přípravek Immunate vypadá a co obsahuje toto balení
Prášek a rozpouštědlo pro injekční roztok. Bílý nebo světle žlutý prášek či drolivá hmota.
Prášek i rozpouštědlo jsou dodávány ve skleněných lahvičkách na jednorázovou dávku (EP), prášek: sklo typu II, rozpouštědlo: sklo typu I, lahvičky jsou uzavřené zátkami z butylové pryže (EP).
Jedno balení obsahuje:
1 lahvičku přípravku Immunate Stim Plus 250 IU FVIII/190 IU VWF 1 lahvičku s vodou na injekci (5 ml)
1 převodní/filtrační soupravu 1 jednorázovou injekční stříkačku (5 ml)
1 jednorázovou jehlu 1 infuzní soupravu (motýlek)
Velikost balení: 1 x 250 IU FVIII/190 IU VWF
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci:
Do 30.11.2016 BAXTER AG Industriestrasse 67 A-1221 Vídeň, Rakousko
Od 1.1.2016
Baxalta Innovations GmbH Industriestrasse 67 A-1220 Vídeň, Rakousko
Výrobce:
Baxter AG Industriestrasse 67 A-1220 Vídeň, Rakousko
Tento léčivý přípravek je v členských státech EHP registrován pod těmito názvy:
Rakousko, Bulharsko, Kypr, Estonsko, Finsko, Německo, Řecko, Lotyšsko, Litva, Malta, Nizozemsko, Polsko, Portugalsko, Rumunsko, Slovenská republika, Slovinsko, Švédsko: Immunate Česká republika: Immunate Stim Plus Maďarsko: Immunate S/D Itálie: Talate
Tato příbalová informace byla naposledy schválena: 10.8.2016
9/9