Humulin R 100 M.j./Ml
sp.zn. sukls213317/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Humulin R 100 m.j ./ml,
Injekční roztok v injekční lahvičce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 ml obsahuje 100 IU insulinum humanum biosyntheticum (původem z rekombinantní DNA produkované E.coli).
Jedna injekční lahvička obsahuje 10 ml, což odpovídá 1000 IU rozpustného inzulinu.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok v injekční lahvičce.
Humulin R je sterilní, čirý, bezbarvý vodný roztok humánního inzulinu.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba pacientů s diabetem mellitus, kteří potřebují inzulin k udržení normální glukózové homeostázy.
4.2 Dávkování a způsob podání
Dávkování má být určeno lékařem v souladu s potřebami pacienta.
Humulin R má být aplikován subkutánní injekcí, je však možná i intramuskulární aplikace, i když není doporučována. V případě potřeby může být podán i intravenózně.
Umístění vpichů by mělo být v horní části paží, na stehnech, hýždích nebo břiše. Místa vpichu mají být měněna rotačním způsobem tak, aby stejné místo nebylo použito vícekrát než přibližně jednou za měsíc.
Při subkutánní aplikaci přípravku Humulin je třeba se pečlivě ujistit o tom, že nedošlo k aplikaci do cévy. Po aplikaci se místo vpichu nemá masírovat. Pacient musí být řádně poučen o správné aplikační technice.
Přípravek Humulin R může být podán v kombinaci s přípravkem Humulin N (viz Návod k použití přípravku a Míchání inzulinů).
Balení přípravku obsahuje příbalovou informaci s instrukcemi popisujícími aplikaci inzulinu.
Hypoglykémie.
Přecitlivělost na Humulin nebo na některou ze složek přípravku, pokud není používán v souvislosti s desenzibilizačním programem.
Za žádných okolností nesmí být jiné formy přípravku kromě rozpustného inzulinu Humulin R použity intravenózně.
4.4 Zvláštní upozornění a zvláštní opatření pro použití
Převedení pacienta na jiný typ nebo značku inzulinu musí být provedeno pod přísným lékařským dohledem. Změny koncentrace, značky (výrobce), typu (rozpustný, isofan, směs), druhu (zvířecí, humánní, analog humánního inzulinu) a/nebo způsobu výroby (rekombinantní DNA versus inzulin zvířecího původu) mohou mít za následek potřebu změny dávkování.
U některých pacientů přecházejících z inzulinu zvířecího původu na humánní může být zapotřebí změna dávkování. Je-li úprava nutná, může se projevit při první dávce nebo během několika prvních týdnů či měsíců.
Malé množství pacientů, kteří měli hypoglykemické reakce po převodu z inzulinu zvířecího původu na humánní inzulin, uvádělo, že časné varovné příznaky hypoglykémie byly méně znatelné nebo odlišné od těch, které zažili při použití předchozího inzulinu. Pacienti, jejichž kontrola glukózy např. intenzifikovanou inzulinovou terapií se výrazně zlepšila, mohou ztratit některé nebo všechny varovné příznaky hypoglykémie a měli by být proto náležitě poučeni. Dalšími okolnostmi, které mohou zeslabit nebo změnit varovné příznaky hypoglykémie, jsou dlouhodobý diabetes, diabetická neuropatie nebo léčba betablokátory. Neřešené hypoglykemické nebo hyperglykemické reakce mohou způsobit ztrátu vědomí, koma nebo smrt.
Použití nedostatečných dávek nebo přerušení léčby, zvláště u inzulin-dependentních diabetiků, může vést k hyperglykémii a diabetické ketoacidóze; stavům, které mohou být letální.
Léčba humánním inzulinem může způsobovat tvorbu protilátek, jejich hladiny jsou však nižší než při užití zvířecích inzulinů.
Potřeba inzulinu se může velmi měnit při onemocnění nadledvin, hypofýzy nebo štítné žlázy a při výskytu ledvinové nebo jaterní choroby.
Potřeba inzulinu může být zvýšena během nemoci nebo vlivem emocionálních rozrušení.
Úprava dávky může být rovněž nutná, pokud pacienti vykonávají zvýšenou fyzickou aktivitu nebo mění svou obvyklou dietu.
Kombinace humánního inzulinu s pioglitazonem
U pacientů užívajících pioglitazon v kombinaci s inzulinem byly hlášeny případy srdečního selhání, zvláště u pacientů s rizikovými faktory pro rozvoj srdečního selhání. Tato skutečnost by měla být brána do úvahy, pokud je zvažována kombinovaná léčba pioglitazonem a humánním inzulinem. Pokud je užita kombinovaná léčba, u pacientů by měly být sledovány známky srdečního selhání, nárůst tělesné hmotnosti a otoky. Léčba pioglitazonem by měla být přerušena, pokud se objeví jakékoliv zhoršení srdečních příznaků.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
U některých léčivých přípravků je známa jejich interakce s metabolismem glukózy. Lékař by měl brát možné interakce do úvahy a ověřit u pacientů jejich další medikaci užívanou společně s humánním inzulinem.
Potřeba inzulinu může být zvýšena léky s hyperglykemickým účinkem, jako jsou glukokortikoidy, hormonální substituce při léčbě poruch štítné žlázy, růstový hormon, danazol, beta-2-mimetika (ritodrin, salbutamol, terbutalin), thiazidy.
Potřeba inzulinu může být snížena při podávání léků s hypoglykemizujícím účinkem, jako jsou perorální antidiabetika, salicyláty (např. kyselina acetylsalicylová), některá antidepresiva (inhibitory monoaminooxidázy), některé inhibitory angiotenzin konvertujícího enzymu (kaptopril, enalapril), blokátory receptorů angiotenzinu II, neselektivní beta blokátory a alkohol.
Analoga somatostatinu (oktreotid, lanreotid) mohou potřebu inzulinu jak snižovat, tak zvyšovat.
Při užívání jiných léčiv podávaných současně s humánním inzulinem by měl být konzultován lékař (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Udržení dobré kontroly glykémie během těhotenství je základním požadavkem léčby diabetu u pacientek léčených inzulinem při inzulin-dependentním nebo gestačním diabetu. Potřeba inzulinu se obvykle snižuje během prvního trimestru a zvyšuje během druhého a třetího trimestru. Pacientky s diabetem by měly být poučeny o tom, aby informovaly svého lékaře v případě těhotenství nebo pokud těhotenství zvažují.
Pečlivé monitorování glykémie stejně jako celkového zdravotního stavu je základním požadavkem u těhotných s diabetem.
U kojících diabetiček může vzniknout potřeba úpravy dávky inzulinu, diety nebo obojího.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Pacientova schopnost koncentrace a reakce může být zhoršena v důsledku hypoglykémie. To může být riskantní v situacích specielně vyžadujících výše uvedené schopnosti (např. řízení auta nebo obsluha strojů).
Pacient by měl být poučen o nutnosti zabránit hypoglykémii během řízení, což je zvláště významné u těch osob, které mají sníženou nebo chybějící vnímavost varovných příznaků hypoglykémie nebo mají časté hypoglykemické epizody. Za těchto okolností by měla být pečlivě zvážena vhodnost řízení motorových vozidel.
Nejčastějším nežádoucím účinkem inzulínové terapie u pacienta s diabetem je hypoglykémie. Závažná hypoglykémie může vést ke ztrátě vědomí a v extrémních případech ke smrti. Vzhledem k tomu, že hypoglykémie je důsledkem jak dávky inzulinu, tak i dalších faktorů jako je intenzita tělesné námahy nebo dieta, není uvedena frekvence výskytu hypoglykémie.
Lokální přecitlivělost je u pacientů častá (1/100 až <1/10). Může se projevit ve formě zarudnutí, otoku a svědění v místě injekce inzulinu. Tento stav obvykle ustoupí během několika dnů nebo týdnů. V některých případech může být tento stav zapříčiněn jinými faktory než inzulinem, například iritací kůže dezinfekčním prostředkem nebo nesprávnou injekční technikou.
Systémová alergie, která je velmi vzácná (<1/10 000), ale potenciálně závažnější, je generalizovanou alergií na inzulin. Může způsobit zarudnutí po celém těle, dušnost, stridor, pokles krevního tlaku, tachykardii nebo pocení. Těžké stavy generalizované alergie mohou ohrožovat život. Ve vzácných případech závažné alergie na přípravek Humulin je vyžadována okamžitá léčba. Může být zapotřebí změna inzulinu nebo desenzibilizace.
Lipodystrofie v místě aplikace injekce je méně častá (1/1 000 až <1/100).
V průběhu léčby inzulinem byly hlášeny případy edémů, obzvláště pokud je pro zvládnutí předcházející špatné metabolické kontroly použita intenzifikovaná inzulinová terapie.
4.9 Předávkování
Inzulin nemá specifickou definici předávkování, protože glykémie je výsledkem komplexních interakcí mezi hladinou inzulinu, dostupností glukózy a ostatními metabolickými procesy. Hypoglykémie se může objevit jako důsledek nadbytku inzulinové aktivity v poměru k příjmu potravy a výdeji energie.
Hypoglykémie může být spojena s netečností, zmateností, palpitacemi, bolestmi hlavy, pocením a zvracením.
Mírné epizody hypoglykémie reagují na perorální podání glukózy nebo výrobku obsahujícího sacharidy. Korekce středně těžké hypoglykémie může být provedena intramuskulární nebo subkutánní injekcí glukagonu a následným perorálním podáním sacharidů, pokud se pacient dostatečně zotavuje. Pacienti, kteří nereagují na glukagon, musí dostat infuzi glukózy intravenózně.
Pokud je pacient v komatu, měl by být aplikován glukagon intramuskulárně nebo subkutánně. Pokud však glukagon není k dispozici nebo pacient na jeho podání nereaguje, musí být podán roztok glukózy intravenózně. Jakmile se pacient probere z bezvědomí, měl by dostat najíst.
Po zdánlivé úpravě klinického stavu je nezbytný další příjem sacharidů a sledování pacienta, protože se hypoglykémie může opakovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmako-terapeutická skupina: Inzuliny a analogy rychle působící, k injekční aplikaci ATC kód: A10AB01
Primárním účinkem inzulínu je regulace glukózového metabolismu.
Navíc má inzulin další anabolické a anti-katabolické účinky na mnoho různých tkání. Ve svalové tkáni tyto účinky zahrnují zvýšení syntézy glykogenu, mastných kyselin, glycerolu a proteinů a vychytávání aminokyselin a zároveň snížení glykogenolýzy, glukoneogeneze, ketogeneze, lipolýzy, proteinového katabolismu a produkce aminokyselin.
Typický průběh aktivity v čase po subkutánní injekci ilustruje silná křivka na následujícím grafu. Rozdíly v čase a intenzitě aktivity inzulinu, které může pacient zaznamenat, znázorňuje stínovaná plocha. Rozdíly závisí na dávce, místě injekce, teplotě a fyzické aktivitě pacienta.
Humulin R
Inzulinová aktivita
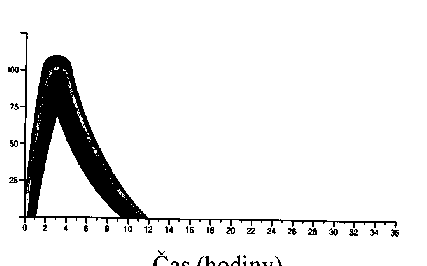
Čas (hodiny)
5.2 Farmakokinetické vlastnosti
Farmakokinetika inzulinu neodráží metabolický účinek tohoto hormonu. Proto je třeba při zvažování aktivity inzulinu vycházet z křivky utilizace glukózy.
5.3 Předklinické údaje vztahující se k bezpečnosti
Humulin je humánní inzulin produkovaný rekombinantní technologií. Při subchronických toxikologických studiích nebyly hlášeny žádné závažné události. V řadě in vitro a in vivo genetických toxikologických studií neměl humánní inzulin mutagenní účinky.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
metakresol glycerol voda na injekci
K úpravě pH může být použito: kyselina chlorovodíková a/nebo hydroxid sodný
6.2 Inkompatibility
Přípravky Humulin by se neměly míchat s inzuliny jiných výrobců nebo s přípravky obsahujícími zvířecí inzulin.
6.3 Doba použitelnosti
Neotevřená lahvička 3 roky
Po _prvním užití 28 dnů
6.4 Zvláštní opatření pro uchovávání
Chraňte před mrazem. Nevystavujte nadměrnému teplu nebo přímému slunečnímu svitu.
Neotevřená lahvička
Uchovávejte v chladničce (2°C - 8°C ).
Po prvním užití
Používaná injekční lahvička by měla být uchovávána při teplotě do 30° C.
6.5 Druh obalu a velikost balení
10 ml suspenze v injekční lahvičce z bezbarvého skla (sklo třídy I) s gumovou zátkou a zabezpečenou hliníkovým pertlem kombinovaným s plastovou krytkou. Krabička.
Velikost balení: 1 injekční lahvička.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Nepoužívejte jehly opakovaně. Jehly zlikvidujte odpovídajícím způsobem. Jehly s nikým nesdílejte. Lahvičky mohou být užívány do vyprázdění, potom je zlikvidujte odpovídajícím způsobem. Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Návod k použití přípravku a zacházení s ním
Injekční suspenzi v injekční lahvičce používejte s vhodnou stříkačkou označenou 100 U.
a) Příprava dávky
Injekční lahvičky obsahující přípravek Humulin R nevyžadují další rozpouštění a měly by být použity pouze tehdy, je-li jejich obsah čirý, bezbarvý, bez viditelných pevných částic a vypadá jako voda.
Míchání inzulinů: do stříkačky natáhněte nejprve rychle působící inzulin, aby se předešlo kontaminaci lahvičky déle působícím přípravkem. Směs si aplikujte ihned po přípravě.
Postupujte vždy stejným způsobem.
Pro podání správného množství každého přípravku je také možné použít samostatné stříkačky nebo samostatné zásobní vložky přípravků Humulin N a R.
Před aplikací si připravte injekční stříkačku podle rad lékaře.
Používejte inzulinovou injekční stříkačku odpovídající síle inzulinu, který si máte aplikovat.
b) Aplikace dávky
Aplikujte si správnou dávku inzulinu dle rady vašeho lékaře nebo zdravotní sestry. Místa vpichu by měla být měněna rotačním způsobem tak, aby stejné místo nebylo použito v průměru víckrát než jednou za měsíc.
Každé balení přípravku obsahuje příbalový leták s pokyny k aplikaci inzulinu.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Eli Lilly ČR, s.r.o., Pobřežní 12, Praha 8, Česká republika
8. REGISTRAČNÍ ČÍSLO
18/205/87-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 4.12.1987 Datum prodloužení registrace: 30.4.2014
10. DATUM REVIZE TEXTU
17.8.2016
7/7