Hiberix
sp.zn.sukls200515/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Hiberix
Vakcína proti Haemophilus influenzae typu b Prášek a rozpouštědlo pro injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Po rekonstituci 1 dávka (0,5 ml) obsahuje:
Haemophilus influenzae typus b polysaccharidum 10 mikrogramů
konjugovaný s tetanickým toxoidem jako bílkovinným nosičem přibližně 25 mikrogramů
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční roztok Popis přípravku:
Lyofilizovaná Hib vakcína: bílý jemný prášek nebo koláč lyofilizátu. Rozpouštědlo: čirá a bezbarvá tekutina.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Hiberix je určen pro aktivní imunizaci všech dětí od 2 měsíců věku proti onemocněním způsobeným Haemophilus influenzae b.
Hiberix neposkytuje ochranu proti onemocněním vyvolanými jinými typy H. influenzae, ani proti meningitidě vyvolané jinými organismy.
4.2 Dávkování a způsob podání
Primární očkovací schéma se skládá ze 3 dávek aplikovaných v prvních 6 měsících života. Očkování zpravidla začíná ve stáří 2 měsíců. V tomto případě se očkuje podle schématu 2-4-6 měsíců.
Očkovací schéma se však může v jednotlivých zemích lišit podle místních doporučení. Pro dosažení dlouhodobé ochrany se doporučuje aplikovat posilovací dávku ve 2. roce života.
Kojenci ve věku 6 - 12 měsíců, kteří ještě nebyli proti Hib očkováni, by měli být očkováni dvěma dávkami vakcíny podanými v intervalu jednoho měsíce, které by měly být následovány posilovací dávkou ve druhém roce života.
Děti ve věku 1 - 5 let, které ještě nebyly proti Hib očkovány, by měly být očkovány jednou dávkou vakcíny.
Způsob podání
Rekonstituovaná vakcína je určena k intramuskulámí aplikaci. Pacientům s trombocytopenií nebo s poruchami krevní srážlivosti se doporučuje aplikovat vakcínu subkutánně.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Hypersenzitivita po předchozí aplikaci vakcín proti Hib.
4.4 Zvláštní upozornění a opatření pro použití
Podobně jako u jiných vakcín by i očkování touto vakcínou mělo být odloženo u subjektů trpících závažným akutním horečnatým onemocněním. Mírná infekce není kontraindikací očkování.
Podobně jako u všech jiných injekčních vakcín musí být pro případ, že se po aplikaci vakcíny Hiberix vzácně vyvine anafylaktická reakce, okamžitě dostupná lékařská pomoc. Z tohoto důvodu musí být očkovaný jedinec 30 minut po aplikaci vakcíny pod lékařským dohledem.
Infekce virem lidské imunodeficience (HIV) není kontraindikací pro očkování vakcínou Hiberix.
I když se může vyskytnout omezená imunitní reakce na tetanovou komponentu, očkování vakcínou Hiberix není náhradou běžného očkování proti tetanu.
Po podání Hib vakcín bylo popsáno vylučování kapsulárního polysacharidového antigenu do moče.
Z toho důvodu nemusí mít v období 1 až 2 týdnů po očkování testy založené na detekci antigenu diagnostickou výpovědní hodnotu pro potvrzení suspektního onemocnění způsobeného Hib a testy mohou být falešně pozitivní.
Hiberix nesmí být v žádném případě aplikován intravenózně.
Možné riziko apnoe a nutnost monitorování dýchání po dobu 48 - 72 hodin by se měly zvážit při podávání dávek základního očkování velmi předčasně narozeným dětem (narozeným ve < 28. týdnu těhotenství) a zvláště těm, v jejichž předchozí anamnéze byla respirační nezralost. Protože prospěch očkování je u této skupiny dětí vysoký, nemělo by se očkování odmítat ani oddalovat.
Podobně jako u jakékoliv injekční aplikace se může po podání vakcíny Hiberix nebo i před ním vyskytnout vazovagální synkopa jako psychogenní reakce na injekční jehlu. Je důležité zajistit, aby při případné mdlobě nedošlo k úrazu.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Hiberix může být aplikován buď samostatně, nebo současně s jinými inaktivovanými či živými vakcínami.
Hiberix může být smíchán ve stejné injekční stříkačce s vakcínou Infanrix (DTPa vakcína). Jiné injekční vakcíny musí být aplikovány do různých míst. Nelze je smíchat v jedné stříkačce.
Podobně jako u jiných vakcín lze očekávat, že u pacientů podstupujících imunosupresivní terapii nebo u imunodeficitních pacientů nemusí být po očkování dosaženo protektivní imunitní odpovědi.
4.6 Fertilita, těhotenství a kojení
Vzhledem k tomu, že vakcína Hiberix není určena k očkování dospělých, nejsou odpovídající údaje o bezpečnosti vakcíny během těhotenství a reprodukční studie u zvířat dostupné.
Kojení
Vzhledem k tomu, že vakcína Hiberix není určena k očkování dospělých, nejsou odpovídající údaje o bezpečnosti vakcíny během kojení a reprodukční studie u zvířat dostupné.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Není relevantní.
4.8 Nežádoucí účinky
• Klinické studie
V kontrolovaných klinických studiích byly reakce a příznaky po podání vakcíny aktivně monitorovány a zaznamenávány do denních karet.
Nejčastějšími místními příznaky hlášenými během prvních 48 hodin po očkování bylo mírné zarudnutí v místě podání injekce, které spontánně odeznělo. Dalšími hlášenými místními příznaky byl mírný otok a bolest v místě podání injekce.
Celkové příznaky, které byly hlášeny během 48 hodin po očkování, měly mírný průběh a spontánně odezněly. Patří k nim teplota, ztráta chuti k jídlu, neklid, zvracení, průjem a neobvyklá plačtivost.
Jako u všech Hib vakcín byly tyto celkové příznaky rovněž hlášeny při společné aplikaci s jinými vakcínami.
• Postmarketingové sledování
Hlášené nežádoucí účinky jsou uvedené podle následující četnosti: Velmi vzácné < 1/10 000
Poruchy imunitního systému
Velmi vzácné: alergické reakce (včetně anafylaktických a anafylaktoidních reakcí),
angioedém.
Poruchy nervového systému
Velmi vzácné: hypotonicko-hyporeaktivní epizoda, křeče (s teplotou nebo bez
teploty), kolaps nebo vasovagální odpověď na injekci, spavost.
Respirační, hrudní a mediastinální poruchy
Velmi vzácné: apnoe [viz bod 4.4 pro apnoe u velmi předčasně narozených dětí
(narozených ve < 28. týdnu těhotenství)].
Poruchy kůže a podkožní tkáně
Velmi vzácné: kopřivka, vyrážka.
Celkové poruchy a reakce v místě aplikace
Velmi vzácné: otok celé končetiny, do které byla vakcína aplikována, indurace
v místě aplikace injekce.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Není znám případ předávkování.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: immunopreparáty, vakcína proti Haemophilus influenzae typu b ATC kód: J07AG01.
Mechanismus účinku
Není pro tento přípravek relevantní.
Farmakodynamické účinky
Jeden měsíc po ukončení základní imunizace je u 95 - 100 % očkovaných dětí dosažen titr protilátek > 0,15 pg/ml. Jeden měsíc po posilovací dávce je dosaženo titru protilátek > 0,15 pg/ml u 100 % všech očkovaných (94,7 % dětí má titr > 1,0 pg/ml).
5.2 Farmakokinetické vlastnosti
Hodnocení farmakokinetických vlastností není u vakcín požadované.
5.3 Předklinické údaje vztahující se k bezpečnosti
Není relevantní.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Lyofilizát: monohydrát laktosy.
Rozpouštědlo: chlorid sodný, voda na injekci.
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Lyofilizovanou vakcínu uchovávejte v chladničce (2 °C - 8 °C). Zmrazení nemá žádný vliv na účinnost lyofilizované vakcíny.
Rozpouštědlo uchovávejte v chladničce (2 °C - 8 °C), nebo při teplotě do 25 °C. Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Skleněná lahvička nebo předplněná injekční stříkačka jsou zhotoveny z neutrálního skla třídy I. Popis balení:
Lyofilizát: skleněná lahvička, pryžová zátka, hliníkový uzávěr s plastovým krytem, krabička. Rozpouštědlo: injekční stříkačka, krabička.
Velikost balení:
1 lahvička s lyofilizátem + 1 předplněná injekční stříkačka s rozpouštědlem + 2 jehly
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Hiberix může být smíchán ve stejné injekční stříkačce s vakcínou Infanrix (DTPa vakcína). Jiné vakcíny musí být aplikovány do různých míst. Nelze je smíchat v jedné stříkačce.
Před použitím musí být rozpouštědlo i rekonstituovaná vakcína vizuálně zkontrolovány na přítomnost cizorodých částic a na netypické změny vzhledu.
Pokud pozorujete jakoukoliv odchylku, vakcínu nesmíte podat.
Návod pro rekonstituci vakcíny přiloženým rozpouštědlem v předplněné injekční stříkačce
Hiberix musí být rekonstituován přidáním celého obsahu rozpouštědla z předplněné injekční stříkačky do injekční lahvičky obsahující prášek.
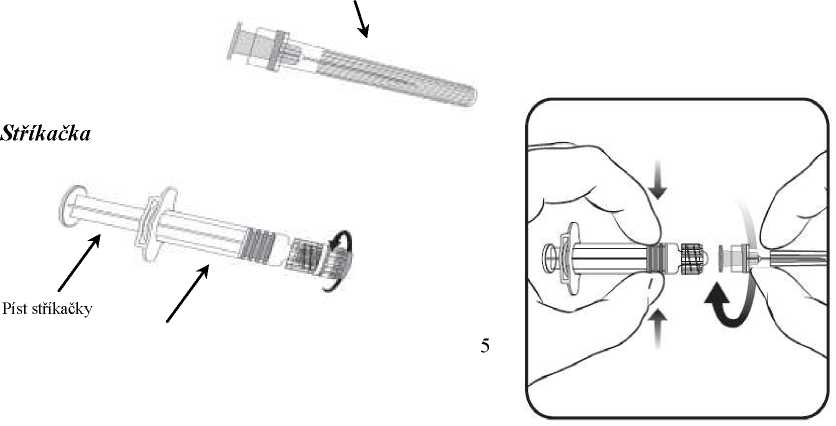
Připojení jehly k injekční stříkačce viz obrázek níže.
Injekční stříkačka dodávaná s vakcínou Hiberix však může být lehce odlišná od injekční stříkačky popsané na obrázku, a to bez šroubovací komponenty.
Jehla
Krytjehly
/
Tělo stříkačky
Kryt stříkačky
1. V jedné ruce držte tělo stříkačky (aniž byste ji drželi za píst) a kryt stříkačky odšroubujte otáčením proti směru hodinových ručiček.
2. Jehlu ke stříkačce připevníte tak, že budete jehlou nasazenou na stříkačku otáčet po směru hodinových ručiček, dokud se nezamkne (viz obrázek).
3. Pak odstraňte ochranný kryt j ehly, což může j ít někdy poněkud ztuha.
Přidejte rozpouštědlo k prášku. Po přidání rozpouštědla k prášku směs protřepávejte, dokud se všechen prášek úplně nerozpustí v rozpouštědle. Naředěná vakcína je čirý opalescentní a bezbarvý roztok.
Po rekonstituci je nutné vakcínu okamžitě použít.
K podání vakcíny je nutné použít novou jehlu.
Celý obsah lahvičky je nutné aplikovat najednou.
Jak je uvedeno výše, Hiberix může být smíchán s vakcínou Infanrix. V tomto případě se pro rekonstituci rozpouštědlo dodané v balení vakcíny Hiberix nahradí roztokem vakcíny Infanrix.
Ujistěte se, že obsahem vakcíny, kterou plánujete smíchat s vakcínou Hiberix, je jedna dávka. Z balení vakcíny Hiberix je třeba odstranit rozpouštědlo.
Kombinovaná vakcína musí být vytvořena přidáním celého obsahu druhé vakcíny do lahvičky obsahující bílý prášek Hib.
Tato na místě vytvořená kombinovaná vakcína musí být použita stejně jako monokomponentní rekonstituovaná vakcína Hiberix.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Glaxo SmithKline Biologicals S.A., Rue de l’Institut 89, 1330 Rixensart, Belgie.
8. REGISTRAČNÍ ČÍSLO
59/1287/97-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 17. 12. 1997
Datum posledního prodloužení registrace: 19. 3. 2014
DATUM POSLEDNÍ REVIZE TEXTU
10.
28.1.2016
7