Fulvestrant Teva 250 Mg
Sp.zn.sukls212132/2014
Příbalová informace: informace pro pacienta
Fulvestrant Teva 250 mg
injekční roztok v předplněné injekční stříkačce fulvestrantum
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je přípravek Fulvestrant Teva a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Fulvestrant Teva užívat
3. Jak se přípravek Fulvestrant Teva užívá
4. Možné nežádoucí účinky
5 Jak přípravek Fulvestrant Teva uchovávat
6. Obsah balení a další informace
1. Co je přípravek Fulvestrant Teva a k čemu se používá
Přípravek Fulvestrant Teva obsahuje léčivou látku fulvestrant, který patří do skupiny blokátorů estrogenů. Estrogeny jsou ženské pohlavní hormony a mohou se v některých případech podílet na růstu karcinomu (zhoubného nádoru) prsu.
Přípravek Fulvestrant Teva se používá k léčbě pokročilého nebo metastazujícího karcinomu prsu u žen po menopauze.
2. Čemu musíte věnovat pozornost, než začnete přípravek Fulvestrant Teva užívat Neužívejte přípravek Fulvestrant Teva:
- jestliže jste alergická na fulvestrant nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6)
- jestliže jste těhotná nebo kojíte (viz bod „Těhotenství, kojení a plodnost“)
- máte-li závažné problémy s játry.
Upozornění a opatření
Před použitím přípravku Fulvestrant Teva se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou, pokud se Vás týká cokoli z následujícího:
- problémy s ledvinami nebo játry
- nízký počet krevních destiček (pomáhají srážet krev) nebo krvácivá porucha
- dřívější problémy s krevními sraženinami
- osteoporóza (úbytek kostní hmoty)
- alkoholizmus (viz bod „Fulvestrant obsahuje etanol 96 % (alkohol)“).
Děti a dospívající
Fulvestrant Teva není určen dětem a dospívajícím mladším 18 let.
Další léčivé přípravky a přípravek Fulvestrant Teva
Informujte svého lékaře, lékárníka nebo zdravotní sestru o všech lécích, které užíváte, které jste v nedávné době užívala nebo které možná budete užívat.
Nezapomeňte lékaře informovat zvláště, pokud užíváte antikoagulancia (léky zamezující tvorbě krevních sraženin).
Těhotenství, kojení a plodnost
Přípravek Fulvestrant Teva nesmíte používat, pokud jste těhotná. Pokud byste mohla otěhotnět, je třeba, abyste v průběhu léčby přípravkem Fulvestrant Teva používala účinnou antikoncepci.
V průběhu léčby přípravkem Fulvestrant Teva nesmíte kojit.
Řízení dopravních prostředků a obsluha strojů
Fulvestrant Teva pravděpodobně neovlivní schopnost řídit nebo obsluhovat stroje. Pokud se však po léčbě cítíte unavená, neřiďte ani neobsluhujte stroje.
Přípravek Fulvestrant Teva obsahuje 96% etanol (alkohol), tj. do 1000 mg v jedné dávce, což odpovídá 20 ml piva nebo 8 ml vína.
Je škodlivý pro osoby, které trpí alkoholismem (nadměrně požívají alkohol).
Je nutno vzít v úvahu u těhotných a kojících žen, dětí a vysoce rizikových skupin, jako jsou pacienti s onemocněním jater nebo ledvin nebo epilepsií.
Přípravek Fulvestrant Teva obsahuje benzylalkohol, množství benzylalkoholu v jedné dávce je 500 mg /5 ml (100 mg benzylalkoholu v 1 ml), který může vyvolat alergické reakce.
Přípravek Fulvestrant Teva obsahuje čištěný ricinový olej, který může způsobit závažné alergické reakce.
3. Jak se přípravek Fulvestrant Teva užívá
Doporučená dávka přípravku je 500 mg fulvestrantu (dvě 250 mg/5 ml injekce) podávaných jednou měsíčně s jednou další 500 mg dávkou podanou 2 týdny po podání zahajovací dávky.
Váš lékař nebo zdravotní sestra Vám podá Fulvestrant Teva jako pomalou nitrosvalovou injekci, po jedné injekci do každé hýždě.
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře, nebo lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud se objeví následující nežádoucí účinky, můžete potřebovat neodkladnou lékařskou pomoc:
selhání jater
Jedná se o závažné nežádoucí účinky. Budete možná potřebovat okamžitou lékařskou pomoc.
Poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou, pokud si všimnete následujících nežádoucích účinků:
Velmi časté nežádoucí účinky (mohou postihnout více než 1 osobu z 10)
• reakce v místě injekce, např. bolest a/nebo zánět
• abnormální hladiny jaterních enzymů (při kontrole krve)*
• pocit na zvracení (nevolnost)
• slabost, únava*
Časté nežádoucí účinky (mohou postihnout až 1 osobu z 10)
• bolest hlavy
• návaly horka
• zvracení, průjem nebo ztráta chuti k jídlu*
• vyrážka
• infekce močových cest
• bolest zad*
• zvýšený bilirubin (žlučové barvivo, které se tvoří v játrech)
Méně časté nežádoucí účinky (mohou postihnout až 1 osobu ze 100)
• snížený počet krevních destiček (trombocytopenie)
• vaginální (poševní) krvácení, hustý bělavý výtok a kandidóza (kvasinková infekce)
• tvorba modřin a krvácení v místě vpichu injekce
• zvýšená hladina GMT, jaterního enzymu, zjištěného při kontrole krve
• Zahrnuje nežádoucí účinky, u kterých nelze přesně určit úlohu přípravku Fulvestrant Teva vzhledem k probíhající nemoci.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci.
Nežádoucí účinky můžete hlásit také přímo na adresu: Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10, webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Fulvestrant Teva uchovávat Uchovávejte tento přípravek mimo dohled a dosah dětí.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce nebo štítku injekční stříkačky za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Nepoužívejte tento přípravek, pokud si všimnete částic nebo změny barvy roztoku.
Předplněnou injekční stříkačku uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Uchovávejte a transportujte v chladničce (2 °C - 8 °C).
Teplotní výkyvy mimo rozmezí 2 °C - 8 °C by měly být omezeny. To zahrnuje vyloučení uchovávání při teplotách vyšších než 25 °C a nepřekračující 28 denní období při průměrné teplotě uchovávání přípravku do 25 °C (ale vyšší než 2 °C - 8 °C). Po teplotních výkyvech by měl být přípravek ihned vrácen do režimu uchovávání za doporučených podmínek (uchovávejte a transportujte v chladničce 2 °C - 8 °C). Teplotní výkyvy mají kumulativní vliv na kvalitu přípravku a 28 denní období nesmí být překročeno v průběhu celé 2 leté doby použitelnosti přípravku Fulvestrant Teva. Vystavení přípravku teplotám nižším než 2 °C nemá za následek poškození přípravku za předpokladu, že nebyl uchováván při teplotách nižších než -20 °C.
Váš zdravotnický pracovník je odpovědný za správné uchovávání, použití a likvidaci přípravku Fulvestrant Teva.
6. Obsah balení a další informace Co přípravek Fulvestrant Teva obsahuje
- Léčivou látkou je fulvestrantum. Jedna předplněná stříkačka (5 ml) obsahuje fulvestrantum 250 mg. Jeden ml roztoku obsahuje fulvestrantum 50 mg.
- Dalšími složkami (pomocnými látkami) jsou etanol (96%), benzylalkohol, benzyl-benzoát a čištěný ricinový olej.
Jak přípravek Fulvestrant Teva vypadá a co obsahuje toto balení
Fulvestrant Teva je čirý bezbarvý až nažloutlý viskózní roztok v předplněné injekční stříkačce, která je opatřena uzávěrem garantujícím neporušenost obalu, obsahující 5 ml injekčního roztoku. K podání doporučené měsíční dávky 500 mg je třeba podat 2 injekční stříkačky.
Fulvestrant Teva se dodává ve 2 baleních
1 balení obsahuje 1 skleněnou předplněnou injekční stříkačku a jednu bezpečnostní jehlu pro připojení k válci injekční stříkačky.
1 balení obsahuje 2 skleněné předplněné injekční stříkačky. Ke každé injekční stříkačce je přiložena bezpečnostní jehla.
Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Teva Pharmaceuticals CR s.r.o.
Radlická 3185/1c Praha 150 00 Česká republika
Výrobci
Pliva Croatia Ltd.
Prilaz baruna Filipovica 25 10000 Zagreb Chorvatsko
Teva Pharmaceutical Works Private Limited Company Táncsics Mihály út 82 H-2100 Godollo Maďarsko
Teva Operations Poland Sp. z o.o.
Ul. Mogilska 80,
31-546 Krakow Polsko
Tato příbalová informace byla naposledy revidována 04/2016
Následující informace jsou určeny pouze pro zdravotnické pracovníky
Fulvestrant Teva 500 mg (2 x 250 mg/5 ml injekční roztok) je třeba podat jako dvě předplněné injekční stříkačky.
Instrukce pro použití
Upozornění - bezpečnostní jehlu před použitím neautoklávujte. Ruce musí zůstat po celou dobu použití a podání stále za jehlou.
Pro každou ze dvou injekčních stříkaček:
Obrázek 1
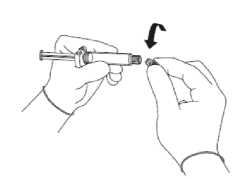
Obrázek 2
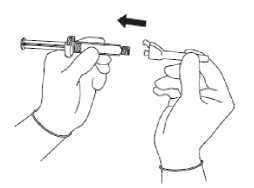
Obrázek 3
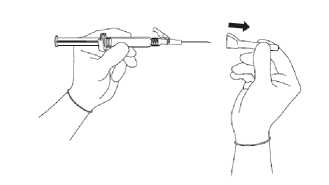
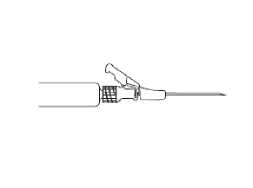
Obrázek 4
• Vyjměte skleněný válec injekční stříkačky z blistru a zkontrolujte, zda není poškozen.
• Zlomte pečeť čirého plastového krytu na spojce Luer injekční stříkačky a kryt sejměte společně s gumovým víčkem (viz obrázek 1).
Sejměte vnější obal bezpečnostní jehly.
Připevněte bezpečnostní jehlu ke koncovce Luer (viz Obrázek 2).
• Otáčejte, až pevně dosedne.
• Otáčejte, abyste jehlu zajistil(a) v koncovce Luer.
• Stáhněte chránítko jehly směrem dopředu tak, abyste nepoškodil(a) hrot jehly (viz obrázek 3).
• Přeneste naplněnou injekční stříkačku na místo aplikace.
• Parenterální roztoky je třeba před podáním vizuálně zkontrolovat na pevné částice nebo změnu barvy.
• Vytlačte přebytečný plyn z injekční stříkačky.
• Podávejte jako pomalou nitrosvalovou injekci
(1-2 minuty/injekci) do hýžďového svalu. Pro komfort uživatele orientujte úkos jehly směrem k rameni páčky (viz
Obrázek 4).
Obrázek 5
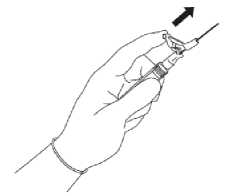
Po aplikaci jedním prstem ihned klepněte na rameno páčky, aby se aktivoval ochranný mechanismus (viz Obrázek 5).
UPOZORNĚNÍ: Vždy aktivujte směrem od sebe a jiných lidí. Zaslechnete kliknutí. Vizuálně se přesvědčte, že hrot jehly je zcela zakryt.
Likvidace
Předplněná stříkačka je určena pouze pro jednorázové použití.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7