Fsme-Immun 0,5 Ml
sp.zn.sukls52484/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU FSME-IMMUN 0,5 ml
Injekční suspenze v předplněné injekční stříkačce Vakcína proti klíšťové encefalitidě (celý inaktivovaný virus)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna dávka (0,5 ml) obsahuje:
Virus encephalitidis inactivatum purificatum1,2 (kmen Neudorfl) 2,4 mikrogramu
Adsorbovaný na hydratovaný hydroxid hlinitý (0,35 miligramů Al3+)
2pomnožený na fibroblastech kuřecích embryí (CEF buňky)
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční suspenze v předplněné injekční stříkačce.
Po protřepání má vakcína vzhled bělavé, opalescentní suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek FSME-IMMUN 0,5 ml je indikován k aktivní (profylaktické) imunizaci osob starších 16 let proti klíšťové encefalitidě (KE).
Přípravek FSME-IMMUN 0,5 ml má být podáván na základě oficiálních doporučení, která se týkají potřeby a načasování očkování proti KE.
4.2 Dávkování a způsob podání
Dávkování
Schéma základního očkování
Základní očkovací schéma je stejné pro všechny osoby od 16 let věku a se skládá ze tří dávek vakcíny FSME-IMMUN 0,5 ml.
První a druhá dávka se podává v 1 až 3 měsíčním intervalu. Pokud je třeba dosáhnout imunitní odpovědi rychle, může být druhá dávka podána za dva týdny po první dávce. Po prvních dvou dávkách se očekává dostatečná ochrana pro nadcházejícíc sezónu klíšťat (viz bod 5.1). Třetí dávka se podává za 5 až 12 měsíců po druhé vakcinaci.
Po třetí dávce je očekávaná ochrana nejméně po dobu 3 let.
Aby bylo dosaženo imunity před začátkem sezónní aktivity klíšťat, což je na jaře, měla by být první a druhá dávka podána nejlépe během zimních měsíců. Vakcinační schéma by se mělo ideálně zakončit třetí dávkou vakcíny během stejné sezóny klíšťat nebo nejpozději před začátkem následující sezóny klíšťat.
|
Základní imunizace |
Dávka |
Běžné schéma |
Zrychlené imunizační schéma |
|
l.dávka |
0,5 ml |
Zvolené datum |
Zvolené datum |
|
2. dávka |
0,5 ml |
1 až 3 měsíce po 1. vakcinaci |
14 dní po 1. vakcinaci |
|
3. dávka |
0,5 ml |
5 až 12 měsíců po 2. vakcinaci |
5 až 12 měsíců po 2. vakcinaci |
Přeočkování
Osoby od 16 do 60 let věku
První přeočkování by se mělo provést za 3 roky po aplikaci třetí dávky (viz bod 5.1). Následná přeočkování mají být prováděna každých 5 let po předchozím přeočkování.
Osoby od 60 let věku
Obecně by intervaly přeočkování osob starších 60 let neměly překročit 3 roky.
|
Přeočkování od 16 do 60 let věku |
Dávka |
Načasování |
|
1. přeočkování |
0,5 ml |
3 roky po 3. vakcinaci |
|
Následná přeočkování |
0,5 ml |
Každých 5 let |
|
Přeočkování po 60 letech věku |
Dávka |
Načasování |
|
Všechna přeočkování |
0,5 ml |
Každé 3 roky |
Prodloužení intervalu mezi jakoukoli dávkou (základní vakcinační schéma a přeočkování) může zanechat očkované osoby v přechodném období s nedostatečnou ochranou proti infekci viz bod 5.1).
Osoby sporuchami imunitního systému (včetně osob na imunosupresivní terapii)
Nejsou k dispozici specifické klinické údaje, na nichž by bylo možno založit doporučené dávkování. Mělo by se však zvážit stanovení koncentrace protilátek za čtyři týdny po druhé dávce a případné podání doplňující dávky, pokud nedošlo v této době k sérokonverzi.To samé platí u každé následné dávky.
Způsob podání
Vakcína má být podávána intramuskulární injekcí do horní části paže (musculus deltoideus).
4.3 Kontraindikace
Přecitlivělost na léčivou látku, jakoukoli pomocnou látku či výrobní rezidua (formaldehyd, neomycin, gentamicin, protaminsulfát). Vzít v úvahu by se měla zkřížená alergie i na aminoglykosidy jiné než neomycin a gentamicin.
Závažná přecitlivělost na vaječné , kuřecí proteiny (anafylaktická reakce po požití vaječné bílkoviny) a latex (např. anafylaktická reakce) může u citlivých jedinců způsobit závažné alergické reakce (viz také bod 4.4).
Vakcinaci proti KE je třeba odložit, jestliže osoba trpí střední nebo závažnou akutní chorobou ( s horečkou nebo bez horečky).
4.4 Zvláštní upozornění a opatření pro použití
Jako u všech injekčních vakcín, musí být i zde vždy pohotově k dispozici příslušná léčba a dohled pro akutní stavy a pro případ vzácné anafylaktické reakce po aplikaci vakcíny.
Nezávažná alergie na vaječnou bílkovinu obvykle není kontraindikací vakcinace přípravkem FSME-IMMUN 0,5 ml. Přesto by takové osoby měly být očkovány pod klinickým dohledem a pro případ urgentní léčby hypersenzitivních reakcí musí být k dispozici vybavení pro léčbu akutních stavů.
Obal tohoto přípravku obsahuje latexovou pryž, která může vyvolat závažné alergické reakce u osob alergických na latex.
Hladiny draslíku a sodíku jsou nižší než 1 mmol v dávce, t.j. v podstatě „bez draslíku a sodíku“.
K intravaskulární aplikaci nesmí dojít, protože by to mohlo vést k těžkým reakcím, včetně hypersenzitivních reakcí spojených se šokem.
Ochranná imunitní odpověď nemusí být vyvolána u osob podstupujících imunosupresivní léčbu.
Případné sérologické testování pro stanovení potřeby následných dávek by mělo být vždy prováděno zkušenou kvalifikovanou laboratoří. Zkřížená reaktivita s preexistujícími protilátkami po přirozené expozici nebo po vakcinaci proti jiným flavivirům (např. japonské encefalitidě, žluté zimnici, viru Dengue) by totiž mohla způsobit falešně pozitivní výsledky.
V případě známého autoimunního onemocnění či při podezření na ně musí být riziko možné infekce KE zváženo vzhledem k riziku nepříznivého vlivu přípravku FSME-IMMUN 0,5 ml na průběh autoimunního onemocnění.
Je třeba pečlivě zvážit indikaci očkování u osob s preexistujícím mozkovým onemocněním jako je aktivní demyelinizační onemocnění nebo špatně kontrolovaná epilepsie.
Data ohledně postexpoziční profylaxe s přípravkem FSME IMMUN 0,5 ml nejsou dostupná.
Stejně jako všechny další vakcíny nemůže přípravek FSME-IMMUN 0,5 ml zcela ochránit všechny očkované před infekcí, k jejíž prevenci je určen. Podrobnosti týkající se podávání přípravku starším osobám a osobám s oslabeným imunitním systémem viz bod 4.2.
Přisátím klíštěte mohou být přenášeny též jiné infekce než KE, včetně určitých patogenů, které někdy vyvolávají klinický obraz podobný klíšťové encefalitidě. Vakcíny proti KE neposkytují ochranu proti infekcím vyvolaným bakterií Borrelia. Výskyt klinických příznaků možné infekce KE u vakcinovaných by proto měl být pečlivě prošetřen s ohledem na jiné možné příčiny.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí s jinými vakcínami či léčivými přípravky. Podávání jiných vakcín ve stejnou dobu s vakcínou FSME-IMMUN 0,5 ml by mělo být prováděno pouze v souladu s oficiálními doporučeními. Pokud se mají podat současně jiné injekční vakcíny, musí být aplikace provedeny do různých míst, nejlépe do různých končetin.
4.6 Fertilita, těhotenství a kojení
Data ohledně použití přípravku FSME-IMMUN 0,5 ml u těhotných žen nejsou známa.
Kojení
Není známo, zda se přípravek FSME-IMMUN 0,5 ml vylučuje do mateřského mléka.
Vakcína FSME-IMMUN 0,5 ml by měla být proto podávána během těhotenství a kojícím ženám pouze při urgentní potřebě dosáhnout ochrany proti infekci KE a po pečlivém zvážení přínosu očkování ve vztahu k možnému riziku.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Je nepravděpodobné, že by vakcína FSME-IMMUN 0,5 ml nepříznivě ovlivnila schopnost člověka řídit a obsluhovat stroje. Mělo by se však vzít v úvahu, že se může vyskytnout porucha zraku či závrať.
4.8 Nežádoucí účinky
Četnosti uvedené v tabulce níže jsou uvedeny na vakcinaci a byly vypočítány na základě společné analýzy nežádoucích účinků ze 7 klinických studií probíhajících s přípravkem FSME-IMMUN 0,5 ml (2,4^g) na osobách ve věku od 16 do 65 let, které obdržely 3 vakcinační dávky (3512 subjektů po 1. vakcinaci, 3477 po 2. vakcinaci a 3274 po 3. vakcinaci).
Uváděné nežádoucí účinky v tomto bodě jsou seřazeny dle doporučené konvence četnosti:
Velmi časté: >1/10 Časté: >1/100 až <1/10 Méně časté: >1/1000 až <1/100 Vzácné: >1/10 000 až < 1/1 000 Velmi vzácné: <1/10 000 Nežádoucí reakce z klinických studií
|
systémů | |||||
|
Velmi časté: |
Časté: |
Méně časté: |
Vzácné: | ||
|
Poruchy krve a lymfatického systému |
Lymfadenopatie | ||||
|
Poruchy ucha a labyrintu | |||||
|
Poruchy imunitního systému |
Hypersenzitivita | ||||
|
Poruchy nervového systému |
Bolesti hlavy |
Poruchy spánku | |||
|
Gastrointestinální poruchy | |||||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Bolesti svalů, bolesti kloubů | ||||
|
Celkové poruchy a reakce v místě aplikace |
Reakce v místě vpichu např. bolest v místě vpichu |
Únava, |
Pyrexie Krvácení v místě vpichu |
Reakce v místě vpichujako: Erytém Ztvrdnutí Otok Parestézie Teplo | |
Nežádoucí reakce z poregistračního použití
Následující další nežádoucí reakce byly hlášeny při poregistračním použití.
|
Třídy orgánových systémů |
Frekvence * |
|
Vzácné | |
|
INFEKCE A INFESTACE |
herpes zoster (vyvolaný u preexponovaného pacienta) |
|
PORUCHY IMUNITNÍHO SYSTÉMU |
nástup /urychlení nebo zhoršení průběhu autoimunních onemocnění. (např. skleroza multiplex), anafylaktická reakce |
|
PORUCHY NERVOVÉHO SYSTÉMU |
demyelinizující nemoci (akutní diseminovaná enecfalomyelitida, Guillain-Barré syndrom, myelitida, transverzální myelitida) enecefalitida, křeče, aseptická meningitida, meningismus, smyslové a motorické abnormality, dysfunkce (faciální paralýza/paréza, paralýza /paréza, neuritida, dysestézie, hypostézie, parestézie), neuralgie, neuritida nervus opticus, závratě |
|
PORUCHY OKA |
poruchy vidění, fotofobie, bolest očí |
|
PORUCHY UCHA A LABYRINTU |
tinitus |
|
SRDEČNÍ PORUCHY | |
|
RESPIRAČNÍ, HRUDNÍ A MEDIASTINÁLNÍ PORUCHY | |
|
PORUCHY KŮŽE A PODKOŽNÍ TKÁNĚ |
urikarie, vyrážka (erytemtózní, makulo-papulární), pruritus, dermatitida, erytém, hyperhidróza |
|
PORUCHY SVALOVÉ A KOSTERNÍ SOUSTAVY A POJIVOVÉ TKANÉ |
bolest v zádech, otok kloubů, bolest v oblasti krku, mukoskeletální ztuhlost (včetně ztuhlosti krku), bolest v končetinách |
|
CELKOVÉ PORUCHY A REAKCE V MÍSTĚ APLIKACE |
poruchy chůze, zimnice, onemocnění podobné chřipce, astenie, edém, zhoršení pohyblivosti kloubu končetiny, do které byla vakcína aplikována, jako je bolest kloubu,, zduření uzlin a zánět |
* Horní hranice 95% intervalu spolehlivosti frekvence případů se vypočte s 3 /n, kde n představuje počet subjektů zahrnutých ve všech klinických studiích s přípravkem FSME-IMMUN 0,5 ml. Proto vypočtená frekvence "vzácný" představuje teoretickou maximální frekvenci těchto událostí.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Nebyl zaznamenán žádný případ předávkování. Vzhledem k balení vakcíny je nechtěné předávkování ve smyslu objemovém nepravděpodobné.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcína proti klíšťové encefalitidě, ATC kód: J07 BA01
Farmakodynamický účinek přípravku spočívá v navození dostatečně vysokého titru protilátek proti KE, aby byla zajištěna ochrana proti viru KE.
Procentuální ochranný účinek u předchozí generace vakcíny proti KE byl stanoven v průběhu kontinuálního sledování u celé rakouské populace od roku 1984. Při tomto sledování byla kalkulována ochrana vyšší než 90% po druhé vakcinaci a vyšší než 97% po dokončení základního očkování (3 dávky).
Na základě pokračujícího sledování u celé rakouské populace v letech 2000 až 2006 byl počítán poměr ochrany 99% se statisticky nevýznamným rozdílem mezi věkovými skupinami u pravidelně očkovaných osob. Ochranný účinek je nejméně stejně vysoký po prvních dvou vakcinacích při základního nebo zrychleného schématu vakcinace, tzn. před dokončením základního schématu třetí dávkou. U osob, u kterých nebylo dodrženo vakcinační schéma, byla míra ochrany signifikantně nižší.
V klinických studiích s přípravkem FSME-IMMUN 0,5 ml byla definována séropozitivita jako hodnota ELISA > 126 VIE U/ml nebo NT titrů >10. Poolované poměry séropozitivity stanovené testy
ELISA a NT 21. den po druhé vakcinaci a třetí vakcinaci při obvyklém a zrychleném schématu očkování jsou shrnuty v tabulce 1. a 2.
Tabulka č. 1: Schéma obvyklé imunizace, poměr1 séropozitivity stanovené metodou ELISA a NT u osob ve věku 16- 65 let
|
ELISA2 |
NT2 | |||
|
dávka |
druhá |
třetí |
druhá |
třetí |
|
Poměr séropozitivity1, % |
87,5 |
98,7 |
94,8 |
99,4 |
|
(n/N) |
(420/480) |
(825/836) |
(330/348) |
(714/718) |
1- Hodnoceno 21 dní po každé dávce
2- Cut-off séropozitivity: ELISA > 126 VIE U/ml; NT > 1:10
Tabulka č. 2: Schéma rychlé imunizace, poměr1 séropozitivity stanovené metodou ELISA a NT
|
ELISA2 |
NT2 | |||
|
dávka |
druhá |
třetí |
druhá |
třetí |
|
Poměr séropozitivity u osob ve věku 1649 let , % (n/N) |
86,6 (168/194) |
99,4 (176/177) |
97,4 (189/194) |
100,0 (177/177) |
|
Poměr séropozitivity u osob ve věku >50, % (n/N) |
72,3 (125/173) |
96,3 (155/161) |
89,0 (154/173) |
98,8 (159/161) |
1- Hodnoceno 21 dní po každé dávce
2- Cut-off séropozitivity: ELISA > 126 VIE U/ml; NT > 1:10
Nejvyšších poměrů séropozitivity stanovených metodou ELISA a NT v obou věkových skupinách bylo dosaženo po podání třetí dávky. Proto téměř u všech osob je dokončení základního schématu vakcinace tří dávek nezbytné k dosažení ochranné hladiny protilátek.
Zrychlená imunizace přípravkem FSME-IMMUN 0,5 ml dosahuje vysoké seropozitivity stanovené NT již za 14 dní po druhé vakcinaci (89,3 %) a 7 dní po třetí vakcinaci (91,7 %).
Výsledky pokračovací studie, která sledovala přetrvávání protilátek proti viru klíšťové encefalitidy, v současnosti podporují potřebu prvního přeočkování do tří let po základním očkování. U dospělých starších 50 let zůstala seropozitivita stanovená NT vysoká až 5 let po první vakcinaci (94.3%); pouze mírné snížení (> 90,2%) bylo pozorováno u osob ve věku 50-60 let, což podporuje přeočkování osob mladších 60ti let v intervalu 5let po prvním přeočkování. Vakcinace přípravkem FSME-IMMUN 0,5 ml vyvolala statisticky ekvivalentní titry viru klíšťové encefalitidy neutralizující protilátky proti evropským, sibiřským virovým kmenům a kmenům Dálného východu. V publikovaných klinických studiích byly také navozeny značné cross-neutralizující protilátky proti viru způsobujícímu Omskou hemorhagickou horečku, avšak tyto titry byly nižší než titry proti virovému subtypu klíšťové encefalitidy.
5.2 Farmakokinetické vlastnosti
Není relevantní.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje založené na běžných studiích bezpečnosti farmakologie neodhalily žádné zvláštní bezpečnostní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Lidský albumin, chlorid sodný, dihydrát hydrogenfosforečnanu sodného, dihydrogenfosforečnan draselný, voda na injekci, sacharóza a hydratovaný hydroxid hlinitý.
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, proto nesmí být vakcína FSME-IMMUN 0,5 ml mísena s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
30 měsíců
6.4. Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2°C-8°C). Uchovávejte předplněnou inj. stříkačku v krabičce, aby byla chráněna před světlem. Chraňte před mrazem.
6.5 Druh obalu a velikost balení
0,5 ml suspenze v předplněné injekční stříkačce (sklo typu I) s pístovou zátkou (halogenbutylová pryž), dostupná s integrovanou jehlou nebo bez integrované jehly. Obaly mohou obsahovat latex (viz bod 4.4). Velikosti balení 1, 10, 20 a 100. Balení Tip Cap (předplněná injekční stříkačka bez integrované jehly) může obsahovat až 2 jehly různé velikosti. Všechny jehly jsou sterilní a pro jednorázové použití. Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Před aplikací by měla vakcína mít pokojovou teplotu. Před podáním důkladně protřepte, aby se suspenze očkovací látky řádně promíchala. Po protřepání je vakcína FSME-IMMUN 0,5 ml bělavá, neprůhledná, homogenní suspenze. Vakcína má být před podáním vizuálně zkontrolovaná s ohledem na obsah cizorodých částic a/nebo změnu fyzikálního vzhledu. Pokud jsou přítomny jakékoli změny vzhledu, vakcínu zlikvidujte.
Veškerý nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Sejměte ochranný kryt jehly následovně:
1. Stříkačku přidržte v dolní části ochranného krytu jehly fixované ke skleněnému tělesu stříkačky.
2. Horní část krytu jehly uchopte druhou rukou mezi palec a ukazovák a otočte tak, aby došlo k rozlomení sváru (evidentnímu přerušení).
3. Oddělenou část ochranného krytu jehly sejměte z jehly vertikálním pohybem.
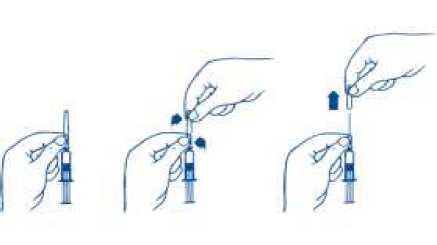
1 2 3
Po odstranění ochranného krytu jehly musí být přípravek FSME-IMMUN 0,5 ml ihned použit.
Aby nedošlo k porušení sterility a/nebo ucpání jehly, nesmí být jehla ponechána delší dobu bez ochrany. Proto má být kryt jehly sejmut až po protřepání a bezprostředně před aplikací.
Doplňující informace pro injekční stříkačku bez integrované jehly:
Po odstranění krytky injekční stříkačky nasaďte okamžitě jehlu a ochranný kryt jehly sejměte bezprostředně před použitím. Po připojení jehly musí být vakcína ihned aplikována.
Aplikaci vakcíny zaznamená lékař do dokumentace, kde uvede i číslo šarže. Ke každé předplněné stříkačce je připevněn oddělitelný štítek pro účely dokumentace.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pfizer, spol. s r.o.
Stroupežnického 17 150 00 Praha 5 Česká republika
8. REGISTRAČNÍ ČÍSLO
59/010/06-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
18.1.2006 / 18.1.2007
10. DATUM REVIZE TEXTU
29.4.2015
8