Fortulin Novolizer 6 Mikrogramů Prášek K Inhalaci
Sp.zn.sukls255322/2012, sukls255323/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Fortulin Novolizer 6 mikrogramů prášek k inhalaci Fortulin Novolizer 12 mikrogramů prášek k inhalaci
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Fortulin Novolizer 6 mikrogramů prášek k inhalaci
Jedna odměřená dávka obsahuje formoteroli fumaras dihydricus 6 mikrogramů (což odpovídá formoteroli fumaras dihydricus 5,1 mikrogramů v jedné podané dávce, která je uvolněna z náustku, což je ekvivalentní formoterolum 4,18 mikrogramů).
Pomocná látka se známým účinkem: 5,457 mg laktózy (jako mohohydrátu) v podané dávce.
Fortulin Novolizer 12 mikrogramů prášek k inhalaci
Jedna odměřená dávka obsahuje formoteroli fumaras dihydricus 12 mikrogramů (což odpovídá formoteroli fumaras dihydricus 10,2 mikrogramů v jedné podané dávce, která je uvolněna z náustku, což je ekvivalentní formoterolum 8,36 mikrogramů).
Pomocná látka se známým účinkem: 10,914 mg laktózy (jako mohohydrátu) v podané dávce.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek k inhalaci Bílý prášek
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Fortulin Novolizer je indikován k léčbě dospělých, dospívajících a dětí ve věku od 6 do 12 let.
Fortulin Novolizer je indikován k dlouhodobé symptomatické léčbě perzistujícího středně těžkého až těžkého bronchiálního astmatu u pacientů vyžadujících pravidelnou léčbu dlouhodobě působícími agonisty p2-adrenergních receptorů v kombinaci s inhalační protizánětlivou terapií (s nebo bez perorálních glukokortikoidů). Terapie glukokortikoidy musí pokračovat v pravidelných intervalech.
Fortulin Novolizer je rovněž indikován k úlevě od symptomů bronchiální obstrukce u pacientů s chronickou obstrukční plicní nemocí (CHOPN).
4.2 Dávkování a způsob podání
Dávkování
Použití mimořádných dávek častěji než dva dny v týdnu je známkou suboptimální kontroly onemocnění a je třeba přehodnotit udržovací léčbu.
Dospělí (včetně starších osob) a dospívající ve věku nad 12 let
Pravidelná udržovací terapie:
Fortulin Novolizer, 6 mikrogramů, prášek k inhalaci
1-2 inhalace (6-12 mikrogramů dihydrátu formoterol-fumarátu) 2x denně. Při závažnějším onemocnění lze tuto dávku zvýšit na 4 inhalace (24 mikrogramů) 2x denně.
Maximální denní dávka je 8 inhalací (4 inhalace 2x denně), což odpovídá 48 mikrogramům.
Fortulin Novolizer, 12 mikrogramů, prášek k inhalaci
1 inhalace (12 mikrogramů dihydrátu formoterol-fumarátu) 2x denně. Při závažnějším onemocnění lze tuto dávku zvýšit na 2 inhalace (24 mikrogramů) 2x denně.
Maximální denní dávka jsou 4 inhalace (2 inhalace 2x denně), což odpovídá 48 mikrogramům.
Starší pacienti a pacienti s poruchou funkce ledvin nebo jater
U starších pacientů a pacientů s poruchou funkce ledvin nebo jater není nutné upravovat doporučené dávkování (viz bod 5.2)
Pediatrická populace
Děti ve věku od 6 let
Pravidelná udržovací terapie:
Fortulin Novolizer, 6 mikrogramů, prášek k inhalaci
1-2 inhalace (6-12 mikrogramů) 2x denně. Při závažnějším onemocnění lze tuto dávku zvýšit na 4 inhalace (24 mikrogramů) 2x denně, ale pouze na doporučení lékaře.
Pravidelná denní dávka by neměla překročit 4 inhalace (24 mikrogramů), nicméně, někdy může být zvýšena až na maximálně 8 inhalací (což odpovídá 48 mikrogramům) v průběhu 24 hodin.
Fortulin Novolizer, 12 mikrogramů, prášek k inhalaci
1 inhalace (12 mikrogramů) 2x denně. Při závažnějším onemocnění lze tuto dávku zvýšit na 2 inhalace (24 mikrogramů) 2x denně, ale pouze na doporučení lékaře.
Pravidelná denní dávka by neměla překročit 2 inhalace (24 mikrogramů), nicméně, někdy může být zvýšena až na maximálně 4 inhalace (což odpovídá 48 mikrogramům) v průběhu 24 hodin.
Děti mladší 6 let:
Fortulin Novolizer se nedoporučuje u dětí do 6 let věku vzhledem k nedostatečným údajům o bezpečnosti a účinnosti v této věkové skupině.
CHOPN
Dospělí (včetně starších osob)
Fortulin Novolizer, 6 mikrogramů, prášek k inhalaci Obvyklá dávka: 1-2 inhalace (6-12 mikrogramů) 2x denně.
Denní dávka při pravidelném používání léku by neměla překročit 4 inhalace (24 mikrogramů).
Pokud je to třeba, je možné pro potlačení symptomů onemocnění toto pravidelné dávkování zvýšit na maximální denní dávku celkem 8 inhalací odpovídající 48 mikrogramům (obvyklá i navýšená). Jednotlivá dávka však nemá překročit 4 inhalace.
Fortulin Novolizer, 12 mikrogramů, prášek k inhalaci Obvyklá dávka: 1 inhalace (12 mikrogramů) 2x denně.
Denní dávka při pravidelném používání léku by neměla překročit 2 inhalace (24 mikrogramů).
Pokud je to třeba, je možné pro potlačení symptomů onemocnění toto pravidelné dávkování zvýšit na maximální denní dávku celkem 4 inhalace odpovídající 48 mikrogramům (obvyklá i navýšena). Jednotlivá dávka však nemá překročit 2 inhalace.
Starší pacienti a pacienti s poruchou funkce ledvin nebo jater
U starších pacientů a pacientů s poruchou funkce ledvin nebo jater není nutné upravovat doporučené dávkování (viz bod 5.2)
Použití formoterolu je indikováno u pacientů, kteří používají inhalační kortikosteroidy, kde je potřebná kromě inhalačních kortikosteroidů i další pravidelná symptomatická léčba astmatu.
Ačkoli má formoterol rychlý nástup účinku, dlouhodobě působící inhalační bronchodilatancia (jako formoterol) mají být používána pouze k udržovací bronchodilatační léčbě a/nebo k prevenci bronchokonstrikce vyvolané fyzickou zátěží.
Pacienti mají být poučeni, aby po zahájení léčby formoterolem nepřerušovali ani neměnili léčbu steroidy.
Pouze pro přípravek Fortulin Novolizer, 6 mikrogramů, prášek k inhalaci
Pro pacienty, kteří potřebují dvě nebo více inhalací, je k dispozici jako alternativa vyšší síla.
Přípravek Fortulin Novolizer je řízený inspiračním průtokem, což znamená, že při vdechu přes náustek se léčivá látka dostane s vdechovaným vzduchem do dýchacích cest.
Způsob podávání
Inhalační podání
Aby bylo zajištěno správné používání přípravku Fortulin Novolizer, pacienti by měli být důkladně poučeni, jak inhalátor používat. Děti by měly používat tento přípravek pouze pod dohledem dospělé osoby.
Je důležité poučit pacienta, že nikdy nesmí žvýkat nebo kousat náustek a nikdy nesmí používat inhalátor, pokud je poškozený nebo pokud je náustek oddělený.
Aby bylo zajištěno, že se do plic dostane optimální množství léčivé látky, je třeba inhalovat plynule, hluboce a tak rychle, jak je to možné (maximální vdech). Slyšitelné cvaknutí a změna barvy v kontrolním průzoru ukazují, že inhalace byla provedena správně. Pokud není slyšet hlasité cvaknutí a nezmění se barva v kontrolním průzoru, inhalaci je třeba opakovat. Inhalátor zůstává zablokován, dokud není inhalace provedena správně.
Použití a manipulace s inhalátorem suchého prášku Novolizer
Obr.
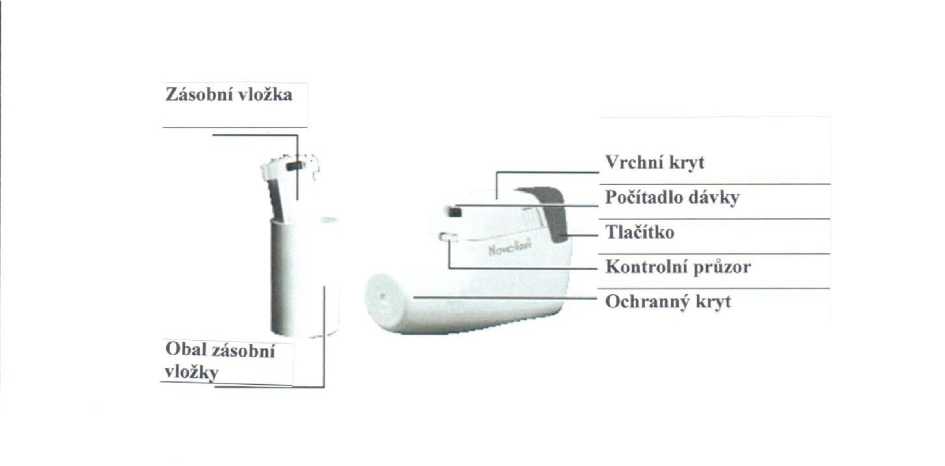
Vložení zásobní vložky
1. Mírně stlačte žebrovaný povrch na obou stranách vrchního krytu, posuňte kryt dopředu a odklopte jej.
2. Sejměte ochrannou aluminiovou fólii z obalu zásobní vložky a vyjměte novou zásobní vložku.
3. Vložte zásobní vložku do inhalátoru Novolizer tak, aby počítadlo dávky směřovalo k náustku.
4. Nasuňte vrchní kryt do bočních vodících drážek a zatlačte jej rovně dolů směrem k tlačítku, dokud nezaskočí na místo. Zásobní vložka může být ponechána v inhalátoru Novolizer až do použití nebo po dobu až 6 měsíců od vložení.
Do inhalátoru suchého prášku Novolizer používejte pouze zásobní vložky Fortulin Novolizer.
Použití
1. Je-li to možné, při inhalaci seďte nebo stůjte. Při použití inhalátoru Novolizer jej vždy držte v horizontální pozici. Nejprve sejměte ochranný kryt.
2. Úplně stlačte barevné dávkovací tlačítko. Uslyšíte dvojité cvaknutí a barva v kontrolním průzoru (níže) se změní z červené na zelenou. Poté barevné dávkovací tlačítko uvolněte. Zelená barva v kontrolním průzoru ukazuje, že je inhalátor Novolizer připraven k použití.
3. Vydechněte (nikoli však do inhalátoru Novolizer).
4. Ústy obemkněte náustek. Hlubokým nádechem inhalujte prášek. Během nádechu uslyšíte hlasité cvaknutí potvrzující správnou inhalaci. Na několik vteřin zadržte dech, a poté znovu začněte normálně dýchat.
Jestliže pacient potřebuje více než 1 inhalační dávku, opakujte kroky 2 - 4.
5. Nasaďte na náustek ochranný kryt. Podání dávky je tímto dokončeno.
6. Počet v horním průzoru ukazuje počet zbývajících inhalačních dávek.
Barevné dávkovací tlačítko se smí stlačit pouze těsně před inhalací.
Inhalátor Novolizer neumožňuje chybnou dvojitou inhalaci. Cvaknutí a změna barvy v kontrolním průzoru ukazují, že inhalace byla provedena správně. Pokud se barva v kontrolním průzoru nezmění, inhalaci je třeba opakovat. Jestliže nedojde ani po několika pokusech ke správnému dokončení inhalace, pacient by se měl poradit s lékařem.
Čištění
Inhalátor suchého prášku Novolizer se má pravidelně čistit, nejméně při každé výměně zásobní vložky. Pokyny, jak se má inhalátor suchého prášku Novolizer čistit, jsou uvedeny v „Návodu k použití“ v příbalové informaci.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku formoterol nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Přípravek Fortulin Novolizer se nemá používat (a není dostatečný) jako lék první volby u astmatu.
Pacienti s astmatem, kteří vyžadují léčbu dlouhodobě působícími p2-agonisty, mají rovněž používat optimální udržovací protizánětlivou léčbu kortikosteroidy. Pacienty je nutno poučit, aby pokračovali v používání protizánětlivé léčby i po zavedení formoterolu do léčby, a aby dávkování nesnižovali bez doporučení lékaře, a to i v případě, že příznaky poleví. Jestliže příznaky přetrvávají nebo se zhoršují nebo je třeba ke kontrole příznaků zintenzivnit léčbu p2-agonisty, znamená to obvykle zhoršení základního onemocnění a pacienti by měli být poučeni, aby kontaktovali svého lékaře, aby astma a jeho udržovací léčba mohly být přehodnoceny.
I když přípravek Fortulin Nonolizer lze nasadit jako přídatnou léčbu k inhalačním kortikosteroidům, pokud při nich nejsou dostatečně kontrolovány příznaky astmatu, léčba přípravkem Fortulin Novolizer nemá být zahájena v průběhu těžké akutní exacerbace astmatu nebo v případě významného zhoršení nebo akutního zhoršení astmatu.
Během léčby formoterolem se mohou vyskytnout závažné nežádoucí účinky související s astmatem a exacerbací astmatu. Pacienty je nutno poučit, aby pokračovali v léčbě, ale zároveň vyhledali lékařskou pomoc v případě, že po zahájení léčby přípravkem Fortulin Novolizer nadále nebudou příznaky astmatu pod kontrolou nebo se zhorší.
Po zvládnutí příznaků astmatu lze uvažovat o postupném snížení dávky přípravku Fortulin Novolizer. Při snižování léčby je důležitá pravidelná kontrola pacientů. Je třeba použít nejnižší účinnou dávku přípravku Fortulin Novolizer.
Přípravek Fortulin Novolizer by měl být používán pouze u pacientů vyžadujících léčbu dlouhodobě působícími bronchodilatancii (viz bod 4.1) a neměl by být používán jako alternativa ke krátkodobě
Fortulin Novolizer 6 mikrogramů, prášek k inhalaci
Maximální denní dávka nemá být překročena. Dlouhodobá bezpečnost pravidelné léčby dávkami vyššími než 8 inhalací denně u dospělých s astmatem, 4 inhalace denně u dětí s astmatem a 4 inhalace denně u pacientů s CHOPN nebyla stanovena.
Fortulin Novolizer 12 mikrogramů, prášek k inhalaci
Maximální denní dávka nemá být překročena. Dlouhodobá bezpečnost pravidelné léčby dávkami vyššími než 4 inhalace denně u dospělých s astmatem, 2 inhalace denně u dětí s astmatem a 2 inhalace denně u pacientů s CHOPN nebyla stanovena.
Opatrnost je nutná při léčbě pacientů s tyreotoxikózou, feochromocytomem, hypertrofickou obstrukční kardiomyopatií, idiopatickou subvalvulární aortální stenózou, těžkou hypertenzí, aneurysmatem či jiným vážným kardiovaskulárním onemocněním, jako je ischemická choroba srdeční, tachyarytmie (zejména třetí stupeň AV blokády) nebo těžké srdeční selhání. Lze zvážit úpravu dávky formoterolu.
Formoterol může vyvolávat prodloužení QTc-intervalu. Při léčbě pacientů s prodloužením QTc-intervalu je proto nutná opatrnost (viz bod 4.5).
Vzhledem k hyperglykemickým účinkům p2-agonistů se u diabetiků zpočátku doporučuje zvýšené monitorování krevní glukózy.
Léčba pomocí p2-agonistů může potenciálně vést k závažné hypokalemii. Zvláštní opatrnost se doporučuje při akutním těžkém astmatu, neboť riziko s tím spojené se může umocňovat hypoxií. Uvedený hypokalemický účinek se může násobit při souběžné léčbě deriváty xantinu, steroidy a diuretiky. V důsledku této skutečnosti je proto nutné monitorovat sérové hladiny draslíku. Zvláštní pozornost je nutná při současném užívání theofylinu a formoterolu u pacientů s preexistujícím srdečním onemocněním.
Stejně jako při jakékoliv jiné inhalační terapii je nutno vzít v úvahu možnost paradoxního bronchospasmu.
Pokud se u pacienta objeví rychlý nástup sípotu a dušnosti po inhalaci, má by být ihned léčen inhalačním bronchodilatanciem s rychlým nástupem účinku. Léčba přípravkem Fortulin Novolizermá být neprodleně přerušena, stav pacienta má být přehodnocen, a pokud je to nezbytné, léčba nahrazena jinou vhodnou léčbou (viz bod 4.8).
Vliv snížené funkce jater nebo ledvin na farmakokinetiku formoterolu a farmakokinetiku u starších osob není znám. Formoterol je primárně odstraňován metabolizací, zvýšenou expozici lze proto očekávat u pacientů s těžkou jaterní cirhózou.
Fortulin Novolizer, 6 mikrogramů, prášek k inhalaci
Fortulin Novolizer obsahuje 5,457 mg laktózy v jedné dávce. Toto množství normálně u pacientů s intolerancí laktóz nepůsobí potíže.
Fortulin Novolizer, 12 mikrogramů, prášek k inhalaci
Fortulin Novolizer obsahuje 10,914 mg laktózy v jedné dávce. Toto množství normálně u pacientů s intolerancí laktóz nepůsobí potíže.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
S přípravkem Fortulin Novolizer nebyly provedeny žádné speciální studie interakcí.
Souběžné léčení jinými sympatomimetickými látkami jako jinými p2-agonisty nebo efedrinem může zesilovat nežádoucí účinky formoterolu a vyžadovat titraci dávky.
Souběžné podávání s deriváty xanthinu, steroidy nebo diuretiky typu thiazidů nebo kličkovými diuretiky může vést k zesílení vzácného hypokalemického nežádoucího účinku p2-agonistů. Hypokalemie může vést k většímu výskytu arytmií u pacientů léčených digitálisovými glykosidy.
Při kombinaci formoterolu s perorálními kortikosteroidy je možný zvýšený hyperglykemický účinek.
Existuje teoretické riziko, že souběžná léčba s jinými léky, o nichž se ví, že prodlužují QTc interval, může vyvolávat farmakodynamické interakce s formoterolem a zvyšovat tak potenciální riziko ventrikulárních arytmií. Příkladem takových léčiv mohou být např. některá antihistaminika (např. terfenadin, astemizol, mizolastin), některá antiarytmika (např. chinidin, disopyramid, prokainamid), fenothiaziny, erythromycin a tricyklická antidepresiva.
Podávání formoterolu pacientům současně léčeným inhibitory monoaminooxidázy (nebo léčeným během posledních 14 dnů) nebo tricyklickými antidepresivy je třeba provádět s opatrností, jelikož může být zesílen účinek p2-adrenergních stimulancií na kardiovaskulární systém.
Dále i levodopa, levothyroxin, oxytocin a alkohol mohou zhoršit toleranci vůči p2-sympatomimetikům.
Zvýšené riziko arytmií existuje u pacientů vystavených souběžné anestézii pomocí halogenovaných uhlovodíků.
P-adrenergní blokátory mohou účinek formoterolu oslabovat nebo tlumit. Proto by se formoterol neměl společně s P-adrenergními blokátory podávat (včetně očních kapek), pokud k takovému podávání neexistují opravdu pádné důvody.
4.6 Fertilita, těhotenství a kojení
Fertilita
K dispozici jsou pouze omezené údaje týkající se fertility (viz bod 5.3). Reprodukční studie na potkanech neodhalily žádné poškození plodnosti při perorálních dávkách až do 3 mg/kg (přibližně 1000násobek doporučené denní inhalační dávky 24 pg u člověka na základě mg/m2).
Neexistují adekvátní údaje o použití formoterolu u těhotných žen. Ve studiích na zvířatech formoterol způsobil implantační ztráty a pokles časného postnatálního přežití a porodní váhy. Tyto účinky se vyskytly při značně vyšší systémové expozici, než je expozice dosažená při klinickém použití přípravku Fortulin Novolizer. Léčba přípravkem Fortulin Novolizer může být uvážena ve všech stádiích těhotenství, pokud je nutné získat kontrolu nad astmatem a pokud předpokládaný přínos pro matku převáží možné riziko pro plod. Potenciální riziko pro člověka není známé.
Kojení
Není známo, zda formoterol přechází do mateřského mléka. Malé množství formoterolu bylo zjištěno v mateřském mléce potkanů. O podávání přípravku Fortulin Novolizer kojícím ženám se tedy může uvažovat pouze v případě, že očekávaný prospěch pro matku převáží nad potenciálním rizikem pro kojené dítě.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Formoterol nemá žádný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Nejčastěji hlášené nežádoucí účinky při léčbě P2-agonisty, jako třes a palpitace, jsou obvykle mírné a ustupují po několika dnech léčení.
Nežádoucí účinky spojované s podáváním formoterolu jsou uvedeny dále, a to podle tříd orgánových systémů a frekvence. Frekvence je definována následujícím způsobem:
velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až < 1/100), vzácné (>1/10 000 až < 1/1000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
|
Orgánové systémy |
Frekvence |
Nežádoucí účinky |
|
Poruchy imunitního systému |
Vzácné |
Hypersenzitivní reakce jako je bronchospasmus, exantém, kopřivka, pruritus, angioedém |
|
Poruchy metabolismu a výživy |
Vzácné |
Hypokalemie |
|
Velmi vzácné |
Hyperglykémie | |
|
Psychiatrické poruchy |
Méně časté |
Agitovanost, neklid, poruchy spánku |
|
Poruchy nervového systému |
Časté | |
|
Vzácné | ||
|
Velmi vzácné |
Závratě, poruchy chuti | |
|
Srdeční poruchy |
Časté |
Palpitace |
|
Méně časté | ||
|
Vzácné |
Srdeční arytmie, např. fibrilace síní, supraventikulární tachykardie, extrasystoly | |
|
Velmi vzácné |
Angina pectoris, prodloužení intervalu QTc | |
|
Cévní poruchy |
Velmi vzácné |
Kolísání krevního tlaku |
|
Respirační hrudní a mediastinální poruchy |
Méně časté |
Orofaryngeální dráždění |
|
Gastrointestinální poruchy |
Vzácné | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Méně časté |
Svalové křeče |
Ve vzácných případech se může, podobně jako u každé inhalační léčby, objevit paradoxní bronchospasmus (viz bod 4.4).
Léčba agonisty p2-adrenergních receptorů může vést ke zvýšení krevní hladiny inzulínu, volných mastných kyselin, glycerolu a ketonů.
Pomocná látka laktóza obsahuje malé množství mléčných proteinů. Ty mohou způsobit alergické reakce. Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky přímo na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky:http:// www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
K dispozici jsou omezené klinické zkušenosti z léčby předávkování. Dá se však předpokládat, že při předávkování dochází k příznakům typickým pro p2-adrenergní agonisty jako je: třes, bolest hlavy, palpitace. Příznaky hlášené v ojedinělých případech byly tachykardie, hyperglykémie, hypokalemie, prodloužení QTc intervalu, arytmie, nauzea a zvracení. Doporučuje se symptomatická a podpůrná léčba.
Použití kardioselektivních p-blokátorů je možné jen s velkou opatrností, protože použití P-adrenergních blokátorů může vyvolat bronchospazmus. Doporučuje se monitorovat hladinu sérového kalia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: léčiva k terapii onemocnění spojených s obstrukcí dýchacích cest, selektivní agonisté beta2 adrenergních receptorů ATC kód: R03AC13
Formoterol je selektivní agonista p2-adrenergních receptorů, který vede k relaxaci bronchiální hladké svaloviny. U pacientů s reverzibilní obstrukcí dýchacích cest působí bronchodilatačně. Bronchodilatační účinek nastupuje velmi rychle (během 1 -3 minut po inhalaci) a trvá průměrně 12 hodin po jednotlivé dávce.
5.2 Farmakokinetické vlastnosti
Absorpce
Inhalační formoterol se rychle absorbuje. Maximální plazmatické koncentrace je dosaženo asi 5 minut po inhalaci.
Plicní depozice formoterolu z práškového inhalátoru Novolizer zjištěná v průběhu klinického hodnocení je v rozmezí ostatních inhalačních přípravků obsahující formoterol.
Distribuce a metabolismus
Vazba na plazmatické bílkoviny je asi 50 %.
Formoterol je metabolizován přímou glukuronidací a O-demethylací. Enzym zodpovědný za O-demethylaci nebyl identifikován. Celková plazmatická clearance a distribuční objem nebyly stanoveny.
Eliminace
Převážná část podané dávky formoterolu je vylučována metabolismem. Po inhalaci prášku podobným inhalačním zařízením se 8 % až 13 % inhalované dávky formoterolu vylučuje močí v nezměněné formě. Zhruba 20 % intravenózní dávky se vyloučí v nezměněné formě močí. Odhaduje se, že terminální poločas po inhalaci je 8 hodin.
Starší lidé a pacienti s poruchou funkce ledvin nebo jater
Vliv snížené funkce jater nebo ledvin na farmakokinetiku formoterolu a farmakokinetiku u starších osob není znám. Formoterol je primárně vylučován metabolismem a lze očekávat, že u pacientů s těžkou jaterní cirhózou může být zvýšena systémová expozice formoterolu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Účinky formoterolu pozorované ve studiích toxicity u potkanů a psů byly spojovány zejména kardiovaskulárním systémem a zahrnovaly hyperémii, tachykardii, arytmie a myokardiální léze. Tyto účinky jsou známé farmakologické projevy pozorované po podání vysokých dávek p2 agonistů.
Ve studiích na zvířatech formoterol způsoboval ztráty při implantaci, snížené přežívání časně po porodu a sníženou porodní hmotnost. Tyto účinky se dostavily při výrazně vyšších systémových expozicích, než jakých je dosahováno při klinickém použití formoterolu. Reprodukční studie na potkanech neodhalily žádné narušení plodnosti při perorálních dávkách až do 3 mg/kg (přibližně 1000násobek doporučené denní inhalační dávky 24 pg u člověka na základě mg/m2).
V in vitro ani in vivo studiích nebyly zjištěny žádné genotoxické účinky. U potkanů a myší bylo pozorováno mírné zvýšení výskytu benigních děložních leiomyomů. Tento efekt je považován za účinek celé třídy léků (class-effect) pozorovaný u hlodavců po dlouhodobé expozici vysokým dávkámi p2-agonistů.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek monohydrát laktózy.
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti • Zásobní vložka
3 roky
Doba použitelnosti zásobní vložky po odstranění fólie: 6 měsíců
• Inhalátor suchého prášku Novolizer
4 roky
Doba použitelnosti po prvním použití: 1 rok
Pozn.: Funkčnost inhalátoru suchého prášku (Novolizer) byla prokázána v testech se 2000 odměřenými dávkami. Nepředpokládá se, že toto množství odměřených dávek bude během jednoho roku při normálním dávkování přípravku překročeno.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
Po prvním otevření uchovávejte při teplotě do 25 °C a chraňte inhalátor suchého prášku Novolizer před vlhkostí.
6.5 Druh obalu a obsah balení
Zásobní vložka je vyrobena z polystyrenu / polypropylenu, baleného v polypropylenové tubě (obal zásobní vložky) uzavřené aluminiovou fólií. Tělo zásobní vložky má na spodní straně malý červený disk s vysoušedlem (silikagel).
Práškový inhalátor: náustek je vyroben z polykarbonátu a inhalátor je vyroben z akrylonitril-butadien-styrol kopolymeru, polyoxymetylénu.
Velikost balení:
1 práškový inhalátor a 1 zásobní vložka (60 dávek)
1 práškový inhalátor a 2 zásobní vložky (60 dávek každá)
1 práškový inhalátor a 1 zásobní vložka (100 dávek)
1 práškový inhalátor a 2 zásobní vložky (100 dávek každá)
Náhradní balení:
1 zásobní vložka (60 dávek)
2 zásobní vložky (60 dávek každá)
3 zásobní vložky (60 dávek každá)
1 zásobní vložka (100 dávek)
2 zásobní vložky (100 dávek každá)
Nemocniční balení:
Balení obsahující 10 kusů (1 práškový inhalátor a 1 zásobní vložka (60 dávek))
Balení obsahující 6 kusů (1 práškový inhalátor a 1 zásobní vložka (100 dávek))
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
MEDA Pharma s.r.o.
Kodaňská 1441/46 100 00 Praha 10 Česká republika
8. REGISTRAČNÍ ČÍSLO
6 mikrogramů: 14/177/15-C 12 mikrogramů: 14/178/15-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 8.4.2015
10. DATUM REVIZE TEXTU 8.4.2015
10