Forotel 12 Mikrogramů
sp.zn. sukls114246/2016
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
FOROTEL12 mikrogramů Suspenze k inhalaci v tlakovém obalu
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna odměřená dávka obsahuje:
12 mikrogramů formoteroli fumaras dihydricus, což odpovídá dávce 11,49 mikrogramů formoteroli fumaras
Pomocné látky se známým účinkem: bezvodý ethanol, sójový lecithin Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Suspenze k inhalaci v tlakovém obalu.
Bílá homogenní inhalační suspenze.
4. KLINICKÉ ÚDAJE
4.1. Terapeutické indikace
FOROTEL v aerosolovém inhalačním dávkovači je indikován k přídatné léčbě pacientů trpících astmatem (včetně nočního astmatu a prevence bronchospazmů vyvolaných fyzickou námahou) a pacientů s chronickou obstrukční chorobou plic vyžadující pravidelnou dlouhodobou bronchodilatační léčbu. Pacienti s těmito onemocněními musí také pravidelně dostávat odpovídající dávky inhalačních protizánětlivých léků (kortikoidů).
4.2. Dávkování a způsob podání,
Lék je určen pro léčbu dospělých a dospívajících od 12 let věku.
Dávkování
Astma:
1 vstřik dvakrát denně ráno a večer (24 pg dihydrátu formoterolu-fumarátu denně). V těžkých případech maximálně až dvě dávky ráno a dvě večer (48 pg dihydrátu formoterolu-fumarátu denně). Maximální doporučená denní dávka je 48 pg denně.
Profylaxe bronchospasmu vyvolaného námahou nebo před expozicí známého alergenu, kterému se nelze vyhnout
1 vstřik 15 minut před plánovanou činností nebo expozicí. U pacientů s těžkým bronchospasmem v anamnéze může stav vyžadovat jako profylaxi aplikaci 2 střiků (24 pg).
Chronická obstrukčníplicní nemoc (CHOPN)
Obvyklá dávka pro dospělé (nad 18 let) je 1 vstřik jednou nebo dvakrát denně (tedy 12 - 24 |ig dihydrátu formoterolu-fumarátu denně).
Maximální dávka nesmí být překročena. Bezpečnost dlouhodobé léčby dávkami vyššími než 36 gg denně u dospělých pacientů s astmatem nebyla stanovena.
Přípravek Forotel není určen k úlevě při akutním astmatickém záchvatu. Jestliže se vyskytne akutní záchvat, je třeba použít krátkodobé beta-2-agonisty.
Pacienty je třeba poučit, aby při zahájení léčby přípravkem Forotel neukončovali nebo neměnili léčbu kortikosteroidy.
Jestliže symptomy přetrvávají nebo se zhoršují, nebo doporučená dávka přípravku Forotel nestačí uspokojivě mírnit symptomy, je to obvyklá známka zhoršení základního onemocnění.
Bronchodilatační účinek FOROTELU je stále výrazný i za 12 hodin po inhalaci. U většiny pacientů s chronickým stavem bronchokonstrikce je udržovací dávka, podávaná dvakrát denně, dostačující pro zvládnutí onemocnění a to jak ve dne, tak i v noci.
Dávkování při poškození renálních a jaterních funkcí
Pro změnu dávkování při poškození jaterních a ledvinných funkcí není žádný teoretický důvod, avšak nebyly ani provedeny žádné klinické studie, které by podporovaly použití přípravku u takto postižených pacientů.
4.3. Kontraindikace Přecitlivělost
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4. Zvláštní upozornění a opatření pro použití
Formoterol, léčivá látka obsažená ve Forotelu, patří do třídy dlouhodobě působících beta2-adrenergních agonistů. Ve studiích se salmeterolem, jiným dlouhodobě působícím beta2-agonistou, byl pozorován vyšší počet úmrtí souvisejících s astmatem u pacientů léčených salmeterolem (13/13176) oproti placebu (3/13179). Žádná adekvátní studie, na jejímž základě by bylo možno rozhodnout, zda je frekvence úmrtí souvisejících s astmatem u formoterolu zvýšena, nebyla provedena.
Doporučené dávkování
Dávkování Forotelu je nutno stanovit individuálně pro každého pacienta; mělo by se jednat o nejnižší možnou dávku postačující k dosažení terapeutického cíle. Maximální doporučená dávka se nesmí překročit (viz bod 4.2).
Forotel by neměl být používán (a není vhodný) jako počáteční léčba astmatu. Protizánětlivá léčba
Pokud léčíte pacienty s astmatem, používejte Forotel, dlouhodobě působícího beta2-agonistu (LABA), pouze jako přídavnou léčbu k inhalačnímu kortikosteroidu (ICS) u pacientů, u kterých nebylo dosaženo dostatečné kontroly samotným ICS, nebo u kterých závažnost onemocnění ospravedlňuje zahájení léčby oběma přípravky, tedy ICS a LABA.
Forotel se nemá používat současně s jiným LABA.
Kdykoli je předepsán Forotel, je nutné u pacientů zhodnotit současnou protizánětlivou léčbu. Pacienti musí být upozorněni, že po zahájení léčby Forotelem, a to i při zlepšení celkového stavu, mají pokračovat v nezměněné protizánětlivé terapii, kterou dosud používali.
Jakmile jsou příznaky astmatu pod kontrolou, může být zváženo postupné snížení dávek Forotelu. Po snížení dávkování je důležité pravidelné monitorování pacientů. Měla by být použita nejnižší účinná dávka Forotelu.
Exacerbace astmatu
Klinické studie s formoterolem naznačovaly vyšší incidenci těžké exacerbace astmatu u pacientů, kteří užívali formoterol, než u těch, kteří dostávali placebo, zejména u pacientů ve věku 5-12 let (viz bod 4.8 Nežádoucí účinky). Tyto studie neumožňují přesné kvantitativní vyjádření rozdílů ve frekvenci závažné exacerbace astmatu mezi léčenými skupinami.
Pokud symptomy onemocnění přetrvávají nebo počet dávek Forotelu není dostatečný pro léčbu astmatu a symptomy se stupňují, znamená to obvykle zhoršení stavu základního onemocnění a lékař by měl antiastmatickou terapii přehodnotit.
V průběhu exacerbace astmatu nesmí být zahájena léčba Forotelem ani nesmí být zvyšováno dávkování.
Forotel se nesmí užívat k úlevě od akutních astmatických obtíží. V případě akutního záchvatu je nutno použít krátkodobě působící beta2-sympatomimetikum. Pacienti musí být informováni, aby v případě náhlého zhoršení astmatu vyhledali okamžitě lékařskou pomoc.
Použití u přidružených onemocněních
Zvýšená péče a dohled s důrazem na omezení dávky Forotelu je nutný u pacientů s následujícími onemocněními:
ischemická choroba srdeční, srdeční arytmie (zejména III. stupeň AV blokády), těžká srdeční dekompenzace, idiopatická subvalvulární stenóza aorty, těžká hypertenze, aneurysma, feochromocytom, hypertrofická obstrukční kardiomyopatie, thyreotoxikóza nebo jiná vážná kardiovaskulární onemocnění (tachyarytmie nebo srdeční selhání).
Formoterol může vyvolat prodloužení intervalu QT. Proto musí být Forotel podáván s velkou opatrností pacientům s prodlouženým intervalem QT a pacientům, kteří užívají léky ovlivňující interval QT (viz bod 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce).
U pacientů s diabetem se vzhledem k hyperglykemickému účinku beta2-agonistů doporučují častější kontrolní vyšetření glykemie
Paradoxní bronchospazmus
Tak jako u každé inhalační terapie se může ojediněle paradoxně objevit bronchospazmus. V takovém případě je třeba léčbu přípravkem okamžitě přerušit a celý léčebný postup musí lékař přehodnotit.
Hypokalémie
Je prokázáno, že při terapii formoterolem je pokles hladiny draslíku vyšší než v průběhu léčby krátkodobými beta2-sympatomimetiky (např. salbutamolem). Proto je třeba hladinu draslíku pečlivě sledovat, zvláště u pacientů s nízkou bazální hladinou draslíku nebo rizikem snížené hladiny draslíku. Tyto hladiny je třeba bedlivě sledovat i v případech, kdy se neobjevily snížené hladiny draslíku při předcházející léčbě krátkodobými beta2-sympatomimetiky. Je-li to nezbytné, musí se podat draslík substitučně.
Hypokalémie se může objevit zvláště u pacientů se závažným astmatem, kteří jsou současně léčeni teofylinem, glukokortikoidy a/nebo diuretiky. Díky snížené hladině draslíku je zvýšen účinek léků obsahujících digitalis.
Protože riziko hypokalémie je zvýšeno hypoxií, je třeba pacienty se závažným astmatem pečlivě sledovat.
Dysfunkce srdečního svalu
U pacientů trpících dysfunkcí srdečního svalu nebo pacientů, u nichž tato dysfunkce hrozí, je nutná opatrnost. Nejzávažnějším, i když vzácným, rizikovým faktorem u jakéhokoliv P-agonisty je dysrytmie. A ještě více ohroženi jsou pacienti s dalšími rizikovými faktory k dysrytmii - thyreotoxikózou, srdeční nedostatečností, hypertenzí, hypertrofickou obstrukční kardiomyopatií asubvalvární stenózou aorty.
Starší pacienti
Pro tuto věkovou kategorii neexistují žádná zvláštní doporučení.
Pediatrická populace:
Děti do 12 let věku nesmí být léčeny FOROTELEM, protože pro tuto věkovou skupinu neexistuje dostatek zkušeností.
4.5. Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné specifické studie interakcí formoterolem.
Potenciálně nebezpečné interakce
FOROTEL je kompetitivním agonistou P2-adrenoceptorů, takže jeho účinky budou antagonizovány antagonisty P-adrenoceptorů (včetně očních kapek) a budou se zvyšovat jinými P2-agonisty. Proto současná léčba těmito léky může vyžadovat titraci dávky
FOROTEL, stejně jako jiná beta2-mimetika, by měl být podáván s opatrností u pacientů léčených léky, jako jsou např. chinidin, disopyramid, prokainamid, fenothiaziny, antihistaminika (terfenadin, astemizole, mizolastine), erythromycin, inhibitory monoaminoxidázy a tricyklická antidepresiva nebo jakékoliv jiné známé léky, které prodlužují interval QTc a zvyšují tak riziko ventrikulárních arytmií.
Současné podání jiných sympatomimetik může potencovat nežádoucí účinky přípravku Forotel a může tak vyžadovat titraci dávky. (viz bod 4.4 Zvláštní
upozornění a opatření pro použití).
Při použití halogenovaných uhlovodíků k celkové anestezii může vzrůst nebezpečí vzniku arytmií.
Při současné terapii xantinovými deriváty, steroidy nebo diuretiky může dojít k posílení možného hypokalemického účinku beta2-mimetik (viz bod 4.4 Zvláštní upozornění a opatření pro použití). Hypokalemie může zvýšit náchylnost k arytmiím u pacientů léčených digitalisovými glykosidy.
Současné použití formoterolu a theofylinu může vyvolat vzájemnou potenciaci účinků a proto existuje také možnost zvýšení nežádoucích účinků, jako např. srdečních arytmií. Také látky jako L-dopa, L-thyroxin, oxytocin nebo alkohol, které samy potencují sympatomimetické účinky, mohou ovlivnit regulaci kardiovaskulárních funkcí, jestliže se užijí společně s formoterolem.
Současné použití formoterolu s inhibitory monoaminooxidázy (IMAO), makrolidy nebo tricyklickými antidepresivy je třeba indikovat s opatrností, protože existuje riziko potencování sympatomimetických účinků na kardiovaskulární systém.
Bronchodilatační účinek formoterolu může být zvýšen anticholinergními látkami.
Interference s klinickými laboratorními testy
Není známa.
4.6. Fertilita, těhotenství a kojení Těhotenství
V pokusech na zvířatech nebyly zjištěny žádné teratogenní účinky. Ve zvířecích studiích formoterol způsobil raný potrat spolu se sníženým postnatálním přežitím a porodní váhou. Tyto účinky formoterolu se objevily po vyšší systémové expozici, než jaké je dosaženo v klinické praxi.
Nicméně, Formoterol se nedoporučuje pro použití u těhotných žen (zvláště pak na konci těhotenství nebo během porodu), ledaže by neexistovala žádná účinná alternativní možnost. Použití formoterolu je možné pouze po důkladném zvážení poměru: očekávaný přínos pro matku/riziko pro plod. V průběhu těhotenství musí být astma pod pečlivou kontrolou, neboť nekontrolované astma může znamenat ohrožení plodu.
Kojící matky
Není známo, zda formoterol přechází do mateřského mléka (jako tomu je u kojících samic potkanů), a proto se doporučuje, aby matky, které formoterol užívají, kojení přerušily.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit a používat stroje nebyly provedeny. Pacienti, kteří trpí závratěmi, mdlobami a nebo podobnými nežádoucími účinky, by neměli řídit ani ovládat těžké stroje.
4.8 Nežádoucí účinky
Frekvence nežádoucích účinků je definována takto: časté (vyskytujícíse více než v 1 %, méně než v 10 %), méně časté (0,1 % - 1 %), vzácné (0,01% - 0,1 %), velmi vzácné (méně než 0,01 %), není známo (z dostupných údajů nelze určit) včetně izolovaných zpráv._
|
Srdeční poruchy |
časté |
Palpitace |
|
méně časté | ||
|
vzácné |
Srdeční arytmie (atriální fibrilace, supraventrikulárnítachykardie, extrasystoly) | |
|
velmi vzácné |
Periferní edém, angina pectoris, prodloužení intervalu QT | |
|
Gastrointestinální poruchy |
vzácné |
Nausea |
|
Poruchy imunitního systému |
velmi vzácné vzácné |
Hypersenzitivita (včetně hypotenze a angioneurotickéhoedému) Hypersenzitivní reakce (bronchospasmus, exantém, kopřivka, pruritus) |
|
Poruchy metabolismu a výživy |
vzácné |
Hypokalemie, |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Velmi vzácné |
hyperglykémie |
|
méně časté |
Svalové křeče, myalgie | |
|
Poruchy nervového systému |
časté |
Bolesti hlavy, třes |
|
méně časté |
závratě | |
|
velmi vzácné |
porucha chuti | |
|
Psychiatrické poruchy |
méně časté | |
|
Cévní poruchy |
velmi vzácné |
Změny tlaku krve |
|
Poruchy ledvin a močových cest |
vzácné |
Nephritis |
|
Poruchy krve a lymfatického systému |
velmi vzácné |
Trombopenie |
|
Respirační, hrudní a mediastinální poruchy | ||
|
méně časté |
Podráždění orofaryngu, bronchospasmus, včetně paradoxního bronchospasmu,akutní exacerbace astmatu* | |
|
není známo |
Kašel** | |
|
Poruchy kůže a podkožní tkáně |
není známo |
vyrážka** |
|
Vyšetření |
není známo |
Zvýšení tlaku krve** |
Jemný třes, nauzea, poruchy chuťového vnímání, podráždění orofaryngu, pocení, neklid, bolesti hlavy, závratě a svalové křeče mohou při pokračující terapii spontánně pominout v průběhu jednoho nebo dvou týdnů.
*Výskyt závažných exacrebací astamtu byl v klinických studiích vyšší ve skupině pacientů užívajících formoterol v porovnání s placebem (viz sekce 4.4 a 5.1).
**Tyto nežádoucí účinky byly hlášeny během postmarketingového sledování u pacientů léčených formoterolem.
Potenciální nežádoucí účinky ohrožující život
Potenciálním rizikem jsou dysrytmie, a to zvláště u pacientů s jinými rizikovými faktory jako je hypoxemie, hypokalémie, dysfunkce srdečního svalu a léčba jinými léky (viz bod 4.4).
Pacienti, kteří si sníží inhalační dávku kortikosteroidu po symptomatickém zlepšení vyvolaném užitím formoterolu, mohou být ohroženi těžkými astmatickými záchvaty.
Těžké nebo nevratné nežádoucí účinky
Kromě potenciální dysrytmie není žádný takový účinek znám. V případě krátkodobě působících P-agonistů existovaly obavy, že se u některých pacientů může po léčbě vysokými dávkami vyvinout tolerance. U formoterolu se tato skutečnost jako klinický problém neprokázala.
Jako u všech inhalačních terapii velmi vzácně se může objevit paradoxní bronchospazmus.
Léčení B2-agonisty může vyvolat zvýšení hladin insulinu, volných ,mastných kyselin, glycerolu a ketonů.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje
to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www .sukl .cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Dlouhodobější podávání formoterolu v dávkách 200 pg/kg denně intraperitoneálně po dobu 24 dní u morčat vyvolalo značné snížení p2-adrenoceptorové hustoty ve všech oblastech srdce a plic, a to o 43% respektive 77 %.
Akutní předávkování
S akutním předávkováním formoterolem nejsou žádné zkušenosti. Stejně tak jako u všech P-agonistů budou hlavními účinky předávkování pravděpodobně nauzea, zvracení, somnolence, palpitace, metabolická acidóza, hyperglykémie, hypokalémie, bolesti hlavy, třes, tachykardie, hypertenze a možná dysrytmie a prodloužení intervalu QT. Léčení p1-adrenoceptorovými antagonisty je sice logické, ale u pacientů s astmatem potenciálně nebezpečné; pokud se považuje za vhodné, musí se provádět opatrně a při zajištěném resuscitačním vybavení. Léčba bude obvykle podpůrná a symptomatická a měla by zahrnovat pečlivé sledování sérových koncentrací draslíku
a srdečního rytmu s korektivními opatřeními, pokud budou nutná.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiastmatikum, bronchodilatans ATC kód: R03AC13
Formoterol je silné selektivní beta2-sympatomimetikum. U pacientů s reverzibilní obstrukcí dýchacích cest působí bronchodilatačně. Účinek nastupuje velmi rychle (během 1-3 minut) a trvá ještě za 12 hodin po inhalaci. V terapeutických dávkách jsou účinky na kardiovaskulární systém minimální a vyskytují se jen příležitostně. Formoterol inhibuje uvolnění histaminu a leukotrienů z pasivně senzibilizovaných lidských plic. U zvířat byly pozorovány některé protizánětlivé účinky, jako je potlačení edému a pokles kumulace zánětlivých buněk.
Ve studiích in-vitro na průdušnici morčat bylo zjištěno, že racemická forma formoterolu a jeho (R,R)- a (S,S)-enantiomery jsou vysoce selektivní agonisté beta2-adrenoreceptorů. (S,S)-enantiomer byl 800 až 1000krát méně účinný než (R,R)-enantiomer a neovlivnil účinek (R,R)-enantiomeru na hladké svalstvo průdušnice. Nebyl prokázán žádný farmakologický podklad pro užití jednoho ze dvou enantiomerů přednostně před racemickou směsí.
U člověka bylo prokázáno, že formoterol je účinný v prevenci bronchospasmu vyvolaného inhalačními alergeny, námahou, chladem, histaminem nebo metacholinem.
Formoterol aplikovaný inhalátorem Aerolizer dvakrát denně v dávkách 12 mikrogramů nebo 24 mikrogramů působí u pacientů se stabilní CHOPN rychlý nástup bronchodilatace, která přetrvává ještě za 12 hodin, a která je subjektivně doprovázena zlepšením kvality života (užití dotazníku Saint George’s Respiratory Questionnaire).
5.2 Farmakokinetické vlastnosti
Rozmezí terapeutických dávek Foradilu je 12 až 24 mikrogramů 2x denně. Informace o farmakokinetice formoterolu v plazmě byly získány u zdravých dobrovolníků po inhalaci vyšších dávek, než je doporučované rozpětí a u pacientů s CHOPN po inhalaci terapeutických dávek. Obsah nezměněného formoterolu vyloučeného močí byl užit jako míra celkové expozice. Množství vyloučené do moči odpovídá hladině léčiva v plazmě. Poločasy vylučování vypočtené pro plazmu a moč jsou podobné.
Absorpce
Po jednorázové inhalaci dávky 120 mikrogramů formoterolfumarátu zdravými dobrovolníky byl formoterol rychle absorbován a maximální koncentrace v plazmě 266 pmol/l bylo dosaženo za 5 minut po inhalaci. U pacientů s CHOPN po inhalaci 12 nebo 24 mikrogramů formoterolfumarátu dvakrát denně po dobu 12 týdnů byla průměrná plazmatická koncentrace formoterolu v rozsahu 11,5 až 25,7 pmol/l, resp. 23,3 až 50,3 pmol/l za 10 minut, 2 hodiny a 6 hodin po inhalaci.
Studie sledující kumulativní vylučování formoterolu močí a/nebo jeho (R,R)- a (S,S)-enantiomerů ukázaly, že dostupné množství formoterolu v oběhu stoupá v závislosti na inhalované dávce (12-96 mikrogramů).
Po inhalaci 12 nebo 24 mikrogramů formoterolfumarátu dvakrát denně po dobu 12 týdnů exkrece nezměněného formoterolu močí vzrostla o 63 až 73% (poslední vs.
první dávka) u pacientů s astmatem a o 19 až 38% u pacientů s CHOPN. Toto dává předpoklad k mírné akumulaci formoterolu v plazmě po opakovaném podávání. Rozdílná relativní akumulace jednotlivých enantiomerů nebyla po opakovaném podání pozorována.
Je pravděpodobné, že tak jak bylo popsáno u ostatních inhalačních přípravků, je většina formoterolu aplikovaného inhalátorem spolknuta a potom absorbována ze zažívacího traktu. Po perorálním podání 80 mikrogramů formoterolfumarátu značeného 3H dvěma zdravým dobrovolníkům bylo nejméně 65% podané dávky absorbováno.
Distribuce
Vazba formoterolu na plazmatické bílkoviny je 61 až 64%, na albumin lidského séra se váže 34%.
V rozmezí koncentrací dosažených terapeutickými dávkami nedochází k úplné saturaci vazebných míst.
Biotransformace
Formoterol je v první řadě metabolizován; přímá glukuronidace je hlavní cesta biotransformačního procesu. O-demethylace následovaná glukuronidací je alternativní cesta biotransformace. Jen částečně dochází ke konjugaci se sírany a deformylaci následované konjugací se sírany. Mnoho izoenzymů metabolizuje formoterolglukuronidací (UGT1A1, 1A3, 1A6, 1A7, 1A8, 1A9, 1A10,2B7 a 2B15) a O-demethylací (CYP2D6, 2C19, 2C9, a 2A6), což předpokládá nízký potenciál interakce s jinými léky inhibicí specifických enzymů, které se podílejí na metabolismu formoterolu. V terapeutické koncentraci formoterol neinhibuje izoenzymy cytochromu P450.
Eliminace
U pacientů s astmatem a CHOPN léčených formoterolfumarátem v dávce 12 nebo 24 mikrogramů 2x denně po dobu 12 týdnů bylo v moči nalezeno přibližně 10%, resp. 7%, nezměněného formoterolu. V moči byly nalezeny (R,R)- a (S,S)-enantiomery v množství 40% a 60%, přepočteno na vyloučený nezměněný formoterol, po jednorázové dávce (12 až 120 mikrogramů) zdravým dobrovolníkům a po jednorázovém a opakovaném podání pacientům s astmatem.
Lék a jeho metabolity je úplně vylučován z organismu, asi 2/3 dávky podané prerorálně se vyloučí močí a 1/3 stolicí. Renální clearanceformoterolu z krve je 150 ml/min.
Po jednorázové inhalaci dávky 120 mikrogramů formoterolfumarátu zdravými dobrovolníky byl terminální poločas vylučování formoterolu z plazmy stanoven na 10 hodin a terminální poločas vylučování (R,R)- a S, S)-enantiomerů, vypočtený z vyloučení do moči potkanů, 13,9, resp. 12,3 hodiny.
Zvláštní populace
Pohlaví: po přepočtu na tělesnou hmotnost nebyl ve farmakokinetice formoterolu nalezen významný rozdíl mezi muži a ženami.
Starší pacienti: u starších pacientů nebyla farmakokinetika formoterolu studována. Děti: ve studii u dětí s astmatem ve věku 5 až 12 let, kterým byl podáván formoterolfumarát v dávkách 12-24 mikrogramů 2krát denně po dobu 12 týdnů, množství vyloučeného formoterolu v nezměněné formě stouplo, o 18 až 84% v porovnání s množstvím naměřeným po první dávce. Akumulace u dětí nepřevyšovala hodnotu u dospělých, kde vzrostla o 63 až 73% (viz výše). U dětí bylo v moči nalezeno přibližně 6% dávky formoterolu v nezměněné formě.
Zhoršená funkce ledvin nebo jater: u pacientů se zhoršenou funkcí jater nebo ledvin nebyla farmakokinetika formoterolu studována.
5.3 Předklinické údaje vztahující se k bezpečnosti Mutagenita
I přes široké spektrum provedených testů na mutagenitu nebyly v in vivo a in vitro studiích nalezeny žádné genotoxické účinky.
Karcinogenita
Ve dvouleté studii na potkanech a myších nebyly prokázánykarcinogenní účinky.
U samců myší, kterým byly podávány vysoké dávky, bylo zaznamenáno mírné zvýšení výskytu benigních tumorů nadledvin ze subkapsulárních buněk. Nicméně tyto nálezy nebyly pozorovány ve druhé studii, kde byly podávány myším vysoké dávky; zde došlo k patologickým změnám zvýšení výskytu benigních tumorů hladkého svalstva v oblasti genitálií u samic a tumorů na játrech u obou pohlaví studovaných zvířat. Nádory hladkého svalstva jsou známým účinkem beta-sympatomimetik podávaných hlodavcům ve vysokých dávkách.
Dvě studie na potkanech, které zahrnovaly různé dávkové rozmezí, ukázaly vzestup výskytu mezovariálních leiomyomů. Tato benigní neoplazmata jsou u potkanů typická a souvisí s dlouhodobou léčbou a s vysokými dávkami beta2-adrenergních látek. Byl také zjištěn zvýšený výskyt ovariálních cyst a benigních granulóza/ thekálních buněčných tumorů. Je známo, že beta sympatomimetika působí na ovaria u samic potkanů a jsou pravděpodobně specifické pro hlodavce. Výskyt jiných druhů nádorů zjištěných v 1. studii při používání vysokých dávek byl ještě v rozmezí v minulosti sledované populace a výskyt těchto nádorů nebyl zjištěn při nízkých dávkách.
Výskyt žádného typu nádoru nebyl statisticky významně zvýšen při použití nízkých dávek. Obdobné nálezy byly i ve druhé studii, kde byla dávka, která vedla k expozici 10x vyšší, než je maximální doporučená dávka formoterolu pro dospělé.
Na základě těchto nálezů a nepřítomnosti mutagenního účinku, je možné uzavřít, že použití formoterolu v terapeutických dávkách nepředstavuje karcinogenní riziko.
Reprodukční toxicita
Při pokusech na zvířatech nebyl zjištěn žádný teratogenní účinek, po perorálním podání byl formoterol vylučován do mléka potkaních samic.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Bezvodý ethanol Sójový lecithin Norfluran (HFA 134 a)
6.2 Inkompatibility
Neuplatňuje se
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30 0C. Chraňte před mrazem. Chraňte před přímým sluncem.
Nádobka je pod tlakem. Nevystavujte teplotám přesahujícím 50°C. Nepropichujte nádobku.
6.5 Druh obalu a obsah balení
1 tlakový hliníkový obal obsahující bílou homogenní inhalační suspenzi pod tlakem, odměrný ventil, dávkovač s ochranným krytem bílé barvy. Každé balení obsahuje 1 tlakovou nádobku, která poskytuje 120 jednotlivých dávek
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlkvidován v souladu s místními požadavky.
Postupujte dle ilustrovaných pokynů, abyste se naučili, jak aerosolový dávkovač FOROTEL používat.
Tento přípravek není určen k použití spolu s inhalačním nástavcem (tzv. spacer). Inhalátor se skládá z následujících částí:

Nádobka Plastový korpus Krytka náustku

Odzkoušení dávkovače
Před prvním použitím dávkovače nebo před jeho použitím po přestávce delší než 3 dnydávkovač dobře protřepeme a pak “zkusíme odstříknout”, tzn. provedeme odstříknutí naprázdno (v případě před prvním použitím odstříkneme dvakrát, v případě přestávky delší než 3 dny odstříkneme jednou).

1. Sejmeme krytku náustku a zkontrolujeme čistotu. Dávkovač dobře protřepeme. Držíme ho ve vzpřímené poloze, jak ukazuje obrázek, s palcem na dnu. Na horní části nádobky máme jeden nebo dva prsty.

2. Zlehka vydechneme
3. Náustek vložíme do úst mezi zuby a rty ho sevřeme (nekoušeme). Hlavu zlehka zakloníme.
Začneme pomalu vdechovat ústy. Při vdechu nádobku stiskneme tak, aby dodala odměřenou dávku, a stále hluboce vdechujeme.

4. Dávkovač z úst vyjmeme a dech zadržíme na 10 sekund nebo alespoň tak dlouho, dokud to dokážeme. Pomalu vydechneme.
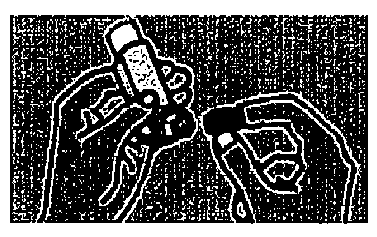

5. Pokud je nutná ještě další dávka, počkáme alespoň jednu minutu a kroky 2 až 4 zopakujeme. Po použití znovu nasadíme krytku náustku.

Důležité:
Kroky 3 a 4 neurychlujeme. Před dodáním dávky je důležité začít dýchat co nejpomaleji. Několikrát si to před prvním použitím vyzkoušíme před zrcadlem. Pokud bude nad dávkovačem nebo po jeho stranách vidět „mlha“, začneme znovu od kroku 1. Unikající mlha svědčí o nesprávném postupu.
Čištění
Je důležité udržovat plastový náustek čistý, aby dávkovač správně fungoval.
Dávkovač čistíme minimálně jednou týdně, a to následovně:
1. Kovovou nádobku opatrně vyjmeme z plastového korpusu dávkovače. Sejmeme krytku náustku.
2. Plastový korpus a krytku náustku ponoříme do teplé vody. Kovovou nádobku do vody nevkládáme.
3. Dále plastový korpus a krytku náustku propláchneme pod tekoucí vodou z vodovodu.
4. Důkladně oklepeme, abychom odstranili ulpívající vodu.
5. Necháme oschnout na teplém místě. Nadměrné horko je nežádoucí. Po oschnutí plastového korpusu nádobku znovu vrátíme nazpět a nasadíme správně krytku náustku.
7. Držitel rozhodnutí o registraci
Cipla UK Ltd., Weybridge, Surrey, Velká Británie
8. Registrační číslo 14/114/13-C
9. Datum první registrace/prodloužení registrace 27.2.2013
10. Datum revize textu 15.6.2016
14