Formoterol-Ratiopharm 12 Mcg
sp.zn. sukls108854/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU FORMOTEROL-RATIOPHARM 12 pg prášek k inhalaci v tvrdé tobolce
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tobolka obsahuje 12 pg formoteroli fumaras, což odpovídá 12,5 pg formoteroli fumaras dihydricus.
To odpovídá podané dávce 10,3 pg formoteroli fumaras.
Pomocná látka: jedna tobolka obsahuje 24 mg monohydrátu laktosy.
Pomocné látky viz 6.1.
3. LÉKOVÁ FORMA
Prášek k inhalaci v tvrdé tobolce.
Bezbarvé transparentní želatinové tobolky obsahující bílý prášek k inhalaci.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Symptomatická dlouhodobá léčba perzistujícího středně těžkého až těžkého astma bronchiale v kombinaci s dlouhodobou protizánětlivou léčbou (např. kortikosteroidy).
Léčba symptomů bronchiální obstrukce u pacientů s chronickou obstrukční plicní nemocí (CHOPN).
Léčba dalších onemocnění dýchacích cest s reverzibilní obstrukční komponentou, jako je chronická bronchitida s emfyzémem nebo bez emfyzému.
Prevence bronchospasmu jako následku vdechnutého alergenu nebo námahy.
Poznámka:
Dosud nebylo zjištěno, že by formoterol mohl nahradit léčbu kortikosteroidy. V každém případě musí být při léčbě bronchiálního astmatu formoterol při inhalaci kombinován s kortikosteroidy.
4.2 Dávkování a způsob podání
Tobolky jsou určeny pouze k inhalačnímu podání.
Bronchodilatační účinek formoterolu je signifikantní ještě 12 hodin po inhalaci. Proto je podávání přípravku 2x denně ve většině případů dostačující ke zvládnutí příznaků astmatu a jiných onemocnění dýchacích cest s reverzibilní nebo ireverzibilní obstrukční komponentou, a to jak ve dne, tak i v noci.
Děti od 6 let , mladiství a dospělí ( včetně starších pacientů)
Bronchiální astma a další onemocnění dýchacích cest s reverzibilní obstrukční komponentou, jako je chronická bronchitida s emfyzémem nebo bez emfyzému a chronická obstrukční plicní nemoc (CHOPN).:
Běžná udržovací dávka je 1 inhalační tobolka (12 pg) 2x denně. Pokud je k úlevě od případných akutních nebo chronických příznaků nezbytné, lze podat další 1-2 tobolky denně. Maximální denní dávka je 2 inhalační tobolky dvakrát denně (48 pg).
Pacient by měl být informován, že pokud je třeba užít mimořádnou dávku častěji než dvakrát týdně, měl by kontaktovat lékaře, který přehodnotí léčbu, jelikož je možné, že se stav zhoršil.
Prevence bronchospasmu způsobeného inhalovaným alergenem nebo námahou:
Obsah jedné tobolky (12 pg) se inhaluje 15 minut před očekávanou aktivitou nebo kontaktem s alergenem. U dospělých pacientů se závažným stupněm astmatu mohou být nezbytné až dvě tobolky (24 Mg).
Renální a jaterní insuficience
Neexistuje teoretický důvod, aby u pacientů s poruchou ledvin nebo jater bylo dávkování formoterolu upraveno, nicméně nejsou k dispozici klinická data o použití přípravku u těchto skupin pacientů.
Je třeba zajistit, aby pacient byl instruován lékařem nebo lékárníkem o použití inhalátoru.
Návod k použití:
1. Sejměte víčko
í
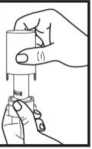
2.
Držte pevně spodní část inhalátoru a otočte náustkem ve směru šipky, až se otevře.
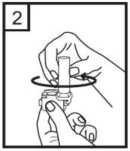
3.
Poté, co se ujistíte, že máte suché ruce, vložte jednu tobolku do jamky určené pro tobolku ve spodní části inhalátoru.

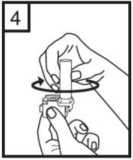
4.
Otočte náustkem do zavírací polohy.
5. Držte inhalátor ve vzpřímené poloze (náustkem nahoru). Současně a pouze jednou silně zmáčkněte dva knoflíky umístěné na spodní části inhalátoru. Tím propíchnete tobolku. Knoflíky uvolněte.

6. Vydechněte co nejvíce.

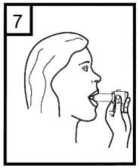
7.
Vložte náustek do úst a lehce zakloňte hlavu dozadu. Sevřete rty kolem náustku a vdechněte co nejrychleji a nejhlouběji, jak můžete.
8. Zadržte dech po dobu, po kterou vyjímáte náustek z úst, a poté dýchejte normálně. Otevřete inhalátor a podívejte se, zda v tobolce nezůstal prášek. Pokud v tobolce prášek zůstal, opakujte kroky 6 až 8.
9. Po použití vyjměte prázdnou tobolku a inhalátor zavřete.
Poznámka:
Je možné, že se z želatinové tobolky mohou uvolnit částečky, které se mohou při inhalaci dostat do úst nebo do krku. Želatina není škodlivá, v ústech změkne a může být polknuta. Riziko fragmentace tobolky je minimalizováno tím, že knoflíky zmáčknete pouze jednou a tobolka nebude perforována více než jednou.
Tobolky by měly zůstat v blistru až do použití a měly by být vyjmuty z blistru bezprostředně před použitím.
Čištění inhalátoru
Aby se odstranil reziduální prášek, je třeba čistit náustek i prostor pro tobolku suchým hadříkem. Rovněž lze použít čistý měkký kartáček.
4.3 Kontraindikace
Přecitlivělost na formoterol, laktosu (která obsahuje malé množství mléčných bílkovin) nebo na kteroukoli pomocnou látku přípravku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Formoterol se nesmí užívat (a není vhodný) jako lék první volby v léčbě astmatu.
Astmatičtí pacienti, kteří jsou pravidelně léčeni beta2-agonisty, by měli také pravidelně užívat odpovídající dávky protizánětlivého léku s kortikosteroidy. Pacienti musí být upozorněni, že v protizánětlivé léčbě mají pokračovat i po zahájení léčby formoterolem, a to i v případě zlepšení stavu. Pokud symptomy onemocnění přetrvávají nebo je třeba navýšit léčbu beta2-agonisty, znamená to zhoršení stavu základního onemocnění a lékař by měl antiastmatickou terapii přehodnotit.
I když je formoterol určen k přídatné léčbě astmatu v případě, že inhalační kortikosteroidy neposkytují dostatečnou kontrolu projevů astmatu, pacienti nesmí zahájit léčbu formoterolem při akutní těžké exacerbaci astmatu nebo při významném zhoršení astmatu nebo při akutní deterioraci astmatu.
V průběhu léčby formoterolem se mohou objevit závažné nežádoucí účinky související s astmatem a exacerbace astmatu. Jestliže se symptomy astmatu nedaří zvládnout nebo se zhoršují po zahájení léčby formoterolem, pacienti by neměli přerušovat léčbu, ale konzultovat svůj zdravotní stav s lékařem. Pokud se symptomy astmatu podaří zvládnout, lze zvážit postupné snižování dávky formoterolu. Důležité je pravidelné monitorování pacientů snižujících dávkování přípravku. Měla by být použita nejnižší účinná dávka formoterolu.
Maximální denní dávka nesmí být překročena. Dlouhodobá bezpečnost pravidelné léčby ve vyšších dávkách než 36 mikrogramů denně u dospělých s astmatem, 18 mikrogramů denně u dětí s astmatem a 18 mikrogramů denně u pacientů s chronickou obstrukční plicní nemocí nebyla stanovena.
Častá potřeba léčby (např. profylaktická léčba kortikosteroidy a dlouhodobě působícími beta2-agonisty) k prevenci námahou vyvolané bronchokonstrikce několikrát každý týden, navzdory přiměřené udržovací léčbě, může být známkou nedostatečné kontroly astmatu a vyžaduje přehodnocení antiastmatické léčby a zhodnocení odpovědi na léčbu.
Opatrnosti je zapotřebí při léčbě pacientů s thyreotoxikózou, feochromocytomem, hypertrofickou obstrukční kardiomyopatií, idiopatickou subvalvulární stenózou aorty, těžkou hypertenzí, aneurysmatem nebo dalšími závažnými kardiovaskulárními onemocněními, jako jsou ischemická choroba srdeční, tachyarytmie nebo těžké srdeční selhání.
Formoterol může způsobit prodloužení QTc intervalu. Opatrnost je zapotřebí u pacientů s prodloužením QTc intervalu a u pacientů léčených léky, které ovlivňují QTc interval (viz bod 4.5).
U pacientů s diabetem se vzhledem k hyperglykemickému účinku beta2-agonistů doporučují častější kontrolní vyšetření glykemie.
Léčba beta-2 agonisty může vést k potenciálně závažné hypokalémii. Zvláštní opatrnosti je třeba u akutního těžkého astmatu, jelikož hypoxiezvyšuje riziko hypokalémie. Hypokalemický účinek může být potencován současnou léčbou jinými léčivými přípravky, jako jsou xantinové deriváty, steroidy a diuretika. V takových situacích by měl být kontrolován draslík v séru.
Stej ně jako u jiné inhalační terapie, i zde je riziko paradoxního bronchospasmu. Pokud k tomu dojde, léčba musí být neprodleně přerušena a zahájena jiná vhodná léčba (viz bod 4.8).
Opatrnost, zejména při dávkování, je zapotřebí při léčbě pacientů s následujícími stavy:
• srdeční arytmie (např. atrioventrikulární blokáda III. stupně);
• arterioskleróza;
• hypertyreóza;
• nádor nadledvin;
• přípravek by neměl být podán méně než 12 hodin před narkózou halogenovanými anestetiky.
Formoterol by neměl být terapeuticky užíván v případě předčasného porodu nebo hrozícího potratu.
Opatrnosti je třeba při současném užívání theofylinu a formoterolu u pacientů s kardiálním onemocněním.
Pediatrická populace
Děti musí užívat tento přípravek pod dohledem dospělého. Formoterol není určen pro děti do 6 let, protože nejsou dostupné dostačující údaje pro tuto skupinu.
Tento léčivý přípravek obsahuje monohydrát laktosy (méně než 500 mikrogramů v podané dávce). Toto množství normálně nezpůsobuje potíže pacientům s intolerancí laktosy. Pacienti se vzácnými dědičnými poruchami, jako intolerance galaktosy, vrozený deficit laktasy nebo malabsorpce glukosy-galaktosy, by neměli tento lék užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné specifické studie interakcí s formoterolem.
Současné podání s jinými sympatomimetiky , jako jsou jiní beta2-agonisté nebo efedrin, může zesílit nežádoucí účinky formoterolu a může vyžadovat titraci dávky.
Při současné terapii deriváty xantinu, steroidy nebo diuretiky, jako jsou thiazidy a kličková diuretika, může dojít k umocnění vzácného hypokalemického nežádoucího účinku beta2-agonistů. Hypokalemie může zvýšit dispozici k srdečním arytmiím u pacientů, kteří j sou léčeni digitalisovými glykosidy.
Existuje teoretické riziko, že při současné terapii s jinými známými léky, které prodlužuj í QTc interval, se může zvyšovat riziko farmakodynamických interakcí s formoterolem a zvyšovat možné riziko vzniku komorových arytmií. Příklady takových léků zahrnují určitá antihistaminika (např. terfenadin, astemizol, mizolastin), určitá antiarytmika (např. chinidin, disopyramid, prokainamid), erythromycin a tricyklická antidepresiva.
U pacientů podstupujících současně anestezii halogenovanými uhlovodíky je zvýšené riziko arytmií. Bronchodilatační účinky formoterolu mohou být zesíleny anticholinergiky.
Beta-adrenergní blokátory mohou oslabit nebo antagonizovat účinek formoterolu. Proto formoterol nemá být podáván současně s beta-adrenergní mi blokátory (včetně očních kapek), pokud pro jejich užití nej sou nezbytné důvody.
Účinky formoterolu a inhibitorů monoaminooxidázy se mohou vzájemně ovlivňovat, proto by formoterol neměl být podáván pacientům užívajícím inhibitory monoaminooxidázy, ani do 14 dnů po ukončení léčby těmito látkami.
Zvýšení sympatomimetického účinku L-dopy, L-thyroxinu, oxytocinu a alkoholu může být potencováno současným podáváním formoterolu.
4.6 Těhotenství a kojení
Nejsou k dispozici odpovídající údaje o podávání formoterolu u těhotných žen. Ve studiích na zvířatech formoterol způsobil implantační ztráty stejně jako snížení časného postnatálního přežití a porodní hmotnosti. Účinky se objevily po značně vyšší systémové expozici, než která byla dosažena během klinického užívání formoterolu. Léčbu formoterolem lze zvážit ve všech stádiích těhotenství, pokud je potřeba získat kontrolu nad astmatem a jestliže očekávaná prospěšnost pro matku je větší než jakékoli možné riziko pro plod. Možné riziko pro těhotné není známo.
Kojení
Není známo, zda se formoterol vylučuje do mateřského mléka. Malé množství formoterolu bylo detekováno v mateřském mléce potkanů. O podání formoterolu kojícím ženám má být uvažováno, pouze pokud očekávaná prospěšnost pro matku je větší než jakékoli možné riziko pro dítě.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Formoterol nemá žádný vliv na schopnost řídit nebo obsluhovat stroje. Nežádoucí účinky, jako je třes a nervozita, mohou ovlivnit schopnost řízení a obsluhy stroj ů.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
Nej častěji hlášené nežádoucí účinky u terapie beta2-agonisty jsou třes a palpitace, mají sklon být mírné a vymizí během několika dnů léčby.
Seznam nežádoucích účinků
Nežádoucí účinky související s formoterolem jsou uvedeny níže, seřazeny podle tříd orgánových systémů a četnosti. Četnost nežádoucích účinků je seřazena následovně: velmi časté ( > 1/10), časté ( > 1/100 až < 1/10), méně časté ( > 1/1000 až < 1/100), vzácné ( > 1/10 000 až < 1/1000), velmi vzácné (< 1/10 000; včetně jednotlivých hlášených případů), není známo (z dostupných údajů nelze určit).
|
Poruchy imunitního systému Vzácné Velmi vzácné |
Reakce z přecitlivělosti, např. bronchospasmus, exantém, urtikarie, pruritus, těžká hypotenze, angioedém Periferní otoky |
|
Poruchy metabolismu a výživy Vzácné Velmi vzácné |
Hypokalémie/hyperkalémie Hyperglykémie |
|
Psychiatrické poruchy Méně časté |
Rozrušení, neklid, poruchy spánku |
|
Poruchy nervového systému Časté Méně časté Velmi vzácné |
Bolesti hlavy, třes Úzkost, nervozita, insomnie Poruchy chuti, závratě |
|
Srdeční poruchy Časté |
Palpitace |
|
Méně časté | |
|
Vzácné |
Srdeční arytmie, např. fibrilace síní, supraventrikulární tachykardie, extrasystoly |
|
Velmi vzácné |
Angina pectoris, prodloužení QTc intervalu |
|
Cévní poruchy Velmi vzácné |
Změny v krevním tlaku |
|
Respirační, hrudní a mediastinální poruchy Časté | |
|
Méně časté |
Zhoršení bronchospasmu |
|
Vzácné |
Paradoxní bronchospasmus |
|
Gastrointestinální poruchy | |
|
Méně časté |
Podráždění orofaryngu |
|
Vzácné |
Nausea |
|
Poruchy kůže a podkožní tkáně | |
|
Vzácné |
Urtikárie, svědění, exantém |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně | |
|
Méně časté |
Svalové křeče, myalgie |
Stejně jako u jiné inhalační terapie se velmi vzácně může objevit paradoxní bronchospasmus (viz bod 4.4).
Léčba beta2-agonisty může mít za následek zvýšené hladiny inzulinu, volných mastných kyselin, glycerolu a ketonů v krvi.
Pomocná látka laktosa obsahuje malé množství mléčných bílkovin. Ty mohou způsobit alergickou reakci.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Srobárova 48
100 41 Praha 10
Webové stránky: http: //www .sukl .cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Klinické zkušenosti s léčbou předávkování jsou omezené. Předávkování by pravděpodobně vedlo k účinkům, které jsou typické pro beta2 agonisty: třes, bolesti hlavy, somnolence, palpitace, metabolická acidóza, hypotenze. Příznaky hlášené z jednotlivých hlášených případů jsou tachykardie, hyperglykémie, hypokalémie, prodloužení QTc intervalu, arytmie, nauzea a zvracení. Je indikována podpůrná a symptomatická léčba.
Kardioselektivní beta-blokátor lze použít, ale pouze s mimořádnou opatrností, jelikož podání beta-adrenergních blokátorů může vyvolat bronchospasmus.
Je třeba monitorovat hladiny kalia v séru.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: selektivní agonisté beta-2-adrenoreceptorů;
ATC kód: R03AC13.
Formoterol je silný selektivní agonista beta-2 adrenergních receptorů. Formoterol vykazuje bronchodilatační efekt u pacientů s reverzibilní a ireverzibilní obstrukcí dýchacích cest. Účinek nastupuje rychle (do 1-3 minut) a je signifikantní ještě 12 hodin po inhalaci.
Formoterol inhibuje uvolňování histaminu a leukotrienů z pasivně senzibilizovaných lidských plic. V experimentech na zvířatech byly pozorovány jisté protizánětlivé vlastnosti, jako inhibice edémů a akumulace buněk aktivních při zánětu.
U lidí je dokázáno, že formoterol je účinný v prevenci bronchospasmu indukovaného inhalačními alergeny, fyzickou aktivitou, studeným vzduchem, histaminem a metacholinem.
Formoterol, inhalovaný v dávkách 12 a 24 pg dvakrát denně, má u pacientů se stabilní chronickou obstrukční plicní nemocí s reverzibilní nebo ireverzibilní komponentou prokázaný bronchodilatační účinek s rychlým nástupem, který přetrvává nejméně 12 hodin. Navíc, léčba způsobuje subjektivní zlepšení kvality života, což bylo hodnoceno za použití Saint Georges Respiratory Questionnaire.
5.2 Farmakokinetické vlastnosti
Absorpce:
Stejně, jak je popsáno u jiných inhalovaných léčivých látek, je pravděpodobné, že až 90 % podané dávky formoterolu je spolknuto a absorbováno ze zažívacího traktu. To znamená, že farmakokinetické charakteristiky pro perorální formy lze ve velké míře aplikovat na inhalační prášek. Po inhalaci terapeutických dávek nelze formoterol v plazmě za použití současných analytických metod detekovat.
Absorpce je rychlá a značná: Při dávkách vyšších než terapeutických (120 pg) je pozorován vrchol plazmatické koncentrace za 5 minut po inhalaci, zatímco nejméně 65 % ze značené 80 pg perorální dávky je absorbováno a perorální dávky do 300 pg jsou rychle absorbovány s vrcholem plazmatických koncentrací nezměněné substance za 0,5 až 1 hodinu. U pacientů s chronickou obstrukční plicní nemocí léčených 12 týdnů formoterol-fumarátem v dávkách 12 nebo 24 pg dvakrát denně byly plazmatické koncentrace v rozmezí 11,5-25,7 pmol/l a 23,3-50,3 pmol/l za 10 minut, 2 hodiny a 6 hodin po inhalaci.
Farmakokinetika formoterolu ve sledovaném dávkovacím intervalu (20-300 pg perorálně) je lineární. Opakované perorální podání 40-160 pg denně nevede k signifikantní akumulaci léčivé látky. Maximální míra vylučování po podání 12-96 pg je dosažena do 1-2 hodin po inhalaci.
Po 12-ti týdenním podávání formoterolu v dávkách 12 pg nebo 24 pg dvakrát denně byla urinární exkrece nezměněného formoterolu zvýšená o 63-73 % u dospělých a o 18-84 % u dětí, což svědčí o mírné a ustupující akumulaci formoterolu v plazmě po opakovaných dávkách.
Studie sledující kumulativní urinámí exkreci formoterolu a/nebo jeho (R, R) a (S, S) enaciomerů po podání inhalačního prášku (12-96 pg) a aerosolové formy (12-96 pg) ukazuje, že absorpce se zvyšuje lineárně s dávkou.
Distribuce:
61-64 % formoterolu se váže na plazmatické bílkoviny (34 % primárně na albuminy). V rozmezí koncentrací dosažených při terapeutických dávkách nedochází k saturaci vazebných míst.
Biotransformace:
Formoterol je eliminován zejména metabolizmem, přímá glukuronidace je hlavní cestou biotransformace a dále je to O-demetylace následována další glukuronidací. Transformaci katalyzují CYP450 izoenzymy (2D6, 2C19, 2C9 a 2A6) a tedy potenciál pro metabolické lékové interakce je nízký. Kinetika formoterolu je podobná po jednotlivé i opakovaných dávkách, což naznačuje, že nedochází k autoindukci nebo inhibici metabolizmu.
Eliminace:
Eliminace formoterolu z cirkulace je pravděpodobně polyfázická; poločas závisí na rozmezí sledovaného časového intervalu. Na základě koncentrací v plazmě nebo krvi za 6, 8 nebo 12 hodin po perorálním podán byl eliminační poločas 2-3 hodiny. Na základě rychlosti vylučování do moče mezi 3 - 16 hodinami po inhalaci byl poločas vylučování 5 hodin.
Údaje o kinetice formoterolu v plazmě a o míře urinární exkrece u zdravých dobrovolníků po inhalačním podání naznačují bifázickou eliminaci s poločasy (R, R) a (S, S)- enantiomerů 13,9 a 12,3 hodin.
Přibližně 6,4-8 % dávky formoterolu bylo vyloučeno močí v nezměněné formě s podílem (R, R) a (S, S)- enantiomerů 40 % a 60 %.
Po podání jednotlivé perorální dávky 3H-formoterolu bylo 59-62 % dávky vyloučeno močí a 32-34 % stolicí. Renální clearance formoterolu je 150ml/min.
U dospělých pacientů s astmatem bylo po opakovaných dávkách 12 a 24 pg přibližně 10 % a 15-18 % formoterolu vyloučeno močí v nezměněné nebo konjugované formě. U dětí bylo po opakovaných dávkách 12 a 24 pg přibližně 6 % a 6,5-9 % formoterolu vyloučeno mocí v nezměněné nebo konjugované formě. U zdravých dobrovolníků byl podíl (R, R) a (S, S)- enantiomerů přibližně 40 a 60 % v nezměněném formoterolu vylučovaném močí, a nebyla zde zjištěna relativní akumulace některého enantiomeru ani po opakovaném podání.
5.3 Předklinické údaje vztahující se k bezpečnosti přípravku
Účinky formoterolu pozorované ve studiích toxicity u potkanů a psů byly spojovány zejména s kardiovaskulárním systémem a zahrnovaly hyperémii, tachykardii, arytmie a myokardiální léze.
Tyto známé farmakologické účinky byly pozorovány po podání vysokých dávek beta2 agonistů.
Mutagenita:
Bylo prováděno široké spektrum testů na mutagenitu. V žádném z in-vitro nebo in-vivo testů nebyl prokázán genotoxický efekt.
Karcinogenita:
2leté studie na potkanech a myších neprokázaly žádný karcinogenní potenciál.
U myších samců léčených velmi vysokými dávkami formoterolu byla pozorována lehce vyšší incidence výskytu benigních adrenálních subkapsulárních tumorů. Předpokládá se, že je to projev změn ve fyziologickém procesu stárnutí.
Dvě studie na potkanech, které zahrnovaly dvě odlišná dávkovací rozmezí, prokázaly zvýšení počtu případů mesovariálních leiomyomů. Tato benigní neoplazmata jsou u potkanů typická v souvislosti s dlouhodobou léčbou vysokými dávkami beta-adrenegních léků. Podobně bylo pozorováno velké množství případů ovariálních cyst a benigních granulóza/tekálních tumorů; je známo, že beta-agonisté
působí na ovaria potkanů, což je pravděpodobně specifické pro hlodavce. Po vysokých dávkách se vyskytlo ještě několik typů dalších tumorů, ale jejich množství bylo v rozmezí, které bylo pozorováno při minulých kontrolách populace, a při experimentech s nízkými dávkami nebyly tyto tumory pozorovány.
Incidence výskytu žádného tumoru nebyla statisticky významně zvýšena při podávání nižší dávky; dávka, která zajišťovala 10x vyšší systémový účinek, než je očekáváno od maximální doporučené dávky formoterolu.
Na základě těchto zjištění, stej ně jako nepřítomnosti mutagenního potenciálu formoterolu, lze shrnout, že formoterol v terapeutických dávkách nevykazuje žádný karcinogenní účinek.
Reprodukční toxicita:
Údaje z experimentů na zvířatech - viz bod 4.6. Po perorálním podání je formoterol vylučován do mléka potkaních samic.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky: monohydrát laktosy (obsahuje malé množství mléčných bílkovin). Obal tobolky: želatina.
6.2 Inkompatibility Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C. Uchovávejte v původním vnitřním obalu.
6.5 Druh obalu a velikost balení
PVC + PVDC/Al blistr a jednodávkový inhalátor pro prášek k inhalaci.
Velikosti balení
1 inhalátor + 60 tobolek
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
ratiopharm GmbH, Graf-Arco-Strasse 3, 89079 Ulm, Německo
Souběžný dovozce :
Top Pharmex Topofčany, spol. s r.o., Odbojárov 340/29, 95501 Topofčany, Slovenská republika
8. REGISTRAČNÍ ČÍSLO(A) 14/162/04-C/PI/001/12
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
29.2.2012
10. DATUM REVIZE TEXTU
9.9.2015
11/11