Fluarix
zastaralé informace, vyhledat novějšísp. zn. sukls8873/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Virus chřipky (inaktivovaný, štěpený) obsahující následující kmeny*:
A/California/7/2009 (H1N1)pdm09 - použitá varianta kmene 15 mikrogramů HA** (NIB-74xp) odvozená z kmene A/Christchurch/16/2010
A/Texas/50/2012 (H3N2) použitá varianta kmene (NYMC X- 15 mikrogramů HA**
223A)
B/Massachusetts/02/2012 - použitá varianta kmene 15 mikrogramů HA**
(NYMC BX-51B)
v 1 dávce 0,5 ml.
* připraveno v oplodněných slepičích vejcích ze zdravých kuřecích chovů ** hemaglutinin
Vakcína vyhovuje doporučení Světové zdravotnické organizace (SZO) (pro severní polokouli) a doporučení EU pro sezónu 2014/2015.
Úplný seznam pomocných látek viz bod 6.1.
Fluarix může obsahovat stopy vaječné bílkoviny (jako je ovalbumin, kuřecí bílkoviny), formaldehyd, gentamicin-sulfát a natrium-deoxycholát, které jsou použity v průběhu výrobního procesu (viz bod 4.3).
3. LÉKOVÁ FORMA
Injekční suspenze v předplněné injekční stříkačce.
Suspenze je bezbarvá nebo slabě opaleskující.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Profylaxe chřipky, zejména u osob se zvýšeným rizikem přidružených komplikací. Fluarix je indikován u dospělých a dětí od 6 měsíce věku.
Fluarix se má používat podle oficiálních doporučení.
4.2 Dávkování a způsob podání
Podávání
Dospělí: 0,5 ml
Pediatrická populace
Děti od 36 měsíců věku a starší: 0,5 ml.
Děti od 6 do 35 měsíců věku: Údaje z klinického hodnocení jsou omezené. Může být podána dávka 0,25 ml nebo 0,5 ml, bližší informace pro podávání dávky 0,25 ml nebo 0,5 ml viz bod 6.6. Dávka má být podána podle existujících národních doporučení.
Dětem do 9 let věku, které dosud nebyly očkovány, by měla být podána druhá dávka. Interval mezi dávkami musí být nejméně 4 týdny.
Děti mladší než 6 měsíců: bezpečnost a účinnost vakcíny Fluarix u dětí mladších 6 měsíců nebyly stanoveny. Nejsou dostupná data.
Způsob podání
Vakcína se má aplikovat buď intramuskulárně, nebo hluboko subkutánně.
Při manipulaci nebo před podáním vakcíny je třeba dodržovat bezpečnostní opatření.
Návod k použití přípravku před podáním viz bod 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na kteroukoliv složku uvedenou jako stopová, např. vejce (ovalbumin, kuřecí bílkoviny), formaldehyd, gentamicin-sulfát a natrium-deoxycholát.
Očkování by mělo být odloženo u osob trpících horečnatým onemocněním nebo akutní infekcí.
4.4 Zvláštní upozornění a opatření pro použití
Podobně jako u všech injekčních vakcín musí být pro případ, že se po aplikaci vakcíny vyvine anafylaktická reakce, okamžitě dostupná odpovídající lékařská pomoc a dohled.
Vakcínu Fluarix nelze v žádném případě aplikovat intravaskulárně.
U pacientů s endogenní nebo iatrogenní imunosupresí může být protilátková odpověď na vakcinaci nedostatečná.
Zvláště u dospívajících se může objevit v průběhu očkování, nebo i před ním, synkopa (mdloba) jako psychogenní reakce na injekční stříkačku s jehlou. Synkopa může být během zotavování doprovázena různými neurologickými příznaky, jako jsou přechodné poruchy zraku, parestézie a tonicko-klonické křeče končetin. Je důležité předem zajistit, aby při eventuální mdlobě nemohlo dojít k úrazu.
Interference se sérologickými testy viz bod 4.5.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Fluarix lze podat současně s jinými vakcínami, tyto vakcíny však musí být aplikovány do různých končetin. Nežádoucí účinky při současné aplikaci s jinými vakcínami však mohou být výraznější.
Imunologická odpověď na vakcinaci může být snížena při současné imunosupresivní terapii.
Po vakcinaci proti chřipce byly pozorovány falešně pozitivní výsledky sérologických testů užívající metodu ELISA na stanovení protilátek proti HIV1, hepatitidě C a zejména proti HTLV1. Tyto falešně pozitivní výsledky v testech ELISA lze vyloučit technikou Western Blot. Přechodné falešné pozitivní reakce mohou být způsobeny odpovědí IgM na vakcinaci.
4.6 Fertilita, těhotenství a kojení
Inaktivované vakcíny proti chřipce mohou být použity v průběhu těhotenství. Ve srovnání s prvním trimestrem jsou od druhého a třetího trimestru dostupné větší soubory dat týkajících se bezpečnosti; avšak data získaná v průběhu celosvětového očkování inaktivovanými vakcínami proti chřipce nenaznačují, že by očkování mohlo mít nežádoucí účinky na plod a matku.
Kojení
Fluarix může být aplikován v období kojení.
Fertilita
Údaje týkající se fertility nejsou dostupné.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Fluarix nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
Bezpečnost trivalentních inaktivovaných vakcín proti chřipce je hodnocena v otevřených nekontrolovaných klinických studiích, které jsou prováděny v rámci každoroční aktualizace složení vakcíny. Do studií je zařazeno nejméně 50 dospělých ve věku od 18 do 60 let a nejméně 50 osob ve věku nad 61 let. Bezpečnost se vyhodnocuje v průběhu prvních tří dnů po očkování.
Seznam nežádoucích účinků
Nežádoucí účinky jsou uvedeny podle frekvence výskytu následovně:
velmi časté (> 1/10);
časté (> 1/100 až < 1/10);
méně časté (> 1/1 000 až < 1/100).
Údaje z klinických studií
|
Třídy orgánových systémů |
Velmi časté > 1/10 |
Časté > 1/100 až < 1/10 |
Méně časté > 1/1 000 až < 1/100 |
|
Poruchy nervového systému |
Bolest hlavy* |
|
Poruchy kůže a podkožní tkáně |
Pocení* | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Myalgie, artralgie* | ||
|
Celkové poruchy a reakce v místě aplikace |
Horečka, únava, svalový třes, nevolnost Místní reakce: bolest, zarudnutí, indurace, otok, ekchymóza* |
* Tyto reakce obvykle odezní bez léčby během 1 - 2 dnů.
Pediatrická populace
Ve třech klinických studiích byla zdravým dětem ve věku 6 měsíců až 17 let podána vakcína Fluarix (více než 3 500 dětem). V této věkové skupině byly hlášeny také následující nežádoucí účinky.
|
Třídy orgánových systémů |
Velmi časté > 1/10 |
Časté > 1/100 až < 1/10 |
Méně časté > 1/1 000 až < 1/100 |
|
Poruchy metabolismu a výživy |
Ztráta chuti k jídlu2 | ||
|
Psychiatrické poruchy | |||
|
Poruchy nervového systému |
Ospalost2, bolest hlavy3 | ||
|
Gastrointestinální poruchy |
Gastrointestinální příznaky3 | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Svalové bolesti3,’ bolest kloubů3 | ||
|
Celkové poruchy a reakce v místě aplikace |
'hlášeno u dětí ve věku od 6 měsíců do 17 let 2hlášeno u dětí ve věku od 6 měsíců do 6 let 3hlášeno u dětí ve věku od 6 let do 17 let
Postmarketingové údaje
Nežádoucí účinky hlášené při postmarketingovém sledování jsou, vedle reakcí pozorovaných během klinických studií, následující:
Poruchy krve a lymfatického systému:
Přechodná trombocytopenie, přechodná lymfadenopatie.
Poruchy imunitního systému:
Alergické reakce (příznaky včetně konjunktivitidy), vzácně vedoucí k šoku, angioedém.
Poruchy nervového systému:
Neuralgie, parestézie, febrilní křeče, neurologické poruchy, jako je encefalomyelitida, neuritida a syndrom Guillain-Barré.
Cévní poruchy:
Vaskulitida spojená ve velmi vzácných případech s přechodným postižením ledvin.
Poruchy kůže a podkožní tkáně:
Generalizované kožní reakce včetně svědění, kopřivky nebo nespecifické vyrážky.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv,
Šrobárova 48,
100 41 Praha 10,
webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek.
4.9 Předávkování
Je velmi nepravděpodobné, že by předávkování mělo za následek nežádoucí účinky.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcína proti chřipce, ATC kód: J07BB02.
Séroprotekce je obvykle dosaženo během 2 až 3 týdnů. Trvání postvakcinační imunity ke kmenům homologním nebo kmenům blízce příbuzným těm, které byly použity ve vakcíně, je rozdílné a pohybuje se od 6 do 12 měsíců.
5.2 Farmakokinetické vlastnosti
Neuplatňuje se.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních studií akutní toxicity, místní snášenlivosti, toxicity po opakovaném podávání, reprodukční a vývojové toxicity a farmakologické bezpečnosti, neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Chlorid sodný, dodekahydrát hydrogenfosforečnanu sodného, dihydrogenfosforečnan draselný, chlorid draselný, hexahydrát chloridu hořečnatého, tokoferol-hydrogen-sukcinát alfa, polysorbát 80, oktoxinol 10, voda na injekci.
6.2 Inkompatibility
Protože nejsou k dispozici studie kompatibility, nelze tuto vakcínu mísit s jinými léčivými přípravky.
6.3 Doba použitelnosti
1 rok.
6.4 Zvláštní opatření pro uchovávání
Uchovávat v chladničce (2 °C - 8 °C).
Vakcína nesmí být zmrazena.
Uchovávejte injekční stříkačku v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
0,5 ml injekční suspenze v předplněné injekční stříkačce (sklo třídy I) s pístem a uzavírací zátkou (butyl), s fixními nebo samostatnými jehlami nebo bez jehel v následujících velikostech balení:
- s fixní jehlou: v balení po 1, 10 nebo 20;
- s 1 samostatnou jehlou: v balení po 1, 10 nebo 20;
- se 2 samostatnými jehlami: v balení po 1;
- bez jehel: v balení po 1, 10 nebo 20.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Vakcína by měla mít před aplikací pokojovou teplotu.
Před aplikací je nutné vakcínu protřepat. Vakcína musí být před použitím vizuálně zkontrolována.
V případě, že se podává dávka 0,5 ml, musí být veškerý obsah injekční stříkačky aplikován najednou.
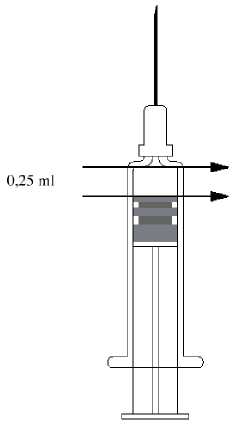
Pokyny k přípravě podání 0,25 ml vakcíny dětem od 6 měsíců do 35 měsíců
V případě, že se podává dávka 0,25 ml, musí být předplněná injekční stříkačka držena ve svislé poloze jehlou vzhůru a polovina objemu musí být odstraněna, až píst dosáhne vyznačenou linii na injekční stříkačce. V případě, že na injekční stříkačce není ryska vyznačena, je k usnadnění aplikace dávky 0,25 ml obrázek 1. Injekční stříkačka se k obrázku přiloží tak, aby horní okraj injekční stříkačky korespondoval s horní šipkou a píst se posune až k dolní šipce. Zatlačte píst stříkačky tak, aby dosáhl dolní šipky. Zbývající objem 0,25 ml může být aplikován.
Obrázek 1
Pokyny k podání vakcíny v předplněné injekční stříkačce bez fixní jehly Připojení jehly k injekční stříkačce viz obrázek 2.
stříkačka
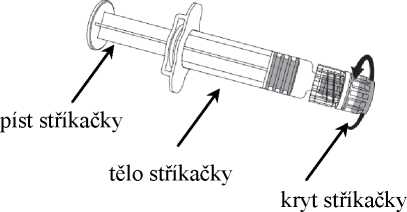
Obrázek 2
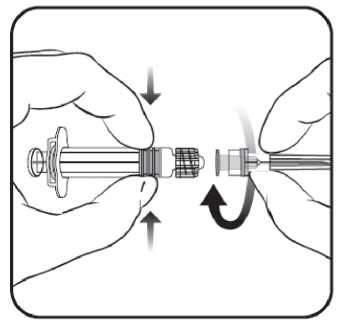
1. V jedné ruce držte tělo stříkačky (aniž byste ji drželi za píst stříkačky) a kryt stříkačky odšroubujte otáčením proti směru hodinových ručiček.
2. Jehlu ke stříkačce připevníte tak, že budete jehlou nasazenou na stříkačku otáčet po směru hodinových ručiček, dokud se nezamkne (viz obrázek 2).
3. Pak odstraňte ochranný kryt j ehly, což může j ít někdy poněkud ztuha.
4. Aplikujte vakcínu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
GlaxoSmithKline Biologicals s.a. Rue de llnstitute 89,
1330 Rixensart, Belgie.
8. REGISTRAČNÍ ČÍSLO(A)
59/1184/93-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 24.11.1993
Datum posledního prodloužení registrace: 2.11.2007
10. DATUM REVIZE TEXTU
22.4.2015
8