Fluarix Tetra
sp. zn. sukls144292/2016
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU
Fluarix Tetra, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaný)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Virus chřipky (inaktivovaný, štěpený) obsahující následující kmeny*:
15 mikrogramů HA** 15 mikrogramů HA** 15 mikrogramů HA** 15 mikrogramů HA**
A/California/7/2009 (H1N1)pdm09 - varianta kmene (A/Christchurch/16/2010, NIB-74xp)
A/Hong Kong/4801/2014 (H3N2) - varianta kmene (A/Hong Kong/4801/2014, NYMC X-263B)
B/Brisbane/60/2008 - varianta kmene (B/Brisbane/60/2008, divoký kmen)
B/Phuket/3073/2013 - varianta kmene (B/Phuket/3073/2013, divoký kmen)
v jedné 0,5ml dávce
* připraveno na oplodněných slepičích vejcích ze zdravých kuřecích chovů **hemaglutinin
Tato vakcína splňuje doporučení Světové zdravotnické organizace (SZO) (pro severní polokouli) a doporučení EU pro sezónu 2016/2017.
Pomocné látky se známým účinkem
Tento přípravek obsahuje v jedné dávce přibližně 3,75 mg chloridu sodného a přibližně 1,3 mg dodekahydrátu hydrogenfosforečnanu sodného (viz bod 4.4).
Tento přípravek obsahuje v jedné dávce přibližně 0,2 mg dihydrogenfosforečnanu draselného a přibližně 0,1 mg chloridu draselného (viz bod 4.4).
Vakcína Fluarix Tetra může obsahovat stopy vaječné bílkoviny (jako je ovalbumin, kuřecí proteiny), formaldehyd, gentamicin-sulfát a natrium-deoxycholát, které se používají v průběhu výrobního postupu (viz bod 4.3).
Úplný seznam pomocných látek viz bod 6.1.
Injekční suspenze v předplněné injekční stříkačce. Suspenze je bezbarvá nebo slabě opaleskující.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Vakcína Fluarix Tetra je indikována k aktivní imunizaci dospělých a dětí od 3 let věku k prevenci chřipky způsobené dvěma subtypy viru chřipky A a dvěma typy viru chřipky B obsaženými ve vakcíně.
Vakcína Fluarix Tetra se používá na základě oficiálních doporučení.
Protože imunita v průběhu roku po vakcinaci klesá a cirkulující kmeny chřipky se mohou rok od roku měnit, doporučuje se každý rok revakcinace aktuální vakcínou.
4.2 Dávkování a způsob podání
Dávkování
Dospělí: 0,5 ml
Pediatrická populace
Děti od 36 měsíců věku: 0,5 ml.
U dětí ve věku < 9 let, které nebyly dosud očkovány proti chřipce, je třeba podat druhou dávku s odstupem nejméně 4 týdnů.
Děti mladší 3 let: bezpečnost a účinnost vakcíny Fluarix Tetra u dětí mladších 3 let nebyla stanovena. Způsob podání
Imunizace se provádí intramuskulární injekcí.
Před manipulací s léčivým přípravkem a před jeho podáním je třeba dodržet příslušná opatření. Návod k přípravě tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na kteroukoli složku přípravku, která v něm může být přítomna ve stopovém množství, jako jsou vejce (ovalbumin, kuřecí proteiny), formaldehyd, gentamicin-sulfát a natrium-deoxycholát.
U pacientů s horečnatým onemocněním a s akutním infekčním onemocněním se musí imunizace odložit.
4.4 Zvláštní upozornění a opatření pro použití
Podle postupů správné klinické praxe předchází očkování shrnutí lékařské anamnézy (zejména s ohledem na předchozí očkování a možný výskyt nežádoucích příhod) a klinické vyšetření.
Stejně jako u všech injekčních vakcín má být pro případ anafylaktické příhody po podání vakcíny vždy okamžitě k dispozici odpovídající lékařská léčba a dohled.
Protilátková odpověď u pacientů s endogenní nebo iatrogenní imunosupresí může být nedostatečná.
Vakcína Fluarix Tetra není účinná proti všem možným kmenům chřipky. Vakcína Fluarix Tetra má poskytovat ochranu proti kmenům virů, ze kterých je připravená, a proti kmenům blízce příbuzným.
Stejně jako u jiných vakcín nemusí být imunitní odpověď vyvolána u všech očkovaných osob.
Vakcína Fluarix Tetra se za žádných okolností nesmí podat intravaskulárně.
Stejně jako jiné intramuskulárně podávané vakcíny se i vakcína Fluarix Tetra musí podávat s opatrností osobám s trombocytopenií nebo jakoukoli poruchou koagulace, protože u těchto osob může po intramuskulárním podání dojít ke krvácení.
Po jakémkoli očkování, nebo dokonce i před ním, může u některých osob dojít k synkopě (ztrátě vědomí), a to zejména u dospívajících pacientů s psychogenní reakcí na injekční jehlu. Tato reakce může být v období rekonvalescence doprovázena závažnými neurologickými příznaky, jako je přechodná porucha zraku, parestezie a tonicko-klonické záškuby končetin. Je důležité, aby očkování probíhalo za takových podmínek, aby se předcházelo poranění v průběhu případné ztráty vědomí.
Interference se sérologickými testy Viz bod 4.5.
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, je tedy prakticky bez sodíku.
Tento léčivý přípravek obsahuje méně než 1 mmol draslíku (39 mg) v jedné dávce, je tedy prakticky bez draslíku.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí. Pokud je potřeba vakcínu Fluarix Tetra podávat současně s jinou injekční vakcínou, je třeba tyto vakcíny podat vždy do různých injekčních míst.
Po očkování proti chřipce byly pozorovány falešně pozitivní výsledky sérologických testů používajících metodu ELISA k detekci protilátek proti viru HIV1, hepatitidy C a zejména HTLV1. Falešně pozitivní výsledky testů ELISA lze vyvrátit pomocí techniky Western Blot. Přechodné falešně pozitivní reakce se mohou objevit v důsledku protilátkové IgM odpovědi na vakcínu.
4.6 Fertilita, těhotenství a kojení
Inaktivované vakcíny proti chřipce lze použít ve všech stadiích těhotenství. Rozsáhlá databáze týkající se bezpečnosti je dostupná pro druhý a třetí trimestr (ve srovnání s prvním trimestrem), údaje z používání z celého světa však nenaznačují, že by inaktivovaná vakcína proti chřipce negativně ovlivňovala fetální vývoj nebo zdravotní stav matky v souvislosti s vakcínou.
Kojení
Vakcínu Fluarix Tetra lze použít v průběhu kojení.
Fertilita
Údaje týkající se fertility nejsou k dispozici.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Vakcína Fluarix Tetra nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky Klinické studie
Souhrn bezpečnostního profilu
Ve dvou klinických studiích byla vakcína Fluarix Tetra nebo vakcína Fluarix (trivalentní vakcína proti chřipce od společnosti GlaxoSmithKline) podávána zdravým dospělým ve věku 18 let a starším a zdravým dětem ve věku 3 až 17 let. Vakcína Fluarix Tetra byla podána více než 3 000 dospělých a 900 dětí a vakcína Fluarix pak více než 1 000 dospělých a 900 dětí.
U osob očkovaných vakcínou Fluarix Tetra a vakcínou Fluarix byl pozorován podobný výskyt vyžádaných nežádoucích účinků.
Ve všech věkových skupinách byla nejčastěji hlášeným lokálním nežádoucím účinkem po očkování bolest v místě vpichu injekce (36,4 % až 40,9 %).
U dospělých ve věku 18 let a starších byly nejčastěji hlášenými nežádoucími účinky po očkování únava (11,1 %), bolest hlavy (9,2 %) a myalgie (11,8 %).
U subjektů ve věku od 6 do 17 let byly nejčastěji hlášenými nežádoucími účinky po očkování únava (12,6 %), myalgie (10,9 %) a bolest hlavy (8,0 %).
U subjektů ve věku od 3 do 5 let byly nejčastěji hlášenými obecnými nežádoucími účinky po očkování ospalost (9,8 %) a iritabilita (11,3 %).
Seznam nežádoucích účinků
Nežádoucí účinky hlášené u vakcíny Fluarix Tetra jsou uvedeny podle následujících kategorií četností na jednu dávku:
Velmi časté: > 1/10 Časté: > 1/100 až < 1/10 Méně časté: > 1/1 000 až < 1/100 Vzácné: > 1/10 000 až < 1/1 000 Velmi vzácné: < 1/10 000
Poruchy metabolismu a výživy Časté: ztráta chuti k jídlu1;
Psychiatrické poruchy Velmi časté: podrážděnost1;
Poruchy nervového systému Časté: ospalost1, bolest hlavy;
Méně časté: závrať2;
Gastrointestinální poruchy
Časté: gastrointestinální příznaky (zahrnující nauzeu, zvracení, průjem a/nebo bolest břicha);
Poruchy kůže a podkožní tkáně Méně časté: vyrážka3;
Poruchy svalové a kosterní soustavy a pojivové tkáně Velmi časté: myalgie;
Časté: artralgie;
Celkové poruchy a reakce v místě aplikace Velmi časté: bolest v místě vpichu injekce, únava;
Časté: zarudnutí v místě vpichu injekce4, otok v místě vpichu injekce4, třes, horečka;
Méně časté: hematom v místě vpichu injekce2, pruritus v místě vpichu injekce.
'hlášené jako vyžádaný příznak u subjektů mladších 6 let;
2hlášené u dospělých subjektů;
3hlášené u subjektů ve věku od 3 do 17 let;
4velmi časté u subjektů ve věku od 3 do 17 let.
Následující nežádoucí účinky byly hlášeny navíc v předchozích studiích s vakcínou Fluarix:
Poruchy kůže a podkožní tkáně Časté: pocení;
Celkové poruchy a reakce v místě aplikace Časté: indurace v místě vpichu injekce.
Údaje po uvedení přípravku na trh
Následující nežádoucí účinky, které byly pozorovány po uvedení na trh vakcíny Fluarix, se mohou vyskytnout i u pacientů po podání vakcíny Fluarix Tetra, protože všechny tři kmeny chřipky obsažené ve vakcíně Fluarix jsou zahrnuty ve vakcíně Fluarix Tetra.
Poruchy krve a lymfatického systému Vzácné: přechodná lymfadenopatie;
Poruchy imunitního systému
Vzácné: alergické reakce (včetně anafylaktických reakcí);
Poruchy nervového systému
Vzácné: neuritida, akutní diseminovaná encefalomyelitida, syndrom Guillain-Barré*.
*Po očkování vakcínou Fluarix byla zaznamenána spontánní hlášení syndromu Guillain-Barré, kauzální vztah mezi vakcinací a syndromem Guillain-Barré však nebyl stanoven.
Poruchy kůže a podkožní tkáně
Vzácné: kopřivka, pruritus, erytém, angioedém;
Celkové poruchy a reakce v místě aplikace Vzácné: chřipkovité onemocnění, malátnost.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv,
Šrobárova 48,
100 41 Praha 10,
webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek.
4.9 Předávkování
Neočekává se, že by předávkování mělo nějaké nepříznivé účinky.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcína proti chřipce, ATC kód: J07BB02 Mechanismus účinku
Vakcína Fluarix Tetra poskytuje aktivní imunizaci proti čtyřem kmenům viru chřipky (dva subtypy A a dva typy B) obsaženým v této vakcíně.
Vakcína Fluarix Tetra indukuje tvorbu humorálních protilátek proti hemaglutininům. Tyto protilátky neutralizují viry chřipky.
Specifické hladiny titru hemaglutinačně inhibičních (HI) protilátek po očkování inaktivovaným virem chřipky nebyly korelovány s ochranou proti chřipce, ale titry HI protilátek byly použity k měření aktivity vakcíny. V některých studiích vystavení antigenu u člověka byl titr HI protilátek > 1:40 spojován s ochranou proti onemocnění chřipkou až u 50 % subjektů.
Farmakodynamické účinky
Imunogenicita vakcíny Fluarix Tetra v porovnání s vakcínou Fluarix
Klinické studie provedené u dospělých pacientů (D-QIV-001 a D-QIV-008) a u dětí ve věku od 3 do 17 let (D-QIV-003) hodnotily non-inferioritu vakcíny Fluarix Tetra vůči vakcíně Fluarix u geometrického průměru titru HI protilátek (GMT) 21. den (u dospělých) a 28. den (u dětí) a výskyt HI sérokonverze (4násobné zvýšení recipročního titru nebo změna od nedetekovatelných hodnot [< 10] k recipročnímu titru > 40).
Ve všech studiích byla imunitní odpověď vyvolaná vakcínou Fluarix Tetra proti třem společným kmenům non-inferiorní vůči vakcíně Fluarix. Vakcína Fluarix Tetra vyvolala superiorní imunitní odpověď i proti dalšímu kmenu B zahrnutému ve vakcíně Fluarix Tetra ve srovnání s vakcínou Fluarix.
Dospělí ve věku 18 let a starší
V klinické studii D-QIV-008 dostalo přibližně 1 800 dospělých ve věku 18 let a starších jednu dávku vakcíny Fluarix Tetra a přibližně 600 subjektů dostalo jednu dávku vakcíny Fluarix.
Tabulka 1: Postvakcinační GMT a výskyt sérokonverze
|
Dospělí ve věku 18 let a |
Fluarix Tetra |
Fluarix1 |
|
starší |
N = 1 809 |
N = 608 |
|
GMT (95% interval spolehlivosti) | ||
|
A/H1N1 |
201,1 (188,1; 215,1) |
218,4 (194,2; 245,6) |
|
A/H3N2 |
314,7 (296,8; 333,6) |
298,2 (268,4; 331,3) |
|
B (Victoria)2 |
404,6 (386,6; 423,4) |
393,8 (362,7; 427,6) |
|
B (Yamagata)3 |
601,8 (573,3; 631,6) |
386,6 (351,5; 425,3) |
|
Výskyt sérokonverze (95% interval spolehlivosti) | ||
|
A/H1N1 |
77,5 % (75,5; 79,4) |
77,2 % (73,6; 80,5) |
|
A/H3N2 |
71,5 % (69,3; 73,5) |
65,8 % (61,9; 69,6) |
|
B (Victoria) |
58,1 % (55,8; 60,4) |
55,4 % (51,3; 59,4) |
|
B (Yamagata) |
61,7 % (59,5; 64,0) |
45,6 % (41,6; 49,7) |
'obsahuje A/H1N1, A/H3N2 a B (linie Victoria)
2kmen doporučený WHO v průběhu sezóny 2010-2011
3další kmen B obsažený ve vakcíně Fluarix Tetra doporučený v sezóně 2008-2009
Výskyt séroprotekce po očkování (21. den, reciproční titr > 40) u vakcíny Fluarix Tetra byl 91,3 % proti kmenu A/H1N1, 96,8 % proti A/H3N2, 98,8 % proti B (Victoria) a 91,8 % proti B (Yamagata).
V klinické studii D-QIV-001 (složení vakcíny pro sezónu 2007-2008) byl výskyt postvakcinační séroprotekce u vakcíny Fluarix Tetra 92,3 % proti kmenu A/H1N1, 97,1 % proti A/H3N2, 97,1 % proti B (Victoria) a 98,1 % proti B (Yamagata).
Děti ve věku od 3 do 17 let
V klinické studii (D-QIV-003) dostalo přibližně 900 dětí ve věku od 3 do 17 let jednu nebo dvě dávky vakcíny Fluarix Tetra nebo vakcíny Fluarix.
Tabulka 2: Postvakcinační GMT a výskyt sérokonverze
|
Děti ve věku od 3 do 17 let |
Fluarix Tetra N = 791 |
Fluarix1 N = 818 |
|
GMT (95% interval spolehlivosti) | ||
|
A/H1N1 |
386,2 (357,3; 417,4) |
433,2 (401,0; 468,0) |
|
A/H3N2 |
228,8 (215,0; 243,4) |
227,3 (213,3; 242,3) |
|
B (Victoria)2 |
244,2 (227,5; 262,1) |
245,6 (229,2; 263,2) |
|
B (Yamagata)3 |
569,6 (533,6; 608,1) |
224,7 (207,9; 242,9) |
|
Výskyt sérokonverze (95% interval spolehlivosti) | ||
|
A/H1N1 |
91,4 % (89,2; 93,3) |
89,9 % (87,6; 91,8) |
|
A/H3N2 |
72,3 % (69,0; 75,4) |
70,7 % (67,4; 73,8) |
|
B (Victoria) |
70,0 % (66,7; 73,2) |
68,5 % (65,2; 71,6) |
|
B (Yamagata) |
72,5 % (69,3; 75,6) |
37,0 % (33,7; 40,5) |
1obsahuje A/H1N1, A/H3N2 a B (linie Victoria)
2kmen doporučený WHO v průběhu sezóny 2010-2011
3další kmen B obsažený ve vakcíně Fluarix Tetra doporučený v sezóně 2008-2009
Výskyt postvakcinační séroprotekce u vakcíny Fluarix Tetra byl 96,6 % proti A/H1N1, 98,0 % proti A/H3N2, 97,3 % proti B (Victoria) a 99,2 % proti B (Y amagata).
Klinická studie provedená u více než 7 600 subjektů v České republice a Finsku hodnotila účinnost vakcíny Fluarix v prevenci případů kultivačně potvrzené chřipky typu A a/nebo B pro kmeny antigenně shodné s kmeny ve vakcíně.
Subjekty byly monitorovány s ohledem na chřipkovité onemocnění, aby mohlo být potvrzeno kultivačně (výsledky viz tabulka níže). Chřipkovité onemocnění bylo definováno jako alespoň jeden obecný příznak (horečka > 37,8°C a/nebo myalgie) a alespoň jeden respirační příznak (kašel a/nebo bolest v krku).
Tabulka 3: Výskyt onemocnění a účinnost vakcíny proti onemocnění souvisejícímu s průkazem infekce chřipky typu A nebo B u dospělých ve věku od 18 do 64 let (kohorta všech očkovaných subjektů)
|
Výskyt onemocnění (n/N)1 |
Účinnost vakcíny (95% CI2) | |||||
|
N |
n |
% |
% |
LL3 |
UL | |
|
Antigenní shoda, kultivačně potvrzená chřipka4 | ||||||
|
Fluarix™ |
5 103 |
49 |
1,0 |
66,9 |
51,9 |
77,4 |
|
Placebo |
2 549 |
74 |
2,9 |
- |
- |
- |
|
Všechny chři |
pky potvrzené kultivačně (se shodou, bez shody nebo bez stanovení typu viru)5 | |||||
|
Fluarix™ |
5 103 |
63 |
1,2 |
61,6 |
46,0 |
72,8 |
|
Placebo |
2 549 |
82 |
3,2 |
- |
- |
- |
'n/N: počet případů/celkový počet subjektů 2CI: interval spolehlivosti 3LL: dolní limit
4Nebyly kultivačně potvrzené případy chřipky odpovídající kmenům chřipky typu A/New Caledonia/20/1999 (H1N1) nebo B/Malaysia/2506/2004 ve skupině s vakcínou Fluarix nebo placebem 5Z 22 dalších případů bylo 18 bez shody a 4 bez určení typu; 15 z 22 případů bylo A (H3N2) (11 případů ve skupině s vakcínou Fluarix a 4 případy ve skupině s placebem).
V této studii byla hodnocena rovněž imunogenicita.
Tabulka 4: Postvakcinační GMT a výskyt sérokonverze
|
Dospělí ve věku od 18 do 64 let |
Fluarix1 N = 291 |
|
GMT (95% interval spolehlivosti) | |
|
A/H1N1 |
541,0 (451,0; 649,0) |
|
A/H3N2 |
133,2 (114,6; 154,7) |
|
B (Victoria) |
242,8 (210,7; 279,7) |
|
Výskyt sérokonverze (95% interval spolehlivosti) | |
|
A/H1N1 |
76,3 % (71,0; 81,1) |
|
A/H3N2 |
73,9 % (68,4; 78,8) |
|
B (Victoria) |
85,2 % (80,6; 89,1) |
1obsahuje A/H1N1, A/H3N2 a B (linie Victoria)
Výskyt séroprotekce byl 97,6 % proti A/H1N1, 86,9 % proti A/H3N2 a 96,2 % proti B (Victoria).
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s vakcínou Fluarix Tetra u jedné nebo více podskupin pediatrické populace v prevenci chřipky způsobené dvěma subtypy viru A a dvěma typy viru B obsaženými ve vakcíně (informace o použití u dětí viz bod 4.2).
Neuplatňuje se.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií akutní toxicity, lokální snášenlivosti, toxicity po opakovaném podávání a reprodukční/vývojové toxicity neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Chlorid sodný, dodekahydrát hydrogenfosforečnanu sodného, dihydrogenfosforečnan draselný, chlorid draselný, hexahydrát chloridu hořečnatého, tokoferol-hydrogen-sukcinát alfa, polysorbát 80, oktoxinol 10 a voda na injekci.
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
1 rok.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
0,5 ml injekční suspenze v předplněné injekční stříkačce (sklo třídy I) s pístem (šedá butylová pryž), s fixními nebo samostatnými jehlami nebo bez jehel v následujících velikostech balení:
- s fixní jehlou: v balení po 1 nebo po 10;
- s 1 samostatnou jehlou: v balení po 1 nebo po 10;
- se 2 samostatnými jehlami: v balení po 1;
- bez jehel: v balení po 1 nebo po 10.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Vakcína má mít před aplikací pokojovou teplotu.
Před aplikací protřepejte. Před podáním vizuálně zkontrolujte.
Pokyny k podání vakcíny v předplněné injekční stříkačce bez fixní jehly
Připojení jehly k injekční stříkačce viz níže přiložený popis.
Jehla
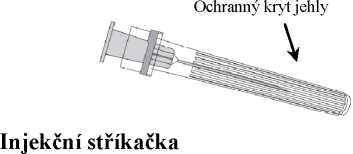
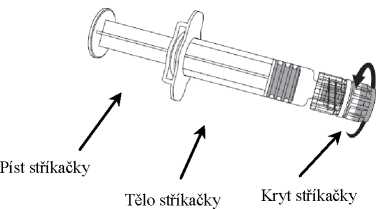
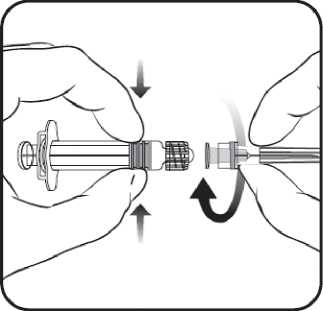
1. V jedné ruce držte tělo stříkačky (aniž byste držel(a) píst stříkačky) a kryt stříkačky odšroubujte otáčením proti směru hodinových ručiček.
2. Jehlu ke stříkačce připevníte tak, že budete jehlou nasazenou na stříkačku otáčet po směru hodinových ručiček, dokud se nezamkne (viz obrázek).
3. Pak odstraňte ochranný kryt jehly, což může jít někdy poněkud ztuha.
4. Aplikujte vakcínu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals s.a.
Rue de lInstitute 89,
1330 Rixensart, Belgie.
8. REGISTRAČNÍ ČÍSLO(A)
59/145/14-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 23. 4. 2014 Datum posledního prodloužení registrace:
10. DATUM REVIZE TEXTU
15.6.2016
10