Fibrovein 2 Mg/Ml Solution For Injection
Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls181237/2009, sukls181238/2012, sukls181239/2009, 181240/2009
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
Fibrovein 2 mg/ml Solution for Injection Fibrovein 5 mg/ml Solution for Injection Fibrovein 10 mg/ml Solution for Injection Fibrovein 30 mg/ml Solution for Injection
Natrii tetradecylis sulfas Injekční roztok
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků v závažné míře, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci.
Co naleznete v této příbalové informaci:
1. Co je Fibrovein a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete Fibrovein používat
3. Jak se Fibrovein používá
4. Možné nežádoucí účinky
5. Jak Fibrovein uchovávat
6. Obsah balení a další informace
1. CO JE FIBROVEIN A K ČEMU SE POUŽÍVÁ
Tento přípravek se jmenuje Fibrovein a jeho léčivou látkou je natrium-tetradecyl-sulfát.
Různé lékové síly Fibroveinu se používají při léčbě křečových žil a žilek, metliček a rozšířených žilek.
Tento injekční přípravek patří do skupiny léků nazývaných sklerotizující látky. Jedná se o chemické látky, které při vstříknutí do postižené žíly způsobují nabobtnání její výstelky a slepení žilních stěn. Tím se zastaví krevní zásobování žíly a ta se mění na jizevnatou tkáň. Do několika týdnů by měla žíla vymizet.
Fibrovein je určen pouze pro dospělé (včetně seniorů).
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE FIBROVEIN POUŽÍVAT Nepoužívejte Fibrovein:
• jestliže jste alergický(á) na natrium-tetradecyl-sulfát nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6)
• jestliže z jakéhokoli důvodu nejste schopen(a) chůze
• jestliže trpíte těžkým zánětem žil v dolních končetinách (akutní flebitida)
• jestliže se v žilách tvoří krevní sraženiny (trombóza)
• jestliže vám hrozí vznik krevních sraženin v žilách z těchto důvodů:
• dědičné poruchy krve, například trombofilie
• výrazná nadváha
• dlouhodobá nepohyblivost
• užívání hormonální antikoncepce nebo hormonální substituční terapie
• jestliže kouříte
• jestliže jste nedávno prodělal(a) operaci
• jestliže se u vás nedávno objevily krevní sraženiny v povrchových nebo hlubokých žilách nebo v plicích
• jestliže u vás dochází k rozvoji nádorového onemocnění
• jestliže máte zkroucené (křečové) žíly způsobené nádory v pánvi nebo břiše, pokud nádor nebyl odstraněn
• jestliže trpíte jakoukoli infekcí
• jestliže trpíte nekompenzovanou chorobou, například diabetem, astmatem, krevní abnormalitou, otravou krve nebo se u vás nedávno objevily kožní nebo dýchací obtíže
• jestliže trpíte závažným srdečním onemocněním
• jestliže trpíte výrazným hromaděním tekutiny v plicích, která způsobuje dušnost
• jestliže došlo k ucpání některé tepny
• jste byl(a) informován(a), že máte potíže s uzavřením chlopní v hlubokých žilách (valvulární insuficience)
• jestliže máte v srdci otvor, který působí potíže (pouze v případě, že je přípravek používán ve formě pěny)
Před použitím přípravku Fibrovein se poraďte s lékařem, jestliže:
• jste alergický(á) na jakoukoli potravinu, lék nebo cokoli jiného; pak lékaře informujte před podáním injekce, aby vám mohl 24 hodin před další terapií podat zkušební dávku
• jste byl(a) informován(a), že trpíte některým onemocněním žil nebo tepen (aterosklerózou)
• se u vás v minulosti objevily krevní sraženiny v povrchových nebo hlubokých žilách nebo v plicích
• trpíte těžkým zánětem a vznikem krevních sraženin v tepnách a žilách, a to s postižením rukou a nohou (Buergerova choroba)
• máte jakékoli dechové obtíže (astma)
• jste byl(a) informován(a), že je nutno některou chlopeň v cévě opravit operativně
• máte v srdci otvor (například mezi pravou a levou komorou srdeční)
• trpíte migrénou
• jste v minulosti trpěl(a) plicní hypertenzí
• jste prodělal(a) mozkovou (cévní nebo jinou) příhodu
Fibrovein smí podávat pouze zkušený zdravotník obeznámený s žilní anatomií a správným podáváním injekcí. Před podáním této injekce pravděpodobně absolvujete vyšetření, zda nemáte potíže s uzavíráním chlopní v žilách.
Lékař se vás zeptá na zdravotní stav a informuje vás o možných nežádoucích účincích tohoto výkonu.
Lékař vás také bude během sklerotizace a po ní sledovat, zda nejevíte známky přecitlivělosti (zarudnutí, svědění, kašel) nebo se neobjeví neurologické potíže (poruchy vidění, migréna, mravenčení nebo necitlivost).
Lékař vás požádá, abyste se dostavili na kontrolu.
Další léčivé přípravky a Fibrovein
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo které jste v nedávné době užíval(a), a to i o lécích, které jsou dostupné bez lékařského předpisu.
Těhotenství a kojení
Informujte lékaře, jestliže:
• jste těhotná nebo máte na těhotenství podezření
2/9
• plánujete těhotenství
• kojíte
O podávání přípravku Fibrovein těhotným ženám nejsou dostatečné informace. Fibrovein nemá být během těhotenství podáván, pokud to není nezbytně nutné. Vhodnost této léčby posoudí lékař.
Není známo, zda se Fibrovein vylučuje do lidského mateřského mléka. Pokud kojíte, lékař zváží, zda lze přípravek použít.
Řízení dopravních prostředků a obsluha strojů
Po podání injekce možná budete muset nosit obvaz nebo kompresivní punčochy k omezení zánětu a pigmentace kůže, což může zkomplikovat řízení vozidel.
3. JAK SE FIBROVEIN POUŽÍVÁ
Fibrovein si nesmíte podávat sami. Vždy jej musí podat zkušený lékař, obeznámený se správným způsobem podání injekce.
Přípravek se podává do postižené žíly nejtenčí možnou jehlou a musí být vstřikován pomalu a s maximální opatrností tak, aby z žíly vytlačil krev. Lék lze manuálně, pomocí dvou stříkaček a konektoru, smísit se vzduchem, a vytvořit tak pěnu, která lépe krev vytlačí z větších žil. V takovém případě jej musí podávat lékař náležitě vyškolený ve správném vytváření a podávání pěny.
Lékař by měl při ošetření neviditelných křečových žil a podávání přípravku ve formě pěny postup kontrolovat pomocí ultrazvuku.
Lékař rozhodne o ošetřovaných oblastech a vhodné dávce. Obvyklé dávky jsou:
Dospělí a starší osoby
• V rozsahu 0,1-2 ml na injekci. Při použití některé ze tří nižších lékových sil lze podat maximálně 10 ml, u nejsilnější varianty však ne více než 4 ml.
Vzhledem k tomuto omezení dávky je možné, že bude třeba aplikaci přípravku opakovat.
Děti
• Fibrovein není určen k podávání dětem.
Po obdržení dávky přípravku Fibrovein dodržujte pokyny lékaře. Možná budete muset nosit obvaz nebo kompresivní punčochy k omezení zánětu a pigmentace kůže.
4. MOŽNÉ NEŽÁDOUCÍ ÚČINKY
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Nejzávažnějším nežádoucím účinkem je velmi silná forma alergická reakce (anafylaktický šok), která je nesmírně vzácná. Při ní je nutný okamžitý léčebný zásah, jinak může končit smrtí. Mohou se také vytvářet krevní sraženiny v plicích. K zamezení této velmi vzácné, ale nebezpečné situace je tento přípravek kontraindikován u pacientů ohrožených vznikem sraženin v žilách a tepnách (pacienti s rizikem trombózy).
Nejčastějšími nežádoucími účinky jsou bolesti v místě injekce, zarudlá svědící kůže (kopřivka), dočasné zabarvení kůže a povrchová tromboflebitida (krevní sraženina v povrchové žíle).
Další možné nežádoucí účinky:
Časté (přinejmenším u jednoho ze 100, ale u méně než 1 z 10 pacientů):
bolest nebo pálení (krátkodobě v místě injekce), změna barvy kůže, povrchový zánět žíly,
vznik droboučkých rozšířených žilek v ošetřované oblasti,
Méně časté (přinejmenším u 1 z 1 000, ale u méně než 1 ze 100 pacientů):
místní alergické a nealergické kožní reakce, například zarudnutí, svědění nebo otok kůže, vyrážka, vznik krevních sraženin v hlubokých žilách (hluboká žilní trombóza možná způsobená základním onemocněním),
poruchy vidění (při podávaní přípravku v podobě pěny)
Vzácné (přinejmenším u 1 z 10 000, ale u méně než 1 z 1 000 pacientů):
lokální odumírání kůže a vzácněji nervů, kašlání, dušnost, tlak či pocit tísně na prsou, pálení, mravenčení, píchání nebo svědění kůže, bolest hlavy, migréna, pocit na omdlení, zmatenost, závratě, ztráta vědomí,
Velmi vzácné (u méně než 1 z 10 000 pacientů):
horečka, návaly horka, astma, zrudnutí a svědění pokožky (kopřivka) nebo těžká alergické reakce (anafylaktický šok),
nevolnost, zvracení, průjem, pocit oteklého (zvětšeného) jazyka, suchá ústa, poruchy vidění (při podávaní přípravku v podobě kapaliny), slabost, příznaky podobné cévní mozkové příhodě (mrtvici),
ucpání některé tepny krevní sraženinou (cévní mozková příhoda, tranzitorní ischemická ataka, plicní embolie),
zánět cév, selhání krevního oběhu, odumření tkáně po injekci do tepny.
Pokud si všimnete jakéhokoliv závažného nežádoucího účinku nebo máte podezření, že na Vás přípravek špatně působí, informujte ihned svého lékaře nebo lékárníka.
5. JAK FIBROVEIN UCHOVÁVAT
Uchovávejte mimo dosah a dohled dětí.
• Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
• Chraňte před mrazem.
• Uchovávejte ampulky/lahvičky v krabičce, aby byl přípravek chráněn před světlem.
• Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Pouze k jednorázovému použití. Po otevření lahvičky její obsah ihned použijte. Jakýkoli nepoužitý přípravek zlikvidujte.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. OBSAH BALENÍ A DALŠÍ INFORMACE
Co Fibrovein obsahuje
Léčivou látkou je: natrii tetradecylis sulfas (natrium-tetradecyl-sulfát).
Koncentrace 0,2 %:
Jeden ml injekčního roztoku obsahuje 2 mg natrii tetradecylis sulfas.
Jedna 5 ml injekční lahvička obsahuje 10 mg natrii tetradecylis sulfas.
Koncentrace 0,5 %:
Jeden ml injekčního roztoku obsahuje 5 mg natrii tetradecylis sulfas.
Jedna 2 ml injekční ampulka obsahuje 10 mg natrii tetradecylis sulfas.
Koncentrace 1 %:
Jeden ml injekčního roztoku obsahuje 10 mg natrii tetradecylis sulfas.
Jedna 2 ml injekční ampulka obsahuje 20 mg natrium-tetradecyl-sulfátu.
Koncentrace 3 %:
Jeden ml injekčního roztoku obsahuje 30 mg natrii tetradecylis sulfas.
Jedna 2 ml injekční ampulka obsahuje 60 mg natrii tetradecylis sulfas.
Jedna 5 ml injekční lahvička obsahuje 150 mg natrii tetradecylis sulfas.
Pomocnými látkami jsou: benzylalkohol (20 mg/ml), dodekahydrát hydrogenfosforečnanu sodného, dihydrogenfosforečnan draselný, voda na injekci, hydroxid sodný (k úpravě pH).
Jak Fibrovein vypadá a co obsahuje toto balení
Tento léčivý přípravek je dodáván jako injekční roztok v ampulkách nebo injekčních lahvičkách z čirého skla. Roztok je čirý a bezbarvý.
Koncentrace 0,2 %: velikost balení 2, 5 nebo 10 injekčních lahviček po 5 ml Koncentrace 0,5 %: velikost balení 5 ampulek po 2 ml Koncentrace 1 %: velikost balení 5 ampulek po 2 ml
Koncentrace 3 %: velikost balení 5 ampulek po 2 ml nebo 2, 5 nebo 10 injekčních lahviček po 5 ml Na trhu nemusí být všechny velikosti balení.
Držitel rozhodnutí o registraci:
STD Pharmaceutical Products Ltd.
Plough Lane, Hereford, HR4 0EL, Velká Británie
Výrobce:
STD Pharmaceutical Products Ltd.
Plough Lane, Hereford, HR4 0EL, Velká Británie
Tato příbalová informace byla naposledy revidována: 19.12.2012
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Fibrovein 2 mg/ml Solution for Injection Fibrovein 5 mg/ml Solution for Injection Fibrovein 10 mg/ml Solution for Injection Fibrovein 30 mg/ml Solution for Injection
Další informace k přípravku najdete v Souhrnu údajů o přípravku.
Kvalitativní a kvantitativní složení
Fibrovein 0,2 % injekční roztok
Jeden ml injekčního roztoku obsahuje 2 mg natrii tetradecylis sulfas.
Jedna 5 ml injekční lahvička obsahuje 10 mg natrii tetradecylis sulfas.
Fibrovein 0,5 % injekční roztok
Jeden ml injekčního roztoku obsahuje 5 mg natrii tetradecylis sulfas.
Jedna 2 ml injekční ampulka obsahuje 10 mg natrii tetradecylis sulfas.
Fibrovein 1 % injekční roztok
Jeden ml injekčního roztoku obsahuje 10 mg natrii tetradecylis sulfas.
Jedna 2 ml injekční ampulka obsahuje 20 mg natrii tetradecylis sulfas.
Fibrovein 3 % injekční roztok
Jeden ml injekčního roztoku obsahuje 30 mg natrii tetradecylis sulfas.
Jedna 2 ml injekční ampulka obsahuje 60 mg natrii tetradecylis sulfas.
Jedna 5 ml injekční lahvička obsahuje 150 mg natrii tetradecylis sulfas.
Úplný seznam pomocných látek viz níže
Léková forma
Injekční roztok.
Čirý, bezbarvý sterilní roztok.
Obsahuje benzylalkohol 20 mg/ml. pH= 7,5-7,9.
Osmolarita 247-273 mOsm/kg.
Terapeutické indikace
Léčba nekomplikovaných primárních varixů, recidivujících nebo reziduálních varixů po operaci, retikulárních varixů, metliček a drobných rozšířených žilek na dolních končetinách s nekomplikovanou dilatací.
Fibrovein je určen pouze pro dospělé (včetně seniorů).
Dávkování a způsob podání
Pouze intravenózní podání. Potřebná léková síla roztoku závisí na intenzitě a rozsahu varikozity.
K ošetření drobných rozšířených žilek a metliček je vhodná koncentrace 0,2 %, u retikulárních žilek 0,5 %, zatímco 1% roztok bude nejvhodnější u malých a středních varikozit a 3% roztok u větších.
Přípravek musí být do žíly podáván v malých dávkách a na několik míst, a to buď ve formě kapaliny, nebo ve směsi se vzduchem (ve formě pěny) tak, jak je uvedeno v následující tabulce. Cílem je zajistit optimální destrukci cévní stěny s minimální koncentrací přípravku. Pokud je koncentrace příliš vysoká, může dojít k nekróze nebo jiným nežádoucím účinkům.
Pokyny k použití pěny najdete dále. Popsána je příprava pěny Tessariho metodou, lze však použít i jiné metody (například DSS, Easyfoam, Sterivein).
S přípravkem je nutno pracovat přísně asepticky. Přípravek je určen k jednorázovému parenterálnímu podání. Po otevření obalu obsah ihned použijte a nepoužitý zbytek zlikvidujte.
Před použitím vizuálně zkontrolujte, zda přípravek neobsahuje částice. Roztoky obsahující částice nepoužívejte.
Tento přípravek není kompatibilní s heparinem.
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
Doporučené dávky a dávkovací režimy Dospělí a starší osoby
|
Koncentrace |
Normální objem podávaný nitrožilně do vhodných míst |
Maximální celkový objem k aplikaci | ||
|
Kapalina |
Pěna* |
Kapalina |
Pěna* | |
|
Fibrovein 3 % |
0,5 až 2 ml |
0,5 až 2 ml |
4 ml |
16 ml |
|
Fibrovein 1 % |
0,1 až 1 ml |
0,5 až 2 ml |
10 ml |
16 ml |
|
Fibrovein 0,5 %, 0,2 % |
0,1 až 1 ml |
- |
10 ml |
- |
* objem je součtem kapaliny a vzduchu
Při aplikacích, kdy je podle Souhrnu údajů o přípravku nutno podání věnovat zvláštní pozornost, doporučujeme podat zkušební dávku 0,25-0,5 ml přípravku a poté pacienta několik hodin před podáním druhé nebo vyšší dávky pozorovat.
U drobných rozšířených žilek je vhodné použít nejmenší jehly (například 30 G); injekci je třeba aplikovat pomalu, aby byla ze žil vytlačena krev. K ošetření drobných rozšířených žilek lze použít zablokování vzduchem.
Pokud je přípravek podáván ve formě pěny, je vhodné aplikaci sledovat pod ultrazvukovou kontrolou. Musí jej podávat lékař náležitě vyškolený ve správném vytváření a podávání pěny.
Zvláštní upozornění a opatření
Fibrovein smí podávat pouze zdravotník obeznámený s žilní anatomií, s diagnostikou a ošetřením žilních potíží a se správným podáváním injekcí. Při aplikaci přípravku mimo žílu může lokálně dojít k těžkým nežádoucím účinkům (nekróza tkáně); proto je jehlu třeba zavádět s maximální opatrností a v každém místě aplikovat jen minimální účinné množství. Roztok je třeba aplikovat pomalu.
Je nutno postupovat opatrně, aby roztok nebyl vstříknut do tepny; to by mohlo vést k odumření (nekróze) tkáně a případně i ztrátě končetiny.
Zvlášť opatrně je nutno postupovat při aplikaci kolem kotníků a níže (maleolární oblast) - zde je riziko zasažení některé z tepen. Při ošetřování menších žil je nutno místo stlačit, jinak může dojít k výronu krve v místě vpichu a vzniku podlitiny.
Při aplikaci v minulosti došlo k alergickým reakcím včetně anafylaxe; lékař musí proto být připraven k zajištění náležité léčby. Zajistěte také okamžitou dostupnost vybavení k akutní resuscitaci.
Z preventivně bezpečnostních důvodů je vhodné přípravek aplikovat v nemocnici.
Příprava pěny (Tessariho technika)
Během přípravy pěny je nutno dodržovat přísně aseptický postup.
Chcete-li vytvořit pěnu, odeberte 1 ml tekutého přípravku do sterilní stříkačky a do další sterilní stříkačky aspirujte 3-4 ml sterilního vzduchu. Sterilita vzduchu je zajištěna jeho aspirací přes 0,2 ^m filtr. Stříkačky pak propojte pomocí sterilního třícestného ventilu (obr. 1).
Směs přípravku se vzduchem poté asi 20x protlačte přes ventil z jedné stříkačky do druhé a zpět, čímž vznikne hladká, stejnoměrná pěna (obr. 2 a 3).
Poté odpojte stříkačku s pěnou a obsah ihned podejte do žíly (obr. 4).
Pěnu je nutno spotřebovat do 60 sekund od vytvoření. Jakékoli zbytky po uplynutí této doby zlikvidujte. V případě potřeby připravte více pěny.
Před použitím kvalitu pěny zkontrolujte. Musí mít homogenní vzhled bez velkých, okem viditelných bublin.
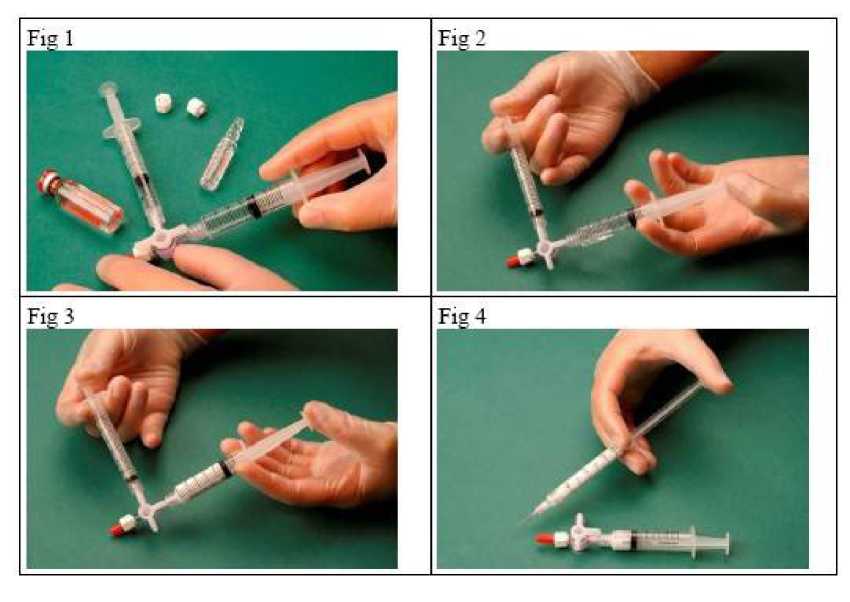
Kvalita pěny závisí na několika faktorech:
1. Koncentrace přípravku: Pěnu lze vytvořit pouze z přípravku o koncentraci 1-3 % natrium-tetradecyl-sulfátu.
2. Poměr kapaliny a vzduchu: Obvykle je to 1 objemový díl kapaliny na 3 díly vzduchu.
3. Počet pasáží směsi: Dodržujte přesně počet pasáží předepsaný u každé metody.
4. Makroskopická konzistence pěny: Před použitím kvalitu pěny zkontrolujte, a to mimo stříkačku. Pěna musí být homogenní, měkká a soudržná bez viditelných velkých bublin. Pokud jsou viditelné velké bubliny, pěnu zlikvidujte a připravte novou.
5. Celková doba přípravy pěny: Příprava zabere asi 10 sekund od první do poslední pasáže mezi stříkačkami.
6. Maximální doba mezi přípravou a aplikací: Pěnu je nutno použít do 60 sekund od vytvoření. Jakékoli zbytky po uplynutí této doby zlikvidujte. V případě potřeby připravte více pěny.
Farmaceutické údaje
Seznam pomocných látek
Benzylalkohol
Dodekahydrát hydrogenfosforečnanu sodného Dihydrogenfosforečnan draselný Hydroxid sodný (k úpravě pH)
Voda na injekci
Doba použitelnosti
3 roky.
Po prvním otevření ihned použijte.
Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Chraňte před mrazem.
Uchovávejte ampulky (lahvičky) v krabičce, aby byl přípravek chráněn před světlem.
Druh obalu a obsah balení
5 ml injekční lahvičky (sklo třídy I) se zátkou a hliníkovým uzávěrem s odtrhávacím víčkem. 2 ml ampulky (sklo třídy I).
Zvláštní opatření pro likvidaci přípravku Žádné zvláštní požadavky pro likvidaci.
9/9