Emla Krém 5%
sp.zn.sukls117969/2012
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
EMLA krém 5%
2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ
Lidocainum 25,0 mg a prilocainum 25,0 mg v 1 g krému. Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Krém.
Bílý, homogenní krém.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Dospělí:
• EMLA krém je indikován k lokální anestezii kůže před:
- vpichem injekční jehly, např. při katetrizaci nebo odběrech krve;
- povrchovými chirurgickými výkony.
• K lokální anestezii sliznice pohlavních orgánů, tj. před povrchovými chirurgickými výkony nebo před infdtrační anestezií sliznice.
• K lokální anestezii bércových vředů k usnadnění mechanického čištění lézí od nekrotické tkáně. Pediatrická populace:
EMLA krém je indikován u následujících věkových skupin: novorozenci od 0-2 měsíců, kojenci od 3-11 měsíců, děti od 1-11 let a dospívající > 12 let k lokální anestezii kůže v souvislosti s použitím injekční jehly, např. intravenózní katetry nebo odběry krve, a u povrchových chirurgických výkonů. EMLA krém je též indikován u pediatrických pacientů s atopickou dermatitidou před prováděním kyretáže molusek.
4.2 Dávkování a způsob podání
|
Druh povrchu/věk |
Výkon |
Způsob aplikace |
|
Kůže |
Nanést silnou vrstvu krému na kůži a překrýt okluzivním obvazem. | |
|
Dospělí a dospívající > 12 let |
Asi 1,5 g/10 cm2 | |
|
Menší výkony, např. před injekční aplikací a chirurgickou léčbou lokálních lézí |
2 g (asi polovina 5 g tuby) na 1-5 hodin 1 | |
|
Chirurgické výkony na větších plochách kůže v nemocničních podmínkách, např. odběr kožních štěpů |
Asi 1,5-2 g/10 cm2 na 2-5 hodin 1J | |
|
Nově oholená velká plocha kůže v ambulantních podmínkách |
Maximální doporučená dávka je 60 g. Maximální ošetřovaná plocha je 600 cm2 n minimálně 1-5 hodin. |
|
Výkony na velkých plochách čerstv oholené kůže, např. odstraňování chloupků laserem (prováděné samotným pacientem) |
Maximální doporučená dávka: 60 g. Maximální doporučená ošetřovaná plocha kůže: 600 cm2 na dobu minimálně 1 hodiny maximálně 5 hodin1-1. | |
|
Pediatrická populace |
Menší výkony, např. před injekční aplikací a chirurgickou léčbou lokálních lézí |
Asi 1,0 g/10 cm2 na dobu asi 1 hodiny (podrobnosti viz níže). |
|
Děti 0 až 2 měsíce 3 8) |
Až 1,0 g a až 10 cm2 2) | |
|
Děti 3-11 měsíců 3) |
Až 2,0 g a až 20 cm2 4) | |
|
Děti 1-5 let |
Až 10 g a až 100 cm2 na 1-5 hodin 1 | |
|
Děti 6-11 let |
Až 20 g a až 200 cm2 na 1-5 hodin 1} | |
|
Dospívající > 12 let |
Viz dospělí a dospívající > 12 let | |
|
Pediatrická populace s atopickou dermatitidou |
Před kyretáží molusek |
Doba aplikace: 30 minut |
|
Sliznice pohlavních orgánů Dospělí |
Chirurgická léčba lokálních lézí, např. odstraňování bradavičnatých výstupků (condylomata acuminata) před injekční aplikací lokálních anestetik Před kyretáží děložního hrdla |
Nanést asi 5-10 g krému na 5-10 minut.1-1. Okluzivní krytí není nutné. Výkon následuj okamžitě po odstranění krému. Nanést 10 g krému laterálně na klenbu poševní na dobu 10 minut |
|
Kůže mužských pohlavních orgánů Dospělí a dospívající > 12 let |
Před injekční aplikací lokálních anestetik |
Nanést silnou vrstvu krému EMLA (1g/10 cm2) s okluzivním krytím na dobu 15 minu |
|
Kůže ženských pohlavních orgánů Dospělí a dospívající > 12 let |
Před injekční aplikací lokálních anestetik7-1 |
Nanést silnou vrstvu krému EMLA (1-2 g/10 cm2) s okluzivním krytím na dobu 60 minut |
|
Bércové vředy Dospělí |
Mechanické čištění bércových vřed od nekrotické tkáně |
ů Nanést silnou vrstvu krému, asi 1 -2 g/10 cm2 (maximálně celkem až 10 g) přímo na vřed(y). 5,6) Překrýt okluzivním obvazem. Doba aplikace 30-60 minut. Čištění následuje bezprostředně po odstranění krému. |
:) Po delší době aplikace (> 5 hodinách) se hloubka anestezie snižuje.
3)
2) Delší doba aplikace než 1 hodina nebyla dosud hodnocena.
4)
Dokud nebudou k dispozici další klinická data, nesmí se EMLA podávat dětem ve věku do 12 měsíců, které jsou léčeny léčivy, která vyvolávají methemoglobinemii.
Nebyl pozorován klinicky významný vzestup methemoglobinemie při době aplikace až 4 hodiny na plochu 16 cm2.
5) EMLA byla opakovaně použita k léčbě bércových vředů a to až 15krát v průběhu 1-2 měsíců bez ztráty účinnosti a nebo zvýšení počtu nebo závažnosti nežádoucích příhod.
6) Aplikace větších dávek než 10 g na bércové vředy nebyla dosud hodnocena s ohledem na plazmatické koncentrace léčivých látek (viz bod 5.2).
7) Při aplikaci samotného krému EMLA na kůži ženských pohlavních orgánů na dobu 60 nebo 90 minut nebylo dosaženo dostatečné anestezie pro použití termokauterizace nebo diatermie při odstraňování bradavičnatých výstupků.
Jeden gram krému EMLA vytlačený z tuby o obsahu 30 g odpovídá délce asi 3,5 cm.
Lidé, kteří často aplikují nebo odstraňují krém EMLA, by se měli v rámci prevence vývoje přecitlivělosti vyvarovat kontaktu s krémem.
Návod k použití přípravku EMLA krém
EMLA krém - návod k použití neprodyšných obvazů Tegaderm:
1. Je-li EMLA použita před odběrem krve, vytlačí se dostatečné množství krému k zakrytí alespoň jedné žíly. Doporučené dávkování je uvedeno v příbalové informaci a na vnějším obalu.
2. Použije se přiložený okluzivní obvaz (Tegaderm). Střední čtvercová část okluzivního obvazu se odlepí.
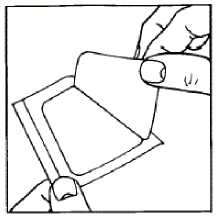
3. Z druhé strany okluzivního obvazu se odtrhne krycí papír.
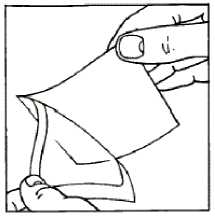
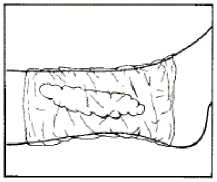
4. Touto stranou se obvaz přiloží na místo, kde je nanesena EMLA. Obvaz se po obvodu opatrně přitlačí tak, aby nedošlo k vytlačení EMLA pod rámeček. 1
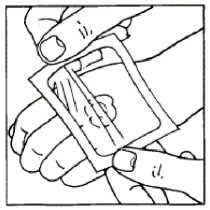
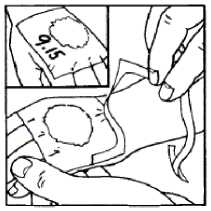
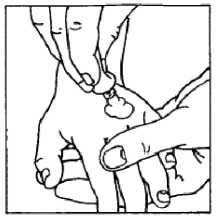
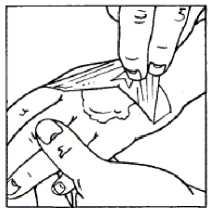
6. Po uplynutí doporučené doby se okluzivní obvaz sejme, krém se setře. Kůži lze dále očistit či jinak připravit k intervenci.
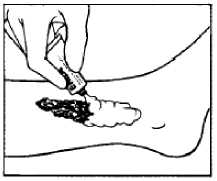
EMLA krém u bércových vředů - návod k použití:
1. Krém se aplikuje v silné vrstvě (asi 1-2 g na plochu 10 cm2) přímo do bércového vředu, maximálně celkem 10 g krému.
2. Ošetřená léze se překryje okluzivním obvazem (např. plastická fólie na potraviny).
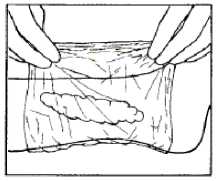
3. Okluzivní obvaz se ponechá po dobu alespoň 30 minut. U chronických bércových vředů, které jsou velmi bolestivé, a absorpce léčiva bývá zpomalena, může být tato doba prodloužena až na 60 minut.
Známá přecitlivělost na lokální anestetika amidového typu nebo kteroukoliv složku přípravku.
4.4 Zvláštní upozornění a zvláštní opatření pro použití
Pacienti s defektní glukózo-6-fosfát dehydrogenázou, vrozenou či idiopatickou methemoglobinemií jsou citlivější k lékově navozeným projevům methemoglobinemie.
U dětí mladších než 3 měsíce byl běžně pozorován přechodný, klinicky nevýznamný vzestup methemoglobinemie až 12 hodin po aplikaci krému EMLA.
EMLA by neměla být aplikována na otevřené rány (kromě bércových vředů), neboť neexistuje dostatek údajů o absorpci léčivých látek.
Vzhledem k potenciálně zvýšené absorpci přes čerstvě oholenou kůži je důležité, aby byla dodržováno doporučené dávkování, ošetřená plocha a doba aplikace (viz bod 4.2).
V klinických studiích nebyla prokázána účinnost přípravku při odběru kapilární krve z paty novorozenců lancetou.
EMLA by neměla být aplikována na sliznici pohlavních orgánů dětí, neboť neexistuje dostatek údajů o absorpci léčivých látek.
Zvýšenou pozornost je třeba věnovat při aplikaci krému u pacientů s atopickou dermatitidou. V tomto případě může být dostatečná doba aplikace 15-30 minut (viz bod 5.1). Doba aplikace krému delší než 30 minut u pacientů s atopickou dermatitidou může vést ke zvýšení výskytu lokálních cévních reakcí, zvláště zarudnutí v místě aplikace a někdy ke vzniku petechií a purpury (viz bod 4.8). Před prováděním kyretáže molusek u dětí s atopickou dermatitidou se doporučuje aplikovat krém na dobu 30 minut.
EMLA krém by se neměl dostat do očí, neboť může vyvolat podráždění oka. Ztráta obranných reflexů může vyvolat podráždění rohovky až její abrazi. Pokud již ke kontaktu dojde, je třeba okamžitě vyplachovat oko vodou nebo fyziologickým roztokem a oko chránit, dokud se neobnoví normální oční citlivost.
EMLA krém by neměl být aplikován na porušenou membránu bubínku. Testy na laboratorních zvířatech prokázaly, že EMLA má ototoxické vlastnosti, pokud je instilována do středního ucha. Při aplikaci krému do vnějšího zvukovodu pokusným zvířatům s neporušeným bubínkem k tomuto projevu nedocházelo.
Pacienti léčení antiarytmiky třídy III (např. amiodaron) by měli být pečlivě sledováni (včetně monitorování EKG), neboť účinky na srdce mohou být aditivní.
Lidokain i prilokain mají baktericidní a antivirotické vlastnosti v koncentracích vyšších než 0,5-2 %.
V jedné klinické studii bylo prokázáno, že odpověď organismu na imunizaci BCG vakcinou nebyla ovlivněna předchozí aplikací přípravku v místě vakcinace. Přesto se, vzhledem ke koncentraci účinných látek v přípravku, doporučuje pečlivě sledovat výsledky intrakutánní aplikace živých vakcin, např. BCG vakciny.
Dokud nebudou k dispozici další klinické údaje, EMLA krém by neměl být používán v následujících případech:
- u dětí do 12 měsíců věku současně léčených induktory tvorby methemoglobinu
- u předčasně narozených dětí, tj. před 37. gestačním týdnem
EMLA krém lze nanášet na sliznice pohlavních orgánů dospělých pouze pod dohledem lékaře či zdravotní sestry.
EMLA krém obsahuje hydrogenricinomakrogol, který může vyvolávat kožní reakce.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Prilokain ve vysokých dávkách může zvyšovat tvorbu methemoglobinu u pacientů léčených současně jinými léčivy známými jako induktory tvorby methemoglobinu, např. sulfonamidy.
Při aplikaci vysokých dávek krému EMLA pacientům, kterým jsou podávána jiná lokální anestetika nebo jiné chemicky příbuzné látky, je nutné mít na zřeteli riziko systémové toxicity, neboť toxické účinky těchto přípravků jsou aditivní.
Specifické interakční studie s lidokainem/prilokainem a antiarytmiky třídy III, např. amiodaron, nebyly provedeny, ale zvýšená pozornost je v tomto případě na místě (viz též bod 4.4).
Léčiva, která snižují vylučování lidokainu (např. cimetidin nebo betablokátory), mohou vyvolat dosažení potenciálně toxických plazmatických koncentrací lidokainu, pokud je lidokain podáván opakovaně ve vysokých dávkách po delší dobu. Tato interakce nemá klinický význam, pokud je lidokain (tj. EMLA krém) podáván krátkodobě a v doporučených dávkách.
4.6 Fertilita, těhotenství a kojení
Studie na zvířatech neprokázaly žádné přímé či nepřímé vlivy na průběh březosti, embryonální a fetální vývoj, průběh porodu a další vývoj.
Lidokain i prilokain přecházejí přes placentární bariéru u zvířat i lidí a mohou být absorbovány tkáněmi plodu. Lidokain a prilokain byly aplikovány velkému počtu těhotných žen a ženám v reprodukčním věku. Nebyly přitom pozorovány žádné specifické známky poškození reprodukčních schopností, např. zvýšený výskyt malformací a jiné přímé i nepřímé škodlivé vlivy na plod. Vždy je však potřebné postupovat opatrně při aplikaci přípravku těhotným ženám.
Kojení
Lidokain, a se vší pravděpodobností i prilokain, se vylučují do mateřského mléka. Vyloučené množství je tak malé, že riziko pro kojence prakticky neexistuje, pokud je dodrženo doporučené dávkování přípravku.
4.7 Účinky na schopnost řídit a obsluhovat stroje
V doporučených dávkách nemá EMLA vliv na schopnost řídit motorová vozidla ani na schopnost obsluhovat stroje.
4.8 Nežádoucí účinky
Frekvence nežádoucích účinků jsou definovány následujícím způsobem:
Velmi časté (> 1/10)
Časté (> 1/100 až < 1/10)
Méně časté (> 1/1000 až < 1/100)
Vzácné (> 1/10 000 až < 1/1000).
Velmi vzácné (< 1/10 000)
Není známo (z dostupných údajů nelze určit)
|
Třída orgánových systémů |
Frekvence |
Nežádoucí účinek |
|
Poruchy kůže a podkožní tkáně. |
Časté |
Přechodné lokální reakce v místě aplikace jako je zblednutí, erytém a edém.1,2,3 Úvodní a obvykle mírný pocit pálení, svědění nebo |
|
tepla v místě aplikace.2,3 | ||
|
Méně časté |
Úvodní mírný pocit pálení, svědění nebo horkosti v místě aplikace.1 Lokální parestézie v místě aplikace, např. brnění.2 Podráždění kůže v místě aplikace.3 | |
|
Celkové poruchy a reakce v místě aplikace. |
Vzácné |
Methemoglobinemie (viz body 4.5 a 4.9). Vzácné případy ohraničených lokálních lézí v místě aplikace podobné jako purpura nebo petechie, zvláště při delší době aplikace u dětí s atopickou dermatitidou nebo molluscum contagiosum. Iritace rohovky po nechtěné aplikaci do oka. Vzácně mohou lokální anestetika vyvolat alergickou reakci (v nejtěžších případech až anafylaktický šok).1,2,3 |
1 Intaktní kůže
2 Sliznice pohlavních orgánů
3 Bércové vředy
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Vzácně byly hlášeny významné klinické projevy methemoglobinemie. Prilokain může ve vysokých dávkách, a zvláště v kombinaci s jinými látkami indukujícími tvorbu methemoglobinu, např. sulfonamidy, vyvolat methemoglobinemii.
Klinicky závažnou methemoglobinemii je nutné léčit podáním pomalé intravenózní injekce methylenové modři.
Pokud by se manifestovaly jiné příznaky systémové toxicity, lze očekávat podobné příznaky jako po podání lokálních anestetik jinými aplikačními způsoby. Toxicita lokálních anestetik se projevuje excitací centrální nervové soustavy (CNS) a v těžkých případech naopak jejím útlumem a útlumem kardiovaskulárního systému.
Těžké neurologické příznaky (křeče a útlum CNS) musí být léčeny symptomaticky podporou dýchání a podáním antikonvulziv, oběhové příznaky se léčí podle běžných doporučení pro resuscitaci.
Vzhledem k tomu, že rychlost absorpce přes neporušenou kůži je pomalá, pacienti by měli být po urgentním zásahu sledováni na projevy toxicity po dobu několika hodin. 2
EMLA krém 5% vyvolává kožní anestezii tím, že dochází k uvolňování a průniku lidokainu a prilokainu z krému do epidermálních a dermálních vrstev kůže a ke kumulaci lidokainu a prilokainu v blízkosti kožních receptorů pro bolest a nervových zakončení. Lidokain a prilokain jsou lokální anestetika amidového typu, stabilizují membránu neuronu tím, že inhibují iontovou výměnu nutnou pro vznik a vedení vzruchu nervovým vláknem.
Kvalita anestezie závisí na době aplikace a aplikované dávce lokálního anestetika. Krém se podává na neporušenou kůži a překryje se okluzivním obvazem. Doba potřebná k dosažení spolehlivé anestezie kůže je 1-2 hodiny v závislosti na druhu výkonu.
Při klinickém hodnocení nebyly pozorovány rozdíly v účinnosti a bezpečnosti (včetně doby nástupu anestezie) mezi staršími (65-96 let) a mladšími subjekty hodnocení při aplikaci EMLA na neporušenou kůži.
Anestezie přetrvává v tomto případě nejméně 2 hodiny po odstranění okluzivního obvazu. Hloubka kožní anestezie se zvyšuje s dobou aplikace. U 90 % pacientů je kožní anestezie dostatečná pro použití bioptických klíštek (o průměru 4 mm) do hloubky 2 mm, resp. 3 mm po aplikaci EMLA na dobu 60 minut, resp. 120 minut.
EMLA je stejně účinná a má stejně rychlý nástup účinku u různě intenzívně pigmentovaných typů kůže (typ I-VI).
Použití EMLA před podáním očkovací látky proti spalničkám-příušnicím-zarděnkám, intramuskulární inaktivované vakcině proti záškrtu-černému kašli-tetanu, vakcině proti polioviru-Hemophilus influenzae skupiny b nebo hepatitidě B neovlivňuje průměrné titry protilátek, rozsah sérokonverze a podíl úspěšně imunizovaných pacientů ve srovnání s placebem.
Průnik léčivých látek sliznicí pohlavních orgánů je rychlejší, což má za následek i rychlejší nástup anestezie ve srovnání s aplikací na kůži.
Po aplikaci krému EMLA na sliznici ženských pohlavních orgánů na dobu 5-10 minut se délka účinné analgezie (měřené jako odezva na stimulaci argonovým laserem vyvolávající ostrou bodavou bolest) pohybovala v rozmezí 15-20 minut (s individuální variabilitou od 5 do 45 minut).
Spolehlivé anestezie pro čištění bércových vředů je u většiny pacientů dosaženo v průběhu 30 minut. Aplikace až po dobu 60 minut může dále prohloubit anestezii. Čištění vředové léze by mělo následovat do 10 minut po odstranění krému. Nejsou k dispozici klinická data předpokládající delší dobu čekání. EMLA snižuje vnímání bolesti po zákroku po dobu až 4 hodin.
EMLA snižuje počet opakovaných zákroků nutných k vyčištění vředové léze ve srovnání s krémem obsahujícím placebo. Nebyl pozorován nepříznivý vliv krému na hojení a bakteriální flóru bércových vředů.
EMLA vyvolává bifázickou vaskulární odpověď; po úvodní vazokonstrikci následuje vazodilatace v místě aplikace (viz bod 4.8). Bez ohledu na vaskulární odpověď usnadňuje EMLA vpich injekční jehly ve srovnání s placebem.
U pacientů s atopickou dermatitidou se objevuje podobná, ale krátkodobější kožní reakce. Erytém se objevuje již za 30-60 minut, což lze vysvětlit rychlejším průnikem léčivých látek přes kůži (viz bod 4.4).
5.2 Farmakokinetické vlastnosti
Systémová absorpce lidokainu a prilokainu z přípravku EMLA závisí na dávce, ošetřené ploše a době aplikace. Dalšími faktory jsou tloušťka kůže, která se mění v různých částech těla, a jiné podmínky, jako je kožní onemocnění a oholení kůže. V případě bércových vředů také na jejich charakteru.
Intaktníkůže
Po aplikaci krému EMLA na stehno dospělého člověka (60 g krému na plochu 400 cm2) na dobu 3 hodin byl rozsah absorpce účinných látek asi 5 %. Maximálních plazmatických koncentrací (cmax) pro lidokain, resp. prilokain (0,12 pg/ml, resp. 0,07 pg/ml) bylo dosaženo asi za 2-6 hodin po aplikaci.
Po aplikaci 10 g krému na plochu 100 cm2 na dobu 2 hodin na tvář byl rozsah absorpce asi 10 % z podané dávky. Maximálních plazmatických koncentrací (0,16 pg/ml, resp. 0,06 pg/ml) pro lidokain, resp. prilokain bylo dosaženo asi za 1,5-3 hodiny po aplikaci.
Plazmatické koncentrace lidokainu a prilokainu u starších a mladých pacientů po aplikaci EMLA na neporušenou kůži je velmi nízká a zdaleka nedosahuje potenciálně toxických koncentrací.
Děti
Při aplikaci 1 g krému EMLA na plochu kůže asi 10 cm2 na dobu 1 hodiny dětem do 3 měsíců byly hodnoty cmax pro lidokain, resp. prilokain 0,135 pg/ml, resp. 0,107 pg/ml. Při aplikaci 2 g krému EMLA na plochu kůže asi 16 cm2 na dobu 4 hodin dětem od 3 do 12 měsíců byly hodnoty cmax pro lidokain, resp. prilokain 0,155 pg/ml, resp. 0,131 pg/ml. Při aplikaci 10 g krému EMLA na plochu kůže asi 100 cm2 na dobu 2 hodin dětem od 2 do 3 roků byly hodnoty cmax pro lidokain, resp. prilokain 0,315 pg/ml, resp. 0,215 pg/ml. Při aplikaci 10-16 g krému EMLA na plochu kůže asi 100-160 cm2 na dobu 2 hodin dětem od 6 do 8 roků byly hodnoty cmax pro lidokain, resp. prilokain 0,299 pg/ml, resp. 0,110 pg/ml.
Sliznice pohlavních orgánů
Po aplikaci 10 g krému EMLA na sliznici pochvy na dobu 10 minut byla cmax lidokainu, resp. prilokainu 0,18 pg/ml, resp. 0,15 pg/ml dosažena za 20-45 minut.
Bércové vředy
Po jednorázové aplikaci 5 až 10 g krému EMLA na bércové vředy o celkové ploše až 64 cm2 na dobu 30 minut byla cmax lidokainu 0,05-0,25 pg/ml, v jednom případě 0,84 pg/ml, a cmax prilokainu 0,02-0,08 pg/ml dosažena za 2-4 hodiny.
Při aplikaci krému EMLA na bércové vředy o celkové ploše až 50-100 cm2 na dobu 24 hodin byla cmax lidokainu 0,19-0,71 pg/ml a cmax prilokainu 0,06-0,28 pg/ml dosažena za 2-4 hodiny.
Po opakované aplikaci 2-10 g krému EMLA na bércové vředy o celkové ploše až 62 cm2 na dobu 30-60 minut 3-7krát za týden a až 15krát v průběhu 1 měsíce nebyla zjištěna kumulace lidokainu a jeho metabolitů monoglycinxylididu a 2,6-xylidinu, resp. prilokainu a jeho metabolitu o-toluidinu v plazmě. Maximální plazmatické koncentrace pro lidokain, monoglycinxylidid a 2,6-xylidin byly 0,41 pg/ml, 0,03 pg/ml a 0,01 pg/ml. Maximální plazmatické koncentrace pro prilokain a o-toluidin byly 0,08 pg/ml a 0,01 pg/ml.
5.3 Předklinické údaje vztahující se k bezpečnosti
Ve studiích u zvířat byly toxické projevy zaznamenané po vysokých dávkách lidokainu nebo prilokainu nebo obou látek v kombinaci složeny z účinků na centrální nervový systém a kardiovaskulární systém. Při kombinaci obou látek byly patrné jen aditivní účinky bez známek synergismu nebo neočekávaných toxických projevů. U obou látek byla potvrzena nízká akutní toxicita po perorálním podání, což dává předpoklad pro dobrý bezpečnostní profil při náhodném požití EMLA. Ve studiích na reprodukční toxicitu nebyly pozorovány na léčivu závislé nežádoucí účinky při podání obou látek jednotlivě či současně.
Žádná z obou látek nemá mutagenní vlastnosti in vitro a in vivo. Studie na karcinogenitu nebyly provedeny s látkami samotnými ani jejich kombinací s ohledem na předpokládané indikace a krátkodobost aplikace přípravku.
Metabolit lidokainu, 2,6-dimethylanilin, a metabolit prilokainu, o-toluidin, mají mutagenní vlastnosti. V předklinických toxikologických studiích bylo prokázáno, že tyto metabolity mají karcinogenní potenciál při dlouhodobé expozici. Hodnocení rizika pro člověka srovnáním maximální expozice při intermitentním podání lidokainu a prilokainu s expozicí v předklinickém hodnocení ukazuje na dostatečný bezpečnostní profil přípravku v klinickém použití.
Byla prokázána dobrá lokální snášenlivost emulze lidokainu a prilokainu v hmotnostním poměru 1:1, krému nebo gelu na neporušené i porušené kůži a sliznicích.
Po jednorázové aplikaci emulze lidokainu a prilokainu v hmotnostním poměru 1:1 v dávce 50 mg/g do oka pokusných zvířat byla pozorována významná iritace. Jedná se o stejnou koncentraci a podobnou aplikační formu jako EMLA náplast a krém. Tato lokální reakce může být způsobena vyšší hodnotou pH přípravku (asi 9,0), ale pravděpodobně i iritačním potenciálem lokálních anestetik samotných.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Karbomer 974 P, hydrogenricinomakrogol, hydroxid sodný, čištěná voda.
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání Chraňte před mrazem.
6.5 Druh obalu a obsah balení
Hliníková tuba, uvnitř lakovaná, PP uzávěr (u balení 5x5 g přiloženy náplasti Tegaderm), krabička. Velikost balení: 5x5 g, 1x30 g.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Ke kožnímu podání.
Krycí hliníkovou fólii v hrdle tuby je třeba propíchnout horní stranou uzávěru.
Pokud se krém používá k ošetření bércových vředů, je tuba s krémem určena pouze k jednorázovému použití. Nespotřebovaný podíl v tubě je nutné zlikvidovat podle platných předpisů.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
AstraZeneca UK Limited, 2 Kingdom Street, London W2 6BD, Velká Británie
8. REGISTRAČNÍ ČÍSLO
01/942/97-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
22. 10. 1997 / 6. 11.2013
10. DATUM REVIZE TEXTU
6.11.2013
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Česká republika/Státní ústav pro kontrolu léčiv www.sukl.cz
11/11
Papírový rámeček se odstraní. Čas nanesení krému je možno poznamenat přímo na okluzivní obvaz. EMLA musí být nanesena alespoň 1 hodinu před zamýšleným zákrokem (viz doporučené časy aplikace)
FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: lokální anestetikum amidového typu. ATC klasifikace: N01B B20