Emerade 500 Mikrogramů
sp. zn. sukls164077/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Emerade 150 mikrogramů Emerade 300 mikrogramů Emerade 500 mikrogramů injekční roztok v předplněném peru
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedno předplněné pero obsahuje 0,5 ml roztoku epinefrinum 1 mg/ml.
Emerade 150 mikrogramů obsahuje jednu dávku 0,15 ml obsahující epinefrinum 150 mikrogramů (jako tartras).
Emerade 300 mikrogramů obsahuje jednu dávku 0,3 ml obsahující epinefrinum 300 mikrogramů (jako tartras ).
Emerade 500 mikrogramů obsahuje jednu dávku 0,5 ml obsahující epinefrinum 500 mikrogramů (jako tartras ).
Jedna dávka 0,15 ml (150 mikrogramů) obsahuje 0,075 mg disiřičitanu sodného (E 223).
Jedna dávka 0,3 ml (300 mikrogramů) obsahuje 0,15 mg disiřičitanu sodného (E 223).
Jedna dávka 0,5 ml (500 mikrogramů) obsahuje 0,25 mg disiřičitanu sodného (E 223).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Injekční roztok v předplněném peru (auto-injektoru). Čirý a bezbarvý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Emerade je indikován k akutní léčbě závažných alergických reakcí (anafylaxe) způsobených alergeny v potravinách, lécích, při hmyzím bodnutí či kousnutí nebo jinými alergeny. Zároveň se používá při reakcích indukovaných námahou nebo idiopatických anafylaxí.
4.2 Dávkování a způsob podání
Dávkování
Účinná dávka je obvykle v rozmezí 5-10 mikrogramů na kg tělesné hmotnosti, nicméně v některých případech je možno použít vyšší dávky.
Pediatrická populace
Emerade 500 mikrogramů není určen pro použití u dětí.
Děti o tělesné hmotnosti pod 15 kg
U dětí vážících méně než 15 kilogramů není možno podat dávku nižší než 150 mikrogramů s dostatečnou přesností, a proto se v těchto případech použití nedoporučuje, pokud nejde o život ohrožující situaci.
Děti o tělesné hmotnosti 15-30 kg Obvyklá dávka je 150 mikrogramů.
Děti o tělesné hmotnosti větší než 30 kg Obvyklá dávka je 300 mikrogramů.
Dospívající o tělesné hmotnosti větší než 30 kg Doporučené dávkování je shodné jako u dospělých pacientů.
Dospělí
Doporučená dávka je 300 mikrogramů u pacientů s tělesnou hmotností pod 60 kg. Doporučená dávka je 300 až 500 mikrogramů u pacientů s tělesnou hmotností nad 60 kg, s ohledem na klinické posouzení.
Počáteční dávka má být podána ihned poté, co se objeví příznaky anafylaktického šoku.
Pokud po první dávce nedojde ke klinickému zlepšení stavu, nebo pokud se stav zhorší, může být po 5-15 minutách od první aplikace nezbytná aplikace druhé injekce Emerade. Je doporučeno, aby lékař pacientovi předepsal dvě pera Emerade které by s sebou nosil za všech okolností.
Způsob podání Intramuskulární podání.
K jednorázovému použití.
Emerade se aplikuje intramuskulárně, jakmile se objeví příznaky anafylaktického šoku. Slabší odeznívání anafylaktické reakce je spojeno s pozdním podáním epinefrinu.
Emerade musí být aplikován do anterolaterální oblasti stehna.
Masírování kolem oblasti aplikace urychluje absorpci.
Injekce může být podána i přes oděv.
Pacient/jeho opatrovník mají být informováni, že po každém použití přípravku Emerade:
• Mají vyhledat okamžitou lékařskou pomoc a oznámit, že se jedná o "anafylaktický šok" a to i v případě, že mají pocit, že se příznaky zlepšily (viz bod 4.4).
• Pacient, který je při vědomí, má pokud možno ležet rovně na zádech s nohama ve zvýšené poloze, pokud má problémy s dýcháním, může se i posadit, Pacient v bezvědomí má být uložen do stabilizované polohy.
• Pacient nemá pokud možno zůstat sám, dokud nedorazí lékařská pomoc.
Podrobné informace o použití viz bod 6.6.
4.3 Kontraindikace
Nejsou známé žádné kontraindikace pro použití Emerade v případě akutní alergické reakce.
4.4 Zvláštní upozornění a opatření pro použití
Neodstraňujte kryt jehly až do doby těsně před použitím.
Emerade se aplikuje pouze do anterolaterální oblasti stehna.
K uvolnění dávky dochází okamžitě po zatlačení autoinjektoru do kůže. Pacienti musí být poučeni, aby neaplikovali injekci Emerade do hýžďového svalu vzhledem k riziku podání injekce do žíly.
Emerade je třeba použít v nouzových situacích, jako je život zachraňující léčba.
Po použití Emerade musí pacient urychleně vyhledat lékařskou pomoc k dalšímu sledování.
Všichni pacienti, kterým byl předepsán Emerade, mají být důkladně poučeni tak, aby dobře rozuměli indikacím a správnému způsobu aplikace (viz bod 6.6). Důrazně se doporučuje také proškolit blízké osoby pacienta (např. rodiče, opatrovníky, učitelé) jak správně použít Emerade v případě, že je potřeba ho použít v nouzové situaci.
Pacient/opatrovník má být informován o možnosti vzniku bifázické anafylaxe, která je charakterizována recidivou symptomů o několik hodin později.
U pacientů s astmatem může být zvýšené riziko závažné anafylaktické reakce.
Opatrnosti je zapotřebí při použití u pacientů s kardiovaskulárním onemocněním, včetně anginy pectoris, srdeční arytmie, corpulmonale, obstrukční kardiomyopatie a aterosklerózy. U pacientů s hypertyreózou, hypertenzí, feochromocytomem, glaukomem, těžkou poruchou funkce ledvin, adenomem prostaty, hyperkalcemií, hypokalemií, diabetem, u starších pacientů a u těhotných žen existuje po podání epinefrinu riziko nežádoucích účinků.
Přípravek obsahuje disiřičitan sodný, který může způsobit u citlivých pacientů alergické reakce včetně příznaků anafylaxe a bronchospasmu, zvláště mají-li v anamnéze astma.
Takoví pacienti proto musí být přesně poučeni, za jakých okolností mohou Emerade používat.
Při neúmyslné aplikaci injekce do ruky nebo nohy může dojít k periferní ischemii, která může vyžadovat následnou léčbu.
Pacienti musí být upozorněni na existenci příbuzných druhů alergenů a měli by být co nejdříve vyšetřeni, aby bylo možné jejich konkrétní alergeny zaznamenat.
Emerade je v podstatě bez sodíku (obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Některé léky mohou zvýšit účinek epinefrinu: tricyklická antidepresiva, inhibitory monoaminooxidázy (IMAO), inhibitory katechol-O-methyltransferázy (inhibitory COMT). Epinefrin se musí používat s opatrností u pacientů léčených halogenovanými uhlovodíky a související léčbou a léky, které mohou zapříčinit srdeční arytmii, např. digitalis, chinidin, halogenovaná anestetika.
Podávání rychle působících vazodilatátorů nebo alfablokátorů může ovlivňovat účinky epinefrinu na krevní tlak. Betablokátory mohou inhibovat stimulační účinek epinefrinu.
Hyperglykemický účinek epinefrinu může způsobit potřebu zvýšení dávky inzulínu nebo perorálních hypoglykemických léků u diabetických pacientů.
4.6 Fertilita, těhotenství a kojení
Nejsou k dispozici adekvátní a dobře kontrolované studie epinefrinu v průběhu těhotenství. V těhotenství je možné podávat epinefrin pouze v případech, kdy očekávaný přínos převýší potenciální riziko pro plod.
Vzhledem k špatné perorální biologické dostupnosti a krátkému eliminačnímu poločasu je nepravděpodobné, že by se epinefrin vylučoval do mateřského mléka a měl účinek na kojence.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Emerade nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje, přesto se nedoporučuje, aby pacienti po podání epinefrinu řídili nebo obsluhovali stroje z důvodu anafylaktické reakce.
4.8 Nežádoucí účinky
Nežádoucí účinky epinefrinu jsou obecně spojeny s alfa a beta receptorovým působením epinefrinu. Následující nežádoucí účinky byly hlášeny v souvislosti s použitím epinefrinu.
Nežádoucí účinky byly klasifikovány dle následujících frekvencí:
Velmi časté (>1/10)
Časté (>1/100 až <1/10)
Méně časté (>1/1000 až <1/100)
Vzácné (>1/10 000 až <1/1 000)
Velmi vzácné (<1/10 000)
Není známo (z dostupných údajů nelze určit).
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinek |
|
Poruchy metabolismu a výživy |
Není známo |
hyperglykemie, hypokalemie, acidóza |
|
Psychiatrické poruchy |
Není známo | |
|
Poruchy nervového systému |
Není známo |
bolest hlavy, závrať, třes, synkopa |
|
Srdeční poruchy |
Není známo |
tachykardie, arytmie, palpitace, angina pectoris, stresová kardiomyopatie |
|
Cévní poruchy |
Není známo |
hypertenze, vazokonstrikce, periferní ischemie |
|
Respirační, hrudní a mediastinální poruchy |
Není známo |
bronchospasmus |
|
Gastrointestinální poruchy |
Není známo | |
|
Celkové poruchy a reakce v místě aplikace |
Není známo |
hyperhidróza, astenie |
Emerade obsahuje disiřičitan sodný, který může vzácně způsobit závažné hypersenzitivní reakce (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www .sukl .cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Předávkování nebo neúmyslná intravaskulámí injekce epinefrinu může způsobit mozkovou haemoragii jako následek rychlého vzestupu krevního tlaku. Fatální následky mohou také nastat v případě plicního edému, protože spolu s periferní vasokonstrikcí dochází k srdeční stimulaci. Závažný plicní edém s dechovými obtížemi může být léčen podáním rychle účinkujících alfablokátorů. Život ohrožující arytmie lze léčit podáním betablokátorů.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: kardiotonika, kromě srdečních glykosidů, adrenergní a dopaminergní látky, epinefrin.
ATC kód: C01CA24
Epinefrin je přírodní aktivní sympatomimetický hormon produkovaný dření nadledvin. Stimuluje alfa a betaadrenergní receptory. Epinefrin je první volbou akutní léčby závažných alergických reakcí a idiopatických nebo námahou indukovaných anafylaxí.
Díky své alfaadrenergní stimulaci má epinefrin silný vasokonstrikční účinek. Tento účinek působí proti vazodilataci a zvýšené vaskulární perfuzi vedoucí ke ztrátě intravaskulámí tekutiny a hypotenzi, což jsou hlavní farmakotoxikologické účinky spojené s anafylaktickým šokem.
Stimulací beta receptorů v plicích má epinefrin silný bronchodilatační účinek a zmírňuje sípot a dušnost. Epinefrin také zmírňuje svědění, urtikarii a angioedém spojený s anafylaxí.
5.2 Farmakokinetické vlastnosti
Epinefrin je metabolizován v játrech a dalších tkáních a je inaktivován enzymy COMT a MAO. Neaktivní metabolity jsou vylučovány močí.
Plazmatický poločas epinefrinu je přibližně 2 až 3 minuty. Nicméně při subkutánním nebo intramuskulárním podání je absorpce zpomalována lokální vasokonstrikcí, takže účinky nastupují pozvolna a přetrvávají mnohem déle, než by předpovídal plazmatický poločas. Pro urychlení vstřebávání je doporučována masáž v okolí místa vpichu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Epinefrin se rozsáhle používá při akutní léčbě závažných alergických reakcí již mnoho let. Pro předepisující lékaře neexistují žádné další předklinické údaje než ty, které již byly popsány v tomto souhrnu údajů o přípravku.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
chlorid sodný disiřičitan sodný (E 223) dihydrát dinatrium-edetátu kyselina chlorovodíková (k úpravě pH) voda na injekci
6.2 Inkompatibility
Vzhledem k absenci studií kompatibility nesmí být tento léčivý přípravek podáván s jinými léčivými přípravky.
6.3 Doba použitelnosti
30 měsíců
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v původním obalu, který je speciálně vyroben k ochraně pera a štítku.
Chraňte před mrazem.
6.5 Druh obalu a obsah balení
Emerade se skládá ze skleněné předplněné injekční stříkačky s pístem z polyizoprenové pryže s jehlou v autoinjektoru. Emerade neobsahuje latex.
Odkrytá délka jehly
Emerade 150 mikrogramů: 16 mm
Emerade 300 mikrogramů a 500 mikrogramů: 23 mm
Obal
Autoinjektor Emerade je uložen v plastovém vnějším obalu.
Velikost balení: 1 nebo 2 předplněná pera.
Na trhu nemusí všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Je důležité informovat pacienty o tom, jak se Emerade používá.
Pouze k jednorázovému použití.
Doba použitelnosti je uvedena na obalu, nepoužívejte Emerade po uplynutí doby použitelnosti. Zlikvidujte a vyměňte autoinjektor po uplynutí doby použitelnosti.
Roztok lze kdykoliv kontrolovat přes kontrolní okénko zvednutím štítku. Pokud je roztok zabarvený nebo obsahuje částice, zlikvidujte a vyměňte Emerade.
Emerade použijte vždy, pokud hrozí riziko anafylaxe.
Emerade je navrženo pro snadné používání jako první pomoc. Emerade se aplikuje pouze do vnější strany stehna. K uvolnění dávky dochází okamžitě po zatlačení pera do kůže. Je možné jej použít přes oděv. Emerade se dá otevřít pouze na straně konce jehly, z opačné strany nelze otevřít.
Způsob podání
Pokyny pro používání musí být dodržovány přesně, aby se zabránilo náhodné injekci. Doporučuje se, aby také Vaši rodinní příslušníci, pečovatelé nebo učitelé byli poučeni jak správně používat Emerade. Emerade se aplikuje pouze do vnější strany stehna. K uvolnění dávky dochází okamžitě při zatlačení pera do kůže stehna. Je možné jej použít přes oděv.
1. Odstraňte kryt j ehly.
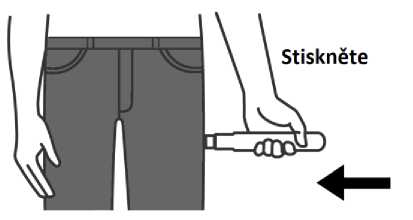
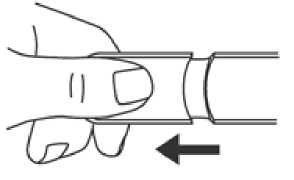
2. Umístěte a stiskněte Emerade proti vnější straně stehna. Uslyšíte cvaknutí, jakmile dojde k uvolnění dávky do svalu.
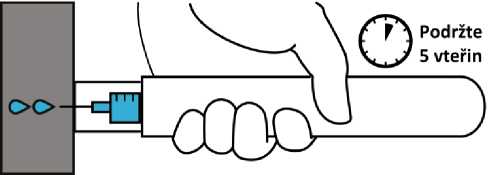
3. Po dobu 5 vteřin držte pero ve stehně. Poté lehce masírujte místo vpichu. Okamžitě vyhledejte lékařskou pomoc.
Jehla v Emerade je chráněna před, během a po podání injekce.
Po aplikaci dávky je v kontrolním okénku po zvednutí štítku viditelný píst.
V některých případech nemusí postačit jedna dávka epinefrinu k úlevě od těžké anafylaktické reakce. Proto může lékař doporučit vzít si po 5-15 minutách další dávku Emerade. Z tohoto důvodu se doporučuje mít vždy u sebe více než jednu dávku Emerade.
Emerade je určen pouze k akutní léčbě. Okamžitě po aplikaci Emerade zavolejte lékařskou pomoc nebo navštivte nejbližší nemocnici kvůli další léčbě. Oznamte svému lékaři, že jste použil(a) injekci epinefrinu. Použitý autoinjektor vezměte s sebou.
Instrukce pro pacienty/ošetřovatele týkající se opatření po každém použití Emerade viz bod 4.2 Neodstraňujte kryt jehly až do doby, než injekci použijete.
Po použití injekce zůstane v autoinjektoru zbytek roztoku. Autoinjektor nelze znovu použít. Zlikvidujte Emerade v souladu s místními požadavky.
Návod k použití je uveden na štítku, obalu a v příbalové informaci.
Autoinjektor bez jehly je určen k nácviku.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
PharmaSwiss Česká republika s.r.o.
Jankovcova 1569/2c 170 00 Praha 7 Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
Emerade 150 mikrogramů: 78/342/15-C Emerade 300 mikrogramů: 78/343/15-C Emerade 500 mikrogramů: 78/344/15-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 22.7.2015
10. DATUM REVIZE TEXTU
1.6.2016
8