Decapeptyl Depot
sp.zn.sukls179060/2015
Příbalová informace: informace pro uživatele
DECAPEPTYL DEPOT 3,75 mg/ml
(Triptorelini acetas)
Prášek a rozpouštědlo pro injekční suspenzi s prodlouženým uvolňováním
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
protože obsahuje pro Vás důležité údaje.
- Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
- Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka.
- Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy.
- Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci.Viz bod 4.
Co naleznete v této příbalové informaci :
1. Co je přípravek Decapeptyl Depot a k čemu se používá
2. Čemu musíte věnovat pozornost, než začnete přípravek Decapeptyl Depot používat
3. Jak se přípravek Decapeptyl Depot používá
4. Možné nežádoucí účinky
5 Jak přípravek Decapeptyl Depot uchovávat
6. Obsah balení a další informace
1. Co je přípravek Decapeptyl depot a k čemu se používá
Tento lék obsahuje triptorelin (ve formě triptorelin acetatu), což je syntetická látka podobná
přirozenému gonadotropin uvolňujícímu hormonu (GnRH). V organismu působí tak, že snižuje
hladiny určitých pohlavních hormonů.
Přípravek se používá:
Muži:
- pokročilá rakovina prostaty, při které je potřeba potlačit tvorbu mužského pohlavního hormonu -testosteronu
- vyšetření hormonální citlivosti karcinomu prostaty
Ženy:
Na potlačení tvorby hormonů produkovaných vaječníky:
- na zmenšení velikosti myomů (symptomatické děložní myomy, děložní myomy spojené se sterilitou nebo infertilitou a výskyt myomů v mladém věku).
- při léčbě symptomatické, laparoskopicky ověřené endometrióze (přítomnost částeček výstelky dutiny děložní mimo dělohu).Léčba je vhodná i před plánovanou endoskopickou chirurgickou léčbou.
- při metodách asistované reprodukce (umělé oplodnění) jako doplňková léčba na vyvolání ovulace za účelem umělého oplodnění a embryonálního transferu.
Děti:
- Léčba prokázané centrální pubertas praecox (puberta, která nastává předčasně a doprovázená tělesnými a hormonálními změnami normální puberty).
2. Čemu musíte věnovat pozornost, než začnete přípravek Decapeptyl depot používat
Nepoužívejte přípravek Decapeptyl Depot
- jestliže jste alergický/á (přecitlivělý/á) na léčivou látku triptorelin, na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
- jestliže j ste alergický/á (přecitlivělý/á) na GnRH (hormon uvolňuj ící gonadotropin) nebo j iné analogy GnRH
Ženy:
- v těhotenství a období kojení
Upozornění a opatření
U pacientů užívajících přípravek Decapeptyl depot byly hlášeny případy deprese, která může být závažná. Pokud užíváte Decapeptyl depot a rozvine se u Vás depresivní nálada, informujte svého lékaře.
Muži:
Sdělte svému lékaři:
- jestliže trpíte bolestí kostí nebo poruchou močení
- jestliže trpíte kompresí míchy nebo obstrukcí močové trubice
- jestliže jste po kastraci
- při zvýšeném riziku onemocnění srdce jako je zvýšený tlak krve nebo problémy se srdečním rytmem
Informujte svého lékaře v případě, že dojde ke zhoršení příznaků onemocnění.
Informujte svého lékaře, pokud trpíte něčím z následujícího:
Jakékoliv srdeční či cévní onemocnění, včetně poruch srdečního rytmu (arytmie), nebo léčba těchto onemocnění. Při užívání přípravku Decapeptyl depot může být zvýšeno riziko poruch srdečního rytmu.
Ženy:
Sdělte svému lékaři,
- jestliže krvácíte během cyklu (s výjimkou prvních měsíců léčby)
- jestliže hrozí zvýšené riziko osteoporózy (například snížená denzita kostí)
Léčba přípravkem Decapeptyl Depot po dobu delší než šest měsíců může vést ke snížení hustoty kostních minerálů. Z tohoto důvodu by léčba neměla být delší než šest měsíců. Po ukončení léčby dochází během 6 - 9 měsíců k obnově ztracené kostní tkáně. Zvláštní pozornost by proto měla být věnována pacientkám se zvýšeným rizikem osteoporózy.
Během léčby
- používejte nehormonální antikoncepční prostředky první měsíc po první injekci a dále pak 4 týdny po poslední injekci až do nástupu periody.
- Vaše perioda ustane. Po ukončení léčby dojde k obnově Vaší periody během 7 - 12 týdnů po poslední injekci.
- informujte svého lékaře, jestliže menstruace během léčby přetrvává..
Při asistované reprodukci (umělé oplodnění)
Informujte ihned svého lékaře pokud se u Vás objeví příznaky jako jsou bolest břicha, otok v oblasti břicha, nevolnosti, zvracení, průjmu, přibývání na váze, dýchací obtíže a snížené močení . Tyto příznaky mohou být projevem vysoké aktivity vaječníků (ovariální hyperstimulační syndrom OHSS), které se mohou stát závažné. Pokud se tyto příznaky stanou závažnými, musí být léčba neplodnosti přerušena a musíte být léčena v nemocnici.
Děti
- na počátku léčby by měl být věk dívek nižší než 9 let a chlapců nižší než 10 let Po ukončení léčby dojde k rozvoji charakteristických znaků puberty. U většiny dívek začíná menstruace v průměru rok po ukončení léčby a je ve většině případů pravidelná.
Další možné nežádoucí účinky jsou uvedeny v části 4.
Další léčivé přípravky a Decapeptyl depot
Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Decapeptyl depot a souběžně užívané přípravky k léčbě poruch srdečního rytmu (např. chinidin, prokainamid, amiodaron a sotalol) se mohou navzájem ovlivňovat. Decapeptyl depot může zvyšovat riziko poruch srdečního rytmu, pokud je užíván s dalšími přípravky (např: metadon (užívaný pro úlevu od bolesti nebo jako část odvykací terapie), moxifloxacin (antibiotikum), antipsychotika užívaná k léčbě závažných duševních poruch).
Opatrnost je na místě tam, kde triptorelin je podáván současně s léky, které ovlivňují hypofyzární sekreci gonadotropinů.
Těhotenství a kojení
Poraďte se se svým lékařem dříve, než začnete užívat jakýkoli lék.
Přípravek Decapeptyl Depot se nesmí užívat během těhotenství a kojení (viz část „Nepoužívejte přípravek Decapeptyl Depot “).
Během léčby používejte nehormonální antikoncepční prostředky jako prevenci otěhotnění.
Řízení dopravních prostředků a obsluha strojů
Přípravek nemá žádný vliv na schopnost řízení motorových vozidel a obsluhu strojů.
3. Jak se přípravek Decapeptyl depot používá
Vždy používejte přípravek Decapeptyl Depot přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
V závisloti na typu onemocnění, na které se léčíte, dostanete potřebnou dávku injekčně buď subkutánně (pod kůži) nebo intramuskulárně (do svalu).
Muži:
Obvykle se podává jedna injekce přípravku Decapeptyl Depot každé 4 týdny. Léčba je dlouhodobá. Ženy:
Děložní myomy a endometrióza
Obvykle se podává jedna injekce přípravku Decapeptyl depot každé 4 týdny po dobu ne delší než 6 měsíců.
Léčba se musí zahájit během prvních 5 dní den menstruace.
Asistovaná reprodukce (umělé oplodnění)
Aplikuje se jednorázově, obvykle 2.-3. den cyklu (folikulární fáze) nebo 22. den cyklu (luteální fáze).
Děti:
Na začátku léčby se v nultém, čtrnáctém a osmadvacátém dni podá 1 injekční stříkačka. Dávkování se řídí tělesnou hmotností. Dětem o hmotnosti pod 20 kg se aplikuje dávka 1,875 mg triptorelinu (poloviční dávka), dětem o hmotnosti 20 kg až 30 kg se aplikuje dávka 2,5 mg (2/3 plné dávky) a dětem o hmotnosti nad 30 kg se aplikuje dávka 3,75 mg triptorelinu (plná dávka). Poté se aplikuje po jedné injekci každé další 4 týdny.
Váš lékař bude kontrolovat délku Vaší léčby nebo délku léčby Vašeho dítěte.
Jestliže jste použil(a) více přípravku Decapeptyl Depot, než jste měl(a)
Vzhledem k způsobu balení a lékové formě se neočekává předávkování triptorelinem.
Jestliže se tak stane, informujte ihned svého lékaře nebo lékárníka.
Jestliže jste zapomněl(a) použít přípravek Decapeptyl Depot
Nezdvojujte následující dávku, abyste nahradil(a) vynechanou dávku.
Jestliže jste přestal(a) používat přípravek Decapeptyl Depot
Léčba přípravkem Decapeptyl Depot by měla být přerušena pouze pod dozorem Vašeho lékaře. Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i přípravek Decapeptyl Depot nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Obecně:
V případě otoku obličeje, rtů, úst nebo krku, které může způsobit potíže při polykání nebo dýchání kontaktujte okamžitě svého lékaře nebo navštivte nejbližší zdravotnické zařízení.
Během léčby agonisty LHRH byly hlášeny případy zvětšení již existujícího adenomu hypofýzy (nezhoubný, pomalu rostoucí nádor předního laloku podvěsku mozkového), nicméně tyto případy nebyly pozorovány při léčbě triptorelinem.
Muži:
Na počátku léčby se v důsledku zvýšení hladin testosteronu mohou zhoršit příznaky onemocnění např. bolesti v kostech nebo jejich zhoršení, obstrukce močové trubice, komprese míchy, svalová slabost a otok dolních končetin, slabost a brnění chodidel a rukou.
Velmi časté nežádoucí účinky, které postihují více než 1 pacienta z 10 léčených pacientů:
V pozdější fázi léčby se mohou vyskytnout potíže spojené s poklesem hladiny pohlavních hormonů jako jsou např. ztráta libida a potence, návaly horka, bolest kostí a obtížné a bolestivé močení.
Časté nežádoucí účinky, které postihují 1 až 10 pacientů ze 100 léčených pacientů:
Alergické reakce, deprese, změny nálady, bolest hlavy, nevolnost, , nadměrné pocení, bolest svalů a kloubů, gynekomastie (zvětšení prsní žlázy u mužů), únava, reakce v místě vpichu, bolest v místě vpichu, podrážděnost.
Méně časté nežádoucí účinky, které postihují 1 až 10 pacientů z 1 000 léčených pacientů: Anafylaktické reakce, snížená chuť k jídlu, embolie, zvýšení krevního tlaku, zhoršení astmatu, bolest břicha, sucho v ústech, zvýšený růst ochlupení, vypadávání vlasů, atrofie varlat, zvýšení hladin jaterních enzymů, snížení/zvýšení tělesné hmotnosti.
Neznámé, jejichž četnost nelze z dostupných zdrojů určit: zánět nosohltanu, zvýšená chuť k jídlu, dna, cukrovka (diabetes mellitus), nespavost, , zmatenost, snížená aktivita, závratě, pocit brnění, píchání nebo znecitlivění, poruchy paměti, porucha chuti, ospalost, abnormální citlivost oka, poruchy vidění, rozmazané vidění, hučení v uších, porucha rovnováhy - závrať, nízký krevní tlak, dušnost, těžká dušnost, krvácení z nosu, zácpa, průjem, zvracení, nadýmání břicha, žaludeční křeče, akné, svědění, vyrážka, puchýře, angioedém (otok podkoží), kopřivka, nachové zabarvení kůže, bolesti v zádech, bolest končetin, svalové křeče, ztuhlost, svalová slabost, ztuhlost a otoky kloubů, bolest prsou, bolest varlat, problémy s ejakulací, tělesná slabost, zarudnutí/zánět v místě vpichu, otok, třesavka, bolest na hrudi, chřipce podobné onemocnění, horečka, malátnost, zvýšení tělesné hmotnosti, zvýšené hodnoty některých enzymů ovlivňující funkci jater a ledvin, EKG změny (prodloužení QT intervalu).
Ženy:
Velmi časté nežádoucí účinky, které postihují více než 1 pacienta z 10 léčených pacientů :
Snížené libido, poruchy spánku, návaly horka, bolest břicha, bolest kostí, nadměrné pocení, vaginální krvácení/špinění, suchost poševní sliznice (vulvovaginální suchost), bolest při pohlavním styku, bolestivá menstruace, zvětšení vaječníků, pánevní bolest, slabost, bolest hlavy a změny nálady.
Časté nežádoucí účinky, které postihují 1 až 10 pacientů ze 100 léčených pacientů:
Alergické reakce, nevolnost, bolest svalů a kloubů, únava, bolest v místě vpichu, podrážděnost.
Méně časté nežádoucí účinky, které postihují 1 až 10 pacientů z 1 000 léčených pacientů: Anafylaktická reakce, změny nálady, deprese, poruchy vidění, pocit brnění, píchání nebo znecitlivění, bolest zad, zvýšený cholesterol, zvýšení hladin některých jaterních enzymů, zvýšení tělesné hmotnosti.
Neznámé, jejichž četnost nelze z dostupných zdrojů určit:výkyvy nálad, stavy zmatenosti, úzkost, závratě, rozmazané vidění, porucha rovnováhy - závrať, dušnost, průjem , zvracení, nevolnost, svědění, vyrážka, angioedém (otok podkoží), kopřivka, onemocnění kostí, svalové křeče, svalová slabost, bolest prsou, silná, prodloužená a/nebo nepravidelná perioda, zarudnutí/zánět v místě vpichu, horečka, malátnost, zvýšení krevního tlaku, snížení/zvýšení tělesné hmotnosti.
Děti:
Méně časté nežádoucí účinky, které postihují 1 až 10 pacientů z 1 000 léčených pacientů: Anafylaktická reakce, změny nálady a deprese, nevolnost, zvracení, vaginální krvácení nebo výtok.
Neznámé, jejichž četnost nelze z dostupných zdrojů určit: alergické reakce, citová labilita, nervozita, bolest hlavy, rozmazané vidění, poruchy vidění, návaly horka, krvácení z nosu, nevolnost, bolest břicha, vyrážka, angioedém (otok podkoží), kopřivka, vypadávání vlasů, červené zbarvení kůže, poškození růstové zóny dlouhých kostí, bolest svalů, krvácení z genitálií, bolest, zánět a zarudnutí v místě vpichu, zvýšení krevního tlaku, zvýšení tělesné hmotnosti.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: http://www.sukl.cz/nahlasit-nezadouci-ucinek
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Decapeptyl depot uchovávat
Uchovávejte v chladničce (2°C - 8°C), chránit před mrazem.
Pro transport (např. z lékárny k lékaři) použijte chladicí obal.
Přípravek Decapeptyl Depot nepoužívejte po uplynutí doby použitelnosti, uvedené na krabičce. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Připravená suspenze má trvanlivost 3 minuty, je určena k okamžité aplikaci.
Uchovávejte mimo dohled a dosah dětí.
Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace Co přípravek Decapeptyl Depot obsahuje
1 _předplněná injekční stříkačka práškem ( mikrotobolky) obsahuje:
- Léčivou látkou je Triptorelini acetas 4,12 mg ( tj. triptorelinum baze) 3,75mg
- Pomocnými látkami jsou:
Polyglaktin 1 : 1 156 mg
Propylenglykol-dioktanodidekanoát 12 mg
1 předplněná injekční stříkačka s 1 ml rozpouštědla obsahuje:
Polysorbát 80 Dextran 70 Chlorid sodný
Dihydrát dihydrogenfosforečnanu sodného Roztok hydroxidu sodného 1mol/l Vodu na injekci
Jak přípravek Decapeptyl Depot vypadá a co obsahuje toto balení
Předplněná injekční stříkačka s práškem (bílé až světle žluté mikrotobolky) a předplněná injekční stříkačka s rozpouštědlem (čirá bezbarvá tekutina), obě injekční stříkačky ze skla typu I, uzavřené gumovými zátkami, 2 injekční jehly (pro s.c. nebo i.m. podání), Luer lok spojovací díl, vše zatavené v PE blistru
Držitel rozhodnutí o registraci a výrobce
Výrobce:
Ferring GmbH, Kiel, Německo
Držitel rozhodnutí o registraci:
FERRING Pharmaceuticals CZ s.r.o.
K Rybníku 475
252 42 Jesenice u Prahy
Česká republika
Tato příbalová informace byla naposledy revidována: 29.10.2015
ZPŮSOB PŘÍPRAVY:
Balení přípravku před plánovanou aplikací vyjměte z chladničky
Mikrotobolky s postupným uvolňováním
(HME

rozpouštědlo
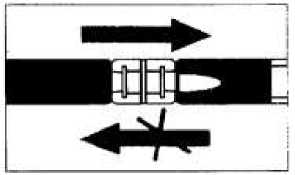
Míchání
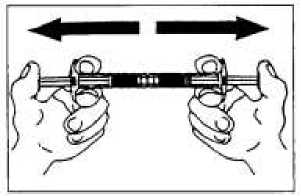
Promíchávání asi 10 krát
Odstraňte uzávěr z předplněné stříkačky s práškem. Stříkačku držte ve vzpřímené poloze, aby se obsah nevysypal.
Otevřete obal s konektorem bez toho, abyste konektor vyndali.
Našroubujte injekční stříkačku s práškem na konektor v původním balení a teprve potom jej odstraňte.
Na volný konec konektoru pevně našroubujte injekční stříkačku s rozpouštědlem.
Vytlačte rozpouštědlo do injekční stříkačky s práškem a potom směs opět přetlačte zpět.
První dva až tři pohyby neprovádějte až na doraz.
Směs se musí přemisťovat tak dlouho, (alespoň 10 krát) než se vytvoří homogenní, mléčná suspenze bílé nebo nažloutlé barvy.
Odstraňte konektor s prázdnou injekční stříkačkou.
Na injekční stříkačku s připravenou suspnzí nasaďte injekční jehlu.
Připravenou suspenzi ihned aplikujte hluboko intramuskulárně nebo subkutánně.
8/8