Caspofungin Sandoz 50 Mg
Sp. zn. sukls182264/2014, sukls182294/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Caspofungin Sandoz 50 mg Caspofungin Sandoz 70 mg prášek pro koncentrát pro infuzní roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Caspofungin Sandoz 50 mg: jedna injekční lahvička obsahuje caspofunginum 50 mg ( jako caspofungini diacetas). Koncentrace rekonstituovaného obsahu injekční lahvičky je 5,2 mg/ml.
Caspofungin Sandoz 70 mg: jedna injekční lahvička obsahuje caspofunginum 70 mg ( jako caspofungini diacetas). Koncentrace rekonstituovaného obsahu injekční lahvičky je 7,2 mg/ml.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Bílý až téměř bílý prášek.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
• Léčba invazivní kandidózy u dospělých nebo pediatrických pacientů.
• Léčba invazivní aspergilózy u dospělých nebo pediatrických pacientů, kteří jsou refrakterní vůči amfotericinu B, lipidovým lékovým formám amfotericinu B a/nebo itrakonazolu, nebo kteří uvedené látky nesnášejí. Refrakterita je definována jako progrese infekce nebo absence zlepšení po minimálně 7 dnech předcházejících terapeutických dávek účinné antimykotické terapie.
• Empirická terapie předpokládané mykotické infekce (jako jsou Candida nebo Aspergillus) u febrilních neutropenických dospělých nebo pediatrických pacientů.
4.2 Dávkování a způsob podání
Léčbu přípravkem Caspofungin Sandoz má zahájit lékař se zkušenostmi s léčbou invazivních mykotických
infekcí.
Dávkování
Dospělí pacienti
První den je nutno podat jednu 70mg nárazovou dávku, poté následují dávky 50 mg denně. U pacientů s tělesnou hmotností nad 80 kg se doporučuje po úvodní nárazové dávce 70 mg pokračovat dávkou 70 mg kaspofunginu denně (viz bod 5.2). S ohledem na pohlaví nebo rasu není žádná úprava dávky potřebná (viz bod 5.2).
Pediatričtí pacienti (12 měsíců až 17 let)
U pediatrických pacientů (ve věku 12 měsíců až 17 let) musí být dávkování odvozeno od plochy povrchu těla pacienta (viz Návod k použití u pediatrických pacientů, Mostellerův1 vzorec). Ve všech indikacích se musí první den podat jedna nárazová dávka 70 mg/m2 (nesmí se přesáhnout skutečná dávka 70 mg), poté následuje dávka 50 mg/m2 denně (nesmí přesáhnout skutečnou dávku 70 mg). Pokud je dávka 50 mg/m2 denně dobře snášena, ale nevede k odpovídající klinické odpovědi, lze denní dávku zvýšit na 70 mg/m2 denně (nesmí se přesáhnout skutečná denní dávka 70 mg).
Bezpečnost a účinnost kaspofunginu nebyla v klinických hodnoceních s novorozenci a kojenci mladšími 12 měsíců věku dostatečně studována. Při léčbě této věkové skupiny se doporučuje zvýšená opatrnost. Omezené údaje naznačují, že u novorozenců a kojenců (ve věku do 3 měsíců) se může zvážit podávání kaspofunginu v dávce 25 mg/m2 denně a u kojenců (ve věku 3 až 11 měsíců) v dávce 50 mg/m2 denně (viz bod 5.2).
Trvání léčby
Délka empirické léčby má vycházet z klinické odpovědi pacienta. Léčba má pokračovat po dobu až 72 hodin po úpravě neutropenie (ANC > 500). Pacienty, u nichž se zjistí mykotická infekce, je nutno léčit minimálně po dobu 14 dní a léčba má pokračovat po dobu alespoň 7 dní po úpravě jak neutropenie, tak klinických symptomů.
Délka léčby invazivní kandidózy má vycházet z klinické a mikrobiologické odpovědi pacienta. Po zmírnění známek a příznaků invazivní kandidózy a poté, co výsledky kultivace budou negativní, lze uvažovat o převedení pacienta na perorální antimykotickou léčbu. Obecně platí, že antimykotická terapie by měla pokračovat minimálně po dobu dalších 14 dní od poslední kultivace s pozitivním výsledkem.
Délka léčby invazivní aspergilózy se určuje individuálně a vychází ze závažnosti základního pacientova onemocnění, zotavení z imunosuprese a klinické odpovědi. Obecně lze říci, že léčba musí pokračovat minimálně po dobu 7 dní po ústupu symptomů.
Informace o bezpečnosti trvání léčby delším než 4 týdny jsou omezené. Dostupné údaje nicméně naznačují, že kaspofungin je při delších léčebných kúrách (až 162 dní u dospělých pacientů a až 87 dní u pediatrických pacientů) nadále dobře snášen.
Zvláštní populace
Starší pacienti
U starších pacientů (65 let a starších) se plocha pod křivkou (area under the curve, AUC) zvyšuje přibližně o 30 %. Není však nutno systematicky dávku upravovat. Jsou pouze omezené zkušenosti s léčbou u pacientů ve věku 65 let a více (viz bod 5.2).
'Mosteller RD: Simplified Calculation of Body Surface Area. N Engl J Med 1987 Oct 22;317(17):1098 (letter)
Porucha funkce ledvin
U pacientů s poruchou funkce ledvin není nutno dávku upravovat (viz bod 5.2).
Porucha funkce jater
Při lehké poruše funkce jater (Child-Pughovo skóre 5-6) není u dospělých pacientů žádné úpravy dávky zapotřebí. U dospělých pacientů se středně těžkou poruchou funkce jater (Child-Pughovo skóre 7-9) se na základě farmakokinetických údajů doporučuje podávat kaspofungin v dávce 35 mg denně. První den je nutno podat počáteční 70mg nárazovou dávku. U dospělých pacientů s těžkou poruchou funkce jater (Child-Pughovo skóre nad 9) a u pediatrických pacientů s jakýmkoli stupněm poruchy funkce jater nejsou k dispozici žádné klinické zkušenosti (viz bod 4.4).
Současné podávání s induktory metabolických enzymů
Omezené množství údajů naznačuje, že zvýšení denní dávky kaspofunginu na 70 mg po 70mg nárazové dávce je při současném podávání kaspofunginu dospělým pacientům s některými induktory metabolických enzymů třeba zvážit (viz bod 4.5). Pokud se kaspofungin podává pediatrickým pacientům (ve věku 12 měsíců až 17 let) spolu s týmiž induktory metabolických enzymů (viz bod 4.5), je nutno podávání kaspofunginu v dávce 70 mg/m2 denně zvážit (nesmí se přesáhnout skutečná denní dávka 70 mg).
Způsob podání
Po rekonstituci a naředění je nutno roztok aplikovat pomalou intravenózní infuzí trvající přibližně 1 hodinu. Pokyny k rekonstituci jsou uvedeny v bodě 6.6.
K dispozici jsou lahvičky o obsahu 70 mg i 50 mg.
Přípravek Caspofungin Sandoz se má podávat jako jedna infuze denně.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
V průběhu podávání kaspofunginu byla hlášena anafylaxe. Pokud se tak stane, kaspofungin musí být vysazen a musí být poskytnuta odpovídající léčba. Byly hlášeny pravděpodobně histaminem zprostředkované nežádoucí účinky zahrnující vyrážku, otok obličeje, angioedém, svědění, pocit tepla
nebo bronchospasmus, které mohou vyžadovat přerušení podávání kaspofunginu a/nebo poskytnutí odpovídající léčby.
Z omezeného množství dat lze usuzovat, že méně běžné non-Candida kvasinky a non-Aspergillus plísně nejsou na kaspofungin citlivé. Účinnost kaspofunginu na tyto mykotické patogeny nebyla stanovena.
Současné podávání kaspofunginu s cyklosporinem bylo hodnoceno u zdravých dospělých dobrovolníků i u dospělých nemocných. Několik zdravých dospělých dobrovolníků, jimž byly podány dvě dávky cyklosporinu
3 mg/kg s kaspofunginem, vykázalo přechodné zvýšení alaninaminotransferázy (ALT) a
aspartátaminotransferázy (AST) ve výši menší nebo rovnající se trojnásobku horní hranice normálu (ULN), které vymizelo při ukončení léčby. V retrospektivní studii se 40 pacienty léčenými kaspofunginem (po uvedení na trh) a cyklosporinem po dobu 1 až 290 dní (medián 17,5 dne) nebyly pozorovány žádné vážné nežádoucí účinky na játra. Tyto údaje naznačují, že kaspofungin lze podávat pacientům užívajícím cyklosporin v případech, kdy případný léčebný přínos převáží možné riziko. Při současném podávání kaspofunginu a cyklosporinu je třeba zvážit nutnost pečlivého sledování jaterních enzymů.
U dospělých pacientů s lehkou a středně těžkou poruchou fUnkce jater se hodnota AUC zvýšila o 20 %, resp. 75 % . Při středně těžké poruše funkce jater se u dospělých doporučuje snížení denní dávky na 35 mg.
U dospělých s těžkou poruchou funkce jater a u pediatrických pacientů s jakýmkoli stupněm poruchy funkce jater nejsou žádné klinické zkušenosti. Předpokládá se vyšší expozice než při středně těžké poruše funkce jater, přičemž u těchto pacientů je nutno kaspofungin užívat opatrně (viz body 4.2 a 5.2).
U zdravých dobrovolníků a u dospělých a pediatrických pacientů léčených kaspofunginem byly pozorovány laboratorní abnormality v testech jaterních funkcí. U některých dospělých a pediatrických pacientů se závažnými základními chorobami, kteří byli vedle kaspofunginu léčeni mnoha dalšími léky, byly hlášeny případy klinicky významné dysfunkce jater, hepatitidy a selhání jater; příčinná souvislost s kaspofunginem nebyla prokázána. Pacienti, u nichž se během léčby kaspofunginem objevily abnormální testy jaterních funkcí, musí být sledováni s ohledem na známky zhoršení jaterních funkcí a poměr rizika a přínosů při pokračování v léčbě kaspofunginem musí být znova zhodnocen.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Studie in vitro ukazují, že kaspofungin není inhibitorem žádného enzymu systému cytochromu P450 (CYP).
V klinických studiích kaspofungin neindukoval metabolismus CYP3A4 jiných látek. Kaspofungin není substrátem P-glykoproteinu a je špatným substrátem enzymů cytochromu P450. Ve farmakologických a klinických studiích však bylo zjištěno, že dochází k interakci kaspofunginu s jinými léčivými přípravky (viz dále).
Ve dvou klinických studiích provedených u zdravých dospělých jedinců zvyšoval cyklosporin A (jedna dávka
4 mg/kg nebo dvě dávky 3 mg/kg v odstupu 12 hodin) AUC kaspofunginu přibližně o 35 %. Tato zvýšení AUC jsou pravděpodobně výsledkem sníženého vychytávání kaspofunginu játry. Kaspofungin nezvyšoval plasmatické hladiny cyklosporinu. Při současném podání kaspofunginu a cyklosporinu došlo k přechodnému zvýšení jaterních ALT a AST ve výši menší nebo rovnající se trojnásobku horní hranice normálu (ULN), které vymizelo po ukončení léčby. V retrospektivní studii se 40 pacienty léčenými kaspofunginem (po uvedení na trh) a cyklosporinem po dobu 1 až 290 dní (medián 17,5 dne) nebyly pozorovány žádné vážné nežádoucí účinky na játra (viz bod 4.4). Při současném podávání obou léků je třeba zvážit nutnost pečlivého sledování jaterních enzymů.
Kaspofungin u zdravých dospělých dobrovolníků snižoval minimální koncentrace takrolimu o 26 %. U pacientů léčených oběma léky je povinné standardní monitorování koncentrací takrolimu v krvi a příslušná úprava dávky takrolimu.
Klinické studie u zdravých dospělých dobrovolníků ukazují, že farmakokinetika kaspofunginu není v klinicky významné míře narušena itrakonazolem, amfotericinem B, mykofenolátem, nelfinavirem ani takrolimem. Kaspofungin neměl vliv na farmakokinetiku amfotericinu B, itrakonazolu, rifampicinu ani mykofenolát mofetilu. I když údaje o bezpečnosti jsou omezené, zdá se, že při současném podávání amfotericinu B, itrakonazolu, nelfinaviru a mykofenolát mofetilu s kaspofunginem nejsou žádná zvláštní opatření nutná.
Rifampicin vedl u zdravých dospělých dobrovolníků k 60% zvýšení AUC a 170% zvýšení minimálních koncentrací kaspofunginu první den současného podávání, pokud bylo podávání obou léků zahájeno současně. Minimální koncentrace kaspofunginu se při opakovaném podávání postupně snižovaly. Po dvoutýdenním podávání měl rifampicin omezený účinek na AUC, ale minimální hladiny byly o 30 % nižší než u dospělých jedinců, kteří dostávali kaspofungin samostatně. Mechanismus interakce by mohl snad být výsledkem počáteční inhibice a následné indukce transportních proteinů. Podobný účinek lze očekávat u jiných léčivých přípravků indukujících metabolické enzymy. Omezené množství údajů z populačních farmakokinetických studií ukazuje, že současné podávání kaspofunginu s induktory efavirenzem, nevirapinem, rifampicinem, dexametazonem, fenytoinem nebo karbamazepinem by mohlo vést ke snížení AUC kaspofunginu. Při současném podávání induktorů metabolických enzymů je u dospělých pacientů třeba zvýšení denní dávky kaspofunginu na 70 mg po 70mg nárazové dávce zvážit (viz bod 4.2).
Všechny výše popsané studie lékových interakcí u dospělých byly provedeny s denní dávkou 50 nebo 70 mg kaspofunginu. Interakce vyšších dávek kaspofunginu s jinými léčivými přípravky nebyly formálně hodnoceny.
U pediatrických pacientů výsledky regresních analýz farmakokinetických údajů naznačují, že současné podávání dexamethasonu s kaspofunginem může vést ke klinicky významným snížením minimálních koncentrací kaspofunginu. Toto zjištění může ukazovat na to, že u pediatrických pacientů dojde k podobným snížením navozeným induktory jako u dospělých. Pokud se kaspofungin pediatrickým pacientům (ve věku 12 měsíců až 17 let) podává společně s induktory metabolismu léčiv, jako je rifampicin, efavirenz, nevirapin, fenytoin, dexamethason nebo karbamazepin, je nutno podávání kaspofunginu v dávce 70 mg/m2 denně zvážit (nesmí se přesáhnout skutečná denní dávka 70 mg).
4.6 Fertilita, těhotenství a kojení
O používání kaspofunginu u těhotných žen nejsou k dispozici žádné nebo jen omezené údaje. Kaspofungin se nemá během těhotenství používat, pokud to není jednoznačně nutné. Studie na zvířatech prokázaly vývojovou toxicitu (viz bod 5.3). Ve studiích se zvířaty bylo zjištěno, že kaspofungin prochází placentární bariérou.
Kojení
Není známo, zda se kaspofungin vylučuje do lidského mateřského mléka. Dostupné
farmakodynamické/toxikologické údaje u zvířat ukázaly, že se kaspofungin vylučuje do mléka. Ženy, kterým je podáván kaspofungin, nemají kojit.
Fertilita
Ohledně kaspofunginu nebyly ve studiích na samcích a samicích potkanů žádné účinky na fertilitu pozorovány (viz bod 5.3). K vyhodnocení vlivu na fertilitu nejsou k dispozici žádné klinické údaje.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny.
4.8 Nežádoucí účinky
Byly hlášeny hypersenzitivní reakce (anafylaxe a pravděpodobně histaminem zprostředkované nežádoucí účinky (viz bod 4.4).
U pacientů s invazivní aspergilózou byl rovněž hlášen plicní edém, syndrom dechové tísně dospělých (adult respirátory distress syndrome - ARDS) a radiograficky zjištěné infiltráty.
Dospělí pacienti
V klinických studiích dostalo 1 865 dospělých jedinců jednorázové nebo opakované dávky kaspofunginu:
564 febrilních neutropenických pacientů (studie empirické terapie), 382 pacientů s invazivní kandidózou,
228 pacientů s invazivní aspergilózou, 297 pacientů s lokalizovanými kandidózami a 394 jedinců zařazených do studií I. fáze. Ve studii empirické terapie byli pacienti léčeni chemoterapií pro malignitu a podstoupili transplantaci hematopoetických kmenových buněk (včetně 39 alogenních transplantací). Většina pacientů s invazivními kandidózami měla ve studiích zahrnujících pacienty s prokázanou kandidovou infekcí závažné základní onemocnění či stav (např. hematologickou nebo jinou malignitu, velký chirurgický výkon v nedávné době, HIV) vyžadující současné podávání několika léků. Pacienti v nesrovnávací studii s patogenem Aspergillus měli často závažné predisponující postižení nebo stav (např. transplantaci kostní dřeně nebo periferních kmenových buněk, hematologickou malignitu, solidní nádor nebo orgánovou transplantaci) vyžadující současné podávání několika léků.
Ve všech pacientských populacích byla často uváděným lokálním nežádoucím účinkem v místě vpichu injekce flebitida. Mezi další místní reakce patřily erytém, bolest/bolestivost, svědění, výtoky a pocity pálení.
Uváděné klinické a laboratorní abnormality u všech dospělých léčených kaspofunginem (celkem 1 780) byly typicky mírné a k ukončení léčby vedly vzácně.
Byly hlášeny následující nežádoucí účinky:
[velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (> 1/1 000 až < 1/100)]
Poruchy krve a lymfatického systému:
Časté: snížená hladina hemoglobinu, snížený hematokrit, snížený počet leukocytů
Méně časté: anemie, trombocytopenie, koagulopatie, leukopenie, zvýšený počet eozinofilů, snížený počet trombocytů, zvýšený počet trombocytů, snížený počet lymfocytů, zvýšený počet leukocytů, snížený počet neutrofilů
Poruchy metabolismu a výživy:
Časté: hypokalemie
Méně časté: hyperhydratace, hypermagnesemie, anorexie, elektrolytová nerovnováha, hyperglykemie, hypokalcemie, metabolická acidóza
Psychiatrické poruchy:
Méně časté: úzkost, dezorientace, insomnie Poruchy nervového systému:
Časté: bolesti hlavy
Méně časté: závrať, dysgeuzie, parestezie, somnolence, tremor, hypestezie Poruchy oka:
Méně časté: oční ikterus, rozmazané vidění, edém očního víčka, zvýšená tvorba slz Srdeční poruchy:
Méně časté: palpitace, tachykardie, arytmie, fibrilace síní, městnavé srdeční selhání Cévní poruchy:
Časté: flebitida
Méně časté: tromboflebitida, zrudnutí, návaly horka, hypertenze, hypotenze Respirační, hrudní a mediastinální poruchy:
Časté: dyspnoe
Méně časté: nazální kongesce, faryngolaryngeální bolest, tachypnoe, bronchospasmus, kašel, paroxysmální noční dušnost, hypoxie, chropy, sípot
Gastrointestinální poruchy:
Časté: nauzea, průjem, zvracení
Méně časté: bolesti břicha, bolest horní poloviny břicha, sucho v ústech, dyspepsie, diskomfort v oblasti žaludku, břišní distenze, ascites, zácpa, dysfagie, flatulence
Poruchy jater a žlučových cest:
Časté: zvýšené hodnoty jaterních testů (alaninaminotransferáza, aspartátaminotransferáza, alkalická fosfatáza, konjugovaný bilirubin, sérový bilirubin)
Méně časté: cholestáza, hepatomegalie, hyperbilirubinemie, ikterus, abnormální funkce jater, hepatotoxicita, jaterní porucha, zvýšení hladiny gama-glutamyltransferáza
Poruchy kůže a podkožní tkáně:
Časté: exantém, svědění, erytém, hyperhidróza
Méně časté: erythema multiforme, makulární exantém, makulo-papulámí exantém, svědivý kožní exantém, kopřivka, alergická dermatitida, generalizovaný pruritus, erytematózní exantém, generalizovaný exantém, morbiliformní exantém, kožní léze
Poruchy svalové a kosterní soustavy a pojivové tkáně:
Časté: artralgie
Méně časté: bolest zad, bolest v končetinách, bolest kostí, svalová slabost, myalgie Poruchy ledvin a močových cest:
Méně časté: renální selhání, akutní renální selhání Celkové poruchy a reakce v místě aplikace:
Časté: pyrexie, zimnice, svědění v místě infuze
Méně časté: bolest, bolest v místě katetru, únava, pocit chladu, pocit horka, erytém v místě infuze, indurace v místě infuze, bolest v místě infuze, otok v místě infuze, flebitida v místě injekce, periferní edém, citlivost, diskomfort v oblasti hrudníku, bolest na hrudi, otok obličeje, pocit změny tělesné teploty, indurace, extravazace v místě infuze, podráždění v místě infuze, flebitida v místě infuze, vyrážka v místě infuze, kopřivka v místě infuze, erytém v místě injekce, edém v místě injekce, bolest v místě injekce, otok v místě injekce, malátnost, edém
Vyšetření:
Časté: snížený draslík v krvi, snížený albumin v krvi
Méně časté: zvýšená hladina kreatininu v krvi, pozitivní nález erytrocytů v moči, snížená celková bílkovina, přítomnost bílkoviny v moči, prodloužený protrombinový čas, zkrácený protrombinový čas, snížená hladina sodíku v krvi, zvýšená hladina sodíku v krvi, snížená hladina vápníku v krvi, zvýšená hladina vápníku v krvi, snížená hladina chloridů v krvi, zvýšená hladina glukózy v krvi, snížená hladina draslíku v krvi, snížená hladina fosforu v krvi, zvýšená hladina fosforu v krvi, zvýšená hladina močoviny v krvi, prodloužený aktivovaný parciální tromboplastinový čas, snížená hladina bikarbonátu v krvi, zvýšená hladina chloridů v krvi, zvýšená hladina draslíku v krvi, zvýšený krevní tlak, hladina kyseliny močové v krvi, přítomnost krve v moči, abnormální dýchací šelesty, snížení parciálního tlaku oxidu uhličitého, zvýšená hladina imunosupresiv, zvýšení INR, nález močových válců v moči, moč pozitivní na leukocyty a zvýšené pH moči.
Kaspofungin byl u 100 dospělých pacientů rovněž hodnocen v dávce 150 mg denně (po dobu až 51 dní) (viz bod 5.1). Studie porovnávala kaspofungin v dávce 50 mg denně (po 70mg nárazové dávce 1. den) oproti 150 mg denně při léčbě invazivní kandidózy. V této skupině pacientů byla bezpečnost kaspofunginu ve vyšší dávce celkově podobná bezpečnosti u pacientů, kteří dostávali 50mg denní dávky kaspofunginu. Podíl pacientů se závažnými nežádoucími reakcemi souvisejícími s léčivem nebo s nežádoucími reakcemi souvisejícími s léčivem vedoucími k vysazení kaspofunginu byl v obou léčených skupinách srovnatelný.
Pediatričtí pacienti
Údaje z 5 klinických studií dokončených u 171 pediatrických pacientů naznačují, že celková incidence klinických nežádoucích účinků (26,3 %; 95% interval spolehlivosti -19,9, 33,6) není horší než celková incidence hlášená u dospělých léčených kaspofunginem (43,1 %; 95% interval spolehlivosti -40,0, 46,2). V porovnání s dospělými pacienty mají však pediatričtí pacienti pravděpodobně jiný profil nežádoucích účinků. Nejčastějšími klinickými nežádoucími účinky souvisejícími s léčivem hlášenými u pediatrických pacientů léčených kaspofunginem byla pyrexie (11,7 %), vyrážka (4,7 %) a bolest hlavy (2,9 %).
Byly hlášeny následující nežádoucí účinky:
[velmi časté (>1/10), časté (>1/100 až <1/10)]
Poruchy krve a lymfatického systému:
Časté: zvýšený počet eozinofilů Poruchy nervového systému:
Časté: bolest hlavy Srdeční poruchy:
Časté: tachykardie Cévní poruchy:
Časté: zrudnutí, hypotenze Poruchy jater a žlučových cest:
Časté: zvýšená hladina jaterních enzymů (AST, ALT)
Poruchy kůže a podkožní tkáně:
Časté: vyrážka, pruritus
Celkové poruchy a reakce v místě aplikace:
Velmi časté: horečka
Časté: zimnice, bolest v místě katetru
Vyšetření:
Časté: snížená hladina draslíku, hypomagnesemie, zvýšená hladina glukózy, snížená hladiny fosforu a zvýšená hladina fosforu
Zkušenosti _po uvedení na trh:
Po uvedení na trh byly popsány následující nežádoucí účinky:
Poruchy jater a žlučových cest:
Jaterní dysfunkce, zvýšení hladiny gama-glutamyltransferázy Celkové poruchy a reakce v místě aplikace:
Otok a periferní edém Vyšetření:
Hyperkalcemie
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10, webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek.
4.9 Předávkování
Bylo hlášeno neúmyslné podání kaspofunginu v dávce až 400 mg v jednom dni. Tato situace nevedla k žádným klinicky významným nežádoucím účinkům. Kaspofungin nelze z organizmu odstranit dialýzou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antimykotika pro systémovou aplikaci, ATC kód: J02AX04 Mechanismus účinku
Kaspofungin-acetát je polosyntetická lipopeptidová (echinokandin) sloučenina syntetizovaná z produktu fermentace Glarea lozoyensis. Kaspofungin-acetát inhibuje syntézu beta (1,3)-D-glukanu, který je základní složkou buněčné stěny mnoha vláknitých hub a kvasinek. Beta (1,3)-D-glukan není v buňkách savců přítomen.
Byl prokázán fungicidní účinek kaspofunginu proti kvasinkám Candida. Studie in vitro a in vivo prokázaly, že expozice plísně Aspergillus kaspofunginu vede k lýze a odumření špiček hrotů a bodů větvení hyf, kde dochází k růstu a dělení buněk.
Farmakodynamické účinky
Kaspofungin má in vitro účinek proti druhům Aspergillus (Aspergillus fumigatus [n = 75], Aspergillus flavus [n = 111], Aspergillus niger [n = 31], Aspergillus nidulans [n = 8], Aspergillus terreus [n = 52] a Aspergillus candidus [n = 3]). Kaspofungin rovněž vykazuje in vitro aktivitu vůči druhům Candida (Candida albicans [n = 1 032], Candida dubliniensis [n = 100], Candida glabrata [n = 151], Candida guilliermondii [n = 67], Candida kefyr [n = 62], Candida krusei [n = 147], Candida lipolytica [n = 20], Candida lusitaniae [n = 80], Candidaparapsilosis [n = 215], Candida rugosa [n = 1] a Candida tropicalis [n = 258]), včetně izolátů s mutacemi v transportních mechanismech vícečetné rezistence a izolátů se získanou nebo přirozenou rezistencí na flukonazol, amfotericin B a 5-flucytosin. Testování citlivosti se provádělo podle modifikace metody M38-A2 (pro rod Aspergillus) a metody M27-A3 (pro rod Candida) Institutu pro klinické a laboratorní standardy (Clinical and Laboratory Standards Institute - CLSI, dříve znám pod názvem Národní výbor pro klinické laboratorní standardy [NCCLS]). EUCAST stanovila standardizované techniky testování citlivosti kvasinek. Nicméně EUCAST neschválila interpretační hraniční koncentrace pro kaspofungin. U malého počtu pacientů byly během léčby zjištěny izoláty kandidy se sníženou citlivostí na kaspofungin (za použití standardizovaných testovacích technik schválených CLSI byly hlášeny MIC kaspofunginu > 2 mg/l (4- až 30násobný vzestup MIC)). Zjištěný mechanismus rezistence spočíval v mutaci genu FKS1/FKS2. Tyto případy byly spojeny se špatnými klinickými výsledky. Byl zjištěn rozvoj in vitro rezistence vůči kaspofunginu u rodu Aspergillus. Při omezených klinických zkušenostech byla pozorována rezistence vůči kaspofunginu u pacientů s invazivní aspergilózou. Mechanismus rezistence není znám. Incidence rezistence vůči kaspofunginu u různých klinických izolátů Candida a Aspergillus je vzácná.
Klinická účinnost a bezpečnost
Invazivní kandidóza u dospělých pacientů: do zahajovací srovnávající kaspofungin a amfotericin B při léčbě invazivní kandidózy bylo zařazeno dvě stě třicet devět pacientů. Dvacet čtyři pacienti měli neutropenii. Nejčastějšími diagnózami byly infekce krevního oběhu (kandidemie) 77 %, n = 186), a peritonitida vyvolaná druhy Candida (8 %, n = 19); pacienti s endokarditidou, osteomyelitidou nebo meningitidou, vyvolanými druhy Candida, byli z této studie vyloučeni. Kaspofungin byl po 70mg nárazové dávce podáván v dávce 50 mg jednou denně, zatímco amfotericin B byl podáván v dávkách 0,6 až 0,7 mg/kg/den pacientům bez neutropenie nebo v dávkách 0,7 až 1,0 mg/kg/den pacientům s neutropenií. Průměrná délka intravenózní terapie byla 11,9 dní, s rozmezím 1 až 28 dní. Příznivá odpověď byla definována jako ústup symptomů i mikrobiologické vyléčení kandidózy.
Do primární analýzy účinnosti (analýza MITT), hodnotící odpověď na konci studie s i.v. terapií, byli zařazeni 224 pacienti; poměr příznivé odpovědi na léčbu invazivní kandidózy byl u kaspofunginu (73 % [80/109]) a amfotericinu B (62 % [71/115]) srovnatelný [% rozdíl 12,7 (95,6% interval spolehlivosti -0,7, 26,0)]. U pacientů s kandidemií byl poměr příznivé odpovědi na konci studie s i.v. terapií v primární analýze účinnosti (analýza MITT) u kaspofunginu (72 % [66/92] a amfotericinu B (63 % [59/94] srovnatelný [% rozdíl 10,0 (95,0% interval spolehlivosti -4,5, 24,5)]. Údaje u pacientů s místy infekce mimo krevní řečiště byly omezenější. Poměr příznivé odpovědi u pacientů s neutropenií byl 7/14 (50 %) ve skupině s kaspofunginem a 4/10 (40 %) ve skupině s amfotericinem B. Tyto omezené údaje jsou podpořeny výstupy studie empirické terapie.
Ve druhé studii dostávali pacienti s invazivní kandidózou denní dávky kaspofunginu 50 mg/den (po 70mg nárazové dávce 1. den) nebo kaspofungin v dávce 150 mg/den (viz bod 4.8). V této studii byla dávka kaspofunginu podávána po dobu 2 hodin (místo obvyklého jednohodinového podávání). Do studie nebyli zařazeni pacienti s podezřením na endokarditidu, meningitidu nebo osteomyelitidu vyvolanou druhy Candida. Jelikož šlo o studii primární terapie, nebyli zařazeni ani pacienti, kteří byli refrakterní na předtím podávaná antimykotika. Rovněž byl omezen počet neutropenických pacientů zařazených do této studie (8,0 %). Účinnost byla v této studii sekundárním kritériem hodnocení. Do analýzy účinnosti byli zařazeni pacienti, kteří vyhověli kritériím pro zařazení a kteří dostali jednu nebo více dávek hodnocené terapie kaspofunginem. Výskyt příznivé celkové odpovědi na konci léčby kaspofunginem byl v obou léčených skupinách podobný: 72 % (73/102) u skupiny léčené kaspofunginem v dávce 50 mg a 78 % (74/95) u skupiny léčené kaspofunginem v dávce 150 mg (rozdíl 6,3 % [95% CI -5,9, 18,4]).
Invazivní aspergilóza u dospělých pacientů: do otevřené nesrovnávací studie s cílem zhodnotit bezpečnost, snášenlivost a účinnost kaspofunginu bylo zařazeno 69 dospělých pacientů (ve věku 18 až 80) s invazivní aspergilózou. Pacienti museli být buď refrakterní (progrese onemocnění nebo neúspěšnost zlepšení jinými antimykotickými terapiemi podávanými po dobu alespoň 7 dní) (84 % zařazených pacientů) nebo trpěli nesnášenlivostí (16 % zařazených pacientů) jiných standardních antimykotických terapií. Většina pacientů měla základní onemocnění (hematologická malignita [n = 24], alogenní transplantace kostní dřeně nebo transplantace kmenových buněk [n = 18], orgánová transplantace [n = 8], solidní nádor [n = 3] nebo jiná onemocnění [n = 10]). Pro stanovení diagnózy invazivní aspergilózy a odpovědi na terapii byly použity přesné definice, vytvořené podle kritérií skupiny pro studium mykóz (příznivá odpověď vyžadovala klinicky významné zlepšení radiogramů jakož i známek a symptomů). Průměrná doba trvání terapie byla 33,7 dní, s rozmezím 1 až 162 dní. Nezávislý sbor odborníků zjistil, že 41 % (26/63) pacientů, kteří dostali minimálně jednu dávku kaspofunginu, mělo příznivou odpověď. U pacientů s více než 7denní aplikací kaspofunginu jich u 50 % (26/52) byla odpověď příznivá.
Četnost příznivých odpovědí u pacientů buď refrakterních nebo nesnášejících předchozí terapie byla 36 %
(19/53) a 70 % (7/10) (v uvedeném pořadí). I když dávky předchozí antimykotické léčby u 5 pacientů zařazených jako nereagujících na léčbu byly nižší, než dávky často podávané při invazivní aspergilóze, byla četnost pozitivní odpovědi během terapie kaspofunginem u těchto pacientů podobná hodnotám, pozorovaným u zbývajících pacientů, nereagujících na léčbu (2/5 versus 17/48, v uvedeném pořadí). Podíl odpovědi u pacientů s plicním onemocněním a extrapulmonálním onemocněním byly 47 % (21/45) a 28 % (5/18), v uvedeném pořadí.
U pacientů s extrapulmonálním onemocněním 2 z 8 pacientů se současným jednoznačným, pravděpodobným nebo možným postižením CNS vykazovali příznivou odpověď.
Empirická terapie dospělých pacientů s horečkou a neutropenií: do klinické studie bylo zařazeno celkem 1 111 pacientů s perzistentní horečkou a s neutropenií, kteří byli léčeni buď kaspofunginem v dávce 50 mg jednou denně po 70mg nasycovací dávce nebo lipozomálním amfotericinem B v dávce 3,0 mg/kg/den. Vhodní pacienti podstoupili chemoterapii pro malignitu nebo transplantaci kmenových hemopoetických buněk a při výchozím vyšetření u nich byla zjištěna neutropenie (< 500 buněk/mm3 po dobu 96 hodin) a horečka (> 38,0 °C) nereagující na > 96hodinovou parenterální antibakteriální léčbu. Pacienti měli být léčeni po dobu až 72 hodin od ústupu neutropenie, maximálně po dobu 28 dní. Pacienty s prokázanou mykotickou infekcí však bylo možno léčit déle. Pokud byl lék dobře snášen, ale horečka u pacienta přetrvávala a klinický stav se po 5 dnech léčby zhoršil, bylo možno dávkování zkoušeného léku zvýšit na 70 mg/den kaspofunginu (13,3 % léčených pacientů) nebo na
5,0 mg/kg/den lipozomálního amfotericinu B (14,3 % léčených pacientů). Do primární modifikované analýzy účinnosti celkové příznivé odpovědi u všech pacientů zařazených do studie („Modified Intention-To-Treat -MITT“) bylo zařazeno 1 095 pacientů; kaspofungin (33,9 %) byl stejně účinný jako lipozomální amfotericin B (33,7 %) [% rozdílu 0,2 (95,2% interval spolehlivosti -5,6, 6,0)]. Celkově příznivá odpověď vyžadovala splnění všech 5 kritérií: (1) úspěšná léčba jakékoli vstupní mykotické infekce (kaspofungin 51,9 % [14/27], lipozomální amfotericin B 25,9 % [7/27]), (2) žádné nové mykotické infekce s náhlým rozvojem (breakthrough) infekce během podávání zkoušeného přípravku nebo do 7 dnů po ukončení léčby (kaspofungin 94,8 % [527/556], lipozomální amfotericin B 95,5 % [515/539]), (3) přežívání po dobu 7 dní po ukončení terapie v klinické studii (kaspofungin 92,6 % [515/556], lipozomální amfotericin B 89,2 % [481/539]), (4) absence nutnosti vysazení zkoušeného léku kvůli toxicitě spojené s přípravkem nebo kvůli nedostatečné účinnosti (kaspofungin 89,7 % [499/556], lipozomální amfotericin B 85,5 % [461/539]) a (5) ústup horečky během trvání neutropenie (kaspofungin 41,2 % [229/556], lipozomální amfotericin B 41,4 % [223/539]). Poměr odpovědí na kaspofungin a lipozomální amfotericin B u vstupních infekcí vyvolaných rodem Aspergillus byl v uvedeném pořadí 41,7 % (5/12) a 8,3 % (1/12) a u infekcí vyvolaných rodem Candida 66,7 % (8/12) a 41,7 % (5/12). U pacientů ve skupině s kaspofunginem došlo k novému náhlému rozvoji infekcí (breakthrough) vyvolaných následujícími pouze ojediněle se vyskytujícími kvasinkami a plísněmi: Trichosporon spp. (1), Fusarium spp. (1), Mucor spp.
(1) a Rhizopus spp. (1).
Pediatrická populace
Bezpečnost a účinnost kaspofunginu byla u pediatrických pacientů ve věku 3 měsíce až 17 let hodnocena ve dvou prospektivních, multicentrických klinických hodnoceních. Uspořádání studie, diagnostická kritéria a kritéria k vyhodnocení účinnosti byly podobné jako v odpovídajících studiích u dospělých pacientů (viz bod 5.1).
První studie, která zahrnovala 82 pacientů ve věku od 2 do 17 let byla randomizovanou, dvojitě zaslepenou studií porovnávající kaspofungin (50 mg/m2 i.v. jednou denně po nárazové dávce 70 mg/m2 podané první den [dávka nesměla přesáhnout 70 mg denně]) s lipozomálním amfotericinem B (3 mg/kg i.v. denně) v léčebném uspořádání v poměru 2:1 (56 léčených kaspofunginem, 26 lipozomálním amfotericinem B) jako empirickou léčbou pediatrických pacientů s přetrvávající horečkou a neutropenií. Celková četnost úspěšnosti podle modifikované analýzy výsledků všech randomizovaných subjektů, upravená podle úrovně rizikovosti, byla následující: 46,6 % (26/56) u kaspofunginu a 32,2 % (8/25) u lipozomálního amfotericinu B.
Druhá studie byla prospektivní, otevřená, bez komparátoru, která hodnotila bezpečnost a účinnost kaspofunginu u pediatrických pacientů (ve věku 6 měsíců až 17 let) s invazivní kandidózou, ezofageální kandidózou a invazivní aspergilózou (jako záchranná léčba). Bylo zařazeno čtyřicet devět pacientů, kterým byl kaspofungin podáván v dávce 50 mg/m2 i.v. jednou denně po nárazové dávce 70 mg/m2 první den (dávka nesměla přesáhnout 70 mg denně), z nichž 48 bylo zařazeno do modifikované analýzy všech pacientů zařazených do studie (MITT).
Z nich 37 mělo invazivní kandidózu, 10 invazivní aspergilózu a 1 ezofageální kandidózu. Podle indikace byla míra příznivých odpovědí na konci léčby kaspofunginem podle modifikované analýzy u všech pacientů zařazených do studie (MITT) následující: 81 % (30/37) u invazivní kandidózy, 50 % (5/10) u invazivní aspergilózy a 100 % (1/1) u ezofageální kandidózy.
5.2 Farmakokinetické vlastnosti
Distribuce
Kaspofungin se ve velké míře váže na albumin. Nenavázaná frakce kaspofunginu v plasmě tvoří od 3,5 % u zdravých dobrovolníků až po 7,6 % u pacientů s invazivní kandidózou. V plasmatické farmakokinetice kaspofunginu sehrává významnou úlohu distribuce, která v dispozičních fázích alfa a beta představuje rychlost regulující krok. Distribuce do tkání dosáhla maxima 1,5 až 2 dny po podání dávky, kdy 92 % dávky bylo rozděleno do tkání. Ve formě mateřské látky se do plasmy pravděpodobně vrací pouze malá frakce kaspofunginu vychytaná tkáněmi. Proto k eliminaci dochází bez distribuční rovnováhy, přičemž skutečný odhad distribučního objemu kaspofunginu v současnosti není možné stanovit.
Biotransformace
Kaspofungin podstupuje spontánní degradaci na sloučeninu s otevřeným řetězcem. Další metabolismus zahrnuje hydrolýzu peptidů a N-acetylaci. Dva intermediámí produkty, které vznikají během degradace kaspofunginu na sloučeninu s otevřeným řetězcem, se kovalentně naváží na plasmatické proteiny, což vede k ireverzibilní vazbě na plasmatické proteiny při nízkých hladinách.
In vitro studie ukázaly, že kaspofungin není inhibitorem enzymů 1A2, 2A6, 2C9, 2C19, 2D6 ani 3A4 cytochromu P450. V klinických studiích kaspofungin ani neindukoval, ani neinhiboval metabolismus jiných léčivých přípravků zprostředkovaný CYP3A4. Kaspofungin není substrátem P-glykoproteinu a je špatným substrátem enzymů cytochromu P450.
Eliminace
Eliminace kaspofunginu z plasmy je pomalá s clearance 10 až 12 ml/min. Koncentrace v plasmě po jednorázové jednohodinové intravenózní infuzi klesá ve více fázích. Krátká alfa fáze nastává bezprostředně po infuzi a je následována beta fází s poločasem 9 až 11 hodin. Dále se objevuje gama fáze s poločasem 45 hodin. Dominantním mechanismem, který ovlivňuje plasmatickou clearance, je distribuce, spíše než exkrece nebo metabolizace.
Během 27 dní bylo zachyceno přibližně 75 % radioaktivní dávky: 41 % v moči a 34 % ve stolici. Vylučování nebo metabolismus kaspofunginu v prvních 30 hodinách po podání jsou minimální. Vylučování je pomalé a terminální poločas radioaktivity byl 12 až 15 dní. Malé množství kaspofunginu se vylučuje močí v nezměněné podobě (přibližně 1,4 % dávky).
Kaspofungin vykazuje středně nelineární farmakokinetiku se zvýšeným hromaděním při zvyšování dávky a závislost na dávce z hlediska doby do dosažení ustáleného stavu při opakovaném podávání.
Zvláštní populace
U dospělých pacientů s poruchou funkce ledvin a lehkou poruchou funkce jater, u žen a u starších jedinců byla pozorována zvýšená expozice kaspofunginu. Obecně je zvýšení středně intenzivní a není natolik velké, aby bylo nutno dávku upravovat. U dospělých pacientů se středně těžkou poruchou funkce jater nebo u pacientů s vyšší tělesnou hmotností může být úpravy dávky potřebná (viz dále).
Tělesná hmotnost: v populační farmakokinetické analýze dospělých pacientů s kandidózou se ukázalo, že farmakokinetiku kaspofunginu ovlivňuje tělesná hmotnost. Plasmatické koncentrace se se zvyšováním hmotnosti snižovaly. Předpokládá se, že průměrná expozice u dospělého pacienta s hmotností 80 kg je asi o 23 % nižší než u dospělého pacienta s hmotností 60 kg (viz bod 4.2).
Porucha funkce jater: u dospělých pacientů s mírnou až středně těžkou poruchou funkce jater se AUC zvýšila o 20 % a 75 % (v uvedeném pořadí). S těžkou poruchou funkce jater u dospělých pacientů a u pediatrických pacientů s jakýmkoli stupněm poruchy funkce jater nejsou žádné klinické zkušenosti. Ve studii s opakovanými dávkami se ukázalo, že snížení denní dávky na 35 mg u dospělých pacientů se středně těžkou poruchou jaterní funkce vedlo k hodnotám AUC podobným jako u dospělých jedinců s normální funkcí jater, kteří dostávali standardní režim (viz bod 4.2).
Porucha funkce ledvin: v klinické studii s jednorázovou dávkou 70 mg byla farmakokinetika kaspofunginu u dospělých dobrovolníků s mírnou poruchou funkce ledvin (clearance kreatininu 50-80 ml/min) a kontrolních jedinců podobná. Středně těžká (clearance kreatininu 31 až 49 ml/min), těžká (clearance kreatininu 5 až 30 ml/min) a terminální (clearance kreatininu < 10 ml/min a závislost na dialýze) porucha funkce ledvin zvýšila plasmatické koncentrace kaspofunginu po podání jednorázové dávky (rozmezí 30 až 49 % u AUC). U dospělých pacientů s invazivní kandidózou, ezofageální kandidózou nebo invazivní aspergilózou, kteří dostali opakovaně denní dávky kaspofunginu v dávce 50 mg, se žádný významný účinek lehké až těžké poruchy funkce ledvin na koncentraci kaspofunginu neprojevil. U pacientů s poruchou funkce ledvin není nutno dávku nijak upravovat. Kaspofungin nelze odstraňovat dialýzou, takže po hemodialýze není nutné doplňující podání.
Pohlaví: plasmatické koncentrace kaspofunginu byly v průměru o 17 až 38 % vyšší u žen než u mužů.
Starší jedinci: u starších mužů bylo na rozdíl od mladých mužů pozorováno středně významné zvýšení AUC (28 %) a C24h (32 %). U pacientů léčených empiricky nebo u pacientů s invazivní kandidózou byl podobný malý vliv věku pozorován u starších pacientů ve srovnání s mladšími pacienty.
Rasa: farmakokinetická data pacientů žádné klinicky významné odlišnosti ve farmakokinetice kaspofunginu u bělochů, černochů, Hispánců a mesticů neprokázala.
Pediatričtí pacienti:
U dospívajících (věk 12 až 17 let), kterým byl kaspofungin podáván v dávce 50 mg/m2 denně (maximálně 70 mg denně) byla AUC0-24 hod kaspofunginu v plasmě obecně srovnatelná s AUC pozorovanou u dospělých, kterým byl kaspofungin podáván v dávce 50 mg denně. Všem dospívajícím byly podávány dávky > 50 mg denně, přičemž ve skutečnosti 6 z 8 dostalo maximální dávku 70 mg/den. Plasmatické koncentrace kaspofunginu byly u těchto dospívajících v porovnání s dospělými, kterým bylo podáváno 70 mg denně, což je dávka podávaná dospívajícím nejčastěji, sníženy.
U dětí (věk 2 až 11 let), kterým byl kaspofungin podáván v dávce 50 mg/m2 denně (maximálně 70 mg denně), byla AUC0-24 hod kaspofunginu v plasmě po opakovaných dávkách srovnatelná s AUC u dospělých, kterým byla podávána dávka kaspofunginu 50 mg/den.
U batolat (věk 12 až 23 měsíců), kterým byl kaspofungin podáván v dávce 50 mg/m2 denně (maximálně 70 mg denně), byla AUC0-24 hod kaspofunginu v plasmě po opakovaných dávkách srovnatelná s AUC u dospělých, kterým byla podávána dávka kaspofunginu 50 mg/den, a s AUC dětí (ve věku 2 až 11 let), kterým byla podána dávka 50 mg/m2 denně.
Celkově platí, že dostupné farmakokinetické údaje a údaje o účinnosti a bezpečnosti jsou pro pacienty ve věku 3 až 10 měsíců omezené. Farmakokinetické údaje od jednoho 10měsíčního dítěte, kterému byla podávána dávka 50 mg/m2 denně, ukázaly hodnotu AUC0-24 hod ve stejném rozmezí, jako byla pozorována u starších dětí a dospívajících při dávce 50 mg/m2, respektive dávce 50 mg, zatímco u jednoho 6měsíčního dítěte, kterému byla podávána dávka 50 mg/m2 denně, byla AUC0-24 hod o něco vyšší.
U novorozenců a kojenců do 3 měsíců věku, kterým byl kaspofungin podáván v dávce 25 mg/m2 denně (což odpovídá průměrné hodnotě denní dávky 2,1 mg/kg), byly maximální koncentrace kaspofunginu (Ci hod) a minimální koncentrace kaspofunginu (C24 hod) po opakovaných dávkách srovnatelné s koncentracemi pozorovanými u dospělých, kterým byl kaspofungin podáván v dávce 50 mg denně. První den byla u těchto novorozenců a dětí ve vztahu k dospělým C1 hod srovnatelná a C24 hod mírně zvýšená (36 %). Nicméně jak u C1 hod (geometrický průměr 4. den 11,73 pg/ml, rozpětí 2,63 až 22,05 pg/ml), tak u C24 hod (geometrický průměr 4. den 3,55 pg/ml, rozpětí 0,13 až 7,17 pg/ml) byla pozorována variabilita. Měření AUC0-24 hod nebyla v této studii provedena kvůli řídkému odběru vzorků plazmy. Nutno poznamenat, že účinnost a bezpečnost kaspofunginu nebyla u novorozenců a kojenců do 3 měsíců věku odpovídajícím způsobem v prospektivních klinických studiích hodnocena.
5.3 Předklinické údaje vztahující se k bezpečnosti
Studie toxicity s opakovanými dávkami u potkanů a opic s použitím dávek až 7 až 8 mg/kg podávaných intravenózně prokázaly reakce na místech aplikace injekce u potkanů a opic, známky uvolňování histaminu u potkanů a důkazy nežádoucích účinků na játra opic. Studie vývojové toxicity u potkanů prokázaly, že kaspofungin vede k poklesu tělesné hmotnosti plodu a zvýšení incidence neúplné osifikace obratlů, sternebra a kostí lebky po dávce 5 mg/kg, která byla spojena s nežádoucími účinky u matek, jako byly známky uvolňování histaminu u březích potkaních samic. Bylo pozorováno i zvýšení incidence krčních žeber. V in vitro zkouškách byl kaspofungin negativní z hlediska potenciální genotoxicity jakož i u chromozomálního testu kostní dřeně in vivo u myší. Nebyly provedeny žádné dlouhodobé studie se zvířaty s cílem hodnocení kancerogenního potenciálu. U kaspofunginu nebyly ve studiích prováděných na samcích a samicích potkanů až do dávky 5 mg/kg/den pozorovány žádné účinky na fertilitu.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Sacharóza
Mannitol
Kyselina jantarová Hydroxid sodný (k úpravě pH)
6.2 Inkompatibility
Nesměšujte s rozpouštědly obsahujícími glukózu, protože přípravek Caspofungin Sandoz není v rozpouštědlech obsahujících glukózu stabilní. S ohledem na neexistenci studií kompatibility se tento léčivý přípravek nesmí mísit s jinými léčivými přípravky.
6.3 Doba použitelnosti
2 roky
Rekonstituovaný koncentrát: má být použit okamžitě. Údaje o stabilitě ukazují, že koncentrát pro infuzní roztok lze uchovávat po dobu maximálně 24 hodin, pokud se lahvička uchovává při teplotě do 25 °C a je rekonstituována vodou na injekci.
Naředěný infuzní roztok k podání pacientovi: má být použít okamžitě. Údaje o stabilitě ukazují, že přípravek lze použít během 24 hodin, pokud se uchovává při teplotě do 25 °C, nebo během 48 hodin, pokud se intravenózní infuzní vak (láhev) uchovává v chladničce (2 °C - 8 °C) a obsah se naředí roztokem chloridu sodného 9 mg/ml (0,9%), 4,5 mg/ml (0,45%) nebo 2,25 mg/ml (0,225%) pro infuzi, nebo Ringerovým laktátovým roztokem.
Z mikrobiologického hlediska má být přípravek použít okamžitě. Není-li použit okamžitě, jsou doby uchovávání a podmínky před použitím v odpovědnosti uživatele a nemají být normálně delší než 24 hodin při 2 °C - 8 °C, neproběhla-li rekonstituce a naředění za kontrolovaných validovaných aseptických podmínek.
6.4 Zvláštní opatření pro uchovávání
Neotevřené injekční lahvičky: uchovávejte v chladničce (2 °C - 8 °C).
Podmínky uchovávání po rekonstituci a naředění léčivého přípravku viz bod 6.3.
6.5 Druh obalu a obsah balení
Caspofungin Sandoz 50 mg:
10ml lahvička ze skla třídy I s brombutylovou zátkou a červeným hliníkovým uzávěrem s transparentním odtrhovacím víčkem.
Caspofungin Sandoz 70 mg:
10ml lahvička ze skla třídy I s brombutylovou zátkou a oranžovým hliníkovým uzávěrem s transparentním odtrhovacím víčkem.
Dodáváno v balení po 1 injekční lahvičce.
6.6 Zvláštní opatření pro likvidaci přípravku a zacházení s ním
Rekonstituce přípravku Caspofungin Sandoz
NEPOUŽÍVEJTE ŽÁDNÁ ROZPOUŠTĚDLA OBSAHUJÍCÍ GLUKÓZU, protože přípravek Caspofungin Sandoz není v rozpouštědlech obsahujících glukózu stabilní. Přípravek Caspofungin Sandoz NESMÍCHÁVEJTE ANI NEPODÁVEJTE V INFUZI SOUČASNĚ S JINÝMI LÉKY, protože nejsou k dispozici žádné údaje o kompatibilitě přípravku Caspofungin Sandoz s jinými intravenózními látkami, aditivy nebo léčivými přípravky. Infuzní roztok zkontrolujte zrakem, zda neobsahuje částečky nebo zda nedošlo ke změně zbarvení.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
NÁVOD K POUŽITÍ U DOSPĚLÝCH PACIENTŮ
Krok 1 Rekonstituce přípravku v klasických injekčních lahvičkách
K rekonstituci prášku je nutno injekční lahvičku nechat ohřát na pokojovou teplotu a za aseptických podmínek přidat vodu na injekci v objemu 10,5 ml. Koncentrace rekonstituovaného obsahu injekčních lahviček bude
5,2 mg/ml (50ml injekční lahvička) nebo 7,2 mg/ml (70ml injekční lahvička).
Bílý až téměř bílý kompaktní lyofilizovaný prášek se úplně rozpustí. Opatrně míchejte, dokud nedostanete čirý a bezbarvý roztok. Rekonstituované roztoky je nutno vizuálně zkontrolovat na případnou přítomnost částic nebo na změnu zbarvení. Tento rekonstituovaný roztok lze uchovávat po dobu až 24 hodin při teplotě do 25 °C.
Krok 2 Přidání rekonstituovaného přípravku Caspofungin Sandoz k infuznímu roztoku pacienta
Rozpouštědly pro konečný infuzní roztok jsou: roztok chloridu sodného pro injekci nebo Ringerův laktátový roztok. Infuzní roztok se připravuje přidáním odpovídajícího množství rekonstituovaného koncentrátu (jak ukazuje tabulka níže) do 250ml infuzního vaku nebo láhve za aseptických podmínek. Je-li to z lékařského hlediska nutné, lze použít zmenšené infuzní objemy ve 100 ml pro denní dávky 50 mg nebo 35 mg. Roztok nepoužívejte, je-li zakalený nebo se vysrážel.
PŘÍPRAVA INFUZNÍHO ROZTOKU PRO DOSPĚLÉ
|
DÁVKA* |
Objem rekonstituovaného přípravku Caspofungin Sandoz k přenesení do vaku nebo láhve pro intravenózní infuzi |
Standardní příprava konečná koncentrace rekonstituovaného přípravku Caspofungin Sandoz přidaného do 250 ml |
Zmenšený infuzní objem konečná koncentrace rekonstituovaného přípravku Caspofungin Sandoz přidaného do 100 ml | |
|
50 mg |
10 ml |
0,20 mg/ml | ||
|
50 mg při zmenšeném objemu |
10 ml |
0,47 mg/ml | ||
|
35 mg při středně těžké poruše funkce jater |
7 ml |
0,14 mg/ml | ||
|
35 mg při středně těžké poruše funkce jater (z jedné 50mg lahvičky) při zmenšeném objemu |
7 ml |
0,34 mg/ml | ||
|
70 mg |
10 ml |
0,28 mg/ml |
Nedoporučuje se | |
|
70 mg | ||||
|
(ze dvou 50mg injekčních lahviček)** |
14 m |
l |
0,28 mg/ml |
Nedoporučuje se |
|
35 mg při středně těžké poruše funkce jater (z jedné 70mg injekční lahvičky) | ||||
|
5 ml |
0,14 mg/ml |
0,34 mg/ml | ||
*Při rekonstituci obsahu všech lahviček je nutno používat množství 10,5 ml.
** Pokud 70mg injekční lahvička není k dispozici, lze dávku 70 mg připravit ze dvou 50ml injekčních lahviček.
NÁVOD K POUŽITÍ U PEDIATRICKÝCH PACIENTŮ
Výpočet_plochy _povrchu těla (BSA) _pro _pediatrické dávkování
Před přípravou infuze vypočítejte plochu povrchu těla pacienta za pomoci následujícího vzorce (Mostellerův vzorec):
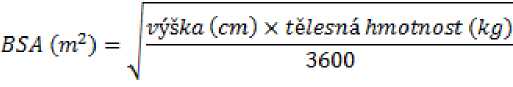
Příprava infuze pro dávku 70 mg/m2 pro pediatrické pacienty ve věku > 3 měsíce (za využití 50mg injekční lahvičky nebo 70ms injekční lahvičky)
1. Stanovte skutečnou nárazovou dávku, která se má použít u pediatrického pacienta za pomoci plochy povrchu těla pacienta (vypočteno dle výše uvedeného postupu) a následující rovnice:
BSA (m2) x 70 mg/m2 = nárazová dávka
Maximální nárazová dávka první den nesmí přesáhnout 70 mg bez ohledu na to, jaká dávka byla pro pacienta vypočítána.
2. Injekční lahvičku přípravku Caspofungin Sandoz vyjmutou z chladničky nechte ohřát na pokojovou teplotu.
3. Asepticky přidejte 10,5 ml vody na injekci.3 Tento rekonstituovaný roztok lze uchovávat po dobu až 24 hodin při teplotě do 25 °C.b Tím se získá konečná koncentrace přípravku Caspofungin Sandoz v injekční lahvičce
5.2 mg/ml (pokud se použije 50mg injekční lahvička) nebo 7,2 mg/ml (pokud se použije 70mg injekční lahvička).
4. Z injekční lahvičky odeberte objem léčivého přípravku rovný vypočtené nárazové dávce (krok 1). Tento objem (ml)c rekonstituovaného přípravku Caspofungin Sandoz asepticky přeneste do i.v. vaku (nebo láhve) obsahujícího 250 ml 0,9%; 0,45% nebo 0,225% roztoku chloridu sodného na injekci nebo Ringerova laktátového roztoku na injekci. Alternativně lze objem (ml)c rekonstituovaného přípravku Caspofungin Sandoz přidat do zmenšeného objemu 0,9%; 0,45% nebo 0,225% roztoku chloridu sodného na injekci nebo Ringerova laktátového roztoku na injekci tak, aby nebyla překročena konečná koncentrace 0,5 mg/ml. Tento infuzní roztok se musí použít do 24 hodin, pokud se uchovává při teplotě do 25 °C nebo do 48 hodin, pokud se uchovává v chladničce při teplotě 2 °C - 8 °C.
Příprava infuze pro dávku 50 mg/m2 pro pediatrické pacienty ve věku > 3 měsíce (za využití 50mg injekční lahvičky nebo 70mg injekční lahvičky)
1. Stanovte skutečnou udržovací dávku, která se má použít u pediatrického pacienta za pomoci plochy povrchu těla pacienta (vypočteno dle výše uvedeného postupu) a následující rovnice:
BSA (m2) x 50 mg/m2 = denní udržovací dávka
Denní udržovací dávka nesmí přesáhnout 70 mg bez ohledu na to, jaká dávka byla pro pacienta vypočítána.
2. Injekční lahvičku přípravku Caspofungin Sandoz vyjmutou z chladničky nechte ohřát na teplotu místnosti.
3. Asepticky přidejte 10,5 ml vody na injekci.íi Tento rekonstituovaný roztok lze uchovávat po dobu až 24 hodin při teplotě do 25 °C .b Tím se získá konečná koncentrace přípravku Caspofungin Sandoz v injekční lahvičce
5.2 mg/ml (pokud se použije 50mg injekční lahvička) nebo 7,2 mg/ml (pokud se použije 70mg injekční lahvička).
4. Z injekční lahvičky odeberte objem léčivého přípravku rovný vypočtené denní udržovací dávce (krok 1). Tento objem (ml)c rekonstituovaného přípravku Caspofungin Sandoz asepticky přeneste do i.v. vaku (nebo láhve) obsahujícího 250 ml 0,9%; 0,45% nebo 0,225% roztoku chloridu sodného na injekci nebo Ringerova laktátového roztoku na injekci. Alternativně lze objem (ml)c rekonstituovaného přípravku Caspofungin Sandoz přidat do zmenšeného objemu 0,9%; 0,45% nebo 0,225% roztoku chloridu sodného na injekci nebo Ringerova laktátového roztoku na injekci tak, aby nebyla překročena konečná koncentrace 0,5 mg/ml. Tento infuzní roztok se musí použít do 24 hodin, pokud se uchovává při teplotě do 25 °C , nebo do 48 hodin, pokud se uchovává v chladničce při teplotě 2°C - 8 °C.
Poznámky kpřípravě:
a. Bílý až téměř bílý kompaktní prášek se zcela rozpustí. Opatrně promíchávejte, dokud nezískáte čirý a bezbarvý roztok.
b. Rekonstituovaný roztok během rekonstituce a před podáním infuze vizuálně kontrolujte na přítomnost pevných částic nebo změnu zabarvení. Roztok nepoužívejte, pokud je zakalen nebo došlo ke vzniku sraženiny.
c. Přípravek Caspofungin Sandoz je formulován tak, aby poskytoval plnou dávku uvedenou na štítku injekční lahvičky (50 mg nebo 70 mg), pokud se z injekční lahvičky odebere 10 ml.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Sandoz s.r.o., U Nákladového nádraží 10, 130 00 Praha 3, Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
Caspofungin Sandoz 50 mg: 26/363/16-C Caspofungin Sandoz 70 mg: 26/364/16-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 31.8.2016