Botox
sp.zn. sukls186803/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU BOTOX
BOTOX 50 Allergan Units BOTOX 200 Allergan Units botulini toxinum typus A Prášek pro inj ekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
BOTOX: léčivá látka je botulini toxinum typus A 100 jednotek v 1 lahvičce (900 kD).
BOTOX 50 Allergan Units: léčivá látka je botulini toxinum typus A 50 jednotek v 1 lahvičce (900 kD)
BOTOX 200 Allergan Units: léčivá látka je botulini toxinum typus A 200 jednotek v 1 lahvičce (900 kD)
Je-li přípravek podán za definovaných podmínek intraperitoneálně myším, odpovídá jedna jednotka střední letální dávce (LD50).
Tyto jednotky jsou specifické pro BOTOX a nejsou použitelné pro jiné přípravky obsahující botulotoxin.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek pro injekční roztok Popis přípravku BOTOX: bílý lyofilizát.
BOTOX 50 Allergan Units, BOTOX 200 Allergan Units: bílý prášek.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
BOTOX je určen k léčbě:
Neurologické poruchy:
• Fokální spasticita spojená s dynamickou equinus deformací nohy v důsledku spasticity u ambulantních pacientů s dětskou mozkovou obrnou od dvou let věku;
• Fokální spasticita zápěstí a ruky vzniklá na podkladě cévní mozkové příhody u dospělých pacientů.
• Fokální spasticita kotníku vzniklá na podkladě cévní mozkové příhody u
dospělých pacientů (viz bod 4.4).
• Blefarospasmus, hemifaciální spasmus a přidružená fokální dystonie.
• Idiopatická rotační cervikální dystonie (spastické torticollis).
• Prevence bolestí hlavy u dospělých s chronickou migrénou (bolesti hlavy nejméně 15 dní v měsíci, z toho je nejméně 8 dní s migrénou).
Dysfunkce močového měchýře:
• Hyperaktivní močový měchýř idiopatické etiologie se symptomy močové inkontinence, naléhavého a častého močení u dospělých pacientů, kteří mají neadekvátní odpověď nebo jsou intolerantní k anticholinergní léčbě.
• Močová inkontinence u dospělých pacientů způsobená neurogenní hyperaktivitou detruzoru vyvolanou neurogenním močovým měchýřem jako důsledek poranění míchy (traumatické nebo netraumatické) nebo sclerosis multiplex.
Poruchy kůže a podkoží:
• Vytrvalá těžká primární hyperhidróza axil, která rušivě zasahuje do každodenních aktivit a je rezistentní na topickou léčbu.
• Přechodné zlepšení vzhledu níže uvedených vrásek na obličeji, pokud má závažnost níže uvedených vrásek důležitý psychologický dopad na dospělé pacienty:
• Středně výrazných až výrazných svislých vrásek mezi obočím, které jsou patrné při maximálním zamračení (glabelární vrásky)
• Středně výrazných až výrazných vějířkovitých vrásek, které jsou patrné při širokém úsměvu
• Středně výrazných až výrazných vějířkovitých vrásek, které jsou patrné při širokém úsměvu současně se svislými vráskami mezi obočím, které jsou patrné při maximálním zamračení
4.2 Dávkování a způsob podání
Dávkování
Jednotky botulotoxinů nejsou mezi jednotlivými výrobky navzájem zaměnitelné. Dávky v jednotkách používaných společností Allergan se liší od jiných přípravků s botulotoxinem.
Starší pacienti
Dávkování u starších pacientů je stejné jako u mladších dospělých. Počáteční dávkování by mělo začít na nejnižší doporučené dávce pro konkrétní indikaci. U starších pacientů, kteří mají významné zdravotní potíže v anamnéze a kteří souběžně užívají jiné léky, je při léčbě třeba dbát zvýšené opatrnosti. O použití přípravku BOTOX k léčbě glabelárních vrásek u pacientů starších 65 let jsou k dispozici jen omezené údaje z klinických studií fáze 3 (viz bod 5.1). Než bude provedeno více studií u této věkové skupiny, použití přípravku BOTOX k léčbě glabelárních vrásek u pacientů starších 65 let se nedoporučuje.
Pediatrická populace
Bezpečnost a účinnost přípravku BOTOX v léčbě individuálních indikací u dětí a dospívajících do věku uvedeného v tabulce níže nebyla stanovena. Nejsou dostupné žádné údaje.
|
Spasticita horní a dolní končetiny související s cévní mozkovou příhodou |
18 let |
|
Cervikální dystonie |
12 let |
|
Dětská mozková obrna |
2 roky |
|
Blefarospasmus, hemifaciální spasmus |
12 let |
|
Prevence chronické migrény |
18 let |
|
Hyperaktivní močový měchýř a neurogenní hyperaktivita detruzoru |
18 let |
|
Primární hyperhidróza axil |
12 let (jsou omezené zkušenosti u dospívajících ve věku 12 až 17 let) |
|
Glabelární vrásky patrné při maximálním zamračení a/nebo vějířkovité vrásky, které jsou patrné při širokém úsměvu |
18 let |
Důležité jsou následující informace:
Používají-li se při aplikaci injekcí různé velikosti injekčních lahviček přípravku BOTOX, je třeba dbát na to, aby se při rekonstituci na příslušný počet jednotek na 0,1 ml používal správný objem rozpouštědla. Objem rozpouštědla se u přípravků
BOTOX 50 Allergan Units, BOTOX 100 Allergan Units a BOTOX 200 Allergan Units liší. Každá injekční stříkačka musí být řádně označena.
K rekonstituci přípravku BOTOX se používá pouze sterilní roztok chloridu sodného 9 mg/ml (0,9 %) pro injekce. Do stříkačky je třeba natáhnout odpovídající objem rozpouštědla (viz tabulka ředění níže).
Tento přípravek je určen k jednorázovému použití a jakýkoli nepoužitý roztok je třeba zlikvidovat.
Pokyny ohledně použití, zacházení s přípravkem a likvidace lahviček viz bod 6.6.
Tabulka ředění přípravku BOTOX 50, 100 a 200 Allergan Units pro všechny indikace s výjimkou poruch močového měchýře
|
lahvička 50 jednotek |
lahvička 100 jednotek |
lahvička 200 jednotek | |
|
Výsledná dávka (jednotky na 0,1 ml) |
Množství rozpouštědla (chlorid sodný 9 mg/ml (0,9%) roztok pro injekci) přidaného do lahvičky o obsahu 50 jednotek |
Množství rozpouštědla (chlorid sodný 9 mg/ml (0,9%) roztok pro injekci) přidaného do lahvičky o obsahu 100 jednotek |
Množství rozpouštědla (chlorid sodný 9 mg/ml (0,9%) roztok pro injekci) přidaného do lahvičky o obsahu 200 jednotek |
|
20 jednotek |
0,25 ml |
0,5 ml |
1 ml |
|
10 jednotek |
0,5 ml |
1 ml |
2 ml |
|
5 jednotek |
1 ml |
2 ml |
4 ml |
|
4 jednotky |
1,25 ml |
2,5 ml |
5 ml |
|
2,5 jednotky |
2 ml |
4 ml |
8 ml |
|
1,25 jednotky |
4 ml |
8 ml |
Není použitelné |
Hyperaktivní močový měchýř idiopatické etiologie:
Pro usnadnění rekonstituce se doporučuje použít lahvičku o obsahu 100 jednotek.
1) BOTOX 50 Allergan Units (50 jednotek v jedné injekční lahvičce, použití 2 injekčních lahviček)
• Proveďte rekonstituci dvou injekčních lahviček přípravku BOTOX o obsahu 50 U, do každé injekční lahvičky přidejte 5 ml roztoku chloridu sodného (0,9 %) bez konzervačních látek a jemně promíchejte.
• Z každé injekční lahvičky natáhněte 5 ml do injekční stříkačky o velikosti 10ml. Výsledkem bude jedna 10 ml injekční stříkačka s celkovým obsahem 100 jednotek rekonstituovaného přípravku BOTOX. Přípravek se musí použít neprodleně po rekonstituci v injekční stříkačce. Nepoužitý roztok znehodnoťte.
2) BOTOX (100 jednotek v jedné injekční lahvičce, použití 1 injekční lahvičky)
• Proveďte rekonstituci jedné injekční lahvičky přípravku BOTOX o obsahu 100 U, do injekční lahvičky přidejte 10 ml roztoku chloridu sodného (0,9 %) bez konzervačních látek a jemně promíchejte.
• Z injekční lahvičky natáhněte 10 ml do injekční stříkačky o velikosti 10 ml. Výsledkem bude jedna 10 ml injekční stříkačka s celkovým obsahem 100 jednotek rekonstituovaného přípravku BOTOX. Přípravek se musí použít neprodleně po rekonstituci v injekční stříkačce. Nepoužitý roztok znehodnoťte.
3) BOTOX 200 Allergan Units (200 jednotek v jedné injekční lahvičce, použití 1 injekční lahvičky)
• Proveďte rekonstituci jedné injekční lahvičky přípravku BOTOX o obsahu 200 U 8 ml roztoku chloridu sodného (0,9 %) bez konzervačních látek a jemně promíchejte.
• Z injekční lahvičky natáhněte 4 ml do jedné 10 ml injekční stříkačky
• Rekonstituci dokončete přidáním 6 ml roztoku chloridu sodného (0,9 %) bez konzervačních látek do injekční stříkačky o velikosti 10 ml a jemně promíchejte.
Výsledkem bude jedna 10 ml injekční stříkačka s celkovým obsahem 100 jednotek rekonstituovaného přípravku BOTOX. Přípravek se musí použít neprodleně po rekonstituci v injekční stříkačce. Nepoužitý roztok znehodnoťte.
Močová inkontinence způsobená neurogenní hyperaktivitou detruzoru:
Pro usnadnění rekonstituce se doporučuje použít dvě lahvičky o obsahu 100 jednotek nebo 1 lahvičku o obsahu 200 jednotek.
1) BOTOX 50 Allergan Units (50 jednotek v jedné injekční lahvičce, použití 4 injekčních lahviček)
• Proveďte rekonstituci čtyř injekčních lahviček přípravku BOTOX o obsahu 50 U, do každé injekční lahvičky přidejte 3 ml roztoku chloridu sodného (0,9 %) bez konzervačních látek a jemně promíchejte.
• Z první injekční lahvičky natáhněte 3 ml a z druhé 1 ml do jedné 10ml injekční stříkačky
• Z třetí injekční lahvičky natáhněte 3 ml a z čtvrté 1 ml do jedné 10ml injekční stříkačky
• Natáhněte zbývající 2 ml z druhé a čtvrté injekční lahvičky do třetí 10ml injekční stříkačky.
• Rekonstituci dokončete přidáním 6 ml roztoku chloridu sodného (0,9 %) bez konzervačních látek do každé ze tří 10 ml injekční stříkaček a jemně promíchejte.
Výsledkem budou tři 10 ml injekční stříkačky s celkovým obsahem 200 jednotek rekonstituovaného přípravku BOTOX. Přípravek se musí použít neprodleně po rekonstituci v injekční stříkačce. Nepoužitý roztok znehodnoťte.
2) BOTOX (100 jednotek v jedné injekční lahvičce, použití 2 injekčních lahviček)
• Proveďte rekonstituci dvou injekčních lahviček přípravku BOTOX o obsahu 100 U, do každé injekční lahvičky přidejte 6 ml roztoku chloridu sodného (0,9 %) bez konzervačních látek a jemně promíchejte.
• Z jednotlivých injekčních lahviček natáhněte 4 ml do každé ze dvou 10 ml injekčních stříkaček.
• Natáhněte zbývající 2 ml z každé injekční lahvičky do třetí 10ml injekční stříkačky.
• Rekonstituci dokončete přidáním 6 ml roztoku chloridu sodného (0,9 %) bez konzervačních látek do každé 10 ml injekční stříkačky a jemně promíchejte.
Výsledkem budou tři 10 ml injekční stříkačky s celkovým obsahem 200 jednotek
rekonstituovaného přípravku BOTOX. Přípravek se musí použít neprodleně po
rekonstituci v injekční stříkačce. Nepoužitý roztok znehodnoťte.
3) BOTOX 200 Allergan Units (200 jednotek v jedné injekční lahvičce, použití 1 injekční lahvičky)
• Proveďte rekonstituci jedné injekční lahvičky přípravku BOTOX o obsahu 200 U 6 ml roztoku chloridu sodného (0,9 %) bez konzervačních látek a jemně promíchejte.
• Z injekční lahvičky natáhněte 2 ml do každé ze tří 10 ml injekčních stříkaček.
• Rekonstituci dokončete přidáním 8 ml roztoku chloridu sodného (0,9 %) bez konzervačních látek do každé 10 ml injekční stříkačky a jemně promíchejte.
Výsledkem budou tři 10 ml injekční stříkačky s celkovým obsahem 200 jednotek rekonstituovaného přípravku BOTOX. Přípravek se musí použít neprodleně po rekonstituci v injekční stříkačce. Nepoužitý roztok znehodnoťte.
Způsob podání:
Viz specifická doporučení pro každou indikaci uvedená níže.
Přípravek BOTOX musí aplikovat pouze lékaři s odpovídající kvalifikací a zkušenostmi s léčbou a s používáním požadovaných pomůcek.
Obecně platná optimální dávka a počet míst aplikace ve svalu nebyly pro všechny indikace pevně stanoveny. V těchto případech by proto měl lékař navrhnout individuální léčebný režim. Optimální dávku je třeba stanovit titrací, přičemž maximální doporučená dávka nesmí být překročena.
NEUROLOGICKÉ PORUCHY:
Dětská mozková obrna
|
Doporučená jehla: |
Sterilní jehla velikosti 23-26 G/0,60-0,45 mm. |
|
Pokyny k podání: |
Aplikuje se v rozdělené dávce do mediální a laterální hlavy postiženého m. gastrocnemius. |
|
Doporučená dávka: |
Při hemiplegii se doporučuje úvodní celková dávka 4 jednotky/kg hmotnosti do postižené končetiny. Při diplegii se doporučuje úvodní celková dávka 6 jednotek/kg hmotnosti rozdělená mezi postižené končetiny. |
Maximální celková dávka: 200 jednotek
|
Doplňující informace: |
Klinické zlepšení obecně nastává během prvních dvou týdnů po aplikaci. Pokud předchozí léčebný účinek poklesne, aplikaci je třeba opakovat, ale ne častěji než každé tři měsíce. Dávkovací režim je možné přizpůsobit tak, aby mezi jednotlivými sezeními byl interval minimálně 6 měsíců. |
Fokální spasticita horní končetiny vyvolaná cévní mozkovou příhodou
|
Doporučená jehla: |
Sterilní jehla velikosti 25, 27 nebo 30 G. Délka jehly by měla být určena na základě umístění a hloubky svalu. |
|
Pokyny k podání: |
K lokalizaci postižených svalů může být vhodné použít elektromyografickou kontrolu nebo techniku nervové stimulace. Aplikace injekcí přípravku BOTOX do více míst umožní rovnoměrný kontakt s inervační oblastí svalu, což je zvláště užitečné u velkých svalů. |
|
Doporučená dávka: |
Velikost dávky a počet vpichů je třeba individuálně upravit na základě velikosti, počtu a lokalizace postižených svalů, míry spasticity, přítomnosti lokální svalové slabosti a pacientovy reakce na předchozí léčbu. V kontrolovaných klinických studiích byly použity následující dávky: |
|
Celková dávka; | |
|
Sval |
Počet míst |
|
Flexor digitorum profundus |
15-50 jednotek, 1-2 místa |
|
Flexor digitorum sublimis |
15-50 jednotek, 1-2 místa |
|
Flexor carpi radialis |
15-60 jednotek, 1-2 místa |
|
Flexor carpi ulnaris |
10-50 jednotek, 1-2 místa |
|
Adductor pollicis |
20 jednotek, 1-2 místa |
|
Flexor pollicis longus |
20 jednotek, 1-2 místa |
Maximální celková dávka: V kontrolovaných i otevřených nekontrolovaných
klinických studiích byly v průběhu jednoho léčebného sezení použity dávky v rozmezí 200 až 240 jednotek, které byly rozděleny mezi vybrané svaly. Další injekce by neměla být podána dříve než za 12 týdnů.
Doplňující informace: V kontrolovaných klinických studiích byli pacienti po
jednorázové léčbě sledováni po dobu 12 týdnů. Zlepšení svalového napětí nastalo během 2 týdnů s tím, že maximální účinek byl obvykle patrný během 4-6 týdnů. V otevřených nekontrolovaných pokračovacích studiích byla většině pacientů další injekce aplikována po 12-16 týdnech, tedy ve chvíli, kdy účinek na svalový tonus zeslábl. Těmto pacientům byly aplikovány až 4 injekce s maximální celkovou dávkou až 960 jednotek během 54 týdnů. Uzná-li to ošetřující lékař za vhodné, opakované dávky mohou být podány, jakmile účinek předcházející injekce klesá. Stupeň a charakter svalové spasticity v době podání opakované injekce může vést ke změně dávky přípravku BOTOX. Je třeba použít nejnižší účinnou dávku.
Fokální spasticita dolní končetiny vzniklá na podkladě cévní mozkové příhody
Doporučená jehla: Sterilní jehla velikosti 25, 27 nebo 30 G. Délka jehly by
měla být určena na základě umístění a hloubky svalu.
Pokyny k podání: K lokalizaci postižených svalů může být vhodné použít
elektromyografickou kontrolu nebo techniku nervové stimulace. Aplikace injekcí přípravku BOTOX do více míst umožní rovnoměrný kontakt s inervační oblastí svalu, což je zvláště užitečné u velkých svalů.
Následující obrázek ukazuje místa vpichu injekce u dospělých se spasticitou dolní končetiny.
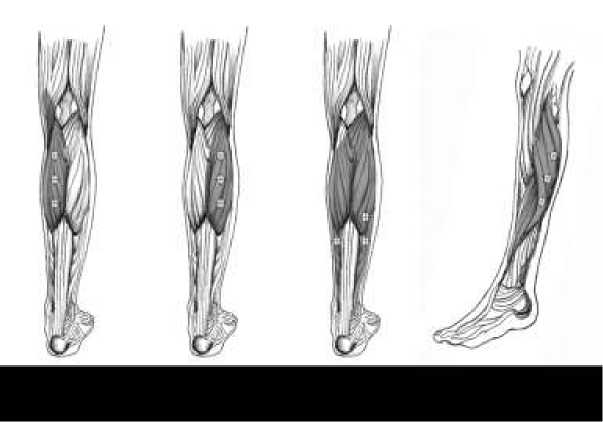
Doporučená dávka: Doporučená dávka pro léčbu dospělých se spasticitou dolní
končetiny zahrnující kotník je 300 jednotek rozdělených mezi 3 svaly.
Dávky přípravku BOTOX do svalu u dospělých se spasticitou dolní končetiny:
|
Sval |
Doporučená dávka Celková dávka; Počet míst |
|
Gastrocnemius Mediální hlava Laterální hlava |
75 jednotek; 3 místa 75 jednotek; 3 místa |
|
Soleus |
75 jednotek; 3 místa |
|
Tibialis Posterior |
75 jednotek; 3 místa |
Doplňující informace: Pokud se zmenší klinický efekt injekce a považuje-li lékař
za vhodné, může být u pacienta zvážena opakovaná aplikace injekce, ale obecně ne dříve než za 12 týdnů po předchozí injekci.
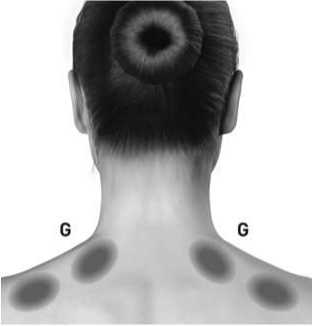
Blefarospasmus/hemifaciální spasmus
Doporučená jehla: Sterilní jehla velikosti 27-30 G/0,40-0,30 mm.
Pokyny k podání: Aplikaci není nutno provádět pod elektromyografickou
kontrolou.
Doporučená dávka: Úvodní doporučená dávka je 1,25-2,5 jednotek
aplikovaných do orbicularis oculi, mediálně a laterálně na horním víčku a pouze laterálně na dolním víčku. Může se
aplikovat také do oblasti obočí, do m. orbicularis lateralis nebo do horní části tváře, pokud zde spasmy ruší vidění.
Maximální celková dávka: Počáteční dávka by neměla překročit 25 jednotek na každé
oko. Celková dávka při léčbě blefarospasmu by neměla překročit 100 jednotek každých 12 týdnů.
Doplňující informace: Komplikace spojené s ptózou mohou být sníženy, pokud
injekce není aplikována do blízkosti m. levator palpebrae superioris. Diplopii můžeme předejít, pokud se vyhneme aplikaci do mediální části dolního víčka, čímž se sníží difuze do m. inferior obliquus. Následující obrázky znázorňují možná místa aplikace:
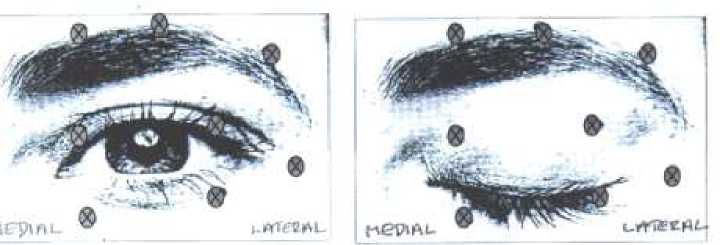
Efekt bývá obvykle patrný do tří dnů, maxima dosahuje za 1-2 týdny po podání. Účinnost každé aplikace trvá asi 3 měsíce, a poté lze léčbu podle potřeby opakovat. Pokud je odpověď na úvodní léčbu nedostatečná, může být při opakovaném sezení dávka zvýšena až na dvojnásobek. Zvyšování dávky nad 5,0 jednotek do každého aplikačního místa je však málo přínosné. Léčba, která je prováděna častěji než každé 3 měsíce, nepřináší obvykle další výhody. U pacientů s hemifaciálním spasmem nebo poruchami inervace n.VII se postupuje jako u unilaterálního blefarospasmu, podle potřeby se injekce aplikují i do jiných postižených obličejových svalů.
Cervikální dystonie
Doporučená jehla: Jehla přiměřené velikosti (obvykle 25-30 G/0,50-0,30 mm).
Pokyny k podání: Léčba cervikální dystonie v klinických studiích většinou
představovala aplikaci injekce přípravku BOTOX do m. sternocleidomastoideus, levator scapulae, scalenae, splenius capitis, semispinalis, longissimus a/nebo trapezius.
Tento seznam není úplný a nezahrnuje všechny svaly zodpovědné za polohu hlavy, které může být třeba léčit.
|
Doporučená dávka: |
Při výběru vhodné dávky je třeba zohlednit objem svalové hmoty a stupeň hypertrofie nebo atrofie. Vzorce svalové aktivity u cervikální dystonie se mohou samovolně změnit bez změn v klinických projevech dystonie. V případě potíží při lokalizaci jednotlivých svalů je třeba injekce aplikovat pod elektromyografickou kontrolou. V první léčebné kúře se nesmí aplikovat více než 200 jednotek a úprava následujících dávek závisí na prvotní reakci pacienta. V úvodních kontrolovaných klinických studiích ke stanovení bezpečnosti a účinnosti u cervikální dystonie se dávky rekonstituovaného přípravku BOTOX pohybovaly v rozmezí od 140 do 280 jednotek. V novějších studiích se dávky pohybovaly v rozmezí od 95 do 360 jednotek (s průměrem přibližně 240 jednotek). Úvodní dávka u nových pacientů, stejně jako u každé jiné léčby, se má zahájit nejnižší účinnou dávkou. Do žádného místa by nemělo být podáno více než 50 jednotek. Do m. sternocleidomastoideus by nemělo být podáno více než 100 jednotek. Pro snížení incidence dysfagie se injekce nesmí aplikovat do m. sternocleidomastoi deus oboustranně. |
Maximální celková dávka: Při jedné aplikaci by nikdy neměla být překročena celková
|
Doplňující informace: |
dávka 300 jednotek. Optimální počet míst vpichu závisí na velikosti svalu. Kratší interval léčby než 10 týdnů se nedoporučuje. Klinické zlepšení obecně nastává během prvních dvou týdnů po aplikaci. Maximální efekt většinou nastane za 6 týdnů po aplikaci. V klinických studiích existovala značná variabilita v délce účinku (od 2 do 33 týdnů) s typickou dobou účinnosti přibližně 12 týdnů. |
Prevence chronické migrény
|
Doporučená jehla: |
Sterilní jehla velikosti 30 G, doporučená délka 12-15mm. |
|
Pokyny k podání: |
Injekce by měly být rozdělěny do 7 specifických svalových oblastí na hlavě/krku tak, jak je uvedeno v tabulce níže. U |
pacientů s extrémně silnými krčními svaly může být v oblasti krku použita delší jehla. S výjimkou m. procerus, který je aplikován v jednom bodě (uprostřed), by všechny ostatní svaly měly být injikovány bilaterálně - polovina aplikačních míst má být na levé a polovina na pravé straně hlavy a krku. Pokud existuje/existují převažující lokalizace bolesti, pak mohou být podávány další injekce na jednu nebo obě strany až do 3 specifických svalů (M.occipitalis, M.temporalis a M.trapezius), a to až do maximální dávky na sval, jak je uvedeno v tabulce níže.
Následující schémata znázorňují aplikační místa injekce:
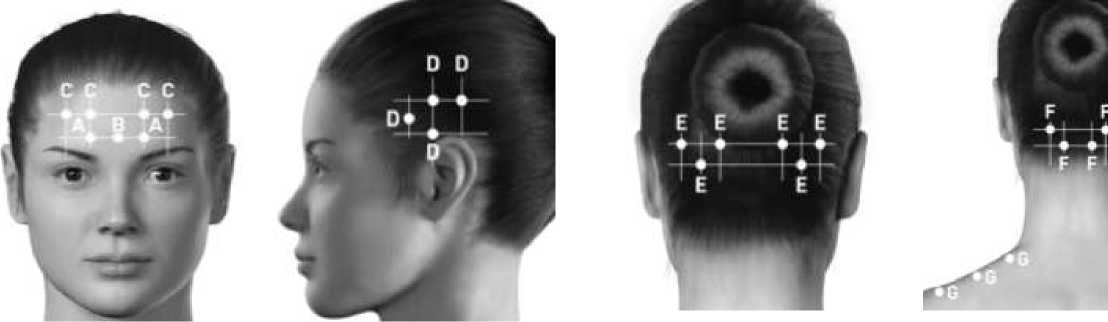
A. M. corrugator: 5 jednotek D. M.temporalis: 20 jednotek
na každou stranu na každou stranu
B. M.procerus: 5 jednotek(1
místo ) I
C. M.frontalis: 10 jednotek na každou stranu
E. M.occipitalis: 15 jednotek F. Cervikální paraspi
na každou stranu skupina svalů: 10 jec
na každou stranu G. M.trapezius: 15 je na každou stranu
Následující schémata znázorňují doporučené svalové skupiny pro volitelné další injekce:

Doporučená dávka: 155 - 195 jednotek aplikovaných intramuskulárně (i.m.) a to
v injekcích po 0,1 ml (5 U) do 31 až 39 injekčních bodů.
Dávkování přípravku BOTOX pro jednotlivé svaly v indikaci prevence chronické migrény
|
Doporučená dávka | |
|
Oblast hlavy a krku |
Celkový počet jednotek (U) (počet i.m. injekčních místa) |
|
M. corrugator b |
10 jednotek (2 místa) |
|
M. procerus |
5 jednotek (1 místo) |
|
M. frontalisb |
20 jednotek (4 místa) |
|
M. temporalisb |
40 jednotek (8 míst) až 50 jednotek (10 míst) |
|
M. occipitalisb |
30 jednotek (6 míst) až 40 jednotek (8 míst) |
|
Cervikální paraspinální skupina svalů b |
20 jednotek (4 místa) |
|
M. trapeziusb |
30 jednotek (6 míst) až 50 jednotek (10 míst) |
|
Rozmezí celkové dávky: |
155 U až 195 U 31 až 39 injekčních míst |
a 1 i.m. injekční místo = 0.1 ml = 5 U BOTOXu (ředění 2ml) b Dávka rozdělena bilaterálně
Doplňující informace: Doporučené schéma následných aplikací je každých
12 týdnů. Použití přípravku BOTOX v indikaci prevence bolestí hlavy u dospělých s chronickou migrénou bylo posouzeno pro 5 cyklů nad 56 týdnů. Nejsou dostupné žádné dlouhodobé údaje o bezpečnosti a účinnosti po 5 cyklech léčby. Potřeba další léčby by měla být určena lékařem na základě individuální odpovědi pacienta.
PORUCHY MOČOVÉHO MĚCHÝŘE:
Pacienti by v době léčby neměli trpět infekcí močových cest.
Pacientům by se měla podat profylaktická antibiotika 1 - 3 dny před léčbou, v den léčby a 1 - 3 dny po léčbě.
Doporučuje se, aby pacienti přerušili antiagregační terapii nejpozději 3 dny před aplikací injekce. U pacientů podstupujících antikoagulační terapii je nutno podniknout příslušná opatření na snížení rizika krvácení.
Léčba dysfunkce močového měchýře za použití přípravku BOTOX by měla být provedena lékařem, který má zkušenosti s diagnostikou a léčbou tohoto onemocnění (tj. urolog, urogynekolog).
Hyperaktivní močový měchýř:
Doporučená jehla: Může být použit flexibilní nebo rigidní cystoskop. Před
zahájením aplikace injekce je třeba do injekční jehly natáhnout přibližně 1 ml rekonstituovaného přípravku BOTOX (podle délky jehly) kvůli odstranění veškerého vzduchu.
Pokyny k podání: Před injekcí lze dle místních obvyklých postupů provést
intravesikální instilaci zředěného anestetika s obsahem sedativ nebo bez nich. Pokud se provádí instilace anestetik, močový měchýř by se měl před dalšími kroky injekční aplikace odsát a vypláchnout sterilním fyziologickým roztokem.
Rekonstituovaný přípravek BOTOX (100 jednotek/10 ml) se aplikuje injekcí do svalu detruzoru mimo oblast trigona a fundu pomocí flexibilního nebo rigidního cytoskopu. Močový měchýř by měl být instilován dostatečným množstvím fyziologického roztoku, aby se dosáhlo odpovídající vizualizace pro aplikaci injekce, nemělo by však dojít k nadměrnému roztažení.
Jehla se zavádí přibližně 2 mm do detruzoru a 20 injekcí, každá o objemu 0,5 ml (celkový objem 10 ml) se aplikuje přibližně ve vzdálenosti 1 cm od sebe (viz nákres níže). V poslední injekci se aplikuje přibližně 1 ml sterilního fyziologického roztoku, aby byla podána celková dávka. Po podání injekce by se fyziologický roztok použitý na vizualizaci stěny močového měchýře neměl odsávat, tak aby pacienti před odchodem z kliniky mohli prokázat svou schopnost močit. Pacienta je nutno sledovat nejméně 30 minut po aplikaci injekce a dále dokud se sám spontánně nevymočí.
Apex
Injekční
místo
Fundus
Ústí levého močovodu
trigonum
Doporučená dávka: Doporučená dávka je 100 jednotek přípravku BOTOX ve
formě injekcí o objemu 0,5 ml (5 jednotek) do 20 míst detruzoru.
Doplňující informace: Klinické zlepšení nastává během 2 týdnů. Když u pacientů
vymizí klinický účinek předchozí dávky, mělo by se uvažovat o podání další injekce (průměrná délka působení přípravku ve 3. fázi klinické studie byla 166 dní, přibližně 24 týdnů), ne však dříve než po uplynutí 3 měsíců od předchozí injekce do močového měchýře.
Močová inkontinence způsobená neurogenní hyperaktivitou detruzoru
|
Doporučená jehla: |
Může být použit flexibilní nebo rigidní cystoskop. Před zahájením aplikace injekce je třeba do injekční jehly natáhnout přibližně 1 ml roztoku (podle délky jehly) kvůli odstranění veškerého vzduchu. |
|
Pokyny k podání: |
Před injekcí lze dle místních obvyklých postupů provést buď intravesikální instilaci zředěného anestetika (s obsahem sedativ nebo bez nich) nebo celkovou anestezii. Pokud se provádí instilace anestetik, močový měchýř by se měl před dalšími kroky injekční aplikace odsát a vypláchnout sterilním fyziologickým roztokem. Rekonstituovaný přípravek BOTOX (200 jednotek/30 ml) se aplikuje injekcí do svalu detruzoru mimo oblast trigona a fundu pomocí flexibilního nebo rigidního cystoskopu. Močový měchýř by měl být instilován dostatečným množstvím fyziologického roztoku, aby se dosáhlo odpovídající vizualizace pro aplikaci injekce, nemělo by však dojít k nadměrnému roztažení. Jehla se zavádí přibližně 2 mm do detruzoru a 30 injekcí, každá o objemu 1 ml (celkový objem 30 ml) se aplikuje přibližně ve vzdálenosti 1 cm od sebe (viz nákres výše). V poslední injekci se aplikuje přibližně 1 ml sterilního fyziologického roztoku, aby byla podána celková dávka. Po podání injekcí se odsaje fyziologický roztok použitý na vizualizaci stěny močového měchýře. Pacienta je nutno sledovat nejméně 30 minut po aplikaci injekce. |
|
Doporučená dávka: |
Doporučená dávka je 200 jednotek přípravku BOTOX ve formě injekcí o objemu 1 ml (přibližně 6,7 jednotek) do 30 míst detruzoru. |
|
Doplňující informace: |
Klinické zlepšení obecně nastává během 2 týdnů. Když u pacientů vymizí klinický účinek předchozí dávky, mělo by se uvažovat o podání další injekce (průměrná délka působení přípravku BOTOX 200 jednotek ve 3. fázi klinické studie byla 256 - 295 dní), ne však dříve než po uplynutí 3 měsíců od předchozí injekce do močového měchýře. |
PORUCHY KŮŽE A PODKOŽÍ: Primární hyperhidróza axil
|
Doporučená jehla: |
Sterilní jehla velikosti 30 G. |
|
Pokyny k podání: |
Hyperhidrotická oblast může být stanovena použitím standardních barvicích technik, jako je např. Minorův jodo-škrobový test. |
|
Doporučená dávka: |
Aplikuje se 50 jednotek přípravku BOTOX intradermálně, v rovnoměrně rozdělených dávkách do více míst, která se nacházejí 1-2 cm od sebe v hyperhidrotické oblasti každé axily. |
Maximální celková dávka: Dávky vyšší než 50 jednotek na axilu se nedoporučují
|
Doplňující informace: |
Injekce se nemají opakovat častěji než za 16 týdnů. (Viz bod 5.1). Klinické zlepšení obecně nastává během prvního týdne po aplikaci. Pokud účinek předcházející injekce klesá a uzná-li to ošetřující lékař za vhodné, může být podána další dávka přípravku BOTOX. |
Glabelární vrásky patrné při maximálním zamračení
|
Doporučená jehla: |
Sterilní jehla velikosti 30 G. |
|
Pokyny k podání: |
Před aplikací injekce je zapotřebí palec nebo ukazováček pevně přitisknout pod okraj orbity, aby nedošlo k extravazaci pod okraj orbity. Jehla by během aplikace měla směřovat nahoru a do středu. Z důvodu snížení rizika ptózy není možné aplikovat injekce do oblasti levator palpebrae superioris, zejména u pacientů s většími komplexy obočí a depresoru (depressor supercilii). Injekce do musculus corrugator je třeba aplikovat do centrální části tohoto svalu, alespoň 1 cm nad obloukem obočí. |
|
Při injekční aplikaci přípravku BOTOX do svislých vrásek mezi obočím, známých také jako glabelární vrásky, je třeba dbát na to, aby nedošlo k aplikaci do krevní cévy, viz bod 4.4. |
Glabelární vrásky vznikají zvýšenou aktivitou musculus corrugator a musculus orbicularis oculi. Tyto svaly pohybují obočím mediálně. Musculus procerus a musculus depresor supercilii táhnou obočí dolů. Tím se vytváří zamračený nebo vrásčitý výraz.
Umístění, velikost a využívání svalů se individuálně značně liší. Vrásky navozené výrazem tváře vznikají kolmo ke směru účinku kontrahovaných obličejových svalů. Potřebná dávka pro odstranění vrásek je určena celkovým pozorováním schopnosti pacienta aktivovat povrchové svaly, do kterých má být injekce aplikována.
Obrázek 1:

Doporučená dávka:
Do každého z 5 injekčních míst se aplikuje 0,1 ml (4 jednotky): (viz Obrázek 1) 2 injekce do každého musculus corrugator a 1 injekce do musculus procerus do celkové dávky 20 jednotek.
|
Doplňující informace: |
Ke zlepšení vzhledu svislých vrásek mezi obočím (glabelární vrásky) dochází obecně do jednoho týdne po ošetření. Byla prokázána účinnost po dobu až 4 měsíců. Intervaly mezi jednotlivými ošetřeními by neměly být kratší než tři měsíce. V případě, že je léčba po opakovaných injekcích neúspěšná nebo účinek nedostatečný je třeba hledat alternativní metody léčby. |
|
Účinnost a bezpečnost opakovaného podání přípravku Botox, delšího než 12 měsíců, nebyla hodnocena. |
Vějířkovité vrásky patrné při širokém úsměvu
|
Doporučená jehla: |
Sterilní jehla velikosti 30G |
|
Pokyny k podání: |
Aby se snížilo riziko ptózy víčka, nesmí být překročena dávka 4 jednotky do jednoho injekčního místa a rovněž tak nesmí být překročen počet injekčních míst. Navíc by injekce měla být vedena temporálně k okraji orbity tak, aby byla zajištěna bezpečná vzdálenost od svalů, které j sou odpovědné za elevaci víčka. Při aplikaci injekce držte zkosený hrot jehly směrem vzhůru a od oka . První injekce (A) by měla být aplikována asi 1,5 až 2,0 cm temporálně do laterálního očního koutku a temporálně do orbitální hrany. Následná místa aplikace injekce budou záviset na tom, zda vrásky v oblasti kolem očí jsou nad a pod laterálním očním koutkem (obrázek č.2 ) nebo primárně pod laterálním očním koutkem (obrázek č.3). Opatrnost je třeba věnovat zajištění toho, aby BOTOX nebyl aplikován v injekci do krevní cévy během aplikace injekce u vějířkovitých vrásek patrných při širokém úsměvu, viz bod 4.4. |
|
Obrázek 2: Obrázek 3: |
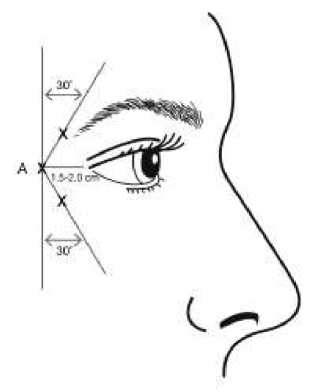
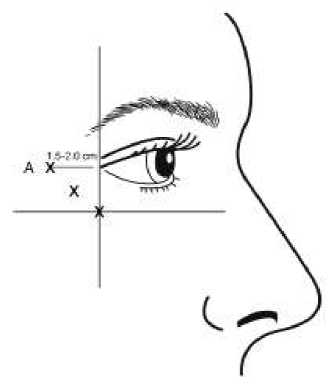
Doporučená dávka:
Objem 0,1 ml (4 U) se injekčně aplikuje do 3 míst na každé straně (celkem 6 míst aplikace injekce) do laterálního m. orbicularis oculi s celkovou dávkou 24 U v celkovém objemu 0,6 ml (12 U na každou stranu).
Pro současnou léčbu s glabelárními vráskami patrnými při maximálním zamračení je dávka 24 U pro vějířkovité vrásky kolem očí, které j sou patrné při širokém úsměvu a 20 U pro glabelární vrásky (viz instrukce pro podávání u glabelárních vrásek a obrázek č.1) s celkovou dávkou 44 U v celkovém objemu 1,1 ml.
Doplňující informace:
Ke zlepšení závažnosti vějířkovitých vrásek kolem očí, patrných při širokém úsměvu při hodnocení pacientem došlo během jednoho týdne po léčbě. Efekt byl prokázán v průměru po dobu 4 měsíců po aplikaci injekce.
Intervaly mezi jednotlivými ošetřeními by neměly být kratší než tři měsíce.
Účinnost a bezpečnost opakovaného podání přípravku Botox, delšího než 12 měsíců, nebyla hodnocena.
Všechny indikace
V případě léčebného selhání po prvním sezení, např. nepřítomnost signifikantního klinického zlepšení proti výchozímu stavu za měsíc po léčbě, je potřeba dodržet následující postup:
- klinické ověření účinku toxinu na příslušný sval, které může zahrnovat elektromyografické vyšetření u specialisty;
- analýza příčin selhání, např. špatný výběr svalů, nedostatečná dávka, špatná injekční technika, výskyt fixní kontraktury, příliš oslabený svalový antagonista, tvorba toxin-neutralizujících protilátek;
- přehodnocení vhodnosti léčby botulotoxinem typu A;
- pokud první léčebná kúra nebyla spojena s výskytem nežádoucích účinků, zahajte další léčbu podle následujícího doporučení: I) upravte dávku, přičemž vezměte v úvahu důvody selhání předcházející léčby; II) použijte EMG a III) zachovejte tříměsíční interval mezi dvěma léčebnými kúrami.
V případě léčebného selhání nebo oslabení účinku opakovaně podávaných injekcí se mají použít alternativní léčebné metody.
4.3 Kontraindikace
Přípravek BOTOX ve všech indikacích je kontraindikován:
- u pacientů se známou přecitlivělostí na botulotoxin typ A nebo kteroukoli ze složek přípravku uvedenou v bodě 6.1;
- při přítomnosti infekce v navrhovaném místě aplikace
Přípravek BOTOX v indikaci léčba poruch močového měchýře je kontraindikován i v následujících případech:
- u pacientů s infekcí močových cest v době léčby,
- u pacientů s akutní retencí moči v době léčby, u kterých se běžně neprovádí
katetrizace.
- u pacientů, kteří nejsou ochotni či schopni zahájit po léčebnou katetrizaci, pokud je
třeba.
Přípravek BOTOX v kosmetické indikaci je kontraindikován i v následujícím případě:
- u pacientů s myasthenia gravis nebo Lambertovým-Eatonovým syndromem.
4.4 Zvláštní upozornění a opatření pro použití
Nesmí se překračovat doporučené dávkování ani zkracovat doporučené intervaly mezi aplikacemi vzhledem k možnosti předávkování, nadměrné svalové slabosti, vzdálenému šíření toxinu a tvorbě neutralizačních protilátek. Počáteční dávkování u pacientů dosud neléčených přípravkem BOTOX by mělo být zahájeno s nejnižší doporučenou dávkou pro specifickou indikaci.
Lékaři i pacienti by si měli být vědomi toho, že se mohou objevit nežádoucí účinky, přestože byla předchozí injekce dobře tolerována. Opatrnosti je tedy třeba v případě každé aplikace.
Byly hlášeny nežádoucí účinky související se šířením toxinu do vzdálených míst od místa podání (viz bod 4.8), které měly někdy za následek úmrtí a které byly v některých případech spojeny s dysfagií, pneumonií a/nebo značnou tělesnou slabostí.
Tyto symptomy jsou v souladu s mechanismem účinku botulotoxinu a byly hlášeny po hodinách až týdnech po aplikaci injekce. Riziko vzniku symptomů je pravděpodobně nej vyšší u pacientů, kteří trpí jiným základním onemocněním nebo doprovodným onemocněním, takže mají predispozice k rozvoji těchto příznaků, a to včetně dětí a dospělých léčených pro spasticitu a léčených vysokými dávkami.
U pacientů léčených terapeutickými dávkami se může projevit nadměrná svalová slabost.
S opatrností by měli být léčeni starší a oslabení pacienti. Obecně v klinických studiích s přípravkem BOTOX nebyly prokázány rozdíly v odpovědi mezi staršími a mladšími pacienty. Dávka pro staršího pacienta by se měla volit s opatrností, obvykle začíná na spodním konci dávkovacího rozmezí.
Před zahájením léčby přípravkem BOTOX by měl být u každého pacienta zvážen poměr přínosu a rizika.
Dysfagie byla hlášena též po aplikaci do jiných míst než krčních svalů (viz bod 4.4 -cervikální dystonie).
Přípravek BOTOX by měl být používán s mimořádnou opatrností a pod zvýšeným dohledem u pacientů se subklinickými nebo klinickými známkami poruch neuromuskulárního přenosu: např. myasthenia gravis nebo Lambertovým-Eatonovým syndromem, u pacientů s periferním neuropatickým onemocněním (např. amyotrofickou laterální sklerózou nebo motorickou neuropatií) a u pacientů se základními neurologickými onemocněními. Tito pacienti mají zvýšenou citlivost k přípravku BOTOX, a to i při aplikaci terapeutických dávek, což může vyvolat nadměrnou svalovou slabost a zvýšené riziko výskytu klinicky významných systémových nežádoucích účinků, včetně závažné dysfagie a respiračních poruch. U takových pacientů je nutné botulotoxinové přípravky používat pouze za dohledu specialisty a pouze v případě, že přínos léčby převáží její rizika. Pacienty s dysfagií a aspirací v anamnéze je nutno léčit s mimořádnou opatrností.
Pacienti nebo jejich ošetřovatelé by měli být upozorněni, aby vyhledali okamžitě lékařskou pomoc, pokud se objeví poruchy polykání, řeči nebo dýchání.
Podobně jako v jiných případech léčby, která umožňuje zvýšení aktivity po ošetření, by měli pacienti, kteří před léčbou vedli sedavý způsob života zahajovat aktivity postupně.
Před podáním přípravku BOTOX je nutné znát všechny důležité anatomické vztahy a změny způsobené dřívějšími operačními výkony a je zapotřebí vyhnout se aplikaci injekcí do citlivých anatomických struktur.
Po aplikaci přípravku BOTOX do oblasti blízko hrudníku byl hlášen s injekční procedurou spojený pneumotorax. Opatrnost se vyžaduje při injekci aplikované v blízkosti plic (zejména pak plicních vrcholů) a do dalších citlivých anatomických struktur.
U pacientů, kterým byl přípravek BOTOX injekčně aplikován v neschválené indikaci přímo do slinných žláz, do oblasti oro-linguálně-faryngeální a do jícnu a žaludku byly hlášeny závažné nežádoucí účinky včetně fatálních následků. Někteří z těchto pacientů měli preexistující dysfagii nebo významnou slabost.
Vzácně byly hlášeny vážné a/nebo okamžité hypersensitivní reakce včetně anafylaxe, sérové nemoci, kopřivky, otoku měkkých tkání a dyspnoe. Některé z těchto reakcí byly hlášeny po použití přípravku BOTOX samotného nebo v kombinaci s použitím jiných přípravků, které vyvolávají podobné nežádoucí reakce. Pokud se objeví taková reakce, podání musí být přerušeno a je potřeba zahájit příslušnou terapii, jako je okamžité podání epinephrinu. Je znám jeden případ anafylaktického šoku, kdy pacient zemřel po injekční aplikaci přípravku BOTOX nesprávně naředěného 5 ml 1% lidokainu.
Stejně jako u ostatních injekčních aplikací může dojít k poškození v souvislosti s aplikací. Injekce může způsobit infekci v místě vpichu, bolest, zánět, parestézii, sníženou citlivost, citlivost na dotek, otok, erytém a/nebo krvácení/podlitiny. Bolest a/nebo strach z aplikace jehlou mohou vyvolat vasovagální odpověď, např. synkopu, hypotenzi atd.
Zvýšená opatrnost při použití přípravku BOTOX je nutná, pokud je v místě plánovaného vpichu přítomen zánět, nebo je přítomna výrazná slabost nebo atrofie v cílovém svalu. Zvýšená opatrnost při použití přípravku BOTOX je také nutná u pacientů s periferním neuropatickým onemocněním (např. amyotrofickou laterální sklerózou nebo motorickou neuropatií).
Po podání přípravku BOTOX byly také hlášeny nežádoucí účinky, týkající se kardiovaskulárního systému, včetně arytmie a infarktu myokardu, některé s letálním koncem. Někteří z těchto pacientů měli rizikové predispozice včetně kardiovaskulárního onemocnění.
Byl hlášen nový nebo opakovaný výskyt záchvatů, obvykle u pacientů, kteří mají k výskytu těchto stavů predispozici. Přesný vztah k injekcím botulotoxinu nebyl u těchto případů stanoven. U dětí byly tyto události hlášeny především u pacientů léčených pro spasticitu spojenou s dětskou mozkovou obrnou.
Tvorba neutralizujících protilátek proti botulotoxinu typu A může snížit účinnost léčby přípravkem BOTOX a to inaktivací biologické aktivity toxinu.
Výsledky z některých studií ukazují, že použití přípravku BOTOX v příliš častých nebo vysokých dávkách může vést k zvýšené tvorbě protilátek. V případě potřeby je možné riziko tvorby protilátek minimalizovat aplikací injekce nejnižší účinné dávky v nejdelším klinicky indikovaném intervalu mezi injekcemi.
Fluktuace klinického stavu během opakovaného použití přípravku BOTOX (stejně jako u všech botulotoxinů) mohou být důsledkem odlišných postupů rekonstituce přípravku, intervalů mezi injekcemi, svalů, do kterých je přípravek aplikován, a mírných rozdílů v hodnocení účinnosti, které jsou dané použitými metodami biologického testování.
Pediatrické použití
Bezpečnost a účinnost přípravku BOTOX v indikacích jiných než jsou popsány pro pediatrickou populaci v bodu 4.1, nebyla stanovena. Po uvedení přípravku na trh bylo u dětských pacientů se současným výskytem dalších onemocnění, především s mozkovou obrnou, velmi vzácně hlášeno možné šíření toxinu do míst vzdálených místu podání. Obecně platí, že byla u těchto případů použita vyšší než doporučená dávka (viz bod 4.8).
Spontánně byly hlášeny vzácné případy úmrtí po aplikaci botulotoxinu u dětí s těžkou mozkovou obrnou, někdy spojené s aspirační pneumonií, včetně případů kdy byl přípravek BOTOX použit v neschválené indikaci (např. oblast krku). Mimořádná opatrnost při použití přípravku BOTOX je nutná u pediatrických pacientů s výrazným neurologickým postižením, dysfagií nebo anamnézou nedávno proběhlé aspirační pneumonie nebo plicního onemocnění.
Při léčbě pacientů se špatným zdravotním stavem je třeba individuálně zvážit poměr přínosu a rizika léčby.
NEUROLOGICKÉ PORUCHY:
Fokální spasticita spojená s dětskou mozkovou obrnou a spasticita kotníku, ruky a zápěstí u dospělých _po cévní mozkové _příhodě
Při léčbě fokální spasticity byl přípravek BOTOX sledován pouze ve spojení se standardní péčí a není určen jako náhrada těchto léčebných metod. Není pravděpodobné, že by přípravek BOTOX zlepšoval rozsah pohybu u kloubů poškozených fixními kontrakturami.
Přípravek BOTOX by neměl být použit pro léčbu fokální spasticity kotníku vzniklé na podkladě cévní mozkové příhody u dospělých pacientů, pokud se neočekává, že léčba bude mít za následek snížení svalového tonu a tím zlepšení svalové funkce (např. zlepšení chůze), nebo zlepšení symptomů (např. snížení bolesti) nebo usnadnění péče. Kromě toho zlepšení aktivní funkce může být limitováno, jestliže je léčba přípravkem BOTOX zahájena déle než 2 roky po cévní mozkové příhodě nebo u pacientů s méně závažnou spasticitou kotníku (Modified Ashworth Scale (MAS) < 3).
Opatrnosti je třeba při léčbě dospělých pacientů se spasticitou vzniklou na podkladě cévní mozkové příhody, u kterých hrozí zvýšené riziko pádu.
Přípravek BOTOX je třeba použít s opatrností pro léčbu fokální spasticity kotníku u starších pacientů po cévní mozkové příhodě s významnou komorbiditou a léčba by měla být zahájena, pouze pokud převažuje prospěch léčby nad jejími potenciálními riziky.
Přípravek BOTOX by měl být použit k léčbě spasticity dolní končetiny vzniklé na podkladě cévní mozkové příhody pouze po zvážení zdravotnickým pracovníkem, který má zkušenosti v rehabilitaci pacientů po cévní mozkové příhodě.
Po uvedení přípravku na trh byly po léčbě botulotoxinem hlášeny případy úmrtí (někdy spojené s aspirační pneumonií) a vzdálené šíření toxinu u dětí s přidruženými chorobami, především s dětskou mozkovou obrnou. Viz upozornění v bodu 4.4 Pediatrické použití.
Blefarospasmus
Snížená četnost mrkání po injekci botulinového toxinu do m. orbicularis může vést ke snížení ochrany rohovky, trvalému poškození epitelu a tvorbě ulcerace rohovky, obzvláště u pacientů s poruchou nervu VII. Je třeba zajistit pečlivé vyšetření citlivosti rohovky u dříve operovaných očí, vyhnout se aplikaci do dolního víčka, aby nedošlo k ektropiu, okamžitě a důkladně léčit každý defekt rohovkového epitelu. Tato léčba může zahrnovat aplikaci ochranných kapek, mastí, terapeutických měkkých kontaktních čoček nebo zakrytí oka přelepením nebo jiným způsobem.
V měkkých tkáních víčka snadno vznikají ekchymózy. Ty mohou být minimalizovány působením jemného tlaku na místo vpichu bezprostředně po injekci.
Vzhledem k anticholinergní aktivitě botulotoxinu je třeba dbát zvýšené opatrnosti při léčbě pacientů s rizikem glaukomu s uzavřeným úhlem, včetně pacientů s anatomicky úzkým úhlem.
Cervikální dystonie
Pacienti s cervikální dystonií by měli být informováni o možném vzniku dysfagie, která může být mírná, ale i závažná. Dysfagie může přetrvávat dva až tři týdny, ale byl hlášen případ trvání i pět měsíců po injekci. Důsledkem dysfagie je možnost aspirace, dyspnoe a příležitostně potřeba výživy sondou. Ve vzácných případech byla po dysfagii hlášena aspirační pneumonie a úmrtí.
Riziko vzniku dysfagie může být sníženo omezením dávky aplikované do m. sternocleidomastoideus na méně než 100 jednotek. U pacientů s nižší svalovou hmotou v oblasti krku nebo u pacientů, kterým je aplikována injekce bilaterálně do musculus sternocleidomastoideus, bylo hlášeno vyšší riziko dysfagie. Dysfagie se přisuzuje šíření toxinu do esofageálních svalů. Aplikace do levator scapulae může být spojena se zvýšením rizika respirační infekce a dysfagie.
Dysfagie může přispět k zhoršenému příjmu potravy i vody a k následnému snížení váhy a dehydrataci. U pacientů se subklinickou dysfagií může být zvýšeno riziko vážnějšího průběhu dysfagie po injekci přípravku BOTOX.
Prevence chronické migrény
Bezpečnost a účinnost při použití u prevence chronické migrény nebyla u pacientů s epizodickou migrénou (bolesti hlavy méně než 15 dní v měsíci) stanovena.
PORUCHY MOČOVÉHO MĚCHÝŘE:
Při provádění cystoskopie je nutno postupovat s náležitou opatrností.
U pacientů bez katetrizace by se měl stanovit do 2 týdnů po léčbě objem postmikčního rezidua a dále pravidelně až po dobu 12 týdnů dle potřeb léčby. Pacienti by měli být poučeni, aby v případě obtíží při močení kontaktovali svého lékaře. V případě potřeby může být nutné provést katetrizaci.
Hyperaktivní močový měchýř
Muži s diagnózou hyperaktivního močového měchýře a příznaky obstrukce močových cest by neměli být léčeni přípravkem BOTOX.
Močová inkontinence způsobená neurogenní hyperaktivitou detruzoru
V souvislosti se zákrokem se může vyskytnout autonomní dysreflexie. Může vyžadovat okamžitou lékařskou pomoc.
PORUCHY KŮŽE A PODKOŽÍ:
K vyloučení případů sekundární hyperhidrózy (např. hypertyreóza, feochromocytom) je třeba odebrat zdravotní anamnézu a provést fyzikální vyšetření a případně další specifická vyšetření. To umožní vyhnout se symptomatické léčbě hyperhidrózy bez diagnózy nebo léčby základního onemocnění.
Svislé vrásky mezi obočím, které jsou patrné při maximálním zamračení a/nebo vějířkovité vrásky patrné při širokém úsměvu
Po rekonstituci je přípravek BOTOX možné použít pouze k jedné aplikaci injekce (injekcí) u jednoho pacienta. Zbytek nepoužitého přípravku musí být zlikvidován, tak, jak je popsáno v bodu 6.6. Zvláštní opatření jsou třeba pro přípravu a podávání přípravku, jakož i pro inaktivaci a likvidaci zbývajícího nepoužitého roztoku (viz bod 6.6).
Použití přípravku BOTOX v kosmetické indikaci se nedoporučuje u pacientů mladších 18 let. U pacientů starších 65 let jsou k dispozici pouze omezené údaje z klinických studií fáze 3.
Je třeba zajistit, aby BOTOX nebyl aplikován do krevního řečiště a to jak v případě aplikace do svislých vrásek mezi obočím, které jsou patrné při maximálním zamračení nebo při aplikaci do vějířovitých vrásek, které jsou patrné při širokém úsměvu, viz bod 4.2. Po léčbě může hrozit riziko ptózy očního víčka, viz bod 4.2 ohledně návodu k aplikaci injekcí a minimalizace tohoto rizika.
Zvýšená opatrnost při kosmetickém použití přípravku BOTOX je nutná u pacientů s kožními zánětlivými projevy v místě aplikace, zřetelnou faciální asymetrií, ptózou, dermatochalazií, hlubokými kožními jizvami nebo kůží se zvýšenou produkcí mazu, protože tito pacienti nebyli zařazeni do 3. fáze klinických studií.
Tento léčivý přípravek obsahuje méně než 1 mmol (23 mg) sodíku v dávce 20 jednotek, tj. v podstatě je „bez sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Účinek botulotoxinu může být teoreticky potencován aminoglykosidovými antibiotiky, spektinomycinem nebo jinými přípravky, které zasahují do neurosvalového přenosu (např. nervosvalové blokátory).
Důsledek podání různých sérotypů botulotoxinu ve stejnou dobu nebo během několika měsíců není znám. Podání dalšího botulotoxinu před odezněním účinků dříve podaného botulotoxinu může vyvolat nadměrnou nervosvalovou slabost.
Žádné studie interakcí nebyly provedeny. Nebyly hlášeny žádné klinicky významné interakce.
Pediatrická populace
Žádné studie interakcí u dětí nebyly provedeny.
4.6 Fertilita, těhotenství a kojení
Nejsou k dispozici žádné adekvátní údaje o použití botulotoxinu typu A u těhotných žen. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Není známé možné riziko pro lidi. Přípravek BOTOX by neměl být používán během těhotenství a u žen ve fertilním věku, které nepoužívají antikoncepci, pokud to není nezbytně nutné.
Kojení
Není známo, zda se přípravek BOTOX vylučuje do lidského mateřského mléka. Během kojení se nedoporučuje přípravek BOTOX používat.
Fertilita
Nejsou k dispozici odpovídající údaje o účincích používání botulotoxinu typu A na plodnost u žen ve fertilním věku. Studie na potkaních samcích a samicích prokázaly snížení plodnosti (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie týkající se účinku na schopnost řídit a používat stroje. Přípravek BOTOX však může způsobovat astenii, svalovou slabost, závratě a poruchy vidění, které mohou mít vliv na řízení.
4.8 Nežádoucí účinky Obecně
V kontrolovaných klinických studiích byly nežádoucí účinky, které podle hodnotitelů souvisí s aplikací přípravku BOTOX hlášeny u 35 % pacientů s blefarospasmem, 28 % s cervikální dystonií, 17 % s dětskou mozkovou obrnou a 11 % s primární hyperhidrózou axil. Nežádoucí účinky zaznamenalo 16 % pacientů s fokální spasticitou horní končetiny spojenou s cévní mozkovou příhodou a 15 % pacientů s fokální spasticitou dolní končetiny na podkladě cévní mozkové příhody, kteří byli v klinických studiích léčeni přípravkem BOTOX.
V klinických studiích zaměřených na hyperaktivní močový měchýř byl výskyt nežádoucích účinků u 26 % pacientů při první léčbě a u 22% při druhé léčbě.
V klinických studiích zaměřených na močovou inkontinenci způsobenou neurogenní hyperaktivitou detruzoru byl výskyt nežádoucích účinků u 32 % pacientů při první léčbě s poklesem na 18 % při druhé léčbě. V klinických studiích zaměřených na chronickou migrénu byl výskyt u 26 % pacientů při první léčbě s poklesem na 11 % při druhé léčbě.
Na základě údajů z kontrolovaných klinických studií lze výskyt nežádoucích reakcí po léčbě glabelárních vrásek přípravkem BOTOX očekávat u 23,5 % (placebo: 19,2 %) pacientů. Tyto nežádoucí reakce mohou souviset s léčbou, injekční technikou nebo s oběma těmito faktory.
Nežádoucí účinky se obecně objevily během několika prvních dní po injekci a byly přechodné, mohou však přetrvávat měsíce a ve vzácných případech i déle.
Lokální svalová slabost představuje očekávané farmakologické působení botulotoxinu ve svalové tkáni. Nicméně, byla hlášena slabost ve svalech přilehlých a/nebo vzdálenějších od místa vpichu injekce. Blefaroptóza, která vznikla v důsledku kosmetického použití na glabelární vrásky a která může souviset s injekční technikou, souvisí s farmakologickým účinkem přípravku BOTOX.
Stejně jako u jiných injekčních postupů může být výkon spojen s místní bolestí, zánětem, hypoastezií, citlivostí, opuchnutím nebo otokem, erytémem, lokalizovanou infekcí, krvácením nebo modřinami v důsledku injekčního podání. Bolest a/nebo strach, související s injekcí, mohou způsobit vaso-vagální reakce, např. přechodné symptomatické snížení krevního tlaku nebo mdloby. Po injekci botulotoxinu byla také hlášena horečka a chřipkový syndrom.
Nežádoucí účinky - četnost podle indikace
Níže jsou uvedeny frekvence nežádoucích účinků pro každou indikaci vycházející z klinických studií. Tyto frekvence jsou definovány takto: velmi časté (> 1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000).
Seznamy nežádoucích účinků uvedené níže se liší v závislosti na části těla, kam se vpichuje injekce přípravku BOTOX.
NEUROLOGICKÉ PORUCHY:
Dětská mozková obrna
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Infekce a infestace |
Velmi časté |
Virové infekce a infekce ucha |
|
Poruchy nervového systému |
Časté |
Ospalost, poruchy chůze a parestézie |
|
Poruchy kůže a podkožní tkáně |
Časté | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté |
Myalgie, svalová slabost a bolest končetin |
|
Poruchy ledvin a močových cest |
Časté |
Močová inkontinence |
|
Poranění, otravy a procedurální komplikace |
Časté |
Pád |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Malátnost, bolest v oblasti vpichu a astenie |
Fokální spasticita horní končetiny vyvolaná cévní mozkovou příhodou
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Psychiatrické poruchy |
Méně časté | |
|
Poruchy nervového systému |
Časté |
Hypertonie |
|
Méně časté |
Hypestézie, bolest hlavy, parestézie, porucha koordinace a amnézie | |
|
Poruchy ucha a labyrintu |
Méně časté | |
|
Cévní poruchy |
Méně časté |
Ortostatická hypotenze |
|
Gastrointestinální poruchy |
Méně časté |
Nauzea, orální parestézie. |
|
Poruchy kůže a podkožní tkáně |
Časté |
Ekchymóza a purpura |
|
Méně časté | ||
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté |
Bolest končetin a svalová slabost |
|
Méně časté |
Artralgie, bursitis | |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Bolest v místě vpichu, pyrexie, onemocnění podobné chřipce, hemoragie, podráždění v místě vpichu |
|
Méně časté |
Astenie, bolest, zvýšená citlivost v místě vpichu, malátnost, periferní otok |
Některé z méně častých nežádoucích účinků mohu souviset s onemocněním.
Fokální spasticita dolní končetiny na podkladě cévní mozkové příhody
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Poruchy kůže a podkožní tkáně |
Časté | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté |
Artralgie, muskuloskeletální ztuhlost |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Periferní otok |
V klinických studiích s pacienty se spasticitou dolní končetiny byla incidence pádu 5,9 % ve skupinách s přípravkem BOTOX a 5,3 % v placebo skupinách.
Nebyla pozorována žádná změna v celkovém bezpečnostním profilu po opakovaném podání.
Blefarospasmus/hemifaciální spasmus
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Poruchy nervového systému |
Méně časté |
Závratě, faciální paréza, faciální obrna |
|
Poruchy oka |
Velmi časté |
Ptóza očního víčka |
|
Časté |
Keratitis punctata, lagoftalmus, suché oko, fotofobie, podráždění a zvýšená tvorba slz | |
|
Méně časté |
Keratitis, ektropium, diplopie, entropium, poruchy vidění, rozostřené vidění | |
|
Vzácné |
Otok očního víčka | |
|
Velmi vzácné |
Ulcerózní keratitida, defekt rohovkového epitelu, perforace rohovky | |
|
Poruchy kůže a podkožní tkáně |
Časté |
Ekchymóza. |
|
Méně časté |
Vyrážka/dermatitida | |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Podráždění, otok obličeje |
|
Méně časté |
Únava |
Cervikální dystonie
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Infekce a infestace |
Časté |
Rýma, infekce horních cest dýchacích |
|
Poruchy nervového systému |
Časté |
Závratě, hypertonie, hypestézie, ospalost a bolest hlavy |
|
Poruchy oka |
Méně časté |
Diplopie, ptóza očního víčka |
|
Respirační, hrudní a mediastinální poruchy |
Méně časté |
Dušnost a dysfonie |
|
Gastrointestinální poruchy |
Velmi časté |
Dysfagie |
|
Časté |
Sucho v ústech, nauzea | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Velmi časté |
Svalová slabost |
|
Časté |
Svalová ztuhlost, bolestivost | |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Bolest |
|
Časté |
Astenie, onemocnění podobné chřipce, malátnost | |
|
Méně časté |
Horečky |
Prevnece chronické migrény
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Poruchy nervového systému |
Časté |
Bolest hlavy, migréna, faciální paréza |
|
Poruchy oka |
Časté |
Ptóza očního víčka |
|
Poruchy kůže a podkožní tkáně |
Časté | |
|
Méně časté |
Bolest kůže | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté |
Bolesti šíje, svalová ztuhlost, svalová slabost, bolest svalů, muskuloskeletální bolest, svalové křeče, svalové napětí |
|
Méně časté |
Bolest čelisti | |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Bolest v místě injekce |
|
Gastrointestinální poruchy |
Méně časté |
Dysfagie |
V placebem kontrolovaných studiích byly bolesti hlavy a migréna hlášeny častěji u pacientů, kterým byl aplikován přípravek BOTOX (9 %), oproti placebo skupině (6 %). Tyto reakce se objevují charakteristicky během prvního měsíce po injekci a jejich incidence klesá s opakovanou léčbou.
PORUCHY MOČOVÉHO MĚCHÝŘE:
Hyperaktivní močový měchýř
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Infekce a infestace |
Velmi časté |
Infekce močových cest |
|
Časté |
Bakteriurie | |
|
Poruchy ledvin a močových cest |
Velmi časté |
|
Časté |
Retence moči, reziduální objem moči*, polakisurie, leukocyturie | |
|
*zvýšený postmikční reziduální objem moči nevyžac |
ující katetrizaci | |
Jako nežádoucí reakce spojené s aplikační procedurou se s častou frekvencí objevila dysurie a hematurie.
Občasná katetrizace byla zahájena u 6,5 % pacientů po léčbě přípravkem BOTOX oproti 0,4 % ve skupině s placebem.
V placebem kontrolovaných klinických studiích bylo z 1242 pacientů 41,4 % ( n=514) pacientů starších než 65 let a 14,7 % (n=182) pacientů bylo starší než 75 let. Nebyl nalezen žádný významný rozdíl v bezpečnostním profilu mezi pacienty staršími a mladšími 65 let s výjimkou infekcí močového traktu, kde byl výskyt vyšší u starších pacientů oproti mladším a to v obou skupinách- ve skupině s přípravkem BOTOX i ve skupině s placebem.
Při opakovaném podání nebyla zjištěna změna typu nežádoucích účinků.
Močová inkontinence způsobená neurogenní hyperaktivitou detruzoru
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Infekce a infestace |
Velmi časté |
Infekce močových cest |
|
Psychiatrické poruchy |
Časté | |
|
Gastrointestinální poruchy |
Časté |
Zácpa |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté |
Svalová slabost, spasmy svalů |
|
Poruchy ledvin a močových cest |
Velmi časté |
Retence moči |
|
Časté |
Hematurie*, dysurie*, divertikl močového měchýře | |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Únava, poruchy chůze |
|
Poranění, otravy a procedurální komplikace spojené se zákrokem |
Časté |
Autonomní dysreflexie*, padání |
*nežádoucí účinky související se zákrokem
V klinických studiích byly hlášeny infekce močového traktu a to u 49,2 % pacientů léčených 200 jednotkami přípravku BOTOX a u 35,7 % pacientů léčených placebem (ve skupině pacientů s sclerosis multiplex to bylo u 53 % pacientů léčených 200 jednotkami přípravku BOTOX, oproti 29,3 % s placebem, ve skupině s poraněním míchy to bylo u 45,4 % pacientů léčených 200 jednotkami přípravku BOTOX oproti 41,7 % s placebem) Retence moči byla hlášena a to u 17,2 % pacientů léčených 200 jednotkami přípravku BOTOX a u 2,9 % pacientů léčených placebem (ve skupině pacientů s sclerosis multiplex to bylo u 28,8 % pacientů léčených 200 jednotkami přípravku BOTOX, oproti 4,5 % s placebem, ve skupině s poraněním míchy to bylo u 5,4 % pacientů léčených 200 jednotkami přípravku BOTOX oproti 1,4 % s placebem).
Při opakovaném podání nebyla zjištěna změna typu nežádoucích účinků.
Do pivotních studií byli zařazeni pacienti s roztroušenou sklerózou. Nebyla zjištěna změna v ročním počtu relapsů u pacientů s roztroušenou sklerózou (tj. počet případů relapsů u pacientů s roztroušenou sklerózou v přepočtu na pacienta a rok) (BOTOX = 0,23, placebo = 0,20).
U pacientů, u kterých se v původním stavu před léčbou neprováděla katetrizace, se katetrizace zahájila u 39,8 % pacientů po léčbě přípravkem BOTOX 200jednotek v porovnání se 17,3 % pacientů dostávajících placebo.
PORUCHY KŮŽE A PODKOŽÍ:
Primární hyperhidróza axily
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Poruchy nervového systému |
Časté |
Bolest hlavy a parestézie |
|
Cévní poruchy |
Časté | |
|
Gastrointestinální poruchy |
Méně časté | |
|
Poruchy kůže a podkožní tkáně |
Časté |
Hyperhidróza (pocení mimo axily), abnormální zápach kůže, svědění, podkožní uzliny, alopecie |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté |
Bolest v končetinách |
|
Méně časté |
Svalová slabost, myalgie a artropatie | |
|
Celkové poruchy a reakce v místě aplikace |
Velmi časté |
Bolest v místě aplikace injekce |
|
Časté |
Bolest, otok v místě vpichu, hemoragie v místě vpichu, citlivost a podráždění v místě vpichu, astenie, reakce v místě vpichu |
Při léčbě primární hyperhidrózy axil bylo do jednoho měsíce od aplikace injekce u 4,5 % pacientů hlášeno zvýšené pocení mimo axily, přičemž nebyl zjištěn žádný specifický vzorec s ohledem na to, které anatomické oblasti byly takto postiženy. U asi 30 % pacientů potíže ustoupily do čtyř měsíců.
Méně často byla také hlášena slabost ruky (0,7 %), která byla mírná, přechodná, nevyžadovala léčbu a odezněla bez následků. Tento nežádoucí účinek může souviset s léčbou, injekční technikou nebo s oběma těmito faktory. Dojde-li k hlášení méně obvyklé svalové slabosti, je třeba zvážit neurologické vyšetření. Navíc je před další aplikací injekce žádoucí přehodnotit injekční techniku, aby byla zajištěna intradermální aplikace injekce.
V nekontrolované bezpečnostní studii přípravku BOTOX (50 jednotek na axilu) u pediatrických pacientů ve věku 12 až 17 let (N=144) se u více než jednoho pacienta (v obou případech u 2 pacientů) objevily bolest v místě injekce a hyperhidróza (pocení mimo oblast axil).
Glabelární vrásky
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Infekce a infestace |
Méně časté |
Infekce |
|
Psychiatrické poruchy |
Méně časté |
Úzkost |
|
Poruchy nervového systému |
Časté | |
|
Méně časté |
Parestézie a závratě | |
|
Poruchy očí |
Časté |
Ptóza očního víčka |
|
Méně časté |
Blefaritis, bolest oka, poruchy vidění | |
|
Gastrointestinální poruchy |
Méně časté |
Nauzea, sucho v ústech |
|
Poruchy kůže a podkožní tkáně |
Časté |
Erytém |
|
Méně časté |
Napětí kůže, otoky (obličeje, očního víčka, periorbitální otoky), fotosenzitivita, svědění, suchá pokožka | |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Časté |
Lokalizovaná svalová slabost |
|
Méně časté |
Záškuby svalů | |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
Bolest v obličeji, otok v místě aplikace injekce, ekchymóza, bolest v místě aplikace injekce, podráždění v místě aplikace injekce |
|
Méně časté |
Chřipkové příznaky, astenie, horečka |
Vějířkovité vrásky
Následující nežádoucí účinky byly hlášeny v dvojitě zaslepených, placebem kontrolovaných klinických studiích po injekci přípravku BOTOX 24 U u samotných vějířkovitých vrásek kolem očí:
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Poruchy očí |
Časté |
Otok očního víčka |
|
Celkové poruchy a reakce v |
Časté |
Krvácení v místě aplikace |
|
místě aplikace |
injekce*, hematom v místě aplikace injekce* | |
|
Méně časté |
Bolest v místě aplikace injekce*,parestezie v místě aplikace injekce |
*nežádoucí účinky související s procedurou
Vějířkovité a glabelární vrásky
Následující nežádoucí účinky byly hlášeny v dvojitě zaslepených, placebem kontrolovaných klinických studiích po injekci přípravku BOTOX 44 U (současná léčba vějířkovitých vrásek kolem očí a glabelárních vrásek):
|
Třídy orgánových systémů |
Frekvence |
Nežádoucí účinky |
|
Celkové poruchy a reakce v místě aplikace |
Časté |
hematom v místě aplikace injekce* |
|
Méně časté |
Krvácení v místě aplikace injekce*, bolest v místě aplikace injekce* |
*nežádoucí účinky související s procedurou
Po opakovaném dávkování nebyla pozorována žádná změna v celkovém bezpečnostním profilu.
Další informace
Následující přehled zahrnuje nežádoucí účinky, které byly oznámeny po uvedení přípravku na trh bez ohledu na indikaci a jsou uvedeny jako doplnění k nežádoucím účinkům uvedeným v bodu 4.4 (Zvláštní upozornění a opatření pro použití) a v bodu 4.8 (Nežádoucí účinky).
|
Třídy orgánových systémů |
Nežádoucí účinky |
|
Poruchy imunitního systému |
Anafylaxe, angioedém, sérová nemoc, kopřivka |
|
Poruchy metabolismu a výživy | |
|
Poruchy nervového systému |
Brachiální plexopatie, dysfonie, dysartrie, obličejová paréza, hypestezie, svalová slabost, myastenia gravis, periferní neuropatie, parestezie, radikulopatie, křeče, synkopa, faciální paréza |
|
Poruchy oka |
Glaukom s uzavřeným úhlem (při léčbě blefarospasmu), lagoftalmus, strabismus, rozmazané vidění a poruchy zraku |
|
Poruchy ucha a labyrintu |
Hypoakuze, tinnitus, závratě |
|
Srdeční poruchy |
Arytmie, infarkt myokardu |
|
Respirační, hrudní a mediastinální poruchy |
Aspirační pneumonie (někdy s fatálním koncem), dušnost, respirační deprese a respirační selhání |
|
Gastrointestinální poruchy |
Bolest břicha, průjem, zácpa, sucho v ústech, dysfagie, nauzea, zvracení |
|
Poruchy kůže a podkožní tkáně |
Alopecie, psoriatiformní dermatitida, multiformní erytém, hyperhidróza, madaróza, svědění, vyrážka |
|
Poruchy svalové a kosterní soustavy a pojivové tkáně |
Svalová atrofie, myalgie |
|
Celkové poruchy a reakce v místě aplikace |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na adresu:
Státní ústav pro kontrolu léčiv Srobárova 48 100 41 Praha 10
Webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Předávkování přípravkem BOTOX je relativní pojem a závisí na dávce, oblasti vpichu a vlastnostech podkožní tkáně. Nebyl hlášen žádný případ systémové toxicity, který by byl vyvolán injekčním podáním přípravku BOTOX. Nebyl hlášen žádný případ požití přípravku BOTOX. Zvýšené dávky mohou způsobit lokální nebo vzdálenou celkovou a silnou neuromuskulární paralýzu. Projevy předávkování nejsou patrny bezprostředně po injekci. Pokud dojde k náhodné injekci nebo požití přípravku, je nutné u pacienta několik dní sledovat rozvíjející se projevy svalové slabosti, které mohou být lokální nebo v místech vzdálených od místa vpichu, což může zahrnovat ptózu, diplopii, dysfagii, dysatrii, celkovou slabost nebo respirační selhání. U těchto pacientů je třeba zvážit další lékařské vyšetření a měla by být okamžitě zavedena příslušná léčebná terapie, která může zahrnovat hospitalizaci.
Při postižení svaloviny orofaryngu a jícnu může dojít k aspiraci, která může vést ke vzniku aspirační pneumonie. Jestliže dojde k paralýze nebo oslabení dýchacích svalů, je zapotřebí intubace a řízeného dýchání, dokud nedojde k úpravě, včetně možné tracheostomie a prolongované mechanické ventilace, to vše jako dodatek k další všeobecné podpůrné péči.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: jiná periferně působící myorelaxancia, botulotoxin ATC kód: M03AX01
Farmakoterapeutická skupina: jiná dermatologika ATC kód: D11AX
Mechanismus účinku
Komplex neurotoxinu Clostridium botulinum typ A blokuje periferní uvolňování acetylcholinu na presynaptických zakončeních cholinergních nervů štěpením SNAP-25, proteinu nezbytného k úspěšnému spojení a uvolnění acetylcholinu z vesikul v nervových zakončeních.
Farmakodynamické účinky
Po injekci se toxin rychle a s vysokou afinitou váže na specifické receptory buněčného povrchu. Potom následuje přenos toxinu přes plasmatickou membránu receptory zprostředkovanou endocytózu. Nakonec se toxin uvolňuje do cytosolu. Tento pozdější proces je provázen postupnou inhibicí uvolňování acetylcholinu, klinické příznaky se projevují během 2-3 dnů, s maximálním účinkem patrným 5-6 týdnů po injekci.
Zotavení po intramuskulární injekci nastává obvykle během 12 týdnů, když nervové zakončení vyroste a znovu se spojí s koncovou ploténkou. U pacientů, kterým bylo do podpaží intradermálně podáno 50 jednotek (cílem jsou ekrinní potní žlázy), trval účinek průměrně 7,5 měsíce po podání první injekce. Nicméně u 27,5 % pacientů trval účinek 1 rok a více. Zotavení nervových zakončení sympatiku, který inervuje potní žlázy, nebylo po intradermálním podání přípravku BOTOX studováno.
Po aplikaci injekce do detruzoru ovlivňuje přípravek BOTOX eferentní dráhy aktivity detruzoru inhibicí uvolňování acetylcholinu. Přípravek BOTOX navíc inhibuje aferentní neurotransmitery a senzorické dráhy.
Klinická účinnost a bezpečnost
Fokální spasticita dolní končetiny vzniklá na podkladě cévní mozkové příhody
Byla provedena dvojitě slepá, placebem kontrolovaná, randomizovaná, multicentrická klinická studie fáze 3 u dospělých pacientů po cévní mozkové příhodě se spasticitou dolní končetiny postihující kotník. Celkem 120 pacientů bylo náhodně rozděleno tak, že dostali buď přípravek BOTOX (n=58) (celková dávka 300 jednotek), nebo placebo (n=62). Tato studie byla provedena pouze u japonských pacientů s Modified Ashworth Scale (MAS) > 3, kteří měli průměrně 6,5 roku po prodělané cévní mozkové příhodě.
Významné zlepšení v porovnání s placebem bylo pozorováno u primárního cílového parametru celkové změny z výchozího stavu kotníku po 12 týdnech na MAS škále, která byla vypočítána pomocí plochy pod křivkou (AUC). Významné zlepšení v porovnání s placebem bylo také pozorováno pro průměrnou změnu z výchozího stavu kotníku na MAS škále na individuálních návštěvách po léčbě v týdnech 4, 6 a 8. Podíl respondérů (pacienti se zlepšením alespoň o 1 stupeň) byl při těchto návštěvách také významně vyšší než u pacientů v placebo skupině.
Léčba přípravkem BOTOX byla také spojena s významným zlepšením funkčního postižení na stupnici globálního klinického dojmu (Clinic Global Impression, CGI) zkoušejícího (sekundární cílový parametr, bez úpravy multiplicity) ve srovnání s placebem. Nebylo zjištěno žádné klinicky významné zlepšení funkce měřené na lékařské hodnotící stupnici (Physician’s Rating Scale, PRS) a v rychlosti chůze.
Výsledky studie fáze 3 jsou uvedeny níže.
Primární a klíčový sekundární cílový parametr účinnosti
|
BOTOX (N=58) |
Placebo (N=62) |
Hodnota p | |
|
Průměrná AUC na škále MAS | |||
|
AUC (den 0 až týden 12) |
-8,5 |
-5,1 |
0,006 |
|
Průměrná změna z výchozího stavu na škále MAS | |||
|
Výchozí stav |
3,28 |
3,24 | |
|
Týden 1 (BTX N=57; PL N=62) |
-0,61 |
-0,52 |
0,222 |
|
Týden 4 (BTX N=56; PL N=62) |
-0,88 |
-0,43 |
< 0,001 |
|
Týden 6 (BTX N=57; PL N=61) |
-0,91 |
-0,47 |
< 0,001 |
|
Týden 8 (BTX N=54; PL N=61) |
-0,82 |
-0,43 |
< 0,001 |
|
Týden 12 (BTX N=54; PL N=61) |
-0,56 |
-0,40 |
0.240 |
|
Procento respondérů* | |||
|
Týden 1 (BTX N=57; PL N=62) |
52,6% |
38,7% |
0,128 |
|
Týden 4 (BTX N=56; PL N=62) |
67,9% |
30,6% |
< 0,001 |
|
Týden 6 (BTX N=57; PL N=61) |
68,4% |
36,1% |
< 0,001 |
|
Týden 8 (BTX N=54; PL N=61) |
66,7% |
32,8% |
< 0,001 |
|
Týden 12 (BTX N=54; PL N=61) |
44,4% |
34,4% |
0,272 |
* Pacienti se zlepšením alespoň o 1 stupeň z výchozího stavu na škále MAS
BTX N = počet pacientů ve skupině s Botoxem; PL N = počet pacientů ve skupině s placebem
Byla pozorována konzistentní odpověď při opakované léčbě.
Prevence chronické migrény
Přípravek BOTOX blokuje uvolňování neurotransmiterů, které souvisí se vznikem bolesti. Předpokládaný mechanismus prevence bolestí hlavy je blokování přenosu periferních signálů do centrální nervové soustavy, což inhibuje centrální senzibilizaci, jak bylo prokázáno v preklinických a klinických studiích.
Pacienti s chronickou migrénou bez jakékoli současně užívané profylaxe bolesti hlavy, kteří měli během 28 dní trvajícího vstupního období 15 a více dní s bolestí hlavy, z nichž alespoň 50% byla migréna/pravděpodobná migréna, a měli 4 a více ataků za den, byli studováni ve dvou klinických studiích fáze 3. Pacienti směli užívat akutní medikaci (65,5% z nich užívalo akutní medikaci během vstupního období). Aplikace přípravku BOTOX měla za následek statisticky signifikantní (p<0,001) a klinicky smysluplné zlepšení jejich stavu oproti počátečnímu stavu ve srovnání s placebem, a to 50procentní redukci počtu dnů s migrénou, průměrné frekvence dnů se středně silnou /silnou bolestí hlavy a celkového kumulovaného počtu hodin bolesti hlavy v těchto dnech. Schopnost vykonávat každodenní činnosti pacientů, jejich vitalita, psychologická úleva a celková kvalita života, sledovaná pomocí testu vlivu bolesti hlavy (Headache Impact Test - HIT6), byla ve srovnání s placebem rovněž signifikantně zlepšena.
PORUCHY MOČOVÉHO MĚCHÝŘE Hyperaktivní močový měchýř
Byly provedeny dvě dvojitě zaslepené placebem kontrolované, randomizované, multicentrické, 24 týdenní klinické studie 3. fáze u pacientů s hyperaktivním močovým měchýřem se symptomy močové inkontinence, nutkavého a častého močení. Celkem 1105 pacientů, jejichž symptomy nebyly adekvátně zvládnuty alespoň jedním typem anticholinergní terapie (inadekvátní odpověď nebo neúnosné nežádoucí účinky) bylo randomizováno, tak že jedna skupina (n=557) dostala 100 jednotek přípravku BOTOX a druhá (n=548) dostala placebo.
V obou studiích bylo oproti původnímu stavu zjištěno signifikantní zlepšení v porovnání s placebem ve prospěch přípravku BOTOX (100 jednotek) a to v denní frekvenci epizod inkontinence v primárním časovém bodě v 12. týdnu (výchozí hodnota byla 5,49 pro přípravek BOTOX a 5,39 pro placebo), včetně podílu pacientů bez inkontinence. Podle škály léčebného přínosu byl podíl pacientů s pozitivní léčebnou odpovědí (velmi zlepšeno nebo zlepšeno) signifikantně vyšší ve skupině s přípravkem BOTOX oproti skupině s placebem a to v obou studiích. Významné zlepšení v porovnání se skupinou s placebem bylo i v denní četnosti močení, nutkání na močení a v epizodách nykturie. Objem na jednu mikci byl také signifikantně vyšší. Výrazné zlepšení bylo pozorováno u všech symptomů hyperaktivního močového měchýře a to od druhého týdne.
Léčba přípravkem BOTOX byla spojena se signifikantním zlepšením oproti skupině s placebem a to v kvalitě života měřené I-QOL dotazníkem (včetně vyhýbání se a limitujícímu chování, psychosociálního dopadu a sociálních rozpaků) a dle KHQ dotazníku (včetně dopadu inkontinence, omezení rolí, sociální, fyzické limitace, osobních vztahů, emocí, poměru spánek/energie a závažnost/zvládnutí opatření).
Nebyl pozorován rozdíl v účinku po léčbě přípravem BOTOX u skupin pacientů starších 65 let a mladších 65 let.
Souhrnné výsledky pivotních studií jsou uvedeny níže:
Primární a sekundární cílové parametry účinnosti ve výchozím stavu a změna oproti výchozímu stavu dle souhrnu pivotních studií:___
|
BOTOX 100 jednotek (N=557) |
Placebo (N=548) |
Hodnota p | |
|
Denní četnost případů inkontinence* | |||
|
Průměrný výchozí stav |
5.49 |
5.39 | |
|
Průměrná změna ve 2.týdnu |
-2.85 |
-1.21 |
< 0.001 |
|
Průměrná změna v ó.týdnu |
-3.11 |
-1.22 |
< 0.001 |
|
Průměrná změna ve 12 týdnu a |
-2.80 |
-0.95 |
< 0.001 |
|
Podíl pozitivní léčebné odpovědi za použití stupnice treatment-benefit (%) | |||
|
2.týden |
64.4 |
34.7 |
< 0.001 |
|
6.týden |
68.1 |
32.8 |
< 0.001 |
|
12. týden a |
61.8 |
28.0 |
< 0.001 |
|
Denní četnost mikčních případů | |||
|
Průměrný výchozí stav |
11.99 |
11.48 | |
|
Průměrná změna ve 2.týdnu |
-1.53 |
-0.78 |
< 0.001 |
|
Průměrná změna v ó.týdnu |
-2.18 |
-0.97 |
< 0.001 |
|
Průměrná změna ve 12 týdnu b |
-2.35 |
-0.87 |
< 0.001 |
|
Denní četnost případů urgence | |||
|
Průměrný výchozí stav |
8.82 |
8.31 | |
|
Průměrná změna ve 2.týdnu |
-2.89 |
-1.35 |
< 0.001 |
|
Průměrná změna v ó.týdnu |
-3.56 |
-1.40 |
< 0.001 |
|
Průměrná změna ve 12 týdnu b |
-3.30 |
-1.23 |
< 0.001 |
|
Celkové skóre kvality života v souvislosti s inkontinencí | |||
|
Průměrný výchozí stav |
34.1 |
34.7 | |
|
Průměrná změna ve 12 týdnu bc |
+22.5 |
+6.6 |
< 0.001 |
|
King’s Health Questionnaire: životní omezení | |||
|
Průměrný výchozí stav |
65.4 |
61.2 | |
|
Průměrná změna ve 12 týdnu bc |
-25.4 |
-3.7 |
< 0.001 |
|
King’s Health Questionnaire:sociální omezení | |||
|
Průměrný výchozí stav |
44.8 |
42.4 | |
|
Průměrná změna ve 12 týdnu bc |
-16.8 |
-2.5 |
< 0.001 |
* Procentuální podíl pacientů bez inkontinence byl v průběhu 12. týdne 27,1 % u skupiny používající přípravek BOTOX a 8,4 % u skupiny používající placebo. Podíly pacientů, u kterých bylo dosaženo nejméně 75% a 50% omezení případů inkontinence oproti výchozímu stavu, byly 46% a 60,5% u skupiny s přípravkem BOTOX, ve skupině s placebem 17,7% a 31%. a Primární cílový parametr b Sekundární cílový parametr
c Předem definovaná minimálně významná změna oproti výchozímu stavu byla +10 bodů pro celkové skóre kvality života a -5 bodů pro KHQ dotazník
Průměrná doba trvání účinku vycházející ze žádosti pacienta o opakování léčby byla 166 dní (24týdnů).
Pouze limitovaný počet pacientů mladších 40 let (n=88, 8.0%), mužů (n= 135, 12.2%) a pacientů nekavkazského původu (n=101, 9.1%) bylo zavzato do studií 3. fáze. Data z těchto podskupin sloužila pouze jako podpůrná pro potvrzení příznivého terapeutického efektu.
Vyšší incidence nežádoucích příhod - retence moči, reziduální objem moči a polakisurie byla pozorována u mužů v porovnání se ženami. Výsledky ko-primárních parametrů pro muže jsou zobrazeny v následující tabulce:
Co-primární cílové parametry účinnosti ve výchozím stavu a změna oproti výchozímu stavu dle souhrnu pivotních studií u mužských pacientů:
|
BOTOX 100 jednotek (N=61) |
Placebo (N=74) |
Hodnota p | |
|
Denní četnost případů inkontinence | |||
|
Průměrný výchozí stav |
5.61 |
4.33 | |
|
Průměrná změna ve 12 týdnu |
-1.86 |
-1.23 |
0.612 |
|
Podíl pozitivní léčebné odpovědi za použití stupnice treatment-benefit (%) | |||
|
12. týden |
40.7 |
25.4 |
0.060 |
Celkem 839 pacientů bylo hodnoceno v dlouhodobé rozšířené studii (n= 758 žen, n=81 mužů). Pro všechny cílové parametry účinnosti došlo u pacientů ke konzistentní odpovědi na opakovanou léčbu.
V podskupině 345 pacientů ( n= 316 žen, n= 29 mužů), kteří dosáhli 12. týdne léčby (3. cyklus léčby), průměrné denní snížení četnosti močové inkontinence bylo postupně -3,07, -3,49 a -3,49 epizod ve 12. týdnu po první, druhé a třetí aplikaci 100 jednotek přípravku BOTOX.
Odpovídající podíl pacientů s pozitivní odpovědí na léčbu při použití stupnice léčebného přínosu byl 63,6%, 76,9%, a 77,3%.
V pivotních studiích nedošlo u žádného z 615 pacientů po podání analyzovaných vzorků ke tvorbě neutralizačních protilátek.
Močová inkontinence způsobená neurogenní hyperaktivitou detruzoru
Byly provedeny dvě dvojitě zaslepené, placebem kontrolované randomizované multicentrické klinické studie 3. fáze u pacientů trpících močovou inkontinencí způsobenou neurogenní hyperaktivitou detruzoru, u kterých docházelo buď ke spontánní mikci, nebo podstoupili katetrizaci. Do studie bylo zahrnuto 691 pacientů s poraněním míchy nebo s roztroušenou sklerózou, u kterých nebyla uspokojivá léčba pomocí nejméně jednoho anticholinergika. Pacienti byli náhodně rozděleni do skupin a dostávali buď 200 jednotek přípravku BOTOX (n = 227), 300 U přípravku BOTOX (n = 223) nebo placebo (n = 241).
V obou studiích 3. fáze bylo u primární proměnné účinnosti - změny v týdenní četnosti případů inkontinence oproti původnímu stavu - zjištěno výrazné zlepšení v porovnání s placebem ve prospěch přípravku BOTOX (200 jednotek a 300 jednotek) v primárním časovém bodě v 6. týdnu, včetně procentuálního podílu pacientů bez inkontinence. Bylo zjištěno výrazné zlepšení urodynamických parametrů včetně zvýšení cystometrické kapacity a snížení maxima tlaku detruzoru během první mimovolní kontrakce detruzoru. Bylo zjištěno také výrazné zlepšení specifických ukazatelů kvality života v souvislosti s inkontinencí v porovnání s placebem dle hodnocení pacientů v dotazníku kvality života v souvislosti s inkontinencí (I-QOL) (včetně nutnosti vyhýbat se limitujícím aktivitám, psychosociálního dopadu a sociálních rozpaků). Nebyly prokázány žádné další výhody přípravku BOTOX o obsahu 300 jednotek oproti přípravku s obsahem 200 jednotek, příznivější bezpečnostní profil byl pak pozorován u Botoxu s obsahem 200 jednotek.
Souhrnné výsledky pivotních studií jsou uvedeny níže:
Primární a sekundární koncové body ve výchozím stavu a změna oproti výchozímu stavu dle souhrnu pivotních studií:
|
BOTOX 200 U (n = 227) |
Placebo (n = 241) |
Hodnota p | |
|
Týdenní četnost případů inkontinence* | |||
|
Průměrný výchozí stav |
32,4 |
31,5 | |
|
Průměrná změna ve 2. týdnu |
-17,7 |
-9,0 |
p<0,001 |
|
Průměrná změna v 6. týdnu a |
-21,3 |
-10,5 |
p<0,001 |
|
Průměrná změna ve 12. týdnu |
-20,6 |
-9,9 |
p<0,001 |
|
Maximální cystometrická kapacita (ml) | |||
|
Průměrný výchozí stav |
250,2 |
253,5 | |
|
Průměrná změna v 6. týdnub |
+153,6 |
+11,9 |
p<0,001 |
|
Maximální tlak detruzoru během 1. mimovolní | |||
|
kontrakce detruzoru (cm H2O) | |||
|
Průměrný výchozí stav |
51,5 |
47,3 | |
|
Průměrná změna v 6. týdnu b |
-32,4 |
+1,1 |
p<0,001 |
|
Celkové skóre kvality života v souvislosti s inkontinencí c’ d |
35,37 |
35,32 | |
|
Průměrný výchozí stav |
+25,89 |
+11,15 |
p<0,001 |
|
Průměrná změna v 6. týdnu b |
+28,89 |
+8,86 |
p<0,001 |
|
Průměrná změna ve 12. týdnu |
* Procentuální podíl pacientů bez inkontinence v průběhu 6. týdne byl 37 % u skupiny používající přípravek BOTOX 200jednotek a 9 % u skupiny používající placebo. Podíly pacientů, u kterých bylo dosaženo nejméně 75% omezení případů inkontinence oproti výchozímu stavu, byly 63 % u přípravku BOTOX 200jednotek a 24 % u placeba. Podíly pacientů, u kterých bylo dosaženo nejméně 50% omezení oproti výchozímu stavu, byly 76 % a 39 %. a Primární cílový parametr b Sekundární cílový parametr
cMěřítko celkového skóre I-QOL leží v rozmezí 0 (největšípotíže) až 100 (vůbec žádné potíže). d Vpivotních studiích byl předem specifikovaný minimálně významný rozdíl (MID) pro celkové skóre I-QOL 8 bodů na základě hodnocení MID ve výši 4 - 11 bodů uváděných u pacientů trpících neurogenní hyperaktivitou detruzoru.
Průměrná doba trvání účinku vycházející ze žádosti pacienta o opakování léčby byla v daných dvou pivotních studiích 256 - 295 dní (36 - 42 týdnů) u skupiny dostávající dávku 200 jednotek oproti 92 dnům (13 týdnům) u skupiny dostávající placebo.
U všech cílových parametrů účinnosti pocítili pacienti při opakování léčby shodnou odezvu.
V pivotních studiích nedošlo u žádného ze 475 pacientů trpících neurogenní hyperaktivitou detruzoru po podání analyzovaných vzorků ke tvorbě neutralizačních protilátek.
Primární hyperhidróza axil
Dvojitě zaslepená multicentrická klinická studie byla provedena u pacientů s perzistující bilaterální primární hyperhidrózou, která byla definována na základě gravimetrického měření za těchto podmínek: nejméně 50 mg spontánní produkce potu v každé axile za 5 minut při pokojové teplotě v klidu. 320 pacientů bylo randomizováno tak, že 242 z nich dostalo 50 jednotek přípravku BOTOX a 78 placebo. Respondenti na léčbu byli ti, u kterých došlo minimálně k 50% snížení axilárního pocení oproti výchozímu stavu. Při prvním hodnocení 4 týdny po aplikaci byl podíl respondentů ve skupině s přípravkem BOTOX 93,8 % proti 35,9 % ve skupině s placebem (p<0,001). Incidence respondentů mezi pacienty ve skupině s přípravkem BOTOX byla nadále signifikantně vyšší (p<0,001), než u pacientů léčených placebem po celou dobu až do 16. týdne.
Následující otevřená studie zahrnovala 207 vhodných pacientů, kteří dostali až 3 kúry přípravku BOTOX. Dvě studie trvající 16 měsíců (dvojitě zaslepená 4 měsíce, pokračující otevřená 12 měsíců) dokončilo celkem 174 pacientů. Incidence klinických odpovědí v 16. týdnu následující po 1. kúře (n=287), 2. kůře (n=123) a 3. kůře (n=30) byla 85,0 %, 86,2 % a 80 %. Průměrná doba trvání účinku ve všech studiích byla 7,5 měsíce po první kúře, avšak u 27,5 % pacientů trval účinek 1 rok i více.
Vějířkovité vrásky kolem očí
Do studií bylo zařazeno 1 362 pacientů se středními až velkými vějířkovitými vráskami kolem očí patrnými při širokém úsměvu buď samotnými (N=445, studie 191622-098) nebo spolu se středními až velkými glabelárními vráskami patrnými při maximálním zamračení (N=917, studie 191622-099).
Injekce přípravku BOTOX významně snížily závažnost vějířkovitých vrásek kolem očí ve srovnání s placebem ve všech časových bodech (p<0.001) po dobu až 5 měsíců. To bylo měřeno podle podílu pacientů, kteří dosáhli stupně závažnosti vrásek kolem očí hodnocených jako žádné nebo mírné při širokém úsměvu v obou pivotních studiích; do dne 150 (ukončení studie) ve studii 191622-098 a do dne 120 (ukončení prvního léčebného cyklu) ve studii 191622-099). U hodnocení zkoušejícím a hodnocení samotným pacientem byl podíl pacientů dosahujících stupně závažnosti vějířkovitých vrásek patrných při širokém úsměvu, hodnocené jako žádné nebo mírně výrazné vrásky vyšší u pacientů se středně výraznými vějířkovitými vráskami, které jsou patrné při širokém úsměvu při výchozím stavu v porovnání s pacienty se závažnými vějířkovitými vráskami, které jsou patrné při širokém úsměvu při výchozím stavu. Tabulka 1 shrnuje výsledky v den 30, což byl časový bod primárního cílového ukazatele účinnosti.
Ve studii 191622-104 (prodloužení studie 191622-099) bylo 101 pacientů, kteří byli dříve randomizováni do placeba, zařazeno do své první léčby dávkou 44 U. Pacienti léčení přípravkem BOTOX měli statisticky významný přínos léčby v primárním cílovém parametru účinnosti ve srovnání s placebem v den 30 po jejich první aktivní léčbě. Míra léčebné odpovědi byla podobná jako ve skupině 44 U v den 30 po první léčbě ve studii 191622-099.
Čtyři cykly přípravku BOTOX v dávce 44 U k léčbě vějířkovitých a glabelárních vrásek obdrželo celkem 123 pacientů.
Den 30: Hodnocení vějířkovitých vrásek kolem očí při širokém úsměvu provedené zkoušejícím a pacientem - procento odezvy (% pacientů, kteří dosáhli hodnocení u vrásek kolem očí žádné nebo mírné)
|
Klinická studie |
Dávka |
BOTOX |
Placebo |
BOTOX |
Placebo |
|
Hodnocení z |
coušejícím |
Hodnocení pacientem | |||
|
191622-098 |
24 U (vějířkovité vrásky kolem očí) |
66,7%* (148/222) |
6,7% (15/223) |
58,1%* (129/222) |
5,4% (12/223) |
|
191622-099 |
24 U (vějířkovité vrásky kolem očí) |
54,9%* (168/306) |
3,3% (10/306) |
45,8%* (140/306) |
3,3% (10/306) |
|
44 U (24 U vějířkovité vrásky kolem očí; 20 U glabelární vrásky) |
59,0%* (180/305) |
3,3% (10/306) |
48,5%* (148/305) |
3,3% (10/306) | |
*p<0,001 (BOTOX vs placebo)
Zlepšení vzhledu vějířkovitých vrásek kolem očí patrných při širokém úsměvu od výchozího stavu, hodnocené subjektem, bylo statisticky významné (p<0,001) pro BOTOX (24 U a 44 U) ve srovnání s placebem v den 30 a ve všech časových bodech po každém léčebném cyklu v obou pivotních studiích.
Léčba přípravkem BOTOX v dávce 24 U rovněž významně snížila závažnost vějířkovitých vrásek v klidu. Z 528 léčených pacientů mělo 63 % (330/528) středně výrazné až výrazné vějířkovité vrásky v klidu při výchozím stavu. Z toho bylo 58 % (192/330) pacientů léčených přípravkem BOTOX považováno za respondenty na léčbu (žádné nebo mírné vrásky) 30 dní po aplikaci injekce v porovnání s 11 % (39/352) pacientů léčených placebem.
V dotazníku výsledků u obličejových vrásek (Facial Line Outcomes, FLO-11) byly podíly pacientů, kteří dosáhli zlepšení v hodnocení psychologického dopadu vrásek kolem očí na vnímání věku, atraktivnosti a únavnosti subjektem, statisticky významné (p<0,001) pro přípravek BOTOX (24 U a 44 U) ve srovnání s placebem v primárním časovém bodě 30 dnů a ve všech následujících časových okamžicích v obou pivotních studiích.
V pivotních studiích bylo 3,9 % (53/1 362) pacientů starších než 65 let. Pacienti v této věkové skupině měli léčebnou odpověď podle hodnocení zkoušejícím 36 % (v den 30) pro BOTOX (24 U a 44 U). Při analýze podle věkových skupin < 50 let a > 50 let vykázaly obě populace statisticky významné zlepšení v porovnání s placebem. Odpověď na léčbu přípravkem BOTOX v dávce 24 U, hodnocená zkoušejícím, byla nižší u skupiny subjektů ve věku > 50 let než u subjektů ve věku < 50 let (42,0% a 71,2% v uvedeném pořadí).
Celková odpověď na léčbu vějířkovitých vrásek přípravkem BOTOX, patrných při širokém úsměvu je nižší (60%) než léčebná odpověď pozorovaná u léčby glabelárních vrásek, patrných při maximálním zamračení (80%).
916 pacientů (517 pacientů s dávkou 24 U a 399 pacientů s dávkou 44 U) léčených přípravkem BOTOX mělo provedenou analýzu vzorků na tvorbu protilátek. U žádného pacienta se nevytvořily neutralizující protilátky.
5.2 Farmakokinetické vlastnosti Obecná charakteristika léčivé látky
Studie distribuce u potkanů naznačují pomalou difusi botulotoxinu typu A označeného I po injekci do m. gastrocnemius, po které následoval rychlý systémový metabolismus a vyloučení močí. Množství radioaktivně značeného materiálu ve svalu se snížilo na polovinu za přibližně 10 hodin. V místě vpichu se radioaktivita vázala na velké molekuly proteinů, zatímco v plazmě se vázala na malé molekuly, což naznačuje rychlý systémový metabolismus substrátu. Během 24 hodin od podání dávky je 60 % radioaktivity vyloučeno močí. Toxin se pravděpodobně metabolizuje proteázami a molekulární složky se opětovně využijí v normální metabolické cestě.
Klasické studie absorpce, distribuce, biotransformace a eliminace léčivé látky nebyly vzhledem k povaze přípravku prováděny.
Charakteristika po podání u pacientů
Je pravděpodobné, že může nastat malá systémová distribuce terapeutických dávek přípravku BOTOX. Klinické studie používající elektromyografickou techniku ukázaly zvýšení elektrofyziologické neuromuskulární aktivity ve svalech vzdálených od místa injekce, která nebyla provázena klinickými příznaky.
5.3 Předklinické údaje vztahující se k bezpečnosti přípravku
Reprodukční studie
Pokud je březím myším, potkanům a králíkům podán intramuskulárně přípravek BOTOX během období organogeneze, vývoj bez nežádoucích účinků (NOAEL) byl při 4,1, respektive 0,125 jednotek/kg. Vyšší dávky byly spojeny s redukcí fetální hmotnosti a/nebo s opožděnou osifikací a u králíků byly zaznamenány potraty.
Další studie
Kromě reprodukční toxikologie byly provedeny následující preklinické studie bezpečnosti přípravku BOTOX: akutní toxicita, toxicita po opakovaném injekčním podání, lokální snášenlivost, mutagenita, antigenita, krevní kompatibilita. Během studií použití klinicky
relevantní dávky se neobjevilo žádné zvláštní riziko pro lidi. Maximální doporučená dávka u lidí během jedné kůry je 300 jednotek (odpovídá 6 jednotek/kg u osoby s hmotností 50 kg). Publikovaná intramuskulární LD50 u juvenilních opic je 39 jednotek/kg.
Po podání jednorázové injekce přípravku BOTOX v dávce <50 jednotek/kg do detruzoru u potkanů nebyla zjištěna systémová toxicita. Při simulaci neúmyslné aplikace injekce byla podána jednorázová dávka přípravku BOTOX (přibližně 7 jednotek/kg) do prostatické části močové trubice a proximálního rekta, semenných váčků a stěny močového měchýře nebo do dělohy u opic (přibližně 3 jednotky/kg) bez nežádoucích klinických účinků. Ve studii sledující opakované podání dávky do detruzoru po 9 měsících (4 injekce) byla zjištěna ptóza při dávce 24 jednotek/kg a mortalita byla zjištěna při dávkách >24 jednotek/kg.
Myofibrická degenerace/regenerace kosterních svalů byla pozorována u zvířat s dávkami 24U/kg a vyššími. Tyto myopatické změny byly považovány za sekundární účinek systémové expozice. Navíc byla myofibrická degenerace pozorována u jednoho zvířete s dávkou 12U/kg. Poškození zde bylo málo závažné a nebylo spojeno s žádnou klinickou manifestací. Nemohlo zde být s jistotou určeno, zda se jedná o souvislost s léčbou přípravkem BOTOX. Dávka 12 U/kg odpovídá 3krát vyšší expozici přípravku BOTOX než představuje doporučená klinická dávka 200 U při močové inkontinenci způsobené neurogenní hyperaktivitou detruzoru (na osobu o hmotnosti 50 kg).
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
• lidský albumin
• chlorid sodný
6.2 Inkompatibility
Protože nebyly provedeny studie inkompatibility, nesmí být přípravek BOTOX mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
BOTOX A BOTOX 50 Allergan Units: Neotevřená lahvička: 3 roky. BOTOX 200 Allergan Units: Neotevřená lahvička: 3 roky
Po rekonstituci v lahvičce byla doložena stabilita na 24 hodin při teplotě 2°C - 8°C.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce při teplotě 2°C - 8°C nebo v mrazících boxech při teplotě pod -5,0°C.
Uchovávání přípravku po rekonstituci: viz bod 6.3.
Mikrobiologické studie a studie účinnosti prokázaly, že po rekonstituci může být přípravek uchováván při teplotě 2°C - 8°C po dobu 5 dnů.
Avšak, vzhledem k tomu, že přípravek neobsahuje konzervanty, je doba a podmínky uchovávání přípravku před použitím v odpovědnosti uživatele a neměla by být delší než 24 hodin při teplotě 2°C - 8°C.
6.5 Druh obalu a obsah baleni
BOTOX 50 Allergan Units: lahvička (sklo typu I) se zátkou (chlorbutylová pryž) uzavřená pertlem (hliník) a flip off uzávěrem (polypropylen) červené barvy s průsvitným povrchem a s popisem Allergan 50 p, krabička.
Velikost balení: 1 lahvička, 2, 3 nebo 6 lahviček o objemu 5 ml.
Na trhu nemusí být všechny velikosti balení.
BOTOX: lahvička z bezbarvého skla uzavřená pertlem a PE flip off uzávěrem fialové barvy s transparentním povrchem a s popisem Allergan 100 p, krabička.
Velikost balení 1a 4 lahvičky o objemu 10 ml.
Na trhu nemusí být všechny velikosti balení
BOTOX 200 Allergan Units: lahvička (sklo typu I) se zátkou (chlorbutylová pryž) uzavřená pertlem (hliník), krabička.
Velikost balení: 1 lahvička, 2, 3 nebo 6 lahviček o objemu 10 ml.
Na trhu nemusí být všechny velikosti balení
6. 6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Doporučuje se připravovat roztok a plnit injekční stříkačku na podložce z buničité vaty, která zachytí případné vystříknutí roztoku. Přípravek BOTOX se rekonstituuje sterilním fyziologickým roztokem bez konzervačních látek (0,9% chlorid sodný roztok pro injekci). Připravte si příslušné množství rozpouštědla do stříkačky. Viz bod 4.2 Pokyny k ředění.
Rozpouštědlo se smí do lahvičky aplikovat jen velmi zvolna, neboť bubláním nebo prudkým mícháním ztrácí přípravek BOTOX účinnost. Nepoužívejte a zničte lahvičku, pokud rozpouštědlo není vtaženo vakuem do lahvičky. Rekonstituovaný přípravek
BOTOX je čirý bezbarvý až světle žlutý roztok bez patrných částic nebo sraženin. Rekonstituovaný roztok přípravku BOTOX by měl být před podáním vizuálně zkontrolován (čirý a bez částic). Naředěný roztok přípravku BOTOX v lahvičce se před podáním může uchovávat v chladničce (při teplotě 2-8°C) nejdéle po dobu 24 hodin. Datum a čas naředění by měl být zaznamenán na obalu. Je-li přípravek BOTOX v injekční stříkačce dále naředěn k použití pro injekci do detrusoru , měl by se aplikovat okamžitě. Přípravek je určen k jednorázovému použití, nespotřebovaný roztok je třeba znehodnotit.
Pro bezpečnou likvidaci musí být nepoužité lahvičky po rekonstituci malým množstvím vody autoklávovány. Použité lahvičky, stříkačky, rozlitý roztok atd. by měly být autoklávovány nebo zbytek přípravku BOTOX inaktivován 0,5% roztokem chlornanu po dobu 5 minut.
Nepoužitý přípravek nebo odpadní materiál by měl být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Allergan Pharmaceuticals Ireland, Westport, Irsko
8. REGISTRAČNÍ ČÍSLO
BOTOX 50 Allergan Units: 63/010/12-C
BOTOX: 63/568/93-C
BOTOX 200 Allergan Units: 63/011/12-C
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
BOTOX 50 Allergan Units a Botox 200 Allergan Units: 11. 1. 2012 BOTOX: 14.7.1993 / 24.6.2009
10. DATUM REVIZE TEXTU
5.5.2015
Stránka 50 z 50