Beriate 1000 Iu
sp. zn. sukls31496/2016
Souhrn údajů o přípravku
1. NÁZEV PŘÍPRAVKU
Beriate 250 IU Beriate 500 IU Beriate 1000 IU Beriate 2000 IU
Prášek a rozpouštědlo pro injekční nebo infuzní roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička obsahuje nominálně:
250/500/1000/2000 IU Factor VIII coagulationis humanus (lidského koagulačního faktoru VIII, FVIII). Po rekonstituci s 2,5/5/10 ml vody na injekci přípravek Beriate 250 IU/500 IU/1000 IU obsahuje 100 IU/ml faktoru VIII.
Beriate 2000 IU se rekonstituuje v 10 ml vody na injekci a obsahuje přibližně 200 IU/ml faktoru VIII.
Síla (IU) se stanovuje chromogenní analýzou podle Evropského lékopisu. Střední hodnota specifické aktivity přípravku Beriate je přibližně 400 IU/mg bílkoviny.
Vyrobeno z plazmy lidských dárců.
Pomocná látka se známým účinkem:
Sodík přibližně 100 mmol/l (2,3 mg/ml).
Úplný seznam pomocných látek viz bod 6.1
3. LÉKOVÁ FORMA
Prášek a rozpouštědlo pro injekční nebo infuzní roztok.
Bílý prášek a čiré, bezbarvé rozpouštědlo pro přípravu injekčního/infuzního roztoku.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba a profylaxe krvácení u pacientů s hemofilií A (vrozený nedostatek faktoru VIII). Tento přípravek se může použít k léčbě získaného nedostatku faktoru VIII.
4.2 Dávkování a způsob podání
Léčba musí být zahájena pod dohledem lékaře se zkušeností s léčbou hemofilie.
Dávkování:
Dávkování a délka substituční terapie závisí na závažnosti deficience faktoru VIII, místě a rozsahu krvácení a na klinickém stavu pacienta.
Počet podaných jednotek faktoru VIII se uvádí v mezinárodních jednotkách (IU), které jsou vztaženy k současnému standardu WHO pro přípravky obsahující faktor VIII. Aktivita faktoru VIII v plazmě se vyjadřuje buď v procentech (vzhledem k normální lidské plazmě) nebo v IU (vzhledem k mezinárodnímu standardu pro faktor VIII v plazmě).
Jedna mezinárodní jednotka (IU) aktivity faktoru VIII odpovídá takovému množství faktoru VIII, které je obsaženo v 1 ml normální lidské plazmy.
Požadovaná léčba
Výpočet požadované dávky faktoru VIII je založen na empirickém předpokladu, že 1 IU faktoru VIII na kg tělesné hmotnosti zvýší aktivitu faktoru VIII v plazmě přibližně o 2% normální aktivity (2 IU/dl). Potřebná dávka se určuje pomocí následujícího vzorce:
Potřebná dávka = tělesná hmotnost (kg) x požadovaný vzestup faktoru VIII (% nebo IU/dl) x 0,5.
Dávka, která má být podána a frekvence podávání musí vždy směřovat k dosažení klinického účinku v individuálním případě.
V případě následujících krvácivých příhod nemá v daném období hladina faktoru VIII klesnout pod danou hodnotu plazmatické aktivity (v % normálu nebo IU/dl). Jako vodítko pro dávkování při krvácení a chirurgických zákrocích lze použít následující tabulku:
|
Stupeň krvácení/ Typ chirurgického výkonu |
Požadovaná hladina faktoru VIII (% nebo IU/dl) |
Frekvence dávkování (hodiny) / Délka trvání léčby (dny) |
|
Krvácení | ||
|
Časná hemartróza, krvácení do svalů nebo do dutiny ústní. |
20 - 40 |
Infuzi opakovat každých 12 - 24 hodin. Nejméně l den, dokud se krvácení, které se projevuje bolestí, nezastaví nebo nedojde ke zhojení. |
|
Rozsáhlejší hemartróza, krvácení do svalů nebo hematom. |
30 - 60 |
Infuzi opakovat každých 12 - 24 hodin po dobu 3 - 4 dnů nebo déle dokud bolest a akutní postižení neustoupí. |
|
Život ohrožující krvácení. |
60 - 100 |
Infuzi opakovat každých 8 - 24 hodin dokud nebezpečí nepomine. |
|
Chirurgické výkony | ||
|
Menší zákroky včetně extrakce zubů |
30 - 60 |
Každých 24 hodin, nejméně 1 den, až je dosaženo zhojení. |
|
Velké zákroky |
80 - 100 (před a po operaci) |
Infuzi opakovat každých 8 - 24 hodin, až do adekvátního zahojení rány, potom pokračovat v léčbě nejméně 7 dní k udržení aktivity faktoru VIII na 30-60% (IU/dl). |
Profylaxe
Na dlouhodobou profylaxi proti krvácení pacientům s těžkou hemofilií A obvykle postačí dávky 20 až 40 IU faktoru VIII na kg tělesné hmotnosti podávané v intervalech 2 až 3 dnů. V některých případech, zejména u mladších pacientů, je nutné zvolit kratší intervaly dávkování nebo vyšší dávky.
Během léčby se doporučuje vhodným způsobem stanovovat hladiny faktoru VIII, což pomůže určit podávanou dávku a frekvenci infuzí. Zejména v případech větších chirurgických výkonů je nezbytné přesně sledovat substituční léčbu pomocí koagulačních vyšetření (aktivita faktoru VIII v plazmě).
U jednotlivých pacientů se může reakce na podávání faktoru VIII lišit tím, že j sou dosahovány různé hladiny in vivo recovery a vykazovány různé poločasy.
Pacienti mají být sledováni s ohledem na vývoj inhibitorů faktoru VIII. Viz také 4.4.
Dříve neléčení pacienti
Bezpečnost a účinnost přípravku Beriate u dříve neléčených pacientů nebyla dosud stanovena.
Pediatrická populace
Dávkování u dětí závisí na tělesné hmotnosti, a proto platí stejné zásady jako při léčbě dospělých. Frekvence dávkování v individuálních případech má být zaměřena na klinickou účinnost. S léčbou dětí do 6 let jsou již určité zkušenosti (viz bod 5.1.).
Způsob podání Intravenózní podání.
Návod k rekonstituci tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
Před podáním má být přípravek ohřátý na pokojovou teplotu nebo tělesnou teplotu. Podává se injekčně nebo pomalou intravenózní infuzí s rychlostí, která vyhovuje pacientovi. Rychlost injekce nebo infuze nemá překročit 2 ml/min.
Pozorujte pacienta, zda nemá bezprostřední reakce. Pokud se vyskytnou jakékoliv reakce, které mohou mít souvislost s podáváním přípravku Beriate, rychlost infuze se má snížit nebo zastavit, jak to vyžaduje klinický stav pacienta (viz též bod 4.4.).
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Hypersenzitivita
Hypersenzitivita alergického typu je možná.
Obj eví-li se příznaky hypersenzitivity, pacienti mají být poučeni, aby okamžitě přerušili používání tohoto léčivého přípravku a kontaktovali svého lékaře. Pacienti musí být informováni o počátečních příznacích hypersenzitivních reakcí včetně vyrážky, generalizované kopřivky, tlaku na hrudi, dušnosti, hypotenze a anafylaxe.
V případě šoku je třeba dodržovat standardní lékařské postupy pro léčbu šoku.
Inhibitory
Tvorba neutralizujících protilátek (inhibitorů) proti faktoru VIII je známá komplikace v léčbě jedinců s hemofilií A. Tyto inhibitory jsou obvykle IgG imunoglobuliny namířené proti prokoagulační aktivitě faktoru VIII, které jsou kvantifikovány v Bethesda jednotkách (BU) na ml plazmy pomocí modifikovaného testu. Riziko vzniku inhibitorů koreluje s expozicí faktorem VIII, toto riziko je nejvyšší během prvních 20 dnů expozice. Vzácně se mohou inhibitory vyvinout po prvních 100 dnech expozice.
Případy recidivující inhibitorů (s nízkým titrem) byly zaznamenány po přechodu z jednoho faktoru VIII na jiný u dříve léčených pacientů s více než 100 dny expozice, kteří mají v anamnéze vývoj inhibitorů. Proto se doporučuje pečlivě sledovat všechny pacienty na výskyt inhibitorů po každé změně přípravku.
Obecně platí, že všichni pacienti, kteří jsou léčeni lidským koagulačním faktorem VIII, musí být pečlivě sledováni s ohledem na vývoj inhibitorů vhodnými klinickými vyšetřeními a laboratorními testy. Pokud se nedosáhne očekávané úrovně plazmatické aktivity faktoru VIII, nebo pokud krvácení není s příslušnou dávkou pod kontrolou, musí být provedeno vyšetření na přítomnost inhibitoru FVIII. U pacientů s vysokými hladinami inhibitoru, nemusí být léčba faktorem VIII účinná a je třeba zvážit jiné možnosti léčby. Léčba těchto pacientů má být vedena lékaři, kteří mají zkušenosti s péčí o pacienty s hemofilií A a s inhibitory faktoru VIII. Viz také bod 4.8.
Přípravek Beriate obsahuje až 28 mg sodíku na 1000 IU. To je třeba vzít v úvahu pacientů na kontrolované sodíkové dietě.
Komplikace spojené s katetrizací
Pokud je požadován centrální žilní přístup (CVAD), je třeba zvážit riziko komplikací souvisejících s CVAD včetně lokálních infekcí, bakteriémie a trombózy v místě zavedení katetru.
Virová bezpečnost
Standardní opatření k předcházení infekcím způsobeným podáváním léčivých přípravků připravených z lidské krve nebo plazmy, zahrnují výběr dárců, testování jednotlivých dárců a plazmatických poolů na specifické infekční markery a zařazení účinných výrobních kroků pro inaktivaci nebo odstranění virů. Navzdory těmto opatřením při podávání léků připravených z lidské krve nebo plazmy nelze zcela vyloučit možnost přenosu infekce. Platí to i pro jakékoli neznámé nebo právě objevené viry nebo jiné patogeny.
Přijatá opatření jsou účinná proti obaleným virům jako je virus lidské imunodeficience (HIV), virus hepatitidy B (HBV) a virus hepatitidy C (HCV) a pro neobalené viry hepatitidy A (HAV) a parvoviru B19.
U pacientů s pravidelným nebo opakovaným příjmem přípravků obsahujících faktor VIII, který se získává z lidské plazmy, je třeba zvážit vhodné očkování (proti hepatitidě A a B).
Důrazně se doporučuje, aby pokaždé, když je přípravek Beriate je podáván pacientovi, byl zaznamenán název a číslo šarže přípravku tak, aby se zachovala souvislost mezi pacientem a šarží přípravku.
Pediatrická populace
Uvedená upozornění a opatření se vztahují na dospělé i děti.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly hlášeny žádné interakce lidského koagulačního faktoru VIII s jinými léčivými přípravky.
4.6 Fertilita, těhotenství a kojení
Reprodukční studie s faktorem VIII se na zvířatech neprováděly.
Těhotenství a kojení
Vzhledem k vzácnému výskytu hemofilie A u žen nejsou k dispozici zkušenosti týkající se použití faktoru VIII během těhotenství a kojení.
Z uvedených důvodů může být faktor VIII podáván během těhotenství a kojení pouze v takovém případě, pokud je to jednoznačně indikováno.
Fertilita
Nejsou k dispozici žádné údaje o fertilitě.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Beriate nemá žádný vliv na schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
Hypersenzitivita nebo alergické reakce (které mohou zahrnovat angioedém, pálení a bodání v místě infuze, zimnici, zarudnutí, generalizovanou urtikarii, bolest hlavy, vyrážka, hypotenze, letargie, nauzea, neklid, tachykardie, tlak na hrudi, brnění, zvracení, sípání) byly pozorovány velmi vzácně a mohou se v některých případech rozvinout do závažné anafylaxe (včetně šoku).
U pacientů s hemofilií A se mohou velmi vzácně vyvinout neutralizující protilátky (inhibitory) faktoru VIII. Jestli se takové inhibitory objeví, tento stav se projeví jako nedostatečná klinická odpověď. V takových případech se doporučuje kontaktovat specializované centrum pro léčbu hemofilie.
Tabulkový přehled nežádoucích účinků
Následující nežádoucí účinky vycházejí z postmarketingových studií bezpečnosti a z literárních údajů. Tabulka uvedená níže je podle MedDRA klasifikace orgánových systémů.
Frekvence byly hodnoceny podle následující konvence: velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000), není známo (z dostupných údajů nelze určit).
|
Třída orgánových systémů MedDRA |
Nežádoucí účinky |
Frekvence |
|
Poruchy krve a lymfatického systému |
Inhibice FVIII |
Velmi vzácné |
|
Celkové poruchy a reakce v místě aplikace |
Velmi vzácné | |
|
Poruchy imunitního systému |
Hypersenzitivita (alergické reakce) |
Velmi vzácné |
Informace o virové bezpečnosti viz bod 4.4.
Pediatrická populace
Očekává se, že frekvence, typ a závažnost nežádoucích účinků u dětí budou stejné jako u dospělých. Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Žádné příznaky předávkování lidským koagulačním faktorem VIII nejsou dosud známy.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Koagulační faktory: krevní koagulační faktory ATC kód: B02BD02
Komplex faktoru VlII/von Willebrandův faktor je tvořen ze dvou molekul (faktor VIII a von Willebrandův faktor) s různými fyziologickými funkcemi.
Po infuzi pacientovi s hemofilií se v jeho krevním oběhu faktor VIII váže na von Willebrandův faktor.
Aktivovaný faktor VIII působí jako kofaktor aktivovaného faktoru IX, který urychluje konverzi faktoru X na aktivovaný faktor X. Aktivovaný faktor X katalyzuje přeměnu protrombinu na trombin. Trombin katalyzuje přeměnu fibrinogenu na fibrin a může vzniknout krevní sraženina.
Hemofilie A je dědičná porucha koagulace krve, která je vázaná na pohlaví a způsobuje sníženou hladinu faktoru VIII: C, která vyvolává těžké krvácení do kloubů, svalů nebo vnitřních orgánů a to buď spontánně nebo v důsledku úrazu nebo chirurgického výkonu. Plazmatické hladiny faktoru VIII se zvyšují substituční terapií a tímto způsobem umožňují přechodnou úpravu nedostatku faktoru VIII a sklonu ke krvácení.
Kromě úlohy jako ochranného proteinu faktoru VIII, von Willebrandův faktor zprostředkovává adhezi trombocytů k místům cévních poranění a hraje roli v agregaci trombocytů.
K dispozici jsou údaje o léčbě 16 dětí mladších 6 let a výsledky klinické účinnosti a bezpečnosti jsou podobné jako u starších pacientů.
5.2 Farmakokinetické vlastnosti
Po intravenózním podání se hladina faktoru VIII snižuje mono- až biexponenciálně. Konečný poločas je v rozmezí 5 a 22 hodin se střední hodnotou asi 12 hodin. Zvýšení aktivity faktoru VIII po podání jedné IU faktoru VIII/kg tělesné hmotnosti (incremental recovery) představovalo přibližně 2 % s variabilitou mezi jednotlivými pacienty (1,5 až 3 %). Střední rezidenční čas (MRT) byl 17 hodin (směrodatná odchylka 5,5 hodiny), střední hodnota plochy pod křivkou plazmatických koncentrací (AUDC) byla 0,4 h x kg / ml (směrodatná odchylka 0,2), průměrná clearance 3 ml/h/kg (směrodatná odchylka 1,5 ml/h/kg).
Pediatrická populace
U dětské populace jsou k dispozici omezené farmakokinetické údaje.
5.3 Předklinické údaje vztahující se k bezpečnosti
Obecná toxicita
Toxikologické studie při opakovaných dávkách se neprováděly z důvodu tvorby protilátek proti heterologní bílkovině.
Toxický účinek na laboratorní zvířata neměly ani dávky několikanásobně vyšší než je doporučená dávka pro člověka.
Zkoušky s tepelně ošetřeným přípravkem s faktorem VIII s polyklonálními precipitujúcimi králičími protilátkami Ouchterlonyho metodou a s testem na pasivní kožní anafylaxi zkoušeným na morčatech nedokázaly změněnou imunologickou reakci v porovnání s nativním proteinem.
Mutagenita:
Protože klinické zkoušky nezaznamenaly žádné tumorigenní a mutagenní účinky lidského koagulačního faktoru VIII, nepovažují se experimentální studie, zejména na heterologních druzích, za smysluplné.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Glycin
Dihydrát chloridu vápenatého
Hydroxid sodný (v malém množství) na úpravu pH)
Sacharóza Chlorid sodný
Dodávané rozpouštědlo: voda na injekci 2,5 ml, 5 ml a 10 ml.
6.2 Inkompatibility
Tento léčivý přípravek se nesmí mísit s jinými léčivými přípravky, rozpouštědly a ředidly s výjimkou těch, které jsou uvedeny v bodě 6.1.
6.3 Doba použitelnosti
3 roky
Chemická a fyzikální stabilita rekonstituovaného přípravku byla prokázána po dobu 8 hodin při teplotě do 25 °C. Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li podán okamžitě, doba uchovávání přípravku nesmí překročit 8 hodin při pokojové teplotě.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C - 8 °C). Chraňte před mrazem. Uchovávejte injekční lahvičku v krabičce, aby byl přípravek chráněn před světlem.
V rámci doby použitelnosti může být Beriate uchováván až do 25 °C, nesmí se překročit kumulativní doba uchovávání 1 měsíce. Jednotlivé doby uchovávání přípravku při pokojové teplotě musí být zaznamenány v souladu s celkovou dobou 1 měsíce.
NEVYSTAVUJTE lahvičky přímému zdroji tepla. Injekční lahvičky nesmí být zahřáté na teplotu vyšší než je tělesná teplota (37 °C).
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Vnitřní obaly:
Injekční lahvičky z bezbarvého skla (250 IU a 500 IU:třídy I, 1000 a 2000 IU: třídy II), uzavřené pryžovou zátkou pod vakuem (brombutyl), hliníkovým uzávěrem a plastikovým krytem (polypropylen).
Jedno balení s 250 IU obsahuje:
1 injekční lahvička s práškem 1 injekční lahvička s 2,5 ml vody na injekci Jedna aplikační souprava obsahuje: l přepouštěcí adaptér s filtrem 20/20 1 injekční stříkačka 5 ml k jednorázovému použití
1 venepunkční set
2 tampony s alkoholem 1 nesterilní náplast
Jedno balení s 500 IU obsahuje:
1 injekční lahvička s práškem 1 injekční lahvička s 5 ml vody na injekci Jedna aplikační souprava obsahuje: l přepouštěcí adaptér s filtrem 20/20 1 injekční stříkačka 5 ml k jednorázovému použití
1 venepunkční set
2 tampony s alkoholem 1 nesterilní náplast
Jedno balení s 1000 IU obsahuje:
1 injekční lahvička s práškem 1 injekční lahvička s 10 ml vody na injekci Jedna aplikační souprava obsahuje: l přepouštěcí adaptér s filtrem 20/20 1 injekční stříkačka 10 ml k jednorázovému použití
1 venepunkční set
2 tampony s alkoholem 1 nesterilní náplast
Jedno balení s 2000 IU obsahuje:
1 injekční lahvička s práškem 1 injekční lahvička s 10 ml vody na injekci Jedna aplikační souprava obsahuje: l přepouštěcí adaptér s filtrem 20/20 1 injekční stříkačka 10 ml k jednorázovému použití
1 venepunkční set
2 tampony s alkoholem 1 nesterilní náplast
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Způsob podání
Všeobecné pokyny:
- Roztok musí být čirý nebo slabě opalescentní. Po filtraci/nasátí (viz níže) musí být rekonstituovaný přípravek před podáním vizuálně zkontrolován na přítomnost částic a změnu barvy. Nepoužívejte roztoky, které jsou zakalené nebo obsahují rezidua (usazeniny/částice).
- Rekonstituce a nasátí musí být provedeno za aseptických podmínek.
Rekonstituce:
Zahřejte rozpouštědlo na pokojovou teplotu. Sejměte vyklápěcí víčka z lahviček s práškem
i s rozpouštědlem, očistěte zátky dezinfekčním roztokem a nechte je oschnout než otevřete balení
Mix2Vial.
1
3
2
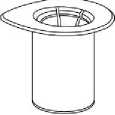
1. Otevřete balení Mix2Vial tím, že vyklopíte víčko. Nevytahujte Mix2Vial z blistru!
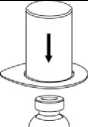
2. Postavte injekční lahvičku s rozpouštědlem na rovný a čistý povrch, držte ji pevně. Uchopte Mix2Vial společně s blistrem a zatlačte hrot modrého konce adaptéru rovně dolů skrz zátku injekční lahvičky s rozpouštědlem.
3. Opatrně odstraňte blistr ze soupravy Mix2Vial tak, že ho držíte za okraj a táhnete svisle vzhůru. Přesvědčte se, že jste vytáhli jen blistrový obal a ne soupravu Mix2Vial.
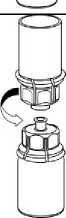
4
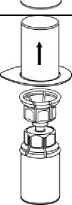
4. Postavte injekční lahvičku s přípravkem na rovný a pevný povrch. Obraťte injekční lahvičku s rozpouštědlem spolu s nasazenou soupravou Mix2Vial a zatlačte hrot průhledného konce adaptéru rovně dolů skrz zátku injekční lahvičky s přípravkem. Rozpouštědlo se samo automaticky nasaje do injekční lahvičky s přípravkem.
5. Uchopte jednou rukou tu část soupravy Mix2Vial, kde je injekční lahvička s práškem a druhou rukou tu část, kde je injekční lahvička od rozpouštědla a odšroubujte je opatrně od sebe proti směru hodinových ručiček na dvě části. Odstraňte injekční lahvičku od rozpouštědla
s modrým adaptérem soupravy Mix2Vial.

6
7
6. Jemně otáčejte injekční lahvičkou s přípravkem s připojeným průhledným adaptérem, dokud se prášek zcela nerozpustí. Netřepejte s ní.
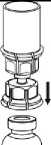
7. Nasajte vzduch do prázdné sterilní injekční stříkačky. Zatímco je injekční lahvička s přípravkem dnem dolů, spojte injekční stříkačku s koncovkou Luer Lock soupravy Mix2Vial šroubováním ve směru hodinových ručiček. Vytlačte vzduch do injekční lahvičky s přípravkem.
Natáhnutí a aplikace

8
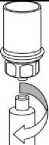

9
8. Zatímco držíte píst injekční stříkačky stlačený, obraťte celý systém dnem vzhůru a pomalým vytahováním pístu natáhněte roztok do injekční stříkačky.
9. Po natažení roztoku do injekční stříkačky uchopte pevně válec injekční stříkačky (píst stále směřuje dolů) a odpojte průhledný adaptér soupravy Mix2Vial od injekční stříkačky odšroubováním proti směru hodinových ručiček.
Na injekci přípravku Beriate je vhodné použít umělohmotnou injekční stříkačku k jednorázovému použití, neboť roztoky tohoto typu mají tendenci přilnout k zabroušenému skleněnému povrchu, který mají všechny skleněné injekční stříkačky.
Roztok podávejte pomalu intravenózně (viz bod 4.2). Ujistěte se, že do stříkačky s přípravkem nevnikla krev. Použijte venepunkční set, který je dodáván s přípravkem, a vpíchněte jehlu do žíly. Nechejte protékat krev zpět na konec hadičky. Připojte injekční stříkačku k zámku na konci venepunkčního setu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
CSL Behring GmbH Emil-von-Behring-Str. 76 35041 Marburg Německo
8. REGISTRAČNÍ ČÍSLO
Beriate 250 IU: 75/203/15-C Beriate 500 IU: 75/204/15-C Beriate 1000 IU: 75/205/15-C Beriate 2000 IU: 75/206/15-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15.4.2015
10. DATUM REVIZE TEXTU
16.6.2016
11/11