Batidor 20 Mg/Ml + 5 Mg/Ml
zastaralé informace, vyhledat novějšíPříloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls234282/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU Batidor 20 mg/ml + 5 mg/ml oční kapky, roztok
dorzolamidum / timololum
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden mililitr obsahuje dorzolamidi hydrochloridum 22,26 mg, což odpovídá dorzolamidum 20 mg a timololi maleas 6,83 mg, což odpovídá timololum 5 mg.
Pomocné látky: benzalkonium-chlorid 0,075 mg/ml.
1 ml obsahuje cca 30 kapek.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Oční kapky, roztok
Popis přípravku: čirý, bezbarvý až světle žlutý sterilní oční roztok (kapky)
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Tento přípravek je určen k léčbě zvýšeného nitroočního tlaku u pacientů s glaukomem s otevřeným úhlem nebo pseudoexfoliativním glaukomem, kde je lokální léčba samotným beta-blokátorem nedostatečná.
4.2 Dávkování a způsob podání
Dávkování
Dospělí
Dávka přípravku je jedna kapka dvakrát denně aplikovaná do spojivkového vaku postiženého oka. Způsob podání
Systémovou absorpci lze snížit použitím nasolakrimální okluze nebo zavřením víček po aplikaci na dobu 2 minut. Toto opatření vede ke snížení systémových nežádoucích účinků a ke zvýšení lokálního účinku léčiva.
Je-li zároveň podáván další oční léčivý přípravek, je nutné dodržet mezi jeho podáním a podáním přípravku Batidor časové rozpětí alespoň 10 minut.
Před podáním přípravku si má pacient umýt ruce a při podávání se má vyvarovat přímého kontaktu špičky kapátka s okem nebo okolní oblastí.
Pacienta je rovněž třeba upozornit, že při nesprávném zacházení může dojít ke kontaminaci bakteriemi, což může způsobit infekci oka. Závažné poškození oka a následná ztráta zraku mohou být důsledkem kontaminace očních kapek.
Pacienti by měli být poučeni o správném zacházení s lahvičkou.
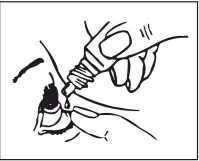
Návod k použití
1. Pacient si před aplikací musí umýt ruce a sednout si či stát, jak je mu to pohodlné
2. Odšroubovat víčko.
3. Zaklonit hlavu.
4. Prstem jemně odtáhnout spodní víčko postiženého oka.
5. Otočit lahvičku vzhůru nohama a přiblížit hrot lahvičky koku, vyvarovat se přímého kontaktu s okem.
NEDOTÝKAT SE OKA NEBO OČNÍHO VÍČKA HROTEM KAPÁTKA.
6. Jemně stisknout lahvičku tak, abyste do oka kápla pouze jedna kapka, a uvolnit spodní víčko.
7. Zavřít oko a proti nosu stisknout prstem oční koutek postiženého oka po dobu 1 minuty.
8. Podle doporučení lékaře zopakovat tento postup u druhého oka.
9. Zavřít lahvičku.
Pediatrická populace
Účinnost přípravku Batidor nebyla u dětí ve věku od narození do 18 let dosud stanovena.
V současnosti dostupné údaje týkající se bezpečnosti přípravku u pediatrických pacientů ve věku od 2 do 6 let jsou posány v bodě 5.1, ale na jejich základě nelze doporučit dávkování u dětí.
4.3 Kontraindikace
Přípravek Batidor je kontraindikován u pacientů s/se
• Hypersenzitivitou na jednu nebo obě léčivé látky nebo na kteroukoli pomocnou látku
• reaktivním onemocněním dýchacích cest včetně průduškového astma, průduškového astma v anamnéze nebo závažné chronické obstrukční nemoci plic
• sinusovou bradykardií, sick sinus syndromem, sinoatriální blokádou, AV blokem II. nebo III. stupně nekontrolovaným pacemakerem, klinicky zjevným srdečním selháním, kariogenním šokem
• závažnou dysfunkcí ledvin (clearance kreatininu< 30 ml/min.) nebo hyperchloremickou acidózou
Uvedené informace se vztahují na jednotlivé léčivé látky a nejsou omezeny pouze na jejich
kombinaci.
4.4 Zvláštní upozornění a opatření pro použití
Stejně jako ostatní lokálně aplikované látky používané v oftalmologii, i timolol je absobován systematicky. Vzhledem k betaadrenergnímu účinku timololu se mohou vyskytnout stejné typy kardiovaskulárních, plicních a ostatních nežádoucích účinků jako u systémových beta-blokátorů. Incidence systémových účinků v souvislosti s lokálním očním podáním je nižší než u systémového podání. Opatření ke snížení systémové absorpce viz bod 4.2.
Srdeční poruchy:
U pacientů s kardiovaskulárním onemocněním (např. koronární onemocnění srdce, Prinzmetalova angina a srdeční selhání) a s antihypertenzní terapií má být kriticky posouzena nutnost léčby očními beta-blokátory a má být zvážena terapie jinou léčivou látkou. U pacientů s kardiovaskulárním onemocněním by měly být sledovány projevy zhoršení onemocnění a výskyt nežádoucích účinků.
Kvůli nežádoucímu vlivu beta-blokátorů na převodní čas se pacientům s AV blokem l.stupně mají podávat beta-blokátory vždy s opatrností.
Cévní poruchy
Pacienti s těžkou periferní cirkulační poruchou/nemocí (např. těžká forma Raynaudovy nemoci anebo Raynaudova syndromu) mají být léčeni s opatrností.
Respirační _ poruchy:
Po podání očních beta-blokátorů byly hlášeny respirační a kardiální reakce včetně úmrtí u pacientů s astmatem v důsledku bronchiálního spasmu a vzácná onemocnění u pacientů se srdečním selháním.
U pacientů s mírnou nebo středně těžkou formou chronické obstrukční plicní nemoci (CHOPN) má být Batidor používán s opatrností a pouze v případě, že potenciální prospěšnost léčby převyšuje její možné riziko.
Hypoglykémie/Diabetes
Pacientům se spontánní hypoglykemií nebo pacientům s labilním diabetem mají být podávány oční beta-blokátory s opatrností, protože mohou maskovat příznaky a známky akutní hypoglykemie.
Jaterní _ poruchy
Užívání přípravku Batidor nebylo zkoumáno u pacientů s jaterní poruchou, a proto musí být u těchto pacientů užíván s opatrností.
Imunologie a přecitlivělost
Jako u všech lokálně podávaných očních léčivých přípravků může dojít rovněž v případě tohoto přípravku k systémovému vstřebávání. Molekula dorzolamidu obsahuje sulfonamidovou skupinu, kterou já rovněž součástí sulfonamidů. Proto může dojít při lokální aplikaci k rozvoji stejných nežádoucích účinků jako u systémové léčby sulfonamidy. Pokud se objeví známky závažných reakcí nebo přecitlivělosti, je nutné léčbu přípravkem přerušit.
Lokální nežádoucí oční reakce podobné reakcím zaznamenaným v souvislosti s užíváním očních kapek s obsahem dorzolamid hydrochloridu byly pozorovány během léčby očními kapkami s kombinací dorzolamidu a timololu. Pokud se objeví takové reakce, je nutné zvážit přerušení léčby přípravkem Batidor.
Anafylaktické reakce
Během užívání beta-blokátorů mohou být pacienti, kteří trpí atopií nebo kteří v minulosti prodělali závažnou anafylaktickou reakci na různé alergeny, citlivější na opakovanou náhodnou, diagnostickou nebo terapeutickou expozici takovýmto alergenům. Tito pacienti nemusí reagovat na obvyklou dávku adrenalinu užívanou v léčbě anafylaktických reakcí.
Další beta-blokátory
Vliv na nitrooční tlak nebo známé účinky na systémovou beta-blokádu mohou být zesíleny v případě, že se Batidor podá pacientům, kteří již užívají systémové beta-blokátory. Klinická odpověď u těchto pacientů má být důkladně sledována. Používání 2 topických beta-blokátorů současně se nedoporučuje. (viz bod 4.5).
Odchlípení chorioidey
Bylo hlášeno odchlípení chorioidey po filtračním zákroku při současném podání léků potlačujících tvorbu komorové tekutiny (např. timolol a acetazolamid).
Chirurgická anestezie
Oční beta-blokátory mohou blokovat systémový účinek beta agonistů (např. adrenalinu). Anesteziolog má být informován, že pacient používá Batidor.
Souběžná léčba
Nedoporučuje se souběžné užívání následujících léků:
> dorzolamid a perorální inhibitory karboanhydrázy
> lokální beta- blokátory .
Přerušení léčby
Jako u systémových beta-blokátorů je v případě nutnosti přerušení léčby očním přípravkem obsahujícím timolol maleinát u pacientů s ischemickou chorobou srdeční třeba vysazovat léčbu postupně.
Další účinky beta-blokátorů
Léčba beta-blokátory může zastřít některé příznaky hypoglykemie u pacientů s diabetes mellitus nebo hypoglykemií.
Léčba beta-blokátory může zastřít některé příznaky hypotyreoidismu. Náhlé přerušení léčby beta-blokátory může vést k exacerbaci příznaků.
Léčba beta-blokátory může zhoršit příznaky myastenie gravis.
Další účinky inhibice karboanhydrázy
Léčba perorálními inhibitory karboanhydrázy je provázena rozvojem urolitiázy v důsledku narušení acido-bazické rovnováhy především u pacientů s ledvinovými kameny v anamnéze. Ačkoliv v souvislosti s podáváním očních kapek s kombinací dorzolamidu a timololu nebyly zaznamenány žádné poruchy acido-bazické rovnováhy, bylo zaznamenáno několik případů rozvoje urolitiázy. Vzhledem ktomu, že přípravek Batidor obsahuje lokální inhibitor karboanhydrázy, který se systémově vstřebává, může být v souvislosti s léčbou přípravkem Batidor u pacientů s ledvinovými kameny v anamnéze zvýšené riziko rozvoje urolitiázy.
Jiné
Léčba pacientů s akutním glaukomem s uzavřeným úhlem vyžaduje současnou léčbu více preparáty plus přípravky na snížení očního tlaku. Podání očních kapek s kombinací dorzolamidu a timololu nebylo zkoumáno u pacientů s akutním glaukomem s uzavřeným úhlem.
V souvislosti s užíváním dorzolamidu bylo u pacientů s chronickým postižením rohovky a/nebo nitroočním chirurgickým zákrokem v anamnéze zaznamenán výskyt rohovkového edému a ireverzibilního zhoršení poškození rohovky. Lokální léčba dorzolamidem má být u těchto pacientů užívána s opatrností.
Oční beta-blokátory mohou vyvolat suchost očí. Pacienti s korneálním onemocněním mají být léčeni s opatrností.
Jako při používání jiných protiglaumatózních léčivých přípravků byla i v případě dlouhodobé léčby očními kapkami s obsahem timolol maleinátu u některých pacientů hlášena snížená reakce na léčbu. V rámci klinických studií bylo sledováno 164 pacientů po dobu alespoň 3 let a po počáteční stabilizaci nebyly hlášeny žádné významně změny středního nitroočního tlaku.
Používání kontaktních čoček
Přípravek Batidor obsahuje jako konzervační látku benzalkonium-chlorid, který může způsobit podráždění oka. Kontaktní čočky je třeba před aplikací kapek přípravku Batidor vyjmout a znovu se mohou nasadit až po alespoň 15 minutách po použití přípravku. O benzalkonium-chloridu je známé, že zbarvuje měkké kontaktní čočky.
Účinky při dopingovém zneužití
Užívání přípravku Batidor může způsobit pozitivní dopingový test.
Pediatrická populace Viz. bod 5.1.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Žádné specifické studie interakcí očních kapek s kombinací dorzolamidu a timololu nebyly provedeny.
V rámci klinických studií byl přípravek ve formě očních kapek v kombinaci dorzolamidu a timololu podáván spolu s následujícími systémovými léčivými přípravky a nebyl zaznamenán výskyt žádných interakcí: ACE inhibitory, blokátory kalciových kanálů, diuretika, nesteroidní protizánětlivé léky včetně kyseliny acetylsalicylové a hormony (např. estrogen, inzulin, tyroxin).
Nicméně může dojít k aditivnímu účinku - a rozvoji hypotenze a/nebo výrazné bradykardie -jsou-li oční kapky s timolol maleinátem podávány spolu s perorálními blokátory kalciových kanálů, léky snižujícími koncentraci katecholaminů nebo léky působícími na beta-receptory, antiarytmika (včetně amiodaron), digitalisové glykosidy, parasympatomimetika, guanethidin, narkotika a inhibitory monoamin-oxidázy (MAO).
Zesílení systémové beta-blokády (např. snížení srdeční frekvence, deprese) byly hlášeny v průběhu užívání kombinace inhibitorů CYP2D6 (např. chinidin, fluoxetin, paroxetin) a timololu.
Dorzolamidová složka přípravku Batidor je inhibitor karboanhydrázy, který se i přes lokální podání systémově vstřebává. V klinických studiích nebyly během léčby očními kapkami dorzolamid-hydrochloridu zaznamenány žádné poruchy acido-bazické rovnováhy. Tyto poruchy byly pozorovány v souvislosti s perorálním podáváním inhibitorů karboanhydrázy, což vedlo v některých případech k rozvoji interakcí (např. toxické účinky během léčby vysokými dávkami salicyláty). U pacientů léčených přípravkem Batidor je nutno vzít tyto skutečnosti v potaz.
Příležitostně byly hlášeny případy mydriázy, když byly oční betablokátory používány spolu s adrenalinem (epinefrinem).
Po přerušení léčby klonidinem mohou perorální beta-blokátory zhoršit stupeň hypertenze; může se jednat o důsledek syndromu z vysazení.
4.6 Fertilita, těhotenství a kojení
Nejsou k dispozici dostatečné údaje o podávání přípravku Batidor těhotným ženám. Batidor nemá být podáván v těhotenství, pokud to není nezbytně nutné.
Opatření ke snížení systémové absorpce, viz bod 4.2.
Epidemiologické studie s perorálně podávanými beta-blokátory neprokázaly malformativní účinky, ale bylo pozorováno riziko zpomalení intrauterinního růstu v případě perorálního podání beta-blokátorů. Navíc byly symptomy systémové blokády (tj. bradykardie, hypotenze, respirační tíseň, hypoglykemie) pozorovány u novorozenců, když byly beta-blokátory podávány matce až do doby porodu. Pokud je Batidor podáván matce až do doby porodu, novorozenci mají být první den po narození pečlivě monitorováni. K dispozici nejsou žádná odpovídající klinická data týkající se těhotných žen exponovaných dorzolamidu. U králíků mělo podávání dorzolamidu v dávkách toxických pro matku teratogenní účinky (viz. bod 5.3).
Kojení
Beta-blokátory se vylučují do mateřského mléka. Avšak, při terapeutických dávkách přípravku Batidor v očních kapkách je nepravděpodobné, že by bylo v mateřském mléce přítomno takové množství účinné látky, aby vyvolalo klinické projevy systémové beta blokády u kojence. Opatření ke snížení systémové absorpce, viz bod 4.2
Není známo, zdali se dorzolamid vylučuje do mateřského mléka. U mateřským mlékem živených mláďat potkanů, kterým byl podáván dorzolamid, byl zaznamenán snížený přírůstek tělesné hmotnosti.
Je-li nezbytná léčba přípravkem Batidor, kojení se během léčby nedoporučuje.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Batidor má středně intenzivní vliv na schopnost řídit a obsluhovat stroje. Možné nežádoucí účinky, jako neostré vidění, mohou u některých jedinců zhoršit schopnost řídit a/nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Stejně jako ostatní lokálně aplikované látky používané v oftalmologii, i Batidor je absorbován do systémového oběhu. Proto může působit podobné nežádoucí účinky, jako byly zaznamenány u systémových beta-blokátorů. Incidence systémových nežádoucích účinků v souvislosti s lokálním očním podáním je nižší než u systémového podání. Mezi očekávané nežádoucí účinky patří nežádoucí účinky pozorované u celé třídy očních beta-blokátorů.
Další nežádoucí účinky byly pozorovány u očních beta-blokátorů a mohou se vyskytnout po podání přípravku Batidor.
V klinických studiích nebyly zaznamenány žádné specifické nežádoucí účinky očních kapek s kombinací dorzolamidu a timololu; nežádoucí účinky byly omezeny na ty, které byly v souvislosti s podáváním dorzolamid hydrochloridu a/nebo timolol maleinátu hlášeny již v minulosti. Časté nežádoucí účinky byly mírné a nevedly k přerušení účasti ve studii.
Přípravkem ve formě očních kapek s obsahem dorzolamidu a timololu bylo v průběhu klinických studií léčeno 1035 pacientů. Přibližně 2,4 % všech pacientů přerušilo léčbu vzhledem k výskytu lokálních očních nežádoucích účinků, přibližně 1,2 % všech pacientů přerušilo léčbu vzhledem k lokálním nežádoucím účinkům charakteru alergie nebo přecitlivělosti (jako je zánět víčka nebo spojivek).
Následující nežádoucí účinky byly hlášeny v souvislosti s užíváním očních kapek s obsahem kombinace dorzolamidu a timololu nebo jedné z jeho složek, a to buď v průběhu klinických studií, nebo po uvedení přípravku na trh:
Nežádoucí účinky jsou rozděleny do následujících kategorií podle frekvence výskytu:
Velmi časté (> 1/10)
Časté (> 1/100 až < 1/10)
Méně časté (> 1/1 000 až < 1/100)
Vzácné (> 1/10 000 až < 1/1 000)
Poruchy imunitního systému:
Oční roztok timolol-maleinátu:
Systémové alergické reakce včetně angioedému, urtikarie, lokalizovaného nebo generalizovaného exantému, pruritu, anafylaktické reakce.
Poruchy pohybového systému a pojivové tkáně
Oční roztok timolol-maleinátu:
Vzácné: systémový lupus erythematosus, myalgie.
Poruchy nervového systému:
Oční roztok dorzolamid-hydrochloridu Časté: bolest hlavy Vzácné: závratě, parestézie
Oční roztok timolol-maleinátu:
Časté: bolest hlavy Méně časté: závratě, deprese
Vzácné: nespavost, noční můry, ztráta paměti, parestézie, nárůst intenzity objektivních a subjektivních příznaků myastenie gravis, cerebrovaskulární příhoda
Poruchy oka:
Batidor
Velmi časté: pálení a štípání
Časté: nastříknuté spojivky, neostré vidění, eroze rohovky, svědění oka, slzení
Oční roztok dorzolamid-hydrochloridu
Časté: zánět očního víčka, podráždění očního víčka
Méně časté: iridocyklitida
Vzácné: podráždění, např. zčervenání, bolest, tvorba strupů na očním víčku, přechodná myopie (která odezní po přerušení léčby), edém rohovky, nitrooční hypotenze a odchlípení cévnatky (po filtrační operaci)
Oční roztok timolol-maleinátu:
Časté: subjektivní a objektivní příznaky podráždění oka (např. pálení, píchání, svědění, slzení, zarudnutí), včetně blefaritidy, keratitidy, snížené citlivosti rohovky a suchosti očí Méně časté: poruchy zraku včetně refrakčních změn (v některých případech v důsledku přerušení myotické léčby)
Vzácné: ptóza, diplopie, odchlípení cévnatky (po filtrační operaci, viz bod 4.4)
Poruchy ucha a poruchy labyrintu:
Oční roztok timolol-maleinátu:
Vzácné: tinitus
Srdeční a vaskulární poruchy:
Oční roztok timolol-maleinátu:
Méně časté: bradykardie, synkopa
Vzácné: hypotenze, bolest na hrudi, palpitace, otoky, arytmie, kongestivní srdeční selhání, atrioventrikulární blok, srdeční selhání, srdeční zástava, cerebrální ischemie, klaudikace, Raynaudův fenomén, pocit studených rukou a nohou
Respirační, hrudní a mediastinální poruchy:
Oční kapky s kombinací dorzolamidu a timololu Časté: sinusitida
Vzácné: dušnost, respirační selhání, rinitida
Oční roztok dorzolamid-hvdrochloridu Vzácné: epistaxe
Oční roztok timolol-maleinátu:
Méně časté: dušnost
Vzácné: bronchospasmus (především u pacientů s bronchospastickým onemocněním v anamnéze), kašel
Gastrointestinální poruchy:
Oční kapky s kombinací dorzolamidu a timololu Velmi časté: poruchy vnímání chuti
Oční roztok dorzolamid-hydrochloridu Časté: nauzea
Vzácné: podráždění hrdla, sucho v ústech
Oční roztok timolol-maleinátu:
Vzácné: průjem, sucho v ústech, bolest břicha, zvracení
Poruchy kůže a podkožní tkáně:
Oční kapky s kombinací dorzolamidu a timololu Vzácné: kontaktní dermatitida
Oční roztok dorzolamid-hydrochloridu Vzácné: exantém
Oční roztok timolol-maleinátu:
Vzácné: alopecie, psoriáziformní exantém nebo exacerbace psoriázy, kožní vyrážka
Renální a močové poruchy:
Batidor
Méně časté: urolitiáza
Poruchy reprodukčního systému a mléčné žlázy:
Oční roztok timolol-maleinátu:
Vzácné: Peyronieova choroba, sexuální dysfunkce, snížené libido.
Celkové poruchy a reakce v místě aplikace:
Oční kapky s kombinací dorzolamidu a timololu
Vzácné: subjektivní a objektivní příznaky systémových alergických reakcí včetně angioedému, kopřivky, pruritu, exantému, anafylaxe, bronchospasmu
Oční roztok dorzolamid-hydrochloridu Časté: astenie/únava
Oční roztok timolol-maleinátu:
Méně časté: astenie/únava
Poruchy metabolismu a výživy:
Oční roztok timolol-maleinátu:
Hypoglykémie
4.9 Předávkování
Nejsou k dispozici údaje o předávkování lidí po úmyslném či neúmyslném požití Batidoru. Příznaky
Byly hlášeny případy neúmyslného předávkování očními kapkami s timolol-maleinátem, které vedlo k systémovým účinkům podobným účinkům systémových blokátorů beta-receptorů, jako jsou závratě, bolest hlavy, dušnost, bradykardie, bronchospasmus a srdeční zástava. Mezi
nejčastější objektivní a subjektivní příznaky, které lze očekávat při předávkování dorzolamid-hydrochloridem jsou elektrolytové poruchy, rozvoj acidózy a možné účinky na CNS.
Jsou k dispozici pouze omezené informace týkající se předávkování po neúmyslném nebo záměrném požití dorzolamid-hydrochloridu u lidí. Po požití přípravku byl hlášen výskyt somnolence; po lokálním podání byla hlášena nauzea, závratě, bolest hlavy, únava, abnormální sny a dysfagie.
Léčba
Léčba má být symptomatická a podpůrná. Je nutné sledovat sérové hladiny elektrolytů (především draslík) a pH krve. Studie prokázaly, že timolol nelze rychle odstranit dialýzou.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: oftalmologikum, antiglaukomatikum a miotikum, betablokátor, timolol, kombinace,
ATC kód S01ED51
Mechanismus účinku
Batidor obsahuje dvě složky: dorzolamid-hydrochlorid a timolol-maleinát. Každá z těchto dvou složek zmírňuje zvýšený nitrooční tlak prostřednictvím snížení tvorby komorové vody a tohoto účinku dosahují různými mechanismy účinku.
Dorzolamid-hydrochlorid je silným inhibitorem lidské karboanhydrázy II. Inhibicí karboanhydrázy ve výběžcích ciliárního tělíska v oku snižuje tvorbu komorové vody, pravděpodobně prostřednictvím zpomalení tvorby bikarbonátových iontů a následným snížením transportu sodíku a tekutiny.
Timolol-maleinát je neselektivní blokátor beta-adrenergních receptorů. Přesný mechanismus účinku timolol-maleinátu na snížení nitroočního tlaku není v současné době přesně znám, ale studie s fluoresceinem a tonografické studie ukazují, že hlavní mechanismus účinku může mít souvislost se snížením tvorby komorové vody. V některých studiích bylo rovněž zaznamenáno mírné zvýšení odtoku komorové vody. Kombinovaný účinek těchto dvou přípravků vede ve srovnání s užíváním samotných přípravků k dalšímu snížení nitroočního tlaku.
Po lokálním podání snižuje přípravek Batidor nitrooční tlak, který může být spojen s glaukomem. Zvýšený nitrooční tlak je hlavním rizikovým faktorem v patogenezi rozvoje poškození optického nervu a glaukomatózní ztrátě zorného pole. Přípravek Batidor snižuje nitrooční tlak bez obvyklých nežádoucích účinků miotik, jako je šeroslepost, spasmus akomodace a zúžení zornic.
Farmakodynamické účinky
Klinický účinek:
Klinické studie trvající déle než 15 měsíců byly provedeny za účelem porovnat účinek kombinace dorzolamid/timolol ve formě očních kapek, roztoku užívaného dvakrát denně (ráno a večer) na snížení nitroočního tlaku se samostatně a v kombinaci 0,5% timolol a 2,0% dorzolamid u pacientů s glaukomem nebo nitrooční hypertenzí, pro které byla kombinovaná léčba vhodná. Ty zahrnovaly jak neléčené pacienty, tak pacienty, jejichž onemocnění nebylo adekvátně kontrolováno přípravkem s obsahem timololu v monoterapii. Většina pacientů byla před zahájením studie léčena topickým beta-blokátorem v monoterapii. V analýze kombinovaných studií byl účinek očních kapek s kombinací dorzolamidu a timololu, užívaný dvakrát denně na snížení nitroočního tlaku, výraznější než účinek přípravků 2% dorzolamid užívaný třikrát denně nebo 0,5% timolol dvakrát denně v monoterapii. Účinek očních kapek s kombinací dorzolamidu a timololu užívaný dvakrát denně na snížení nitroočního tlaku odpovídal účinku kombinované léčby dorzolamidem dvakrát denně a timolol dvakrát denně.
9/12
Účinek očních kapek s obsahem dorzolamidu a timololu, užívaných dvakrát denně na snížení nitroočního tlaku byl prokázán při měření v různém čase během dne a tento účinek přetrvával během dlouhodobého podávání.
Pediatrická populace
Byla provedena tříměsíční kontrolovaná studie s primárním cílem prokázat bezpečnost 2% dorzolamid hydrochloridu, očního roztoku u dětí mladších 6 let. V této studii 30 pacientů mladších 6 let a starších 2 let, u kterých nebyl nitrooční tlak adekvátně kontrolován dorzolamidem nebo timololem v monoterapii ve formě očních kapek s kombinací dorzolamidu a timololu, podávaného rámci otevřené fáze studie. Účinnost u těchto pacientů nebyla stanovena. V této malé skupině pacientů byla aplikace očních kapek s kombinací dorzolamidu a timololu dvakrát denně obecně dobře snášena. Devatenáct pacientů dokončilo léčebnou fázi a 11 pacientů přerušilo léčbu vzhledem k operačnímu zákroku, změně medikamentózní léčby nebo z jiného důvodu.
5.2 Farmakokinetické vlastnosti
Dorzolamid-hydrochlorid
Na rozdíl od perorálně podaných inhibitorů karboanhydrázy umožňuje lokální podání dorzolamid hydrochloridu uplatnění svých účinků přímo na oko, a to ve výrazně nižších dávkách a menší systémové expozici. V klinických studiích vedl tento účinek ke snížení nitroočního tlaku bez narušení acido-bazické rovnováhy nebo rozvoje elektrolytových poruch charakteristických pro perorálně podané inhibitory karboanhydrázy.
Po lokálním podání proniká dorzolamid do systémové cirkulace. Pro hodnocení možné systémové inhibice karboanhydrázy po lokálním podání byly měřeny koncentrace léku a jeho metabolitu v červených krvinkách a plasmě a rovněž byla stanovena míra inhibice karboanhydrázy v červených krvinkách. V průběhu udržovací terapie se dorzolamid akumuluje v červených krvinkách v důsledku selektivní vazby na karboanhydrázu II (CA-II), zatímco v plasmě zůstávají extrémně nízké koncentrace volné léčivé látky.
Ačkoliv se z původní lékové formy vytváří jediný metabolit N-desetyl, který ve srovnání s původní lékovou formou inhibuje karboanhydrázu II (CA-II) v menší míře, rovněž inhibuje další méně aktivní izoenzym (CA-I). Tento metabolit se rovněž akumuluje v červených krvinkách, kde se váže především na CA-I. Dorzolamid vykazuje mírnou vazebnost na plasmatické bílkoviny (přibližně 33%) a vylučuje se v nezměněné formě především v moči; metabolit se rovněž vylučuje močí. Jakmile je ukončeno podávání, je dorzolamid z červených krvinek vymýván nelineárně, což nejprve vede k výraznému poklesu koncentrace, po které následuje pomalejší eliminační fáze s poločasem přibližně čtyři měsíce.
Po perorálním podání dorzolamidu pro simulaci maximální systémové expozice po dlouhodobém užívání topické oční formy byl rovnovážný stav dosažen během 13 týdnů. V rovnovážném stavu nebyla v plasmě detekována ani volná forma léku, ani jeho metabolity; nižší inhibice karboanhydrázy v červených krvinkách byla považována za nezbytnou pro dosažení farmakologického účinku na renální funkce a respiraci. Podobné farmakokinetické účinky byly pozorovány po podání topické udržovací léčby dorzolamid hydrochloridem. U některých pacientů pokročilého věku s renální dysfunkcí (clearance kreatininu přibližně 3060 ml/minutu) byly prokázány vyšší koncentrace metabolitu v červených krvinkách; výsledky neprokázaly žádný rozdíl s ohledem na inhibici karboanhydrázy a žádné klinicky významné systémové závažné účinky.
Timolol- maleinát
Koncentrace v komorové vodě: U králíků dosahovala maximální koncentrace v komorové vodě 461ng/100mg; naměřeno 60 minut po podání 1 kapky 1,0% timololu. U lidí dosahovala koncentrace timololu v komorové vodě během 1. a 2. hodiny po podání 2 kapek 0,5% timololu 150 ng/100 mg. Po 7 hodinách účinek pominul a koncentrace klesla na 10 ng/100 mg.
Koncentrace v tkáni oka:
Po aplikaci jedné kapky 0,25% roztoku 14C-značeného timololu dosáhla různá tkáň oka u králíka maximální radioaktivity po 15 až 60 minutách. Rohovka, membrána nictitans a duhovka/řasnaté tělísko vykazovaly radioaktivitu odpovídající 1 až 10 ng timololu/100 mg tkáně.
Systémová resorpce:
Studie prokázaly, že po lokálním podání timololu do oka dochází k systémovému vstřebávání.
V jedné studii byla přítomnost timololu zjištěna v moči všech vyšetřených zdravých subjektů a pacientů. (Timolol -maleinát a jeho metabolity jsou vylučovány primárně ledvinami.)
Koncentrace v krvi:
Koncentrace timololu v krvi u lidí po lokální aplikaci do oka v doporučených klinických dávkách často nelze stanovit (nižší než 2 ng/ml), ani po podání jedné dávky ani po léčbě po dobu dvou týdnů. Maximální naměřené plasmatické koncentrace byly 9,6 ng/ml pro dávku 2 x 2 kapky/den. Maximálních plasmatických koncentrací bylo dosaženo po 30-90 minutách.
V několika případech bylo prokázáno, že aplikace očních kapek s obsahem timololu v doporučených dávkách u novorozenců a batolat vedla ve srovnání s dospělými k výraznějšímu nárůstu plasmatické koncentrace. Plasmatické koncentrace u třítýdenního novorozence po podání 1 kapky očních kapek s obsahem 0,25 % timololu 2x denně dosáhly 34 ng/ml.
5.3 Předklinické údaje vztahující se k bezpečnosti
Profil bezpečnosti pro oči a systémové bezpečnosti jednotlivých léčivých látek je dobře znám.
Účinky léčby byly v rámci neklinických studií zkoumány pouze při expozicích považovaných za dostatečně převyšující maximální expozici indikující nízkou relevanci pro klinické použití.
Dorzolamid
Při podávání přípravku v toxických dávkách spojených s rozvojem metabolické acidózy u králíků byl pozorován výskyt malformací obratlových těl.
Timolol
Předklinické účinky byly zaznamenány po expozici timololu v množství, které dostatečnou měrou převyšovalo maximální terapeutické dávky pro lidi. Relevantnost těchto pozorování pro lidi se považuje za minimální.
Ve studiích na zvířatech nebyl prokázán teratogenní vliv léčby.
U zvířat léčených lokálním očním roztokem dorzolamid-hydrochloridu a timolol-maleinátu (podávaných zvlášť nebo v kombinaci) nebyl zaznamenán výskyt žádných nežádoucích účinků postihujících oči. In vitro a in vivo studie obou složek neodhalily mutagenní potenciál léčby. S ohledem na aplikaci přípravku Batidor v terapeutických dávkách se nepředpokládá žádné významné riziko pro lidi.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Benzalkonium-chlorid
Hyetelosa
Mannitol
Dihydrát natrium-citrátu
Roztok hydroxidu sodného 1 mol/l (pro úpravu pH) Voda na injekci
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
Doba použitelnosti: 2 roky
Doba použitelnosti po prvním otevření: 28 dnů
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25°C.
Uchovávejte lahvičku v krabičce, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a velikost balení
LDPE lahvička s LDPE kapátkem a polypropylenovým uzávěrem obsahující 5 ml roztoku, krabička.
Přípravek Batidor je k dispozici v následujících velikostech balení:
1 lahvička po 5 ml 3 lahvičky po 5 ml 6 lahviček po 5 ml
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Dr. Gerhard Mann Chem.-pharm. Fabrik GmbH Brunsbutteler Damm 165 - 173 13581 Berlín Německo
8. REGISTRAČNÍ ČÍSLO
64/351/11-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
20.7.2011
10. DATUM REVIZE TEXTU
30.3.2012
12/12