Asthalin Inhaler 100 Mikrogramů
sp.zn. sukls117957/2016
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
ASTHALIN INHALER 100 mikrogramů Suspenze k inhalaci v tlakovém obalu
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna odměřená dávka přípravku obsahuje 120,5 mikrogramů salbutamoli sulphas, to odpovídá 100 mikrogramům salbutamolum.
Úplný seznam pomocných látek viz 6.1
3. LÉKOVÁ FORMA
Suspenze k inhalaci v tlakovém obalu.
Bílá nebo téměř bílá suspenze.
4. KLINICKÉ ÚDAJE
4.1. Terapeutické indikace
ASTHALIN INHALER je určen k léčbě bronchospazmů při průduškovém astmatu, chronické bronchitidě a rozedmě.
Prevence astmatu vyvolaného námahou.
Přípravek je určen pro dospělé, mladistvé a děti od 4 let.
4.2. Dávkování a způsob podání Dávkování
Pediatrická populace:
Léčba akutního bronchospasmu
Děti: 100 mikrogramů, je-li třeba zvýšení dávky, může se aplikovat až 200 mikrogramů.
Prevence bronchospasmů provokovaných alergenem nebo námahou
Děti: 100 mikrogramů před očekávanou námahou, dávku lze zvýšit až na 200 mikrogramů.
Chronická terapie
Děti: až 200 mikrogramů čtyřikrát denně.
Dospělí:
Léčba akutního bronchospasmu Dospělí: 100 nebo 200 mikrogramů.
Prevence bronchospasmů provokovaných alergenem nebo námahou
Dospělí: 200 mikrogramů 10 - 15 minut před očekávanou námahou.
Chronická terapie
Dospělí: až 200 mikrogramů čtyřikrát denně.
Způsob podání
ASTHALIN INHALER je určen pouze pro inhalační vdechování ústy. Může být použit se zdravotním prostředkem Aerochamber Plus u pacientů, kteří obtížně synchronizují vdech s aplikací aerosolu (děti a starší pacienti).
Stoupající potřeba používání beta2-agonistů může být známkou zhoršování astmatu. Za těchto okolností je třeba přehodnotit léčebný plán pacienta a má se zvážit současná glukokortikosteroidní terapie.
Protože nadměrné dávkování může být spojováno s výskytem nežádoucích účinků, má se síla jednotlivých dávek nebo četnost jejich aplikace zvyšovat pouze na doporučení ošetřujícího lékaře.
U většiny pacientů trvá léčebný účinek 4 až 6 hodin.
Přípravek se nemá podávat častěji než čtyřikrát denně. Mezi jednotlivými dávkami musí být časový odstup šesti hodin. Potřebuje-li pacient častější aplikaci než čtyřikrát denně nebo potřebuje-li zvýšení jednotlivých dávek, svědčí to o zhoršování astmatu (viz bod 4.4).
4.3. Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 Ačkoliv salbutamol aplikovaný nitrožilně a někdy i perorálně se používá v terapii předčasného porodu nekomplikovaného stavy jako jsou placenta praevia, prepartální hemoragie nebo těhotenská toxémie, inhalační přípravky obsahující salbutamol nejsou k terapii předčasného porodu vhodné. Přípravky obsahující salbutamol se nemají používat k terapii hrozícího potratu.
4.4. Zvláštní upozornění a opatření pro použití
Léčba astmatu má být vedena podle stupňového programu a odezvu pacienta je třeba sledovat klinicky i prostřednictvím funkčního vyšetření plic.
Zvyšující se potřeba krátkodobě působících inhalačních beta2-agonistů k zvládnutí příznaků znamená zhoršování kontroly astmatu. Za těchto okolností má být přehodnocen léčebný plán pacienta.
Náhlé a progresivní zhoršování kontroly astmatu potenciálně ohrožuje život a je třeba zvážit zahájení kortikosteroidní terapie nebo její zintenzivnění. U pacientů považovaných za rizikové lze zahájit každodenní monitorování maximální výdechové rychlosti (PEF).
Pacient má být upozorněn na to, aby v případě, že mu dosud účinná dávka inhalačního salbutamolu už neposkytuje úlevu trvající alespoň tři hodiny, má vyhledal lékaře, který učiní nezbytná opatření.
Aby se zajistila optimální léčiva dodávka do plic, je třeba přezkoušet, jak pacient ovládá techniku inhalace, a ujistit se, že je schopen synchronizovat nádech se spuštěním dávkovacího ventilu.
Salbutamol má být podáván zvlášť opatrně pacientům s tyreotoxikózou.
Důsledkem terapie beta2-agonistickým léčivem může být potenciálně závažná hypokalémie. Zvláštní opatrnost se doporučuje u pacientů s těžkým astmatem. Hypokalémie se může vyskytnout také u hypoxických pacientů a pacientů se souběžnou terapií xantinovými deriváty, kortikosteroidy, diuretiky a dlouhodobě užívanými laxativy. V těchto situacích se doporučuje opatrnost a monitorování hladin draslíku v krevním séru.
Kardiovaskulární účinky mohou být zaznamenány u všech sympatomimetik, včetně salbutamolu. Některá postmarketingová data a publikované literární údaje ukazují na řídce se vyskytující ischemii myokardu související s podáváním salbutamolu. Pacienti se závažným základním onemocněním kardiovaskulárního systému (např. ischemickou chorobou srdeční, arytmií nebo závažným srdečním selháním), léčení salbutamolem, mají být upozorněni, aby vyhledali lékaře v případě, že pociťují bolest na hrudi nebo další příznaky zhoršujícího se kardiovaskulárního onemocnění. Pozornost by měla být věnována hodnocení symptomů, jako jsou dyspnoe a bolest na hrudi, neboť tyto mohou být respiračního či kardiálního původu.
Zvýšená opatrnost je nutná u pacientů s nedostatečně kontrolovaným diabetem
4.5. Interakce s jinými léčivými přípravky a jiné formy interakce
Salbutamol se obvykle nemá předepisovat společně s neselektivními beta-blokátory, jako je propranolol.
Pacienti léčení inhibitory monoaminooxidázy nebo tricyklickými antidepresivy musí být na počátku léčby salbutamolem pečlivě monitorování, protože může dojít k potenciaci účinku salbutamolu na vaskulární systém.
Při současném podávání xantinových derivátů, kortikosteroidů, diuretik, dlouhodobě užívaných laxativ a srdečních glykosidů (digoxin) je zvýšeno riziko vzniku závažné hypokalémie. V takovém případě je nutno sledovat hladiny draslíku v séru.
Jelikož ASTHALIN INHALER obsahuje etanol, teoreticky je možná interakce u pacientů užívajících disulfiram nebo metronidazol. Množství etanolu v přípravku je malé, ale přesto může urychlit reakci u některých citlivých pacientů.
Při současném užívání salbutamolu a srdečních glykosidů se zvyšuje riziko arytmií, a to i v důsledku hypokalémie navozené beta2-mimetiky.
Při podávání halogenovaných anestetik, např. halotanu, metoxyfluranu či enfluranu, u pacientů léčených salbutamolem je nutno počítat se zvýšeným rizikem závažné arytmie a hypotenze. Je-li plánovaná anestezie halogenovaným anestetikem, mělo by být zajištěno, aby salbutamol nebyl podán po dobu nejméně 6 hodin před zahájením anestezie.
4.6. Fertilita, těhotenství a kojení
Podávání tohoto léku během těhotenství se uvažuje pouze v případě, že přínos léčby pro matku převáží nad jakýmkoliv potenciálním nebezpečím pro plod. V celosvětové marketingové praxi byly u potomků pacientek léčených salbutamolem jen vzácně hlášeny případy různých vrozených anomálií, včetně rozštěpů patra a vývojových defektů končetin. Některé z těchto matek během těhotenství užívaly několik různých léčiv. Protože není možné rozpoznat jednotnou povahu defektů a běžný výskyt vrozených anomálií je 2-3 %, nelze jednoznačně zjistit přímý podíl salbutamolu na jejich výskytu.
Kojení
Salbutamol se pravděpodobně vylučuje do mateřského mléka, a proto se nedoporučuje jeho podávání kojícím matkám, pokud očekávaná prospěšnost nepřevažuje nad jakýmkoli možným rizikem. Není známo, zda salbutamol v mateřském mléce má nějaký škodlivý účinek na kojence.
4.7. Účinky na schopnost řídit a obsluhovat stroje
Nejsou známy
4.8. Nežádoucí účinky
Níže uvedené nežádoucí účinky vycházejí z hodnocení frekvencí výskytu podle následující definice: velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1000 až < 1/100); vzácné (> 1/10.000 až < 1/1000) a velmi vzácné (< 1/10.000), včetně jednotlivých hlášených případů. Velmi časté a časté nežádoucí účinky byly obecně stanovené na základě dat získaných z klinických studií. Vzácné a velmi vzácné nežádoucí účinky byly obecně stanovené na základě dobrovolných hlášení.
Poruchy imunitního systému
Velmi vzácné: Reakce přecitlivělosti, včetně angioedému, kopřivky, bronchospasmu, hypotenze a kolapsu
Poruchy metabolismu a výživy
Vzácné: Hypokalémie, laktátová acidóza
Potenciálně závažná hypokalémie může vzniknout jako výsledek léčby beta2 agonisty.
Poruchy nervového systému
Časté: Třes, bolest hlavy
Velmi vzácné: Hyperaktivita (zejména u dětí), závratě, neklid, poruchy spánku, halucinace
Srdeční poruchy
Časté: Tachykardie Méně časté: Palpitace
Velmi vzácné: Srdeční arytmie, včetně fibrilace síní, supraventrikulární tachykardie a extrasystol Neznámé: Ischémie myokardu (viz též bod 4.4.).
Cévní poruchy
Vzácné: Periferní vazodilatace
Respirační, hrudní a mediastinální poruchy
Velmi vzácné: Paradoxní bronchospasmus
Stejně jako při jiné inhalační léčbě může po podání dávky dojít k paradoxnímu bronchospazmu s náhlým vznikem hvízdavého dýchání. V takovém případě je nutné ihned podat alternativní přípravek nebo rychle působící bronchodilatační lék. Podávání salbutamolu je nutné okamžitě přerušit, pacient musí být řádně vyšetřen a v případě potřeby je nutné předepsat náhradní léčbu.
Gastrointestinální poruchy
Méně časté: Podráždění v oblasti úst a hrdla, sucho v ústech Velmi vzácně: nevolnost
Poruchy svalové a kosterní soustavy a pojivové tkáně
Méně časté: Svalové křeče
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www .sukl .cz/nahlasit-nezadouci-ucinek
4.9. Předávkování
Očekávané symptomy předávkování jsou stejné jako v případě nadměrné beta-adrenergní stimulace, tzn. třes, hypotenze, tachykardie (s hodnotami až do 200 tepů/min), arytmie, paliptace, bolest na hrudi, stimulace CNS, hypokalémie, hyperglykémie, poruchy spánku, neklid, únava, případně psychotické reakce. Fatální srdeční zástava je možná a souvisí s nesprávným použitím přípravku ASTHALIN INHALER.
Obvyklým antidotem při předávkování salbutamolem je kardioselektivní beta-blokátor, musí se však použít velmi opatrně především u pacientů s bronchospasmem v anamnéze.
Při hypokalemii může dojít k snadnějšímu vývoji příznaků předávkování. Je zapotřebí pravidelně sledovat hladinu draslíku.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1. Farmakodynamické vlastnosti
Farmakoterapeutická skupina - Antiastmatikum, bronchodilatans Klasifikace ATC - R03AC02
Aktivace beta2-adrenergních receptorů hladkého svalstva dýchacích cest vede k aktivaci adenylcyklázy a ke zvýšení intracelulární koncentrace cyklického 3',5'-adenozinmonofosfátu (cyklický AMP). Toto zvýšení cyklického AMP vede k aktivaci proteinové kinázy A inhibující fosforylaci myozinu a snižující intracelulární koncentrace kalciových iontů, což vede ke svalovému uvolnění. Salbutamol tak uvolňuje hladké svalstvo dýchacích cest od průdušnice až k terminálním průdušinkám. Působí jako funkční antagonista uvolňující dýchací cesty bez ohledu na zúčastněný spazmogen, čímž chrání před jakýmkoliv nebezpečím stažení průdušky. Zvýšené koncentrace cyklického AMP také souvisejí s inhibicí uvolnění mediátorů z žírných buněk v dýchacích cestách.
Bronchodilatační aktivita salbutamolu je velmi podobná izoprenalinové, ale vliv salbutamolu na kardiovaskulární systém - byť zanedbatelný - je ještě menší než u izoprenalinu. Salbutamol má delší dobu působení než izoprenalin. Po inhalaci salbutamolu nastupuje rychlý bronchodilatační účinek a při dávkách stejné bronchodilatační účinnosti má delší účinnost než izoprenalin s menší pravděpodobností nežádoucích kardiovaskulárních účinků.
Bronchiální účinek inhalovaného salbutamolu je detekován po pár minutách a normálně přetrvává 4-6 hodin.
5.2. Farmakokinetické vlastnosti
Absorpce
Po inhalačním podání salbutamolu se dostane přibližně 10 až 20 % dávky do dolních cest dýchacích. Zbytek látky je zadržen v horních částech dýchacích cest nebo v nosohltanu, odkud je spolknut. Část deponovaná v dýchacích cestách je absorbována epiteliální výstelkou plicní tkáně a dostává se do cirkulace, ale není metabolizována v plicích.
Po inhalaci doporučených dávek jsou systémové hladiny salbutamolu nízké. Studie provedená u 12 zdravých subjektů mužského i ženského pohlaví užívajících vyšší dávku (1.080 ^g báze salbutamolu) prokázala, že po použití salbutamolu dodaného pomocí hnacího plynu norfluran jsou průměrné maximální plazmatické koncentrace asi 3 ng/ml. Ve srovnání s inhalačním salbutamolem poháněným CFC (tmax = 0,17 hod) se průměrný čas pro dosažení maximálních koncentrací (tmax) po podání salbutamolu HFA (tmax = 0,42 hod) zbrzdil.
Distribuce
Přibližně 10 % salbutamolu se váže na plazmatické bílkoviny.
Metabolismus
Bohatý vaskulární systém plic dopravuje látku k metabolizaci do jater. Salbutamol se vylučuje primárně ledvinami, a to v metabolicky inaktivní formě a ve formě fenolsulfátového metabolitu. Část látky spolknuté v průběhu inhalace se vstřebá ze zažívacího traktu a prochází játry, kde podléhá metabolizaci při prvním průchodu játry za vzniku fenolsulfátového metabolitu. Jak metabolicky intaktní léčivo, tak konjugovaný metabolit se vylučují primárně močí.
Vylučování
Salbutamol a jeho metabolit jsou vylučovány primárně ledvinami. Vylučování stolicí je minimální. Většina inhalačně nebo perorálně podané dávky salbutamolu je vylučována během 72 hodin.
5.3. Předklinické údaje vztahující se k bezpečnosti
Karcinogenese, mutageneze, zhoršení plodnosti:
Ve dvouletém sledování u krys Sprague-Dawley vyvolával sulfát salbutamol v dávkách 2,0 mg/kg a větších (asi 14-násobek maximální doporučované denní inhalační dávky pro dospělé v mg/m2 a přibližně 6-násobek maximální doporučované denní inhalační dávky pro děti v mg/m2) zvýšený výskyt benigních leiomyomů mezovaria s tím, že tento zvýšený výskyt souvisel s velikostí dávky. V jiném sledování byl tento účinek blokován souběžným podáním propranololu, což je neselektivní beta-adrenergní antagonista. V 18-měsíčním sledování u myší CD-1 neprokázal sulfát salbutamol žádnou karcinogenitu v dávkách do 500 mg/kg (přibližně 1.700-násobek maximální doporučované denní inhalační dávky pro dospělé v mg/m2 a přibližně 800-násobek maximální doporučované denní inhalační dávky pro děti v mg/m2). V 22-měsíčním sledování u zlatých křečků neprokázal sulfát salbutamol žádnou karcinogenitu v dávkách do 50 mg/kg (přibližně 225-násobek maximální doporučované denní inhalační dávky pro dospělé v mg/m2 a přibližně 110-násobek maximální doporučované denní inhalační dávky pro děti v mg/m2).
Salbutamol sulfát nebyl mutagenní ani v Amesově testu ani v mutačním testu s kvasinkami. V testu s periferními lymfocyty člověka ani v mikro-jaderném testu u myší kmene AH1 nevykazoval salbutamol sulfát žádný klastogenní potenciál.
Reprodukční sledování u krys neprokázala zhoršení plodnosti po perorálních dávkách salbutamol sulfátu do 50 mg/kg (přibližně 340-násobek maximální doporučované denní inhalační dávky pro dospělé v mg/m2).
Teratogenní účinky
Těhotenská kategorie C. Salbutamol sulfát vykazoval teratogenní potenciál u myší. Sledování provedené u myší CD-1 prokázalo, že salbutamol sulfát podaný podkožně v dávce 0,25 mg/kg (méně než maximální doporučovaná denní inhalační dávka pro dospělé v mg/m2) vyvolal u 5 z 111 plodů (4,5 %) rozštěp patra a při dávce 2,5 mg/kg (přibližně 8-násobek maximální doporučované denní inhalační dávky pro dospělé v mg/m2) to bylo u 10 ze 108 plodů (9,3 %). Látka nevyvolala tento defekt při dávce 0,025 mg/kg (méně než maximální doporučovaná denní inhalační dávka pro dospělé v mg/m2). Rozštěp patra se také objevil u 22 ze 72 plodů (30,5 %) samic léčených podkožně 2,5 mg/kg izoproteronolu (pozitivní kontrola).
Reprodukční studie u králíků Stride Dutch prokázala rozštěp lebečního krytu u 7 z 19 plodů (37 %) při perorálním podání salbutamol sulfátu v dávce 50 mg/kg (přibližně 680-násobek maximální doporučované denní inhalační dávky pro dospělé v mg/m2).
V reprodukčním sledování inhalačního podání novozélandským bílým králíkům vykazoval salbutamol sulfát/HFA-134a zvětšení přední části fontanel plodů u inhalačních dávek 0,0193 mg/kg a větších (méně než maximální doporučovaná denní inhalační dávka pro dospělé v mg/m1).
Studie, v níž březím krysám dávkovali radiologicky značený salbutamol sulfát, prokázala, že se materiál související s účinnou látkou přenáší z oběhu matky na plod.
Neexistují žádné adekvátní a dobře kontrolované studie se salbutamolem HFA nebo salbutamol sulfátem u těhotných žen. Salbutamol HFA by se měl v průběhu těhotenství užívat pouze v případě, že potenciální prospěch takové léčby opodstatní potenciální riziko pro plod.
Během celosvětového sledování bezpečnosti přípravku po jeho zavedení na trh byly hlášeny nejrůznější vrozené vady včetně rozštěpu patra a postižení končetin u plodů pacientů, kteří salbutamol užívali. Některé z matek užívaly v průběhu těhotenství řadu přípravků. Není možné vystopovat žádný jednoznačný model defektů a souvislost mezi podáváním salbutamolu a výskytem vrozených anomálií potvrzena nebyla.
6. FARMACEUTICKÉ ÚDAJE
6.1. Seznam pomocných látek
Kyselina olejová Bezvodý ethanol Norfluran
6.2. Inkompatibility
Neuplatňuje se
6.3. Doba použitelnosti
2 roky
6.4. Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 30°C.
Chraňte před mrazem a přímým slunečním světlem
Nádobka je pod stálým tlakem. Neodhazujte do ohně, nepropichujte a neničte násilím, ani když se zdá být prázdná. Chraňte oči.
6.5. Druh obalu a obsah balení
Tlaková hliníková nádobka s dávkovacím ventilem vložená do plastového aplikátoru s náustkem a ochranným krytem, papírová krabička.
Velikost balení: 200 odměřených dávek
6.6. Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním.
1) Sejměte ochranný kryt z ústí aplikátoru. Přesvědčte se, že ústní aplikátor je čistý. Případný prach a nečistoty odstraňte.
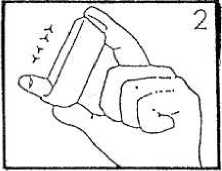
Je-li inhalátor nový nebo nebyl-li používán 3 nebo více dnů, je třeba ověřit jeho fungování jednou inhalační dávkou do vzduchu. Pokud byl přípravek přechováván při nízké teplotě, je nutné ho ohřát dvě minuty v dlaních a rovněž ověřit jeho fungování jednou inhalační dávkou do vzduchu.
3) Hluboce vydechněte, abyste vyprázdnili plíce. Ústní aplikátor vsuňte mezi rty a pevně je sevřete.
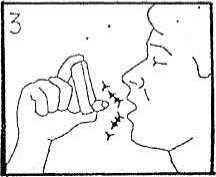
4) Pokud možno zhluboka a pozvolna se nadechněte
a současně stlačte ukazovákem dno nádobky, aby došlo k vystříknutí aerosolu a uvolnění léku. Pokračujte v nádechu.
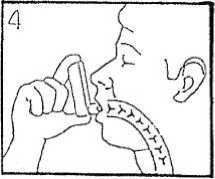
5) Vyjměte nádobku z úst a zadržte dech na 10 sekund nebo, jak nejdéle můžete. Pomalu vydechněte.
6) Pokud máte předepsanou víc než 1 dávku, počkejte nejméně 1 minutu a postup opakujte od kroku 2. Nasaďte ochranný kryt na aplikátor.
Nepřehlédněte krok 4. Je důležité, abyste začali s nádechem co nejpomaleji je to možné a těsně před použitím inhalátoru. Zkuste si to několikrát před zrcadlem. Jestliže nepoužíváte ASTHALIN INHALER správně, uniká značné množství přípravku, které je viditelné jako jemná mlha. Pokud se tedy vytvoří mlha v horní části inhalátoru nebo po stranách vašich úst musíte začít znovu od kroku 2.
Čistění inhalátoru
Čistěte inhalátor nejméně jednou týdně.
Sejměte ochranný kryt a vyjměte kovovou nádobku z plastového obalu. Plastový obal omyjte teplou vodou a důkladně vysušte. Zvláště důležité je dobře propláchnout malou dírku v ústním aplikátoru. Po vysušení vložte nádobku do plastového obalu a nasaďte ochranný kryt. Kovová nádobka nesmí přijít do kontaktu s vodou.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 2
CIPLA UK Ltd.,
The Old Post House,
Heath Road, Weybridge, Surrey KT13 8TS Velká Británie
8. REGISTRAČNÍ ČÍSLO
14/083/13-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
6. 2. 2013
10. DATUM REVIZE TEXTU
17.6.2016
9
Držte nádobku dnem vzhůru s palcem na spodní straně a ukazovákem na horním okraji. Nádobku krátce a důkladně protřepejte pohybem nahoru a dolů.
DRŽITEL ROZHODNUTÍ O REGISTRACI