Afreloxa 500 Mg/125 Mg
Sp. zn. sukls138643/2014
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Afreloxa 500 mg/125 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje amoxicillinum trihydricum odpovídající amoxicillinum 500 mg a kalii clavulanas odpovídající acidum clavulanicum 125 mg.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta.
Afreloxa 500 mg/125 mg jsou bílé, oválné, potahované tablety s vyraženým „A“ na jedné straně a s „64“ na druhé straně.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Afreloxa 500 mg/125 mg je indikován k léčbě následujících infekcí u dospělých a dětí (viz body 4.2, 4.4 a 5.1):
• Akutní bakteriální sinusitida (odpovídajícím způsobem diagnostikovaná)
• Akutní zánět středního ucha
• Akutní exacerbace chronické bronchitidy (odpovídajícím způsobem diagnostikovaná)
• Komunitní pneumonie
• Cystitida
• Pyelonefritida
• Infekce kůže a měkkých tkání, zejména celulitida, pokousání zvířaty, závažný dentální absces se šířící se celulitidou
• Infekce kostí a kloubů, zejména osteomyelitida
Je třeba vzít v úvahu oficiální směrnice pro vhodné používání antibiotik.
4.2 Dávkování a způsob podání Dávkování
Dávky jsou vyjádřeny poměrem obsahu amoxicilinu/kyseliny klavulanové, s výjimkou případů, kdy jsou dávky uváděny na základě obsahu individuální složky.
Při určování dávky amoxicilinu/kyseliny klavulanové k léčbě příslušné infekce individuálního pacienta je třeba vzít v úvahu:
• předpokládané patogeny a jejich pravděpodobnou citlivost k antibiotiku (viz bod 4.4)
• závažnost a místo infekce
• věk, tělesnou hmotnost a renální funkce pacienta tak, jak je uvedeno níže.
Podle potřeby je možno zvážit použití alternativních typů přípravku s amoxicilinem/kyselinou klavulanovou (např. přípravků s vyšším obsahem amoxicilinu a/nebo s rozdílným poměrem amoxicilinu a kyseliny klavulanové) (viz body 4.4 a 5.1).
Při doporučeném dávkování uvedeném níže poskytuje tato formulace amoxicilinu/kyseliny klavulanové při podávání dospělým a dětem s tělesnou hmotností > 40 kg celkovou denní dávku 1500 mg amoxicilinu a 375 mg kyseliny klavulanové, při doporučeném dávkování uvedeném níže. Při doporučeném dávkování uvedeném níže poskytuje tato formulace amoxicilinu/kyseliny klavulanové při podávání dětem s tělesnou hmotností < 40 kg maximální denní dávku 2400 mg amoxicilinu a 600 mg kyseliny klavulanové. Pokud je třeba podat vyšší denní dávku amoxicilinu, doporučuje se použít jiný přípravek s amoxicilinem/kyselinou klavulanovou a vyhnout se tak podání zbytečně vysokých denních dávek kyseliny klavulanové (viz body 4.4 a 5.1).
Délka léčby závisí na odpovědi pacienta. Některé infekce (např. osteomyelitida) vyžadují delší dobu léčby. Léčba nemá trvat déle než 14 dní bez dalšího přehodnocení (viz též bod 4.4 zmiňující „prodlouženou léčbu“).
Dospělí a děti > 40 kg
Jedna tableta přípravku Afreloxa 500 mg/125 mg třikrát denně.
Děti < 40 kg
Dávka 20 mg/5 mg/kg/den až 60 mg/15 mg/kg/den, rozdělena do třech dílčích dávek.
Děti mohou být léčeny tabletami přípravku Afreloxa 500 mg/125 mg nebo suspenzí amoxicilinu/kyselinou klavulanovou (prášek pro perorální suspenzi v lahvičkách nebo sáčcích). Děti ve věku 6 let a mladší mají být přednostně léčeny kombinací amoxicilin/kyselina klavulanová v suspenzi (prášek pro perorální suspenzi v lahvičkách nebo v sáčcích).
O používání amoxicilinu/kyseliny klavulanové v lékových formách s poměrem složek 4:1, který je podáván v dávkách vyšších než 40 mg/10 mg/kg/den, nejsou u dětí mladších 2 let dostupné žádné klinické údaje.
Starší pacienti
Není nutná žádná úprava dávkování.
Porucha funkce ledvin
Dávka se upravuje dle maximální doporučené hladiny amoxicilinu.
Úprava dávky není nutná u pacientů s clearance kreatininu (CrCl ) vyšší než 30 ml/min.
Dospělí a děti > 40 kg
|
CrCl: 10-30 ml/min |
500mg/125 mg dvakrát denně |
|
CrCl < 10 ml/min |
500mg/125 mg jednou denně |
|
Hemodialýza |
500 mg/125 mg každých 24 hodin, plus 500 mg/125 mg během dialýzy, opakovat na konci dialýzy (protože koncentrace amoxicilinu i kyseliny klavulanové v séru jsou snížené) |
Děti < 40 kg
|
CrCl: 10-30 ml/min |
15 mg/3,75 mg/kg dvakrát denně (maximálně 500 mg/125 mg dvakrát denně) |
|
CrCl < 10 ml/min |
15 mg/3,75 mg/kg v jedné denní dávce (maximálně 500 mg/125 mg) |
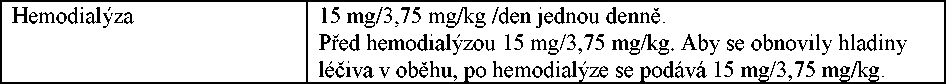
Porucha funkce jater
Přípravek je třeba podávat s opatrností a sledovat v pravidelných intervalech funkce jater (viz body
4.3 a 4.4).
Způsob podání
Přípravek Afreloxa 500 mg/125 mg je určen pro perorální podání.
Doporučuje se užívat amoxicilin/kyselinu klavulanovou na začátku jídla, aby se minimalizovala potenciální gastrointestinální nesnášenlivost a optimalizovala absorpce amoxicilinu/kyseliny klavulanové.
Léčba může být zahájena parenterálně podle SPC intravenózního přípravku obsahujícího amoxicilin/kyselinu klavulanovou a pokračovat s perorálními přípravky.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku, na peniciliny nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Závažná okamžitá hypersenzitivní reakce (např. anafylaxe) v anamnéze na další beta-laktamová antibiotika (např. cefalosporin, karbapenem nebo monobaktam).
Žloutenka/jaterní poškození v anamnéze vzniklé v souvislosti s užitím amoxicilinu/kyseliny klavulanové (viz bod 4.8).
4.4 Zvláštní upozornění a opatření pro použití
Před zahájením léčby amoxicilinem/kyselinou klavulanovou je nutné získat podrobnou anamnézu zejména s ohledem na předchozí hypersenzitivní reakce na penicilinová, cefalosporiny nebo další betalaktamová antibiotika (viz body 4.3 a 4.8).
U pacientů léčených peniciliny byly hlášeny závažné a v ojedinělých případech fatální hypersenzitivní reakce (anafylaktoidní). Uvedené reakce se vyskytují spíše u osob, které udávají hypersenzitivitu na penicilin nebo trpí atopickým ekzémem. Dojde-li k alergické reakci, musí se léčba amoxicilinem/kyselinou klavulanovou ihned přerušit a zahájí se vhodná alternativní léčba.
V případě, že je prokázáno, že je infekce způsobena organismy citlivými na amoxicilin, má být v souladu s oficiálními doporučeními zváženo převedení pacienta z léčby amoxicilinem/kyselinou klavulanovou na samotný amoxicilin.
Tento typ amoxicilinu/kyseliny klavulanové není vhodné podávat v případech, kdy existuje vysoké riziko, že předpokládané patogeny mají sníženou vnímavost nebo jsou rezistentní k beta-laktamovým antibiotikům, přičemž snížená citlivost či rezistence není zprostředkována beta-laktamázami vnímavými k inhibici kyselinou klavulanovou. Tento typ přípravku nemá být užíván k léčení infekce způsobené na penicilin rezistentního S. pneumoniae.
U pacientů s poruchou funkce ledvin nebo u pacientů užívajících vysoké dávky se mohou objevit křeče (viz 4.8).
Kombinace amoxicilin/klavulanová kyselina nemá být podávána pacientům s podezřením na infekční mononukleózu, neboť po léčbě amoxicilinem byla u těchto pacientů pozorována morbiliformní vyrážka.
Souběžné užívání alopurinolu při léčbě amoxicilinem může zvýšit pravděpodobnost výskytu alergické reakce.
Dlouhodobé podávání může vést k pomnožení necitlivých mikroorganismů.
Na začátku léčby se může objevit generalizovaný erytém s výskytem pustul doprovázený horečnatým stavem, což může být symptom akutní generalizované exantematózní pustulózy (AGEP) (viz bod 4.8). Pokud se objeví tato reakce, je třeba ukončit léčbu amoxicilinem/kyselinou klavulanovou a další podávání amoxicilinu je kontraindikováno.
U pacientů s poruchou funkce jater mají být přípravky s obsahem amoxicilinu/kyseliny klavulanové užívány s opatrností (viz body 4.2).
Jaterní příhody byly hlášeny zejména u mužů a starších pacientů a mohou být spojeny s prodlouženou léčbou. U dětí byly tyto příhody hlášeny velmi vzácně. V celé populaci pacientů se známky a příznaky obvykle objevují v průběhu léčby nebo krátce po skončení léčby, ale v některých případech se mohou objevit až za několik týdnů po skončení léčby. Obvykle bývají reverzibilní. Jaterní příznaky mohou být závažné a ve velmi vzácných případech byla hlášena i úmrtí. K tomu docházelo téměř vždy u pacientů se současným závažným onemocněním nebo při současném užívání léčiv se známými potenciálními nežádoucími účinky na jaterní funkce (viz bod 4.8).
Kolitida vznikající v souvislosti s léčbou antibiotiky byla hlášena téměř u všech antibiotik a může být lehká až život ohrožující (viz bod 4.8). Tuto diagnózu je tedy třeba mít na paměti u pacientů, u kterých se v průběhu léčby nebo po léčbě antibiotiky objeví průjem. Pokud se objeví kolitida vznikající v souvislosti s léčbou antibiotiky, léčba amoxicilinem/kyselinou klavulanovou musí být okamžitě přerušena, je nutno vyhledat lékaře a musí být zahájena vhodná léčba. Podávání léčiv snižujících peristaltiku je v této situaci kontraindikováno.
Během dlouhodobé léčby se doporučuje sledovat pravidelně funkci jednotlivých orgánů a systémů, včetně ledvin, jater a krvetvorby.
U pacientů léčených amoxicilinem/kyselinou klavulanovou bylo ojediněle zjištěno prodloužení protrombinového času. Jestliže pacienti současně užívají antikoagulancia, je třeba jej pečlivě sledovat. Úprava dávkování perorálních antikoagulancií může být nezbytná k udržení požadované úrovně antikoagulačního účinku (viz body 4.5 a 4.8).
U pacientů s renální insuficiencí je nutné upravit dávku podle stupně insuficience (viz bod 4.2).
U pacientů se sníženou diurézou byla velmi vzácně zaznamenána krystalurie, a to zejména při parenterální léčbě. Při podávání vysokých dávek amoxicilinu je vhodné udržovat dostatečný příjem a výdej tekutin, aby se předešlo možné amoxicilinové krystalurii. U pacientů se zavedeným močovým katétrem je třeba pravidelně kontrolovat jeho průchodnost (viz bod 4.9).
Při určování přítomnosti glukózy v moči v průběhu léčby amoxicilinem mají být používány enzymatické glukózo-oxidázové metody, protože při použití jiných než enzymatických metod může dojít k falešně pozitivním výsledkům.
Přítomnost kyseliny klavulanové v kombinaci amoxicilin/kyselina klavulanová může vést k nespecifické vazbě IgG a albuminu na membránu erytrocytů vedoucí k falešné pozitivitě Coombsova testu.
Byly hlášeny případy pozitivity testů za použití Bio-Red Laboratories Platelia Aspergillus EIA testů u pacientů užívajících amoxicilin/kyselinu klavulanovou, přičemž následně bylo zjištěno, že tito pacienti neměli infekci způsobenou Aspergillem. Byly hlášeny zkřížené reakce mezi non-Aspergillovými polysacharidy a polyfuranózami a Bio-Red Laboratories Platelia Aspergillus EIA testem. Z tohoto důvodu je třeba pozitivní výsledky těchto testů u pacientů užívajících amoxicilin/kyselinu klavulanovou posuzovat s opatrností a je třeba je potvrdit dalšími diagnostickými metodami.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Perorální antikoagulancia
Perorální antikoagulancia a penicilinová antibiotika jsou široce užívána v klinické praxi, aniž by byly hlášeny interakce. V odborné literatuře však nicméně byly popsány případy zvýšeného mezinárodního normalizovaného poměru (INR) u pacientů dlouhodobě užívajících acenokumarol nebo warfarin a zároveň užívajících amoxicillin. Pokud je současné užívání nezbytné, musí být při současném podávání nebo po ukončení léčby amoxicillinem pečlivě monitorován protrombinový čas nebo mezinárodní normalizovaný poměr (INR). Dále může být nezbytná úprava dávek perorálních antikoagulancií (viz bod 4.4 a 4.8).
Methotrexát
Peniciliny mohou snižovat vylučování metothrexátu, což může vest k potenciálnímu zvýšení jeho toxicity.
Probenecid
Současné podávání probenecidu se nedoporučuje. Probenecid snižuje renální tubulární sekreci amoxicilinu. Současné užití probenecidu může vést ke zvýšeným a přetrvávajícím krevním hladinám amoxicilinu, nikoliv kyseliny klavulanové.
Mofetil-mykofenolát
U pacientů, kteří jsou po transplantaci ledvin, užívajících mofetil-mykofenolát byl při současném podávání s perorálním amoxicilinem v kombinaci s kyselinou klavulanovou hlášen přibližně 50% pokles koncentrace aktivního metabolitu kyseliny mykofenolové (MPA) před další dávkou. Tento účinek má tendenci se snižovat po pokračujícím užívání amoxicilinu s kyselinou klavulanovou a ustanou během několika dnů po jejím ukončení. Změna hladiny před podáním další dávky nemusí přesně odrážet změny v celkové expozici MPA. Proto při nepřítomnosti klinických známek dysfunkce štěpu není obvykle změna dávkování mofetil-mykofenolátu nutná. Nicméně během kombinované terapie a krátce po ukončení léčby antibiotiky se musí provádět pečlivé klinické sledování.
4.6 Fertilita, těhotenství a kojení
Studie na zvířatech nenaznačují přímé ani nepřímé škodlivé účinky na průběh těhotenství, embryonální/fetální vývoj, porod nebo postnatální vývoj (viz bod 5.3). Omezené údaje týkající se použití amoxicilinu/kyseliny klavulanové v době těhotenství nenaznačují zvýšené riziko vrozených malformací. Studie u žen s předčasnou rupturou vaku blan plodu ukázala, že může být souvislost mezi profylaktickým podáváním amoxicilinu/kyseliny klavulanové a zvýšeným rizikem nekrotizující enterokolitidy novorozenců. Přípravek nemá být podáván v těhotenství, pokud to lékař nepovažuje za naprosto nezbytné.
Kojení
Obě léčivé látky jsou vylučovány do mateřského mléka (není známo, zda má kyselina klavulanová nějaké účinky na kojence). Důsledkem může být výskyt průjmu a mykotických infekcí sliznic u kojenců, což někdy může vest k nutnosti přerušení kojení.
Amoxicilin/kyselina klavulanová mohou být užívány v době kojení pouze po zvážení poměru rizika a prospěchu ošetřujícím lékařem.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje nebyly provedeny. Mohou se však objevit nežádoucí účinky (např. alergické reakce, závratě, křeče), které mohou ovlivnit schopnost řídit a obsluhovat stroje (viz bod 4.8).
4.8 Nežádoucí účinky
Nejčastěji hlášenými nežádoucími účinky jsou průjem, nauzea a zvracení.
Nežádoucí účinky amoxicilinu/kyseliny klavulanové zaznamenané v průběhu klinických studií a po uvedení přípravku na trh seřazené podle MedDRA systémově-orgánové klasifikace jsou uvedeny níže.
Pro určování četnosti nežádoucích účinků se používá následující terminologie: velmi časté (>1/10) časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10 000 až <1/1000), velmi vzácné (<1/10 000), není známo (na základě dostupných údajů nelze odhadnout).
|
Infekce a infestace | |
|
Kožní a slizniční kandidóza |
Časté |
|
Přerůstání necitlivých organismů |
Není známo |
|
Aseptická meningitida |
Není známo |
|
Poruchy krve a lymfatického systému | |
|
Reverzibilní leukopenie (včetně neutropenie) |
Vzácné |
|
T rombocytopenie |
Vzácné |
|
Reverzibilní agranulocytóza |
Není známo |
|
Hemolytická anémie |
Není známo |
|
Prodloužení doby krvácení a protrombinového času1 |
Není známo |
|
Poruchy imunitního systému10 | |
|
Angioneurotický edém |
Není známo |
|
Anafylaxe |
Není známo |
|
Syndrom podobný sérové nemoci |
Není známo |
|
Hypersenzitivní vaskulitida |
Není známo |
|
Poruchy nervového systému | |
|
Závratě |
Méně časté |
|
Méně časté | |
|
Reverzibilní hyperaktivita |
Není známo |
|
Křeče2 |
Není známo |
|
Srdeční poruchy | |
|
Kounisův syndrom |
Není známo |
|
Poruchy gastrointestinálního traktu | |
|
Velmi časté | |
|
Časté | |
|
Časté | |
|
Poruchy trávení |
Méně časté |
|
Kolitida spojená s antibiotiky4 |
Není známo |
|
Černé zbarvení jazyka, který se zdál být ochlupený |
Není známo |
|
Poruchy jater a žlučových cest | |
|
Zvýšení AST a/nebo ALT5 |
Méně částé |
|
Hepatitida6 |
Není známo |
|
Cholestatická žloutenka6 |
Není známo |
|
Cholangitida |
Není známo |
|
Poruchy kůže a podkožní tkáně7 | |
|
Kožní vyrážka |
Méně časté |
|
Méně časté | |
|
Kopřivka |
Méně časté |
|
Erytema multiforme |
Vzácné |
|
Stevens-Johnsonův syndrom |
Není známo |
|
Toxická epidermální nekrolýza |
Není známo |
|
Bulózní exfoliativní dermatitida |
Není známo |
|
Akutní generalizovaná exantematózní pustulóza (AGEP)9 |
Není známo |
|
Poruchy ledvin a močových cest | |
|
Intersticiální nefritida |
Není známo |
|
Krystalurie8 |
Není známo |
|
1Viz bod 4.4 2Viz bod 4.4 | |
|
3 Nauzea se objevuje častěji při vyšších perorálních dávkách. Pokud se objeví gastrointestinální reakce, je možno je zmírnit užíváním amoxicilinem/kyselinou klavulanovou těsně před jídlem 4 Včetně pseudomembranózní kolitidy a hemoragické kolitidy (viz bod 4.4) 5 U pacientů léčených beta-laktamovými antibiotiky bylo zaznamenáno mírné zvýšení AST a/nebo ALT, význam tohoto nálezu však není znám. 6 Tyto nežádoucí účinky byly zaznamenány u dalších penicilinů a cefalosporinů (viz bod 4.4). 7 Dojde-li k výskytu hypersenzitivní kožní reakce, musí se léčba přerušit (viz bod 4.4) 8 Viz bod 4.9 | |
|
9 Viz bod 4.4 10 Viz bod 4.3 a 4.4 | |
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www .sukl .cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Příznaky předávkování
Mohou se objevit gastrointestinální příznaky a poruchy vodní a elektrolytové rovnováhy. Velmi vzácně byla zaznamenána krystalurie amoxicilinu způsobující v některých případech až renální selhání (viz bod 4.4).
U pacientů s poruchou renálních funkcí nebo u pacientů užívajících vysoké dávky se mohou objevit křeče.
Byly hlášeny případy vzniku sraženin v močovém katetru, zejména po intravenózním podání vysokých dávek. U pacientů se zavedeným močovým katétrem je třeba pravidelně kontrolovat jeho průchodnost (viz bod 4.4).
Léčba intoxikace
Gastrointestinální příznaky se léčí symptomaticky s důrazem na vodní/elektrolytovou rovnováhu. Amoxicilin/kyselina klavulanová mohou být odstraněny z oběhu hemodialýzou.
FARMAKOLOGICKÉ VLASTNOSTI
5.
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Kombinace penicilinů, včetně inhibitorů beta-laktamáz; ATC kód: J01CR02.
Mechanismus účinku
Amoxicilin je polosyntetický penicilin (beta-laktamové antibiotikum) inhibující jeden nebo více enzymů (často označovaných jako proteiny vážící penicilin, PBPs) účastnících se biosyntetické tvorby bakteriálního peptidoglykanu, který je nedílnou strukturální součástí bakteriální buněčné stěny. Inhibice syntézy peptidoglykanu vede k oslabení buněčné stěny, obvykle následované buněčným rozpadem a bakteriální smrtí.
Amoxicilin je náchylný k degradaci pomocí beta-laktamáz produkovanými rezistentními bakteriemi a z tohoto důvodu spektrum aktivity samotného amoxicilinu neobsahuje organismy produkující tyto enzymy.
Kyselina klavulanová má beta-laktamovou strukturu podobnou penicilinům. Inaktivuje některé beta-laktamázy a tím zabraňuje inaktivaci amoxicilinu. Samotná kyselina klavulanová nevykazuje klinický využitelný antibakteriální účinek.
Vztah PK/PD
Čas nad minimální inhibiční koncentrací (T (čas)>MIC) je považován za nejdůležitější parametr účinnosti amoxicilinu.
Mechanismy rezistence
Dvěma hlavními mechanismy rezistence na amoxocilin/kyselinu klavulanovou jsou:
• inaktivace těmi bakteriálními beta-laktamázami, které nej sou samy inhibovány kyselinou klavulanovou včetně třídy B, C a D.
• alterace PBP, která snižuje afinitu antibakteriální látky k cílovému objektu.
Nepropustnost bakterií nebo mechanizmy aktivního vylučování (efluxní pumpa) mohou způsobit nebo přispět k rezistenci bakterií, hlavně v případě gramnegativních bakterií.
Hraniční koncentrace
Hraniční koncentrace MIC pro amoxicilin/kyselinu klavulanovou je určena Evropským výborem pro stanovení antimikrobiální účinnosti (EUCAST).
|
Organismus |
Hraniční hodnoty citlivosti (^g/ml) | ||
|
Citlivé |
Středně citlivé |
Rezistentní | |
|
Haemophilus influenzae1 |
<1 |
- |
>1 |
|
Moraxella catarrhalis1 |
<1 |
- |
>1 |
|
Staphylococcus aureus2 |
<2 |
- |
>2 |
|
Koaguláza-negativní stafylokoky2 |
<0,25 |
>0,25 | |
|
Enterococcus1 |
<4 |
8 |
>8 |
|
Streptococcus A, B, C, G5 |
<0,25 |
- |
>0,25 |
|
Streptococcus pneumoniae3 |
<0,5 |
1-2 |
>2 |
|
Enterobacteriaceae1,4 |
- |
- |
>8 |
|
Gramnegativní anaeroby1 |
<4 |
8 |
>8 |
|
Grampozitivní anaeroby1 |
<4 |
8 |
>8 |
|
Hraniční hodnoty vztahující se k “non-species”1 |
<2 |
4-8 |
>8 |
'Uváděné hladiny se týkají koncentrací amoxicilinu. Pro účely testování citlivosti se používají fixní hladiny kyseliny klavulanové 2 mg/l.
2 Uváděné hladiny jsou koncentrace oxacilinu.
3 Hraniční hodnoty uvedené v tabulce vycházejí z hraničních hodnot pro ampicilin.
4 Hraniční hodnota rezistentních kmenů R>8 mg/l zaručuje, že všechny izoláty s mechanismem rezistence jsou hlášeny jako rezistentní.
5 Hraniční hodnoty uvedené v tabulce vycházejí z hraničních hodnot pro benzylpenicilin._
Prevalence rezistence se může u jednotlivých druhů lišit místně i časově. Informace o lokální rezistenci je proto žádoucí, zejména při léčbě závažných infekcí. Podle potřeby může být nutné vyžádat si doporučení experta v případech, kdy místní prevalence rezistence je taková, že použití léčiva je při nejmenším u některých typů infekcí sporné.
Obvykle citlivé druhy_
Aerobní grampositivní mikroorganismy Enterococcus faecalis Gardnerella vaginalis
Staphylococcus aureus (citlivý na methicillin) £
Koaguláza negativní stafylokok (citlivý na methicillin) Streptococcus agalactiae Streptococcus pneumoniae1
Streptococcus pyogenes a další beta-hemolytické streptokoky Skupina Streptococcus viridans
Aerobní gramnegativní mikroorganismy Capnocytophaga spp.
Eikenella corrodens Haemophilus influenzae2 Moraxella catarrhalis Pasteurella multocida
Anaerobní mikroorganismy Bacteroides fragilis Fusobacterium nucleatum Prevotella spp.
Druhy, u kterých může být získaná rezistence problémem Aerobní grampositivní mikroorganismy Enterococcus faecium $
Aerobní gramnegativní mikroorganismy
Escherichia coli
Klebsiella oxytoca
Klebsiella pneumoniae
Proteus mirabilis
Proteus vulgaris
Přirozeně rezistentní organismy Aerobní gramnegativní mikroorganismy Acinetobacter sp.
Citrobacter freundii Enterobacter sp.
Legionella pneumophila
Morganella morganii
Providencia spp._
Pseudomonas sp.
Serratia sp.
Stenotrophomonas maltophilia
Ostatní mikroorganismy Chlamydophila pneumoniae Chlamydophila psittaci Coxiella burnetti Mycoplasma pneumoniae
$ Přirozená střední citlivost v nepřítomnosti získaných mechanismů rezistence.
£Všechny stafylokoky rezistentní na methicilin j sou rezistentní na amoxicilin/kyselinu klavulanovou.
'K léčbě infekcí způsobených Streptococcus pneumoniae rezistentním na penicilin, nemá být použita tato kombinace amoxicilinu/kyseliny klavulanové (viz body 4.2 a 4.4).
2V některých zemích EU byly hlášeny kmeny se sníženou citlivostí, a to s frekvencí vyšší než 10 %.
5.2 Farmakokinetické vlastnosti
Absorpce
Amoxicilin a kyselina klavulanová jsou při fyziologickém pH zcela rozpustné ve vodě. Obě složky se po perorálním podání rychle a dobře vstřebávají. Optimální absorpce amoxicilinu/kyseliny klavulanové je dosaženo při užívání přípravku na začátku jídla. Po perorálním podání je biologická dostupnost amoxicilinu a kyseliny klavulanové přibližně 70 %. Plazmatické profily obou složek jsou podobné a čas k dosažení nejvyšších plazmatických koncentrací (Tmax) je v obou případech přibližně jedna hodina.
Výsledky farmakokinetické studie, kdy byl zdravým dobrovolníkům nalačno podáván amoxicilin/kyselina klavulanová (500 mg/125 mg podávaných třikrát denně), jsou shrnuty v následující tabulce.
|
Průměrné (±SD) hodnoty farmakokinetických parametrů | |||||
|
Podaná léčivá látka/léčivé |
Dávka |
C v-/max |
T * T max |
AUC (0-24h) |
T 1/2 |
|
látky |
(mg) |
(pg/ml) |
(h) |
(pg.h/ml) |
(h) |
|
Amoxicilin | |||||
|
AMX/CA 500 mg/125 mg |
500 |
7,19±2,26 |
1,5 (1,0-2,5) |
53,5±8,87 |
1,15±0,20 |
|
Kyselina klavulanová | |||||
|
AMX/CA 500 mg/125 mg |
125 |
2,24±0,83 |
1,5 (1,0-2,0) |
15,72±3,86 |
0,98±0,12 |
|
AMX - amoxicilin, CA - kyselina klavulanová | |||||
|
* Medián (rozmezí) | |||||
Sérové koncentrace amoxicilinu a kyseliny klavulanové dosažené po podání amoxicilinu/kyseliny klavulanové j sou srovnatelné s koncentracemi, které nacházíme po perorálním podání ekvivalentního množství samotného amoxicilinu a kyseliny klavulanové.
Distribuce
Asi 25 % celkového plazmatického množství kyseliny klavulanové a 18 % celkového plazmatického množství amoxicilinu se váže na bílkoviny.
Zjevný distribuční objem je přibližně 0,3 - 0,4 l/kg pro amoxicilin a přibližně 0,2 l/kg pro kyselinu klavulanovou.
Po intravenózním podání byly amoxicilin i kyselina klavulanová nalezeny ve žlučníku, abdominální tkáni, kůži, tuku, svalovině, synoviální a peritoneální tekutině, žluči a hnisu. Amoxicilin není dostatečně distribuován do cerebrospinální tekutiny.
Ve studiích na zvířatech nebyla prokázána významná tkáňová retence metabolitů žádné z léčivých látek. Amoxicilin, podobně jako další peniciliny, může být detekován v mateřském mléce. Stopová množství kyseliny klavulanové mohou být též nalezena v mateřském mléce (viz bod 4.6).
Amoxicilin i kyselina klavulanová procházejí placentární bariérou (viz bod 4.6).
Biotransformace
Amoxicilin je částečně vylučován močí ve formě neaktivní kyseliny penicilinové a to v množství odpovídajícím 10-25 % podané počáteční dávky. Kyselina klavulanová se u člověka intenzivně metabolizuje a vylučuje se močí, stolicí a ve formě kysličníku uhličitého vylučovaného plicní ventilací.
Vylučování
Amoxicilin se vylučuje převážně ledvinami, zatímco kyselina klavulanová se vylučuje ledvinami i mimoledvinnou cestou.
Amoxicillin/kyselina klavulanová má u zdravých osob průměrný eliminační poločas přibližně 1 hodinu a průměrnou celkovou clearance přibližně 25 l/hodinu. Asi 60-70 % amoxicilinu a asi 40-65 % kyseliny klavulanové se vyloučí v nezměněné formě močí během prvních 6 hodin po podání jedné tablety amoxicilinu/kyseliny klavulanové 250 mg/125 mg nebo 500 mg/125 mg. Na základě různých studií činilo ledvinné vylučování v průběhu 24 hodin 50-85 % pro amoxicilin a 27-60 % pro kyselinu klavulanovou. V případě kyseliny klavulanové je největší podíl léčiva vyloučen v průběhu prvních 2 hodin po podání.
Současné podání probenecidu prodlužuje vylučování amoxicilinu, ale neprodlužuje renální vylučování kyseliny klavulanové (viz bod 4.5).
Věk
Eliminační poločas amoxicilinu je u dětí ve věku od přibližně 3 měsíců do 2 let podobný a srovnatelný s eliminačním poločasem zaznamenaným u starších dětí a dospělých. U velmi malých dětí (včetně nedonošených novorozenců) by v prvním měsíci života neměl interval podávání překročit dvě dávky denně vzhledem k nezralosti renální cesty vylučování.
Vzhledem k tomu, že u starších pacientů je větší pravděpodobnost snížené renální funkce, je třeba určovat dávku s opatrností a může být užitečné sledovat renální funkce.
Pohlaví
Při perorálním podávání amoxicilinu/kyseliny klavulanové zdravým mužům a ženám nemělo pohlaví významný vliv na farmakokinetiku amoxicilinu ani kyseliny klavulanové.
Porucha funkce ledvin
Celková sérová clearance amoxicilinu/kyseliny klavulanové se snižuje proporcionálně se snižující se renální funkcí. Snížení clearance je významnější u amoxicilinu než u kyseliny klavulanové, neboť amoxicilin je vylučován ledvinami ve větší míře. Dávkování při renální insuficienci je tedy třeba upravit tak, aby se zabránilo nepřiměřené akumulaci amoxicilinu a přitom byly udrženy adekvátní hladiny kyseliny klavulanové (viz bod 4.2).
Porucha funkce jater
Pacienti s poruchou jaterních funkcí musí být léčeni s opatrností a jaterní funkce mají být monitorovány v pravidelných intervalech.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě farmakologických studií bezpečnosti, genotoxicity a reprodukční toxicity neodhalily žádné zvláštní riziko pro člověka.
Studie toxicity po opakovaném podávání amoxicilinu/kyseliny klavulanové psům prokázala žaludeční podráždění a zvracení a změnu barvy jazyka.
Studie kancerogenity nebyly s amoxicilinem/kyselinou klavulanovou ani s jeho metabolity prováděny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety:
Mikrokrystalická celulosa (E460)
Koloidní bezvodý oxid křemičitý Magnesium-stearát (E470b)
Sodná sůl karboxymethylškrobu (Typ A)
Potahová vrstva:
Hypromelosa (E464)
Makrogol 400 Oxid titaničitý (E171)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem a vlhkostí.
6.5 Druh obalu a obsah balení
Tablety jsou baleny v Al/Al blistrech a Al/Al stripech v krabičce.
Přípravek Afreloxa 500 mg/125 mg je dostupný v blistrech a stripech po 4/5/6/7/8/10/12/14/15/16/20/21/25/30/35/40/50/100/500 potahovaných tabletách.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Actavis Group PTC ehf.
Reykjavikurvegur 76 - 78 220 Hafnarfjordur Island
8. REGISTRAČNÍ ČÍSLO(A)
15/078/15-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
1.4.2015
10. DATUM REVIZE TEXTU
1.4.2015
13