Actikerall 5 Mg/G + 100 Mg/G
Sp.zn. sukls131120/2015
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Actikerall 5 mg/g + 100 mg/g Kožní roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1 g kožního roztoku obsahuje fluorouracilum 5 mg a acidum salicylicum 100 mg.
Pomocná látka se známým účinkem: 80 mg dimethyl sulfoxidu/g roztoku.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Kožní roztok.
Actikerall je čirý, bezbarvý až slabě oranžovo-bílý roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Actikerall je indikován pro místní léčbu hyperkeratotické iradiační keratózy stupně I/II (slabě hmatné a/nebo středně ztluštělé léze) u imunokompetentních pacientů dospělého věku.
Stupeň I/II vychází ze čtyřbodové škály podle Olsena et al. (1991), viz bod 5.1.
4.2 Dávkování a způsob podání Dávkování u dospělých včetně starších pacientů Kožní podání.
Actikerall má být aplikován na ložiska iradiační keratózy jednou denně dokud ložiska zcela nevymizí nebo nejdéle po dobu 12 týdnů. Pokud se vyskytnou závažné nežádoucí účinky, omezte četnost podání na tři aplikace týdně, dokud se nežádoucí účinek nezlepší. Při léčbě oblastí kůže s tenkou vrstvou epidermis, má být roztok aplikován méně často a průběh léčby má být častěji monitorován.
Odezva na léčbu může nastat již po šesti týdnech. Účinek se v čase zesiluje, k dispozici jsou klinická data z léčby v trvání až 12 týdnů. Kompletní vyhojení kožních lézí resp. optimální terapeutický efekt nemusí být zřejmý až do doby osmi týdnů po ukončení léčby. Při posuzování možností léčby rekurentních ložisek by měl lékař vzít v úvahu skutečnost, že účinnost opakované léčby přípravkem Actikerall nebyla v klinických studiích formálně hodnocena.
Pediatrická populace
Iradiační keratóza není onemocněním dětského věku; bezpečnost a účinnost přípravku Actikerall nebyla tedy v této populaci zkoušena.
Způsob podání
Ložiska vícečetné iradiační keratózy mohou být léčena současně. Klinické zkušenosti jsou s léčením až 10 ložisek zároveň. Celková plocha kůže, na kterou je aplikován přípravek Actikerall, by však neměla přesáhnout 25 cm2 (5cm x 5cm).
Actikerall by se měl aplikovat pouze na samotné ložisko iradiační keratózy s přesahem max. 0,5 cm na zdravou kůži v okolí léze.
Actikerall se podává na ložisko iradiační keratózy pomocí štětečkového aplikátoru nasazeného na uzávěr. Aby se zabránilo většímu stékání roztoku na okolní kůži při aplikaci, měl by se přebytečný roztok ze štětečkového aplikátoru před samotným nanesením odstranit otřením o hrdlo lahvičky.
Bezprostředně po aplikaci se léčené plochy nemají zakrývat; roztok se má nechat vyschnout a nechat vytvořit nad postiženými místy film.
Při každé následující aplikaci přípravku Actikerall je zapotřebí stávající film zaschlého léku z kůže setřít. K odstranění filmu pomáhá teplá voda.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Actikerall se nesmí používat během kojení, při těhotenství a ani u žen, u kterých nelze těhotenství s jistotou vyloučit.
Actikerall se nesmí používat v léčbě pacientů s nedostatečnou funkcí ledvin.
Actikerall se nesmí používat při současném podávání brivudinu, sorivudinu a jejich analogů. Brivudin, sorivudin a jejich analoga jsou potentními inhibitory fluorouracil-degradujícího enzymu dihydropyrimidin dehydrogenázy (DPD) (viz také body 4.4 a 4.5).
Actikerall se nesmí dostat do kontaktu s očima a se sliznicemi.
4.4 Zvláštní upozornění a opatření pro použití
Actikerall obsahuje cytostatickou látku 5-fluorouracil.
Enzym dihydropyrimidin dehydrogenáza (DPD) hraje důležitou roli v degradaci fluorouracilu. Deficit, snížená aktivita nebo blokáda účinku tohoto enzymu můžou mít za následek akumulaci fluorouracilu.
Pokud je to proveditelné, je stanovení aktivity enzymu DPD indikováno před zahájením léčby fluorouracilem nebo jinými fluoropyrimidiny.
U pacientů, kteří současně s fluorouracilem užívají fenytoin, by se měla pravidelně sledovat plazmatická hladina fenytoinu vzhledem k riziku jejího zvýšení.
U pacientů s poruchami kožní citlivosti (např. s onemocněním diabetes mellitus) je zapotřebí pečlivého klinického sledování léčených míst.
Iradiační keratóza je způsobená chronickým poškozením UV zářením a lokální podráždění v místě aplikace přípravku Actikerall se může zhoršit při expozici slunci. Pacientům má být doporučeno, aby si kůži chránili před dalším nadměrným či kumulativním kontaktem se slunečním zářením, zejména v léčené oblasti.
Nejsou zkušenosti s léčbou bazaliomu a Bowenovy choroby, proto by tyto stavy neměly být přípravkem léčeny.
Actikerall nemá být používán na krvácející ložiska.
Nejsou zkušenosti s léčbou iradiační keratózy v oblasti, která je postižena i dalším kožním onemocněním. Lékař by měl vzít v úvahu možnost, že výsledek léčby může být odlišný.
V současné době nejsou k dispozici poznatky z používání přípravku Actikerall na jiných oblastech těla nežli na obličeji, čele a na kůži lebky při holohlavosti.
Pokud jsou léčeny oblasti kůže, kde je pokožka přirozeně tenčí, měl by se léčebný roztok aplikovat méně často a efekt léčby je potřeba častěji sledovat a hodnotit.
Léčivý přípravek Actikerall obsahuje dimetylsulfoxid. Tato látka může vyvolat podráždění kůže.
Po každém použití je nutné lahvičku pevně uzavřít, jinak dojde k rychlému vyschnutí látky a přípravek už nebude možné správně používat.
Pokud dojde ke krystalizaci v roztoku, nemá se přípravek už dále používat.
Přípravek Actikerall by neměl přijít do styku s textiliemi a akrylovými hmotami (např. akrylátové vany), protože na nich může zanechávat trvalé skvrny.
Pozor, hořlavina: nevystavujte otevřenému ohni.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Enzym dihydropyrimidin dehydrogenáza (DPD) hraje důležitou roli v degradaci fluorouracilu. Analoga nukleosidů, jako např. brivudin a sorivudin tento enzym blokují; jejich současné podávání může vést k drastickému zvýšení plazmatických koncentrací fluorouracilu a dalších fluoropyrimidinů a zvyšovat jejich toxicitu. Z tohoto důvodu musí být dodržen odstup v podávání fluorouracilu a brivudinu, sorivudinu nebo jejich analog v trvání nejméně 4 týdny.
V případě náhodného podání nukleosidových analog, jako jsou brivudin a sorivudin pacientům, kteří jsou léčeni fluorouracilem, musí být přijata adekvátní opatření k zamezení projevů toxicity fluorouracilu. Indikováno může být nemocniční ošetřování. Pozornost musí být věnována zejména ochraně před systémovými infekcemi a před dehydratací.
Při současném podávání fenytoinu a fluorouracilu byly zaznamenány zvýšené plazmatické hladiny fenytoinu, které vedly i k projevům toxicity. (viz bod 4.4).
Neexistují důkazy o podstatnější systémové absorbci salicylové kyseliny, ale absorbovaná salicylová kyselina by mohla vstupovat do interakce s methotrexatem a deriváty sulfonylurey.
4.6 Fertilita, těhotenství a kojení Těhotenství
Z použití kožních forem fluorouracilu u těhotných žen není zatím dostatek dat. U zvířat byly pozorovány teratogenní účinky systémově podávaného fluorouracilu. Kyselina salicylová může nežádoucím způsobem ovlivnit výsledek těhotenství u hlodavců.
Kojení
Není jasné, jestli je fluorouracil nebo jeho metabolity po topickém podání vylučován do mateřského mléka. Riziko pro kojené dítě nelze vyloučit.
Fertilita
Studie fertility se systémově podávaným fluorouracilem zjistily přechodnou infertilitu u samců a snížení procenta březosti u samic hlodavců. Význam pro člověka je však nepravděpodobný vzhledem k velmi omezené absorpci účinných látek po kožním podání přípravku Actikerall.
Actikerall je kontraindikován v těhotenství a při kojení (viz bod 4.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Actikerall nemá vliv na schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Nežádoucí účinky řazené dle třídy orgánových systémů podle MedDRA a s klesající četností jsou uvedeny níže.
Četnosti jsou definovány jako velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10000 až <1/1000), velmi vzácné (<1/10000) a není známo (z dostupných údajů nelze určit).
Celkové poruchy a reakce v místě aplikace:
Velmi časté v místě aplikace: zarudnutí, zánět, podráždění (včetně popálení), bolest, svědění.
Časté v místě aplikace: krvácení, eroze, strup.
Méně časté v místě aplikace: dermatitida, edém, vřed.
Poruchy kůže a podkožní tkáně:
Časté: kožní exfoliace.
Poruchy nervového systému:
Časté: bolest hlavy.
Poruchy oka:
Méně časté: suchost očí, svědění oka, zvýšené slzení.
Mírné až středně závažné podráždění resp. zanícení míst aplikace se vyskytuje u většiny pacientů léčených tímto roztokem s indikací iradiační keratózy. V případě vážnějších reakcí je vhodné snížit četnost aplikace.
Protože má tento léčivý přípravek velmi silný změkčující efekt na rohovou vrstvu kůže (stratum corneum), může se, zejména v oblastech kolem lézí, objevovat bělavé odbarvení kůže a její odlupování v šupinách.
Díky obsahu salicylové kyseliny může používání tohoto přípravku vyvolat mírné známky kožního podráždění jako je dermatitida nebo kontaktní alergické reakce, zejména u predisponovaných pacientů. Tato kontaktní alergie se může projevovat svěděním a zarudnutím nebo vznikem malých puchýřků dokonce i mimo oblasti aplikace přípravku.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48 100 41 Praha 10
Webové stránky: www .sukl .cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Pokud je přípravek aplikován na kůži doporučovaným způsobem, je systémová intoxikace kteroukoli z léčivých látek vysoce nepravděpodobná. Výrazně častější nežli doporučené používání vede k četnějším a také závažnějším reakcím v místě aplikace.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatika, antimetabolity, analogy pyrimidinu, ATC kód: L01BC52 Fluorouracil:
Léčivá látka fluorouracil (FU) je cytostatickou látkou s antimetabolickým efektem. Díky strukturální podobnosti s thyminem (5-metyluracil), který se přirozeně vyskytuje v nukleových kyselinách, zabraňuje fluorouracil formování a vazbám nukleových kyselin a tímto způsobem inhibuje syntézu jak DNA, tak RNA. Výsledkem je inhibice růstu zejména těch buněk, u kterých dochází k akcelerovanému množení a tedy i výraznější absorbci FU; tento mechanismus je pozorován i u iradiační keratózy. Současně je inhibován i růst virů, které se mohou v patogenezi iradiační keratózy uplatňovat.
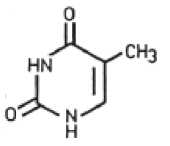
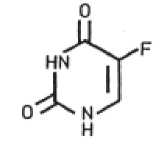
Thymin Fluorouracil
Salicylová kyselina:
Kožní aplikace salicylové kyseliny vykazuje keratolytický efekt a snižuje hyperkeratózu spojenou s iradiační keratózou. Salicylová kyselina je aromatickou kyselinou s fenolovou složkou a je dobře rozpustná v tucích. Její keratolytický efekt spočívá zřejmě v potlačení adheze korneocytů, rozpouštění mezibuněčného pojiva a v rozvolňování buněk rohové vrstvy kůže. Jako organické rozpouštědlo dokáže salicylová kyselina rozpouštět tuk spojující obaly buněk rohové vrstvy kůže.
V klíčové studii fáze 3 (multicentrické, dvojitě slepé, placebem kontrolované) bylo 470 pacientů s iradiační keratózou stupně I-II rozděleno do tří skupin. Pacienti byli léčeni buď roztokem fluorouracilu (5 mg/g) a salicylové kyseliny (100 mg/g) (5-FU-SA) nebo dostávali placebo nebo diklofenak gel (30 mg/g) (DG). 187 pacientů bylo léčeno fixní kombinací 5-FU-SA po dobu až 12 týdnů. Primárním hodnotícím kritériem bylo vymizení lézí v histologickém preparátu po 8 týdnech od ukončení léčby. Topická léčba roztokem 5-FU-SA vykazovala převahu nad léčbou placebem nebo diklofenak gelem. Sekundárními parametry účinnosti byly celkový počet lézí, jejich celková velikost, reakce na léčbu, hodnocení efektivity lékařem i pacientem; vyhodnocení těchto sekundárních parametrů korelovalo s výsledkem parametru primárního. U 72% nemocných ve skupině 5-FU-SA nebyla iradiační keratóza v bioptickém materiálu prokazatelná, zatímco vymizení lézí ve skupině s placebem nastalo u 44,8% nemocných a ve skupině s DG u 59,1% nemocných (per protokol analýza). Nejčastějším nežádoucím účinkem léčby 5-FU-SA bylo podráždění v místě aplikace (vč. popálení) - 86,1%, a zánět v místě aplikace - 73,3%. S vysokou četností se vyskytovalo také svědění (44,9%) a bolest (25,1%) v místě aplikace. Dalšími nežádoucími reakcemi na léčených místech bylo zarudnutí a eroze. Přerušení léčby z důvodu výskytu nežádoucích reakcí bylo nicméně nízké (0.5 %).
Klinické zkušenosti s podáváním přípravku Actikerall jsou pouze pro aplikační místa na obličeji, na čele a na kůži lebky při holohlavosti. Pokud se uvažuje o aplikaci na jiná místa, měla by se vzít v úvahu rozdílná tloušťka pokožky v různých tělních oblastech:
Průměrná tloušťka (mikrometry)
Část těla
Zdroj: Koehler et al. 2010 (Skin Res Technol 2010; 16:259-264); Sandby-Moller et al. 2003 (Acta Derm Venereol 2003; 83(6):410-3); Whitton et Everall 1973 (Br J Dermatol 1973; 89(5):467-76)
Stupeň postižení kůže iradiační keratózou byl klasifikován na čtyřbodové škále dle Olsena et al., 1991 (J Am Acad Dermatol 1991; 24: 738-743):
Stupeň
0 žádná
1 mírná
II střední
III těžká
Klinický popis
Žádné léze nejsou přítomny, ani viditelné ani hmatné
Ploché, růžové skvrny bez známek hyperkeratózy a zarudnutí, slabě hmatné; ložiska bývají lépe hmatná nežli viditelná
Růžové až zarudlé pupínky a zarudlé plaky s hyperkeratotickým povrchem, středně ztluštělé; ložiska jsou dobře viditelná i hmatná Výrazně ztluštělá, zřejmá ložiska iradiační keratózy
5.2 Farmakokinetické vlastnosti
Ve studii zaměřené na systémovou absorpci fluorouracilu u vepřů nebyla po kožní aplikaci i vysokých dávek FU účinná látka v séru detekovatelná; tzn. že látka se nevstřebává v takovém množství, které by bylo zjistitelné současnými analytickými metodami (HPLC).
Koncentrace fluorouracilu nad 0.05 ^g/ml v séru nebyla u pacientů s iradiační keratózou zjištěna (n=12).
Podle farmakokinetických studií anylyzujících vstřebávání léčivé látky při léčení bradavic totožným léčivým roztokem, byl podíl vstřebané látky zřetelně pod 0.1 %.
Po nanesení na kůži vytvoří Actikerall solidní film, který po odpaření rozpouštědla získá bílou barvu. Dojde tak k zamezení odpařování účinné látky a ke zlepšení penetrace do epidermis, do ložisek iradiační keratózy.
Salicylová kyselina se do roztoku přidává pro své keratolytické vlastnosti v zájmu zlepšení průniku léčivé látky, která je v hyperkeratotických ložiscích obzvlášť obtížná. Stejný účinek je dosažen použitím další pomocné látky dimetyl sulfoxidu, která působí jako rozpouštědlo pro hlavní léčivou látku fluorouracil.
Keratolytický efekt salicylové kyseliny je založen na jejím přímém působení na mezibuněčné pojivo a tzv. desmosomy, které se účastní procesu rohovění kůže.
Pokusy na zvířatech a lidské farmakokinetické studie prokázaly, že salicylová kyselina proniká povrchem rychle v závislosti na stavu pokožky a na použitém lékovém substrátu.
Salicylová kyselina je metabolizována konjugací s glycinem na kyselinu salicylurovou; s glukuronovou kyselinou na fenolové OH skupině tvoří eter glukuronid popř. na COOH skupině tvoří ester glukuronid.
Další možností je hydroxylace na kyselinu gentisovou a dihydroxybenzoovou. Při normálním dávkování má
salicylová kyselina poločas 2-3 hodiny, ale v případě vysokého dávkování se může poločas prodloužit až na 15-30 hodin jako důsledek omezené schopnosti jater konjugovat kyselinu salicylovou.
Při topickém použití všeobecně nelze očekávat výskyt jakýchkoli toxických vedlejších efektů (nicméně viz oddíl kontraindikace), protože sérové hladiny vyšší než 5 mg/dl mohou být stěží dosaženy. Časné symptomy intoxikace salicyláty lze očekávat až při sérových hladinách nad 30 mg/dl.
5.3 Předklinické údaje vztahující se k bezpečnosti
K dispozici nemáme žádná experimentální data týkající se akutní nebo sub-chronické toxicity fluorouracilu (FU) při topickém používání. U potkanů nastává určitá na dávce závislá systémová absorpce FU, jejímž následkem jsou těžké místní reakce a také fatální systémové účinky vyplývající z účinku FU jako cytostatika s antimetabolickým působením v. takto vysokých dávkách (až 10000-násobek lidské dávky), které nejsou při doporučeném dávkování přípravku Actikerall nikdy dosaženy.
U některých testovaných druhů byl FU in vitro mutagení. Několik studií hodnotilo karcinogenitu FU u h s negativním výsledkem. V jedné studii však byl nalezen důkaz karcinogenity FU u myší po i.p. podání. Některé studie ukázaly potenciální teratogenní či embryotoxické účinky po systémovém podání vysokých dávek FU, nicméně byly zjištěny velmi malý či nulový vliv na fertilitu či celkovou reprodukční výkonnost. Vzhledem k velmi omezené absorpci při zevním používání, je jakékoliv z výše uvedených nežádoucích působení při použití u člověka velmi nepravděpodobné.
Salicylová kyselina se vyznačuje velmi nízkou akutní toxicitou, ale pokud je podávána ve vyšší koncentraci, může vyvolat kožní reakce. O kyselině salicylové není známo, že by měla jakýkoli mutagenní, genotoxický, karcinogenní nebo teratogenní účinek.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Dimetyl sulfoxid Ethanol Ethyl-acetát Pyroxylin
Poly(butyl methakrylát, methyl methakrylát)
6.2 Inkompatibility
Nevztahuje se.
6.3 Doba použitelnosti
2 roky
Doba použitelnosti po prvním otevření: 3 měsíce
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
Chraňte před chladem a mrazem.
Uchovávejte lahvičku pevně uzavřenou.
6.5 Druh obalu a obsah balení
Tento léčivý přípravek je balen v hnědé skleněné lahvičce s bílým polypropylenovým uzávěrem zabezpečeným proti otevření dětmi a v papírové krabičce. Uzávěr lahvičky je spojen se štětečkovým aplikátorem, kterým se roztok nanáší. Štětečkový aplikátor (označen CE značkou) je vyroben z polyetylenu (HDPE a LDPE v poměru 1:1), štětiny jsou vyrobeny z nylonu a rukojeť z nerezové oceli (V2A).
Velikost balení: 25 ml roztoku.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními nařízeními.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Almirall Hermal GmbH Scholtzstrasse 3 21465 Reinbek Německo
8. REGISTRAČNÍ ČÍSLO(A)
46/250/12-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 4. 4. 2012
Datum posledního prodloužení registrace: 20.5.2016
10. DATUM REVIZE TEXTU
13.7.2016
8